8.4 常见的盐 教学课件(共37张PPT内嵌视频)_初中化学科粤版(2024)九年级下册教学
文档属性
| 名称 | 8.4 常见的盐 教学课件(共37张PPT内嵌视频)_初中化学科粤版(2024)九年级下册教学 |  | |
| 格式 | pptx | ||
| 文件大小 | 74.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-09 23:09:28 | ||
图片预览











文档简介
(共37张PPT)
8.4 常见的盐
核心素养目标
一、化学观念
形成 “盐是由金属离子(或铵根离子)和酸根离子构成” 的物质组成观;
理解盐能与酸、碱、盐发生反应及复分解反应发生条件,构建化学反应与物
质转化观念;认识常见盐在生活和生产中的应用,体会化学物质的价值 。
二、科学思维
通过分析盐的组成,推测盐的化学性质,培养逻辑推理能力;对盐的相关
实验现象进行归纳总结,提升归纳概括能力;依据复分解反应条件判断反应能
否发生,培养批判性思维和解决问题的能力。
三、科学态度与责任
严谨认真地进行实验观察和记录,尊重实验事实;认识到化学在生产生活
中的重要作用,增强合理利用化学物质的社会责任感。
学习重难点
重点:
常见盐的用途、组成和化学性质
复分解反应发生的条件
难点:
盐的化学性质的理解和应用
根据复分解反应条件判断反应能否发生
几种常见盐的用途
PART 01
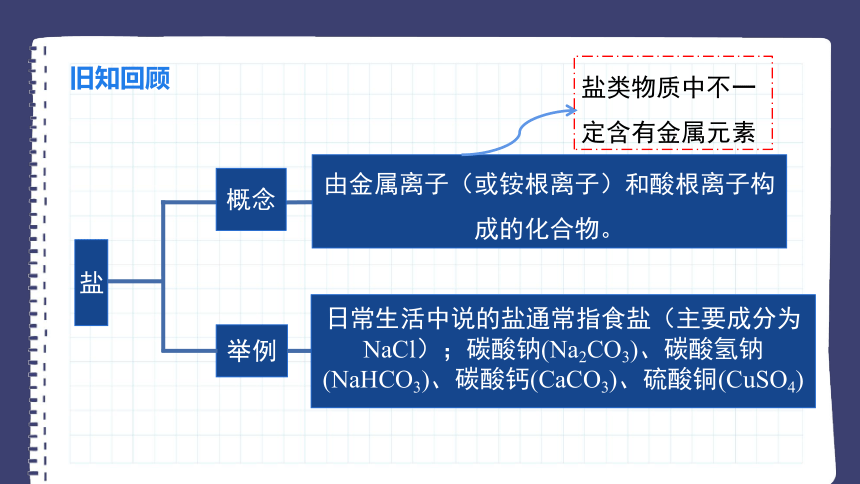
旧知回顾
盐
举例
由金属离子(或铵根离子)和酸根离子构成的化合物。
概念
盐类物质中不一定含有金属元素
日常生活中说的盐通常指食盐(主要成分为NaCl);碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)、碳酸钙(CaCO3)、硫酸铜(CuSO4)
1. 盐的成员
天然存在
工厂制造
盐的成员
氯化钠、碳酸钙等
碳酸钠、碳酸氢钠等
跟酸和碱相比,盐的成员更多,用途更广,用量更大。
2. 氯化钠及其主要用途
(1)俗称:食盐
(2)化学式:NaCl
(3)性状:白色晶体,易溶于水,有咸味,溶液呈中性
(4)主要用途:
2. 氯化钠及其主要用途
盐湖
盐井
盐矿
海水
(5)氯化钠的来源
3. 碳酸钙及其主要用途
(1)石灰石、贝壳、大理石的主要成分
(2)化学式: CaCO3
(3)形状:多为灰白色矿物,纯净物为白色粉末;难溶于水,
能与酸反应。
4. 碳酸钠及其主要用途
(1)俗名:纯碱、苏打
(2)化学式: Na2CO3
(3)形状:白色晶体,风化成粉末;易溶于水,水溶液显碱性
5. 碳酸氢钠及其主要用途
(1)俗名:小苏打
(2)化学式: NaHCO3
(3)形状:白色粉末,能溶于水,水溶液有弱碱性,较易分解
拓展延伸
(1)盐溶液不一定呈中性
有些盐溶液呈中性,如氯化钠溶液;有些盐溶液呈碱性,如碳酸钠溶液和碳酸氢钠溶液;有些盐溶液呈酸性,如硫酸铵、氯化铵溶液。
(2)工业用盐——亚硝酸钠(NaNO2),外形与食盐相似且有咸味,但NaNO2有毒,不可直接食用。
盐的组成、分类和
溶解性
PART 02
1. 盐的分类
根据阳离子的类别
Na2CO3
CaCO3
钠盐
钙盐
CaSO4
NaCl
NaHCO3
NH4NO3
铵盐
NH4Cl
根据阴离子的类别
Na2CO3
CaCO3
碳酸盐
硫酸盐
CaSO4
Na2SO4
硝酸盐
KNO3
NaNO3
2. 常见酸、碱、盐的溶解性
酸
几种常见的酸都能溶于水
碱
可溶:氢氧化钠、氢氧化钾、氢氧化钡、NH3·H2O
微溶:氢氧化钙
其余不溶
盐
钠盐、钾盐、铵盐、硝酸盐都可溶
盐酸盐:氯化银不溶,其余都可溶
硫酸盐:硫酸钡不溶,硫酸钙和硫酸银微溶,其余都可溶
碳酸盐:碳酸钾、碳酸钠、碳酸铵可溶,其余都不溶
☆AgCl、BaSO4即不溶与水又不溶于酸
盐的化学性质
PART 03
讨论与交流>>>
不同的盐可以由酸与碱发生中和反应得到,你知道下列各种盐可以由什么相关的酸和碱反应得到吗
H2SO4
NaOH
HNO3
HNO3
HCl
HCl
H2SO4
H2SO4
H2SO4
KOH
Mg(OH)2
Fe(OH)3
NaOH
Ba(OH)2
Cu(OH)2
Ca(OH)2
1. 盐的化学性质——与酸反应
盐
CaCO3 + 2HCl===CaCl2 +H2O + CO2 ↑
回顾第五单元5.3实验室制取二氧化碳中碳酸钙与盐酸的复分解反应
酸
新盐
新酸(碳酸)
再回顾第八单元8.2[实验8-8]稀酸与盐的反应,由此可知:
盐可能与酸发生复分解反应,生成新盐和新酸。
2. 盐的化学性质——与碱反应
回顾第四单元4.2[实验4-3]硫酸铜溶液与氢氧化钠溶液的反应。
CuSO4 +2NaOH ===Na2SO4 + Cu( OH)2↓
盐
碱
新碱
新盐
再回顾第八单元8.2【实验8-11]碱溶液与盐溶液的反应,由此可知:
盐可能与碱发生复分解反应,生成新盐和新碱。
3. 盐的化学性质——与盐反应
[实验8-15]向装有少量碳酸钠溶液的试管中加入少量氯化钙溶液、装有少量硫酸钠溶液的试管中加入少量硝酸钡溶液,观察现象,并写出相应反应的化学方程式。
盐溶液 加入试剂 现象 化学方程式
碳酸钠溶液 氯化钙溶液
硫酸钠溶液 硝酸钡溶液
有白色沉淀生成
有白色沉淀生成
Na2CO3+CaCl2==== + .
CaCO3↓
2NaCl
Na2SO4+Ba(NO3)2===BaSO4↓+2NaNO3
盐1
盐2
新盐2
新盐1
由此得到:两种盐之间可能发生复分解反应,生成另外两种新盐。
长话短说
1. 盐与酸、碱、其他盐之间可能发生复分解反应:
①盐+酸→新盐+新酸;
②盐+碱→新盐+新碱;
③盐 1+ 盐 2→新盐 1+ 新盐 2
2. 盐溶液与某些金属可能发生置换反应:
盐+活动性较强的金属 → 新盐+活动性较弱的金属
复分解反应发生的
条件
PART 04
1. 复分解反应发生的条件
[目的]
了解复分解反应的条件
观察活动
[实验8-16]如下表所示进行实验,观察现象并写出化学方程式。
1. 复分解反应发生的条件
实验序号 实验操作 现象 化学方程式 生成物特征
① 向装有稀盐酸的试管中滴加硝酸银溶液
② 向装有稀盐酸的试管中滴加碳酸氢钠溶液
有白色沉淀生成
有气泡产生
HCl+AgNO3=AgCl↓+HNO3
HCl+NaHCO3=NaCl+H2O+CO2↑
有沉淀
有气体和水
1. 复分解反应发生的条件
归纳前面实验中所发生的复分解反应的生成物的特征:
编号 实验 化学方程式 生成物特征
实验8-7 氧化铜与稀盐酸
实验8-8 稀盐酸与碳酸钠
实验8-11 氢氧化钠与氯化铁
实验8-15 硫酸钠与硝酸钡
实验8-13 稀盐酸与氢氧化钠
实验8-14 稀硫酸与氢氧化钠
复分解反应发生的条件是生成物中有沉淀(难溶物)、气体或水等。
2HCl+CuO==CuCl2+H2O
2HCl+Na2CO3=2NaCl+CO2↑ +H2O
3NaOH+FeCl3=Fe(OH)3↓+3NaCl
Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3
HCl+NaOH =NaCl+H2O
H2SO4+2NaOH =Na2SO4+2H2O
有水生成
有气体和水生成
有沉淀生成
有沉淀生成
有水生成
有水生成
思考讨论
以下反应能否发生复分解反应?
水
气体
水
沉淀
AgNO3 + NaCl ══ AgCl ↓+ NaNO3
CaCO3+ 2HNO3 ══ Ca(NO3)2+ H2O + CO2↑
Cu(OH) 2+2HNO3 ══ Cu(NO3)2 + 2H2O
讨论与交流
请你预测稀盐酸与硝酸钾溶液能否发生反应。
假设稀盐酸与硝酸钾溶液能发生反应,根据复分解反应的特征,写出其反应方程式:
HCl+KNO3=KCl+HNO3
HCl和KNO3两种物质在溶液中相互交换成分后没有沉淀、气体或水生成,不能发生反应
2. 常见复分解反应的类型与发生反应的具体条件
反应物的类别 反应物条件 生成物条件
酸+金属氧化物
酸+碱 酸+盐 碱+盐 盐+盐 酸可溶
至少一种可溶
酸可溶
酸和碱均可溶
两种盐均可溶
至少满足下列三个条件中的一个:
①有沉淀生成;
②有气体生成;
③有水生成
知识视窗
溶洞里奇妙的钟乳石
许多同学可能都参观过溶洞。你一定会为洞里千姿百态的钟乳石而惊叹不已(如图)。你是否思考过它们是怎样形成的呢
石灰岩地区溶洞岩石的主要成分是碳酸钙,碳酸钙遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:
溶有碳酸氢钙的水遇热或压强突然减小时,溶解在水里的碳酸氢钙又会逐渐分解成难溶的碳酸钙沉积下来,同时产生二氧化碳和水:
CaCO3+CO2 + H2O ══ Ca(HCO3)2
Ca(HCO3)2══ CaCO3↓+CO2↑+ H2O
知识视窗
溶洞里奇妙的钟乳石
上述的变化是一个十分缓慢、长年累月积累的过程。那么,为什么又有石笋、石钟乳、石柱的不同呢?原来洞顶的水在缓慢向下渗漏时,水中的碳酸氢钙发生分解,有的沉积在洞底,慢慢地形成石笋,有的残留在洞顶,渐渐地形成石钟乳,当石笋和石钟乳逐渐相连时就形成了石柱。
总结归纳
1. 下列日常生活中的物质与其用途不对应的是( )
A. Na2CO3—配制生理盐水
B. NaCl—用作调味品
C. CaCO3—用作补钙剂
D. NaHCO3—焙制糕点
随堂练习
A
2. 下列物质间能够发生复分解反应,且有明显现象的是( )
A. Zn和稀硫酸
B. 稀盐酸和KOH溶液
C. NaOH溶液和MgCl2溶液
D. NaOH溶液和KCl溶液
随堂练习
C
3. 有一瓶失去标签的溶液X,下表记录了向X溶液中分别加入三种物质所产生的实验现象,则溶液X可能是( )
A. CuSO4溶液
B. Na2CO3溶液
C. Na2SO4溶液
D. CuCl2溶液
随堂练习
A
4. 松花皮蛋外面料灰的配料中有纯碱、食盐、生石灰、草木灰(含K2CO3),当用水将其调和包在蛋壳外面时,这个过程中发生的复分解反应有( )。
A.1个 B.2个 C.3个 D.4个
随堂练习
B
谢谢观看
8.4 常见的盐
核心素养目标
一、化学观念
形成 “盐是由金属离子(或铵根离子)和酸根离子构成” 的物质组成观;
理解盐能与酸、碱、盐发生反应及复分解反应发生条件,构建化学反应与物
质转化观念;认识常见盐在生活和生产中的应用,体会化学物质的价值 。
二、科学思维
通过分析盐的组成,推测盐的化学性质,培养逻辑推理能力;对盐的相关
实验现象进行归纳总结,提升归纳概括能力;依据复分解反应条件判断反应能
否发生,培养批判性思维和解决问题的能力。
三、科学态度与责任
严谨认真地进行实验观察和记录,尊重实验事实;认识到化学在生产生活
中的重要作用,增强合理利用化学物质的社会责任感。
学习重难点
重点:
常见盐的用途、组成和化学性质
复分解反应发生的条件
难点:
盐的化学性质的理解和应用
根据复分解反应条件判断反应能否发生
几种常见盐的用途
PART 01
旧知回顾
盐
举例
由金属离子(或铵根离子)和酸根离子构成的化合物。
概念
盐类物质中不一定含有金属元素
日常生活中说的盐通常指食盐(主要成分为NaCl);碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)、碳酸钙(CaCO3)、硫酸铜(CuSO4)
1. 盐的成员
天然存在
工厂制造
盐的成员
氯化钠、碳酸钙等
碳酸钠、碳酸氢钠等
跟酸和碱相比,盐的成员更多,用途更广,用量更大。
2. 氯化钠及其主要用途
(1)俗称:食盐
(2)化学式:NaCl
(3)性状:白色晶体,易溶于水,有咸味,溶液呈中性
(4)主要用途:
2. 氯化钠及其主要用途
盐湖
盐井
盐矿
海水
(5)氯化钠的来源
3. 碳酸钙及其主要用途
(1)石灰石、贝壳、大理石的主要成分
(2)化学式: CaCO3
(3)形状:多为灰白色矿物,纯净物为白色粉末;难溶于水,
能与酸反应。
4. 碳酸钠及其主要用途
(1)俗名:纯碱、苏打
(2)化学式: Na2CO3
(3)形状:白色晶体,风化成粉末;易溶于水,水溶液显碱性
5. 碳酸氢钠及其主要用途
(1)俗名:小苏打
(2)化学式: NaHCO3
(3)形状:白色粉末,能溶于水,水溶液有弱碱性,较易分解
拓展延伸
(1)盐溶液不一定呈中性
有些盐溶液呈中性,如氯化钠溶液;有些盐溶液呈碱性,如碳酸钠溶液和碳酸氢钠溶液;有些盐溶液呈酸性,如硫酸铵、氯化铵溶液。
(2)工业用盐——亚硝酸钠(NaNO2),外形与食盐相似且有咸味,但NaNO2有毒,不可直接食用。
盐的组成、分类和
溶解性
PART 02
1. 盐的分类
根据阳离子的类别
Na2CO3
CaCO3
钠盐
钙盐
CaSO4
NaCl
NaHCO3
NH4NO3
铵盐
NH4Cl
根据阴离子的类别
Na2CO3
CaCO3
碳酸盐
硫酸盐
CaSO4
Na2SO4
硝酸盐
KNO3
NaNO3
2. 常见酸、碱、盐的溶解性
酸
几种常见的酸都能溶于水
碱
可溶:氢氧化钠、氢氧化钾、氢氧化钡、NH3·H2O
微溶:氢氧化钙
其余不溶
盐
钠盐、钾盐、铵盐、硝酸盐都可溶
盐酸盐:氯化银不溶,其余都可溶
硫酸盐:硫酸钡不溶,硫酸钙和硫酸银微溶,其余都可溶
碳酸盐:碳酸钾、碳酸钠、碳酸铵可溶,其余都不溶
☆AgCl、BaSO4即不溶与水又不溶于酸
盐的化学性质
PART 03
讨论与交流>>>
不同的盐可以由酸与碱发生中和反应得到,你知道下列各种盐可以由什么相关的酸和碱反应得到吗
H2SO4
NaOH
HNO3
HNO3
HCl
HCl
H2SO4
H2SO4
H2SO4
KOH
Mg(OH)2
Fe(OH)3
NaOH
Ba(OH)2
Cu(OH)2
Ca(OH)2
1. 盐的化学性质——与酸反应
盐
CaCO3 + 2HCl===CaCl2 +H2O + CO2 ↑
回顾第五单元5.3实验室制取二氧化碳中碳酸钙与盐酸的复分解反应
酸
新盐
新酸(碳酸)
再回顾第八单元8.2[实验8-8]稀酸与盐的反应,由此可知:
盐可能与酸发生复分解反应,生成新盐和新酸。
2. 盐的化学性质——与碱反应
回顾第四单元4.2[实验4-3]硫酸铜溶液与氢氧化钠溶液的反应。
CuSO4 +2NaOH ===Na2SO4 + Cu( OH)2↓
盐
碱
新碱
新盐
再回顾第八单元8.2【实验8-11]碱溶液与盐溶液的反应,由此可知:
盐可能与碱发生复分解反应,生成新盐和新碱。
3. 盐的化学性质——与盐反应
[实验8-15]向装有少量碳酸钠溶液的试管中加入少量氯化钙溶液、装有少量硫酸钠溶液的试管中加入少量硝酸钡溶液,观察现象,并写出相应反应的化学方程式。
盐溶液 加入试剂 现象 化学方程式
碳酸钠溶液 氯化钙溶液
硫酸钠溶液 硝酸钡溶液
有白色沉淀生成
有白色沉淀生成
Na2CO3+CaCl2==== + .
CaCO3↓
2NaCl
Na2SO4+Ba(NO3)2===BaSO4↓+2NaNO3
盐1
盐2
新盐2
新盐1
由此得到:两种盐之间可能发生复分解反应,生成另外两种新盐。
长话短说
1. 盐与酸、碱、其他盐之间可能发生复分解反应:
①盐+酸→新盐+新酸;
②盐+碱→新盐+新碱;
③盐 1+ 盐 2→新盐 1+ 新盐 2
2. 盐溶液与某些金属可能发生置换反应:
盐+活动性较强的金属 → 新盐+活动性较弱的金属
复分解反应发生的
条件
PART 04
1. 复分解反应发生的条件
[目的]
了解复分解反应的条件
观察活动
[实验8-16]如下表所示进行实验,观察现象并写出化学方程式。
1. 复分解反应发生的条件
实验序号 实验操作 现象 化学方程式 生成物特征
① 向装有稀盐酸的试管中滴加硝酸银溶液
② 向装有稀盐酸的试管中滴加碳酸氢钠溶液
有白色沉淀生成
有气泡产生
HCl+AgNO3=AgCl↓+HNO3
HCl+NaHCO3=NaCl+H2O+CO2↑
有沉淀
有气体和水
1. 复分解反应发生的条件
归纳前面实验中所发生的复分解反应的生成物的特征:
编号 实验 化学方程式 生成物特征
实验8-7 氧化铜与稀盐酸
实验8-8 稀盐酸与碳酸钠
实验8-11 氢氧化钠与氯化铁
实验8-15 硫酸钠与硝酸钡
实验8-13 稀盐酸与氢氧化钠
实验8-14 稀硫酸与氢氧化钠
复分解反应发生的条件是生成物中有沉淀(难溶物)、气体或水等。
2HCl+CuO==CuCl2+H2O
2HCl+Na2CO3=2NaCl+CO2↑ +H2O
3NaOH+FeCl3=Fe(OH)3↓+3NaCl
Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3
HCl+NaOH =NaCl+H2O
H2SO4+2NaOH =Na2SO4+2H2O
有水生成
有气体和水生成
有沉淀生成
有沉淀生成
有水生成
有水生成
思考讨论
以下反应能否发生复分解反应?
水
气体
水
沉淀
AgNO3 + NaCl ══ AgCl ↓+ NaNO3
CaCO3+ 2HNO3 ══ Ca(NO3)2+ H2O + CO2↑
Cu(OH) 2+2HNO3 ══ Cu(NO3)2 + 2H2O
讨论与交流
请你预测稀盐酸与硝酸钾溶液能否发生反应。
假设稀盐酸与硝酸钾溶液能发生反应,根据复分解反应的特征,写出其反应方程式:
HCl+KNO3=KCl+HNO3
HCl和KNO3两种物质在溶液中相互交换成分后没有沉淀、气体或水生成,不能发生反应
2. 常见复分解反应的类型与发生反应的具体条件
反应物的类别 反应物条件 生成物条件
酸+金属氧化物
酸+碱 酸+盐 碱+盐 盐+盐 酸可溶
至少一种可溶
酸可溶
酸和碱均可溶
两种盐均可溶
至少满足下列三个条件中的一个:
①有沉淀生成;
②有气体生成;
③有水生成
知识视窗
溶洞里奇妙的钟乳石
许多同学可能都参观过溶洞。你一定会为洞里千姿百态的钟乳石而惊叹不已(如图)。你是否思考过它们是怎样形成的呢
石灰岩地区溶洞岩石的主要成分是碳酸钙,碳酸钙遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:
溶有碳酸氢钙的水遇热或压强突然减小时,溶解在水里的碳酸氢钙又会逐渐分解成难溶的碳酸钙沉积下来,同时产生二氧化碳和水:
CaCO3+CO2 + H2O ══ Ca(HCO3)2
Ca(HCO3)2══ CaCO3↓+CO2↑+ H2O
知识视窗
溶洞里奇妙的钟乳石
上述的变化是一个十分缓慢、长年累月积累的过程。那么,为什么又有石笋、石钟乳、石柱的不同呢?原来洞顶的水在缓慢向下渗漏时,水中的碳酸氢钙发生分解,有的沉积在洞底,慢慢地形成石笋,有的残留在洞顶,渐渐地形成石钟乳,当石笋和石钟乳逐渐相连时就形成了石柱。
总结归纳
1. 下列日常生活中的物质与其用途不对应的是( )
A. Na2CO3—配制生理盐水
B. NaCl—用作调味品
C. CaCO3—用作补钙剂
D. NaHCO3—焙制糕点
随堂练习
A
2. 下列物质间能够发生复分解反应,且有明显现象的是( )
A. Zn和稀硫酸
B. 稀盐酸和KOH溶液
C. NaOH溶液和MgCl2溶液
D. NaOH溶液和KCl溶液
随堂练习
C
3. 有一瓶失去标签的溶液X,下表记录了向X溶液中分别加入三种物质所产生的实验现象,则溶液X可能是( )
A. CuSO4溶液
B. Na2CO3溶液
C. Na2SO4溶液
D. CuCl2溶液
随堂练习
A
4. 松花皮蛋外面料灰的配料中有纯碱、食盐、生石灰、草木灰(含K2CO3),当用水将其调和包在蛋壳外面时,这个过程中发生的复分解反应有( )。
A.1个 B.2个 C.3个 D.4个
随堂练习
B
谢谢观看
