8.2.3 常见的碱 教学课件(共33张PPT内嵌视频)_初中化学科粤版(2024)九年级下册教学
文档属性
| 名称 | 8.2.3 常见的碱 教学课件(共33张PPT内嵌视频)_初中化学科粤版(2024)九年级下册教学 |  | |
| 格式 | pptx | ||
| 文件大小 | 55.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-09 21:48:06 | ||
图片预览









文档简介
(共33张PPT)
8.2.2 常见的碱
核心素养目标
一、化学观念
1. 认识常见碱的组成、性质与用途,构建 “物质性质决定用途” 的化学观念;
2. 理解碱的化学共性,形成 “同类物质性质相似” 的观念,从微观角度认识
碱具有相似化学性质的本质原因。
二、科学思维
1. 通过对碱的化学性质进行实验探究、分析推理,培养归纳总结和演绎推
理的能力;
2. 能运用类比的方法推测未知碱的性质,提升逻辑思维水平。
三、科学态度与责任
1. 在实验探究中培养严谨、认真的科学态度;
2. 认识到强碱的腐蚀性,树立安全意识和环保意识。
学习重难点
重点:
1. 常见碱(氢氧化钙、氢氧化钠)的物理性质、用途及制法;
2. 碱的化学共性,如与非金属氧化物、盐溶液的反应。
难点:
1. 理解碱具有相似化学性质的本质;
2. 设计实验验证二氧化碳与氢氧化钠溶液的反应;
3. 运用碱的化学性质解决实际问题。
新课导入
同学们,在日常生活中,我们经常会用到一些清洁用品,比如厨房中用来去除油污的清洁剂,其中就含有碱。另外,在建筑工地上,我们能看到工人师傅使用石灰浆来砌墙,石灰浆的主要成分也是一种碱 —— 氢氧化钙。那这些碱都有哪些特性?它们在化学反应中又会有怎样的表现呢?今天,就让我们一起走进碱的化学世界,探索碱的奥秘。
常见的碱
PART 01
1. 氢氧化钙
(1)俗称:熟石灰或消石灰
(2)物理性质:白色粉末状固体,微溶于水,溶解度随温度的升高而减小。
(3)用途:作建筑材料,制漂白粉,处理污水,改良酸性土壤,配制农药波尔多液;氢氧化钙的水溶液即澄清石灰水可以用来检验CO2 。
2. 氢氧化钠
(1)俗称:苛性钠、火碱或烧碱
(2)物理性质:白色固体,易潮解,易溶于水,且溶于水时放热。
(3)用途:制肥皂、洗涤剂,用于造纸、纺织工业、炼制石油。
☆氢氧化钠具有强烈的腐蚀性,如果不慎沾到皮肤上,应立即用大量水冲洗,再涂上硼酸溶液。
3. 氢氧化钙的制取
原料:石灰石(主要成分是CaCO3)
石灰石
高温煅烧
生石灰
水
熟石灰
CaO+H2O=Ca(OH)2
生石灰与水反应时放出大量热,甚至能将放在石灰中的生鸡蛋煮熟。
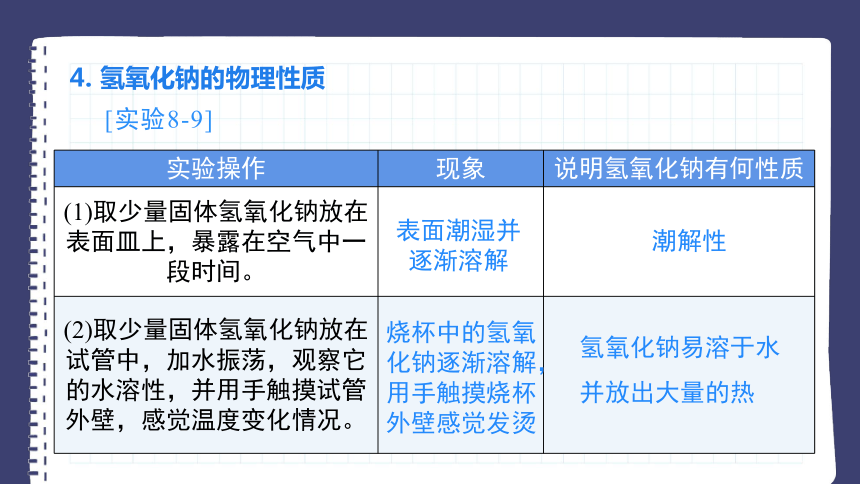
4. 氢氧化钠的物理性质
[目的]
认识氢氧化钠的潮解性和水溶性
观察活动
4. 氢氧化钠的物理性质
[实验8-9]
实验操作 现象 说明氢氧化钠有何性质
(1)取少量固体氢氧化钠放在表面皿上,暴露在空气中一段时间。
(2)取少量固体氢氧化钠放在试管中,加水振荡,观察它的水溶性,并用手触摸试管外壁,感觉温度变化情况。
烧杯中的氢氧化钠逐渐溶解,用手触摸烧杯外壁感觉发烫
表面潮湿并逐渐溶解
潮解性
氢氧化钠易溶于水
并放出大量的热
1. 氢氧化钠潮解的过程是物理变化还是化学变化,如何判断
思考讨论
2. 氢氧化钠易潮解,该如何保存?
物理变化,反应过程中没有新物质生成。
氢氧化钠需密封保存。
思考讨论
3. 根据氢氧化钠易潮解的此性质,有什么用途?
氢氧化钠固体具有吸水性,可作干燥剂,用来干燥某些中性或碱性气体,但不能干燥酸性气体,如HCl、CO2、SO2等。(氢氧化钠溶液无吸水性,不可作干燥剂)
球形干燥管
U形干燥管
拓展延伸
干燥剂的选择原则
干燥剂的选择应根据被干燥气体的性质和干燥剂的性质而定,其原则是干燥剂只能吸收被干燥气体中的水分而不能与被干燥气体发生反应。
CO2(H2O) 选择NaOH固体干燥剂
CO2+NaOH=Na2CO3+H2O
拓展延伸
常见的气体干燥剂 干燥剂 可干燥的气体 不可干燥的气体 装置
酸性 浓硫酸 中性气体:H2、O2、CO、CH4等 碱性气体:NH3
酸性气体:CO2、SO2、HCl等 碱性 固体氢氧化钠、氧化钙 中性气体:H2、O2、CO、CH4等 酸性气体:CO2、SO2、HCl等
碱性气体:NH3 中性 无水氯化铵 除NH3以外的所有气体 NH3 U形干燥管
球形干燥管
碱的化学性质
PART 02
1. 与指示剂反应
紫色石蕊溶液 无色酚酞溶液
氢氧化钠溶液
氢氧化钙溶液
变红
变蓝
变红
变蓝
(1)碱能使紫色石蕊溶液变蓝,能使无色酚酞溶液变红。
2. 探究碱的其他化学共性
[目的]
认识碱的化学性质
学生实验探究
[提出问题]
碱具有哪些化学共性?
[形成假设]
碱溶液能与 发生反应,说说你假设的理由。
某些非金属氧化物和盐溶液
2. 探究碱的其他化学共性——与某些非金属氧化物的反应
[实验8-10]碱溶液与某些非金属氧化物的反应
回顾:
Ca(OH)2 + CO2 === CaCO3↓ + H2O
(碱)
(非金属氧化物)
2. 探究碱的其他化学共性——与某些非金属氧化物的反应
[实验8-10]碱溶液与某些非金属氧化物的反应
实验
实验记录 现象:
右图实验中反应的化学方程式:
两支充满二氧化碳的试管,一支倒插人水中,另一支倒插人氢氧化钠溶液中,摆动试管。
两支试管的液面均上升,右边液面上升比左边试管液面上升的高。
CO2+2NaOH=Na2CO3+H2O
(2)碱 + 非金属氧化物 → 盐 + 水
2. 探究碱的其他化学共性——与某些非金属氧化物的反应
[分析解释]
【实验8-10】中什么现象说明CO2与NaOH溶液发生了反应?
实验中倒插入水中的试管内液面上升的高度远低于倒插入氢氧化钠溶液的试管内液面高度,说明CO2与NaOH发生了反应。
2. 探究碱的其他化学共性——与某些非金属氧化物的反应
[分析解释]
【实验8-10】你还能设计其他实验证明CO2与NaOH溶液发生了反应吗?
鸡蛋被吸入瓶中
瓶内气球变大
石灰水不变浑浊
可通过压强变化或反应物的消失或新物质的生成来判断
2. 探究碱的其他化学共性——与某些非金属氧化物的反应
[反思评价]
为什么用澄清石灰水而不是氢氧化钠溶液来检验二氧化碳?
因为NaOH溶液和CO2反应没有沉淀等明显现象,因此实验室不用NaOH 溶液检验 CO2,而用澄清石灰水。
2. 探究碱的其他化学共性——与盐溶液的反应
[实验8-11]碱溶液与盐溶液的反应
回顾:
2NaOH+CuSO4=== Cu(OH)2↓ + Na2SO4
(碱)
(盐)
(新碱)
(新盐)
实验 向碱溶液中加入合适的试剂,观察现象。
备选试剂:氢氧化钠溶液、氢氧化钙溶液、氯化铁溶液、硫酸铜溶液、碳酸钠溶液
2. 探究碱的其他化学共性——与盐溶液的反应
实验记录:
编号 碱溶液 加入试剂 现象与化学方程式
① 氢氧化钠溶液 氯化铁 溶液 现象:
化学方程式:
② 现象:
化学方程式:
③ 现象:
化学方程式:
有红色沉淀生成
3NaOH+FeCl3=Fe(OH)3↓+3NaCl
氢氧化钙溶液
硫酸铜溶液
氢氧化钙溶液
碳酸钠溶液
有蓝色沉淀生成
Ca(OH)2+CuSO4=Cu(OH)2↓+CaSO4
有白色沉淀生成
Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
(3)碱 + 盐 → 新碱+ 新盐
家庭小实验
[目的]
学习用碱性溶液制作“叶脉书签”
选用有网状叶脉的树叶,洗净。
选叶
用苏打粉溶液或石灰乳浸泡树叶,加热煮沸数分钟,当叶肉绿色褪去并变黄即可取出。
碱煮:
把煮过的叶片用清水漂去碱液,再把叶片平铺在玻璃上用柔软毛刷或牙刷轻刷叶肉,留下叶脉。
清刷
根据自己的喜好,染色并装饰,制成漂亮的“叶脉书签”。
美化
01
02
03
04
总结归纳
1. 下列有关氢氧化钠、氢氧化钙的说法中,错误的是( )
A. 用托盘天平称量它们的质量时,要将它们放在烧杯内称量
B. 它们都具有吸水性,可用作气体干燥剂
C. 氢氧化钠易溶于水,氢氧化钙微溶于水
D. 工业上通常以生石灰和水为原料制取氢氧化钙
随堂练习
B
2. 关于氢氧化钙的下列用途,错误的是( )
A.用于改良酸性土壤
B.用于配制农药波尔多液
C.用于治疗胃酸过多
D.用于制取烧碱
随堂练习
C
随堂练习
3. 含有少量水蒸气和二氧化硫的空气依次通过NaOH溶液、浓硫酸和灼热的铜网,剩余气体是( )
①稀有气体 ②氮气 ③二氧化碳
④二氧化硫 ⑤水蒸气 ⑥氧气
A. ①②⑥ B. ①②⑤
C. ①② D. ①②③④
C
随堂练习
4. 下列对实验意外事故的处理错误的是( )
A. 氢氧化钠溶液不慎沾到皮肤上,要用较多的水冲洗,再涂上硫
酸溶液
B. 实验药液溅入眼睛,立即用水冲洗,切不可用手揉搓
C. 酒精灯洒出的酒精在桌上燃烧,立即用湿布或沙子扑灭
D. 浓硫酸沾到皮肤上,立即用大量的水冲洗,再涂上3%~5%的
碳酸氢钠溶液
A
随堂练习
5. 某同学进行“制作叶脉书签”的家庭小实验时,用苏打粉溶液或石灰乳浸泡树叶并煮沸。下列有关说法错误的是( )
A. 制作过程中涉及化学变化
B. 苏打粉易溶于水,其水溶液显酸性
C. 石灰乳有腐蚀性,可腐蚀叶肉
D. 制作完成后,废液应回收处理
B
谢谢观看
8.2.2 常见的碱
核心素养目标
一、化学观念
1. 认识常见碱的组成、性质与用途,构建 “物质性质决定用途” 的化学观念;
2. 理解碱的化学共性,形成 “同类物质性质相似” 的观念,从微观角度认识
碱具有相似化学性质的本质原因。
二、科学思维
1. 通过对碱的化学性质进行实验探究、分析推理,培养归纳总结和演绎推
理的能力;
2. 能运用类比的方法推测未知碱的性质,提升逻辑思维水平。
三、科学态度与责任
1. 在实验探究中培养严谨、认真的科学态度;
2. 认识到强碱的腐蚀性,树立安全意识和环保意识。
学习重难点
重点:
1. 常见碱(氢氧化钙、氢氧化钠)的物理性质、用途及制法;
2. 碱的化学共性,如与非金属氧化物、盐溶液的反应。
难点:
1. 理解碱具有相似化学性质的本质;
2. 设计实验验证二氧化碳与氢氧化钠溶液的反应;
3. 运用碱的化学性质解决实际问题。
新课导入
同学们,在日常生活中,我们经常会用到一些清洁用品,比如厨房中用来去除油污的清洁剂,其中就含有碱。另外,在建筑工地上,我们能看到工人师傅使用石灰浆来砌墙,石灰浆的主要成分也是一种碱 —— 氢氧化钙。那这些碱都有哪些特性?它们在化学反应中又会有怎样的表现呢?今天,就让我们一起走进碱的化学世界,探索碱的奥秘。
常见的碱
PART 01
1. 氢氧化钙
(1)俗称:熟石灰或消石灰
(2)物理性质:白色粉末状固体,微溶于水,溶解度随温度的升高而减小。
(3)用途:作建筑材料,制漂白粉,处理污水,改良酸性土壤,配制农药波尔多液;氢氧化钙的水溶液即澄清石灰水可以用来检验CO2 。
2. 氢氧化钠
(1)俗称:苛性钠、火碱或烧碱
(2)物理性质:白色固体,易潮解,易溶于水,且溶于水时放热。
(3)用途:制肥皂、洗涤剂,用于造纸、纺织工业、炼制石油。
☆氢氧化钠具有强烈的腐蚀性,如果不慎沾到皮肤上,应立即用大量水冲洗,再涂上硼酸溶液。
3. 氢氧化钙的制取
原料:石灰石(主要成分是CaCO3)
石灰石
高温煅烧
生石灰
水
熟石灰
CaO+H2O=Ca(OH)2
生石灰与水反应时放出大量热,甚至能将放在石灰中的生鸡蛋煮熟。
4. 氢氧化钠的物理性质
[目的]
认识氢氧化钠的潮解性和水溶性
观察活动
4. 氢氧化钠的物理性质
[实验8-9]
实验操作 现象 说明氢氧化钠有何性质
(1)取少量固体氢氧化钠放在表面皿上,暴露在空气中一段时间。
(2)取少量固体氢氧化钠放在试管中,加水振荡,观察它的水溶性,并用手触摸试管外壁,感觉温度变化情况。
烧杯中的氢氧化钠逐渐溶解,用手触摸烧杯外壁感觉发烫
表面潮湿并逐渐溶解
潮解性
氢氧化钠易溶于水
并放出大量的热
1. 氢氧化钠潮解的过程是物理变化还是化学变化,如何判断
思考讨论
2. 氢氧化钠易潮解,该如何保存?
物理变化,反应过程中没有新物质生成。
氢氧化钠需密封保存。
思考讨论
3. 根据氢氧化钠易潮解的此性质,有什么用途?
氢氧化钠固体具有吸水性,可作干燥剂,用来干燥某些中性或碱性气体,但不能干燥酸性气体,如HCl、CO2、SO2等。(氢氧化钠溶液无吸水性,不可作干燥剂)
球形干燥管
U形干燥管
拓展延伸
干燥剂的选择原则
干燥剂的选择应根据被干燥气体的性质和干燥剂的性质而定,其原则是干燥剂只能吸收被干燥气体中的水分而不能与被干燥气体发生反应。
CO2(H2O) 选择NaOH固体干燥剂
CO2+NaOH=Na2CO3+H2O
拓展延伸
常见的气体干燥剂 干燥剂 可干燥的气体 不可干燥的气体 装置
酸性 浓硫酸 中性气体:H2、O2、CO、CH4等 碱性气体:NH3
酸性气体:CO2、SO2、HCl等 碱性 固体氢氧化钠、氧化钙 中性气体:H2、O2、CO、CH4等 酸性气体:CO2、SO2、HCl等
碱性气体:NH3 中性 无水氯化铵 除NH3以外的所有气体 NH3 U形干燥管
球形干燥管
碱的化学性质
PART 02
1. 与指示剂反应
紫色石蕊溶液 无色酚酞溶液
氢氧化钠溶液
氢氧化钙溶液
变红
变蓝
变红
变蓝
(1)碱能使紫色石蕊溶液变蓝,能使无色酚酞溶液变红。
2. 探究碱的其他化学共性
[目的]
认识碱的化学性质
学生实验探究
[提出问题]
碱具有哪些化学共性?
[形成假设]
碱溶液能与 发生反应,说说你假设的理由。
某些非金属氧化物和盐溶液
2. 探究碱的其他化学共性——与某些非金属氧化物的反应
[实验8-10]碱溶液与某些非金属氧化物的反应
回顾:
Ca(OH)2 + CO2 === CaCO3↓ + H2O
(碱)
(非金属氧化物)
2. 探究碱的其他化学共性——与某些非金属氧化物的反应
[实验8-10]碱溶液与某些非金属氧化物的反应
实验
实验记录 现象:
右图实验中反应的化学方程式:
两支充满二氧化碳的试管,一支倒插人水中,另一支倒插人氢氧化钠溶液中,摆动试管。
两支试管的液面均上升,右边液面上升比左边试管液面上升的高。
CO2+2NaOH=Na2CO3+H2O
(2)碱 + 非金属氧化物 → 盐 + 水
2. 探究碱的其他化学共性——与某些非金属氧化物的反应
[分析解释]
【实验8-10】中什么现象说明CO2与NaOH溶液发生了反应?
实验中倒插入水中的试管内液面上升的高度远低于倒插入氢氧化钠溶液的试管内液面高度,说明CO2与NaOH发生了反应。
2. 探究碱的其他化学共性——与某些非金属氧化物的反应
[分析解释]
【实验8-10】你还能设计其他实验证明CO2与NaOH溶液发生了反应吗?
鸡蛋被吸入瓶中
瓶内气球变大
石灰水不变浑浊
可通过压强变化或反应物的消失或新物质的生成来判断
2. 探究碱的其他化学共性——与某些非金属氧化物的反应
[反思评价]
为什么用澄清石灰水而不是氢氧化钠溶液来检验二氧化碳?
因为NaOH溶液和CO2反应没有沉淀等明显现象,因此实验室不用NaOH 溶液检验 CO2,而用澄清石灰水。
2. 探究碱的其他化学共性——与盐溶液的反应
[实验8-11]碱溶液与盐溶液的反应
回顾:
2NaOH+CuSO4=== Cu(OH)2↓ + Na2SO4
(碱)
(盐)
(新碱)
(新盐)
实验 向碱溶液中加入合适的试剂,观察现象。
备选试剂:氢氧化钠溶液、氢氧化钙溶液、氯化铁溶液、硫酸铜溶液、碳酸钠溶液
2. 探究碱的其他化学共性——与盐溶液的反应
实验记录:
编号 碱溶液 加入试剂 现象与化学方程式
① 氢氧化钠溶液 氯化铁 溶液 现象:
化学方程式:
② 现象:
化学方程式:
③ 现象:
化学方程式:
有红色沉淀生成
3NaOH+FeCl3=Fe(OH)3↓+3NaCl
氢氧化钙溶液
硫酸铜溶液
氢氧化钙溶液
碳酸钠溶液
有蓝色沉淀生成
Ca(OH)2+CuSO4=Cu(OH)2↓+CaSO4
有白色沉淀生成
Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
(3)碱 + 盐 → 新碱+ 新盐
家庭小实验
[目的]
学习用碱性溶液制作“叶脉书签”
选用有网状叶脉的树叶,洗净。
选叶
用苏打粉溶液或石灰乳浸泡树叶,加热煮沸数分钟,当叶肉绿色褪去并变黄即可取出。
碱煮:
把煮过的叶片用清水漂去碱液,再把叶片平铺在玻璃上用柔软毛刷或牙刷轻刷叶肉,留下叶脉。
清刷
根据自己的喜好,染色并装饰,制成漂亮的“叶脉书签”。
美化
01
02
03
04
总结归纳
1. 下列有关氢氧化钠、氢氧化钙的说法中,错误的是( )
A. 用托盘天平称量它们的质量时,要将它们放在烧杯内称量
B. 它们都具有吸水性,可用作气体干燥剂
C. 氢氧化钠易溶于水,氢氧化钙微溶于水
D. 工业上通常以生石灰和水为原料制取氢氧化钙
随堂练习
B
2. 关于氢氧化钙的下列用途,错误的是( )
A.用于改良酸性土壤
B.用于配制农药波尔多液
C.用于治疗胃酸过多
D.用于制取烧碱
随堂练习
C
随堂练习
3. 含有少量水蒸气和二氧化硫的空气依次通过NaOH溶液、浓硫酸和灼热的铜网,剩余气体是( )
①稀有气体 ②氮气 ③二氧化碳
④二氧化硫 ⑤水蒸气 ⑥氧气
A. ①②⑥ B. ①②⑤
C. ①② D. ①②③④
C
随堂练习
4. 下列对实验意外事故的处理错误的是( )
A. 氢氧化钠溶液不慎沾到皮肤上,要用较多的水冲洗,再涂上硫
酸溶液
B. 实验药液溅入眼睛,立即用水冲洗,切不可用手揉搓
C. 酒精灯洒出的酒精在桌上燃烧,立即用湿布或沙子扑灭
D. 浓硫酸沾到皮肤上,立即用大量的水冲洗,再涂上3%~5%的
碳酸氢钠溶液
A
随堂练习
5. 某同学进行“制作叶脉书签”的家庭小实验时,用苏打粉溶液或石灰乳浸泡树叶并煮沸。下列有关说法错误的是( )
A. 制作过程中涉及化学变化
B. 苏打粉易溶于水,其水溶液显酸性
C. 石灰乳有腐蚀性,可腐蚀叶肉
D. 制作完成后,废液应回收处理
B
谢谢观看
