鲁科版高中化学选择性必修三第一章第三节第一课时烃烷烃及其性质课件(共23张PPT)
文档属性
| 名称 | 鲁科版高中化学选择性必修三第一章第三节第一课时烃烷烃及其性质课件(共23张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 458.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-12 09:44:32 | ||
图片预览








文档简介
(共23张PPT)
第1课时 烷烃及其性质
1.知道烷烃的物理性质的变化与分子中碳原子数目的关系。
2.认识烷烃的结构特征,能以典型代表物为例,理解烷烃的化学性质。
核心素养发展目标
一、烷烃的结构
随堂演练 知识落实
课时对点练
二、烷烃的性质
内
容
索
引
三、烃的燃烧规律
1.概念
烷烃是一种 烃,属于 烃。
2.结构特点
分子中碳原子之间以单键结合,碳原子剩余的价键被氢原子饱和的链烃。
3.通式
。
一、烷烃的结构
饱和链
脂肪
CnH2n+2(n≥1)
(1)在烷烃分子中,所有的碳碳键都是碳碳单键( )
(2)烷烃分子中所有化学键都是极性共价键( )
(3)烷烃分子中所有碳原子都是sp3杂化( )
(4)所有饱和烃都属于烷烃( )
(5)分子式符合CnH2n+2(n≥1)的烃一定是烷烃( )
正误判断
√
×
√
×
√
1.写出下列烃的化学式:
(1)十一烷: 。
(2)十三烷: 。
(3)二十九烷: 。
理解应用
C11H24
C13H28
C29H60
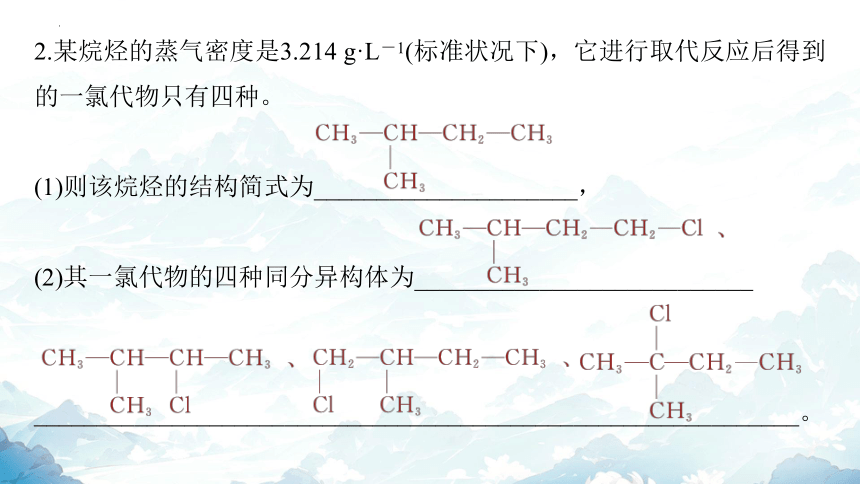
2.某烷烃的蒸气密度是3.214 g·L-1(标准状况下),它进行取代反应后得到的一氯代物只有四种。
(1)则该烷烃的结构简式为_____________________,
(2)其一氯代物的四种同分异构体为___________________________
_____________________________________________________________。
返回
解析 根据烷烃密度可求出其相对分子质量为3.214×22.4≈72,再根据烷烃通式CnH2n+2求出n=5。
二、烷烃的性质
1.物理性质
物理性质 变化规律
状态 烷烃常温下存在的状态由 态逐渐过渡到 态、 态。当碳原子数小于或等于4时,烷烃在常温下呈气态
溶解性 都不溶于 ,易溶于________
沸点 随碳原子数的增加,熔、沸点逐渐 ,同种烷烃的不同异构体中,支链越多,熔、沸点越低
密度 随碳原子数的增加,密度逐渐 ,但比水的___
气
液
固
水
有机溶剂
升高
增大
小
2.化学性质
(1)稳定性
因为烷烃分子中碳氢键和碳碳单键的键能较高,所以常温下烷烃很不活泼,与 、 、 和 都不发生反应。
(2)取代反应
在 条件下,烷烃能与Cl2、Br2等卤素单质发生取代反应。
反应举例:CH3CH3+Cl2 (一氯取代)。
强酸
强碱
强氧化剂
还原剂
光照
CH3CH2Cl+HCl
(3)与氧气的反应
烷烃可在空气或氧气中燃烧生成CO2和H2O,燃烧的通式为
。
(1)甲烷与乙烷具有相似的化学性质( )
(2)烷烃的卤代反应很难得到纯净的产物( )
(3)在光照条件下,烷烃易与溴水发生取代反应( )
(4)除甲烷外,很多烷烃能使酸性KMnO4溶液的紫色褪去( )
(5)含C18以上烷烃的重油经过催化裂化可以得到汽油( )
正误判断
√
√
×
×
√
1.下列关于丙烷结构、性质的推断中正确的是
A.丙烷能使溴水、酸性KMnO4溶液都褪色
B.丙烷可与氯水发生取代反应
C.丙烷的3个碳原子不在同一直线上
D.丙烷可与强酸或强碱反应
理解应用
√
解析 丙烷不能使溴水、酸性KMnO4溶液都褪色,A选项错误;
丙烷可与氯气在光照条件下发生取代反应,但不能与氯水发生取代反应,B选项错误;
丙烷的3个碳原子呈锯齿形排列,不在同一直线上,C选项正确;
丙烷与强酸或强碱不反应,D选项错误。
2.光照条件下,将1 mol甲烷和1 mol氯气混合充分反应后,得到的产物为
A.CH3Cl、HCl
B.HCl、CCl4
C.CH3Cl、CH2Cl2
D.CH3Cl、CH2Cl2、CHCl3、CCl4、HCl
√
解析 虽然甲烷和氯气按等物质的量混合,但实际上反应不会只停留在生成CH3Cl的第一步取代,而是逐步发生四步取代反应,所以生成物就是CH3Cl、CH2Cl2、CHCl3、CCl4、HCl。
烷烃卤代反应需注意的5个方面
归纳总结
返回
(1)反应的条件——光照。
(2)反应物状态——卤素单质(F2、Cl2、Br2、I2)而不是其水溶液。
(3)反应的特点——氢原子被卤素原子逐步取代,多步反应同时进行。
(4)反应产物——混合物(多种卤代烃),不适宜制备卤代烃。
(5)定量关系——n(X2)=n(一卤代物)+2n(二卤代物)+3n(三卤代物)+…=n(HX)。
三、烃的燃烧规律
1.烃类(CxHy)完全燃烧的化学方程式:
。
2.烃完全燃烧耗氧量与生成CO2和H2O的规律
(1)等质量的烃(CxHy)完全燃烧时, 的值越大,则H元素的质量分数越 ,耗氧量越 ,生成的水越 ,生成的CO2 。
(2)等物质的量的烃(CxHy)完全燃烧时, 的值越大,耗氧量越多。其中 值越大,生成的CO2越多; 值越大,生成的水越多。
大
多
越少
多
x
y
x+
(3)最简式(实验式)相同的有机物不论以何种比例混合,只要混合物的总质量一定,则完全燃烧时生成的CO2的量 ,生成的H2O的量 ,耗氧量也 。
(4)不同的有机物完全燃烧时,若生成的CO2和H2O的物质的量之比相同,则它们分子中C原子与H原子的原子个数比也相同。
一定
一定
一定
3.同温同压下,气态烃(CxHy)完全燃烧前后气体体积变化规律
(1)燃烧后温度高于100 ℃时,水为气态
反应前后气体体积变化 V前=V后 V前>V后 V前<V后
x、y满足的条件 _____ _____ _____
(2)燃烧后温度低于100 ℃时,水为液态,反应后气体体积变化是 。
y=4
y<4
y>4
1.下列各组化合物中,不论两者以什么比例混合,只要总质量一定,则完全燃烧时消耗O2的质量和生成水或CO2的质量不变的是
A.CH4 C2H6 B.C2H6 C3H6
C.C2H4 C3H6 D.C2H4 C3H4
理解应用
√
解析 质量一定时,生成的水或CO2的质量不变,则两种有机物中C、H的质量分数分别相等。C项,由于两者的最简式相同,因此两种有机物中C和H的质量分数相同,故只要质量一定时,则完全燃烧时消耗O2的质量、生成水的质量和CO2的质量不变。
2.25 ℃时,10 mL某气态烃和50 mL氧气混合,完全燃烧后恢复到原来的温度和压强,体积变为35 mL,则该烃可能为
A.CH4 B.C2H4
C.C3H6 D.C4H6
√
解析 设该气态烃分子式为CxHy,
10 mL V mL(耗氧) 10 mL+50 mL
-35 mL=25 mL
利用烃类燃烧通式处理相关问题时的注意事项
归纳总结
返回
(1)水的状态是液态还是气态。
(2)气态烃完全燃烧前后,气体体积变化只与烃分子中氢原子个数有关。
(3)注意烃是否完全燃烧,也就是O2是否足量。
第1课时 烷烃及其性质
1.知道烷烃的物理性质的变化与分子中碳原子数目的关系。
2.认识烷烃的结构特征,能以典型代表物为例,理解烷烃的化学性质。
核心素养发展目标
一、烷烃的结构
随堂演练 知识落实
课时对点练
二、烷烃的性质
内
容
索
引
三、烃的燃烧规律
1.概念
烷烃是一种 烃,属于 烃。
2.结构特点
分子中碳原子之间以单键结合,碳原子剩余的价键被氢原子饱和的链烃。
3.通式
。
一、烷烃的结构
饱和链
脂肪
CnH2n+2(n≥1)
(1)在烷烃分子中,所有的碳碳键都是碳碳单键( )
(2)烷烃分子中所有化学键都是极性共价键( )
(3)烷烃分子中所有碳原子都是sp3杂化( )
(4)所有饱和烃都属于烷烃( )
(5)分子式符合CnH2n+2(n≥1)的烃一定是烷烃( )
正误判断
√
×
√
×
√
1.写出下列烃的化学式:
(1)十一烷: 。
(2)十三烷: 。
(3)二十九烷: 。
理解应用
C11H24
C13H28
C29H60
2.某烷烃的蒸气密度是3.214 g·L-1(标准状况下),它进行取代反应后得到的一氯代物只有四种。
(1)则该烷烃的结构简式为_____________________,
(2)其一氯代物的四种同分异构体为___________________________
_____________________________________________________________。
返回
解析 根据烷烃密度可求出其相对分子质量为3.214×22.4≈72,再根据烷烃通式CnH2n+2求出n=5。
二、烷烃的性质
1.物理性质
物理性质 变化规律
状态 烷烃常温下存在的状态由 态逐渐过渡到 态、 态。当碳原子数小于或等于4时,烷烃在常温下呈气态
溶解性 都不溶于 ,易溶于________
沸点 随碳原子数的增加,熔、沸点逐渐 ,同种烷烃的不同异构体中,支链越多,熔、沸点越低
密度 随碳原子数的增加,密度逐渐 ,但比水的___
气
液
固
水
有机溶剂
升高
增大
小
2.化学性质
(1)稳定性
因为烷烃分子中碳氢键和碳碳单键的键能较高,所以常温下烷烃很不活泼,与 、 、 和 都不发生反应。
(2)取代反应
在 条件下,烷烃能与Cl2、Br2等卤素单质发生取代反应。
反应举例:CH3CH3+Cl2 (一氯取代)。
强酸
强碱
强氧化剂
还原剂
光照
CH3CH2Cl+HCl
(3)与氧气的反应
烷烃可在空气或氧气中燃烧生成CO2和H2O,燃烧的通式为
。
(1)甲烷与乙烷具有相似的化学性质( )
(2)烷烃的卤代反应很难得到纯净的产物( )
(3)在光照条件下,烷烃易与溴水发生取代反应( )
(4)除甲烷外,很多烷烃能使酸性KMnO4溶液的紫色褪去( )
(5)含C18以上烷烃的重油经过催化裂化可以得到汽油( )
正误判断
√
√
×
×
√
1.下列关于丙烷结构、性质的推断中正确的是
A.丙烷能使溴水、酸性KMnO4溶液都褪色
B.丙烷可与氯水发生取代反应
C.丙烷的3个碳原子不在同一直线上
D.丙烷可与强酸或强碱反应
理解应用
√
解析 丙烷不能使溴水、酸性KMnO4溶液都褪色,A选项错误;
丙烷可与氯气在光照条件下发生取代反应,但不能与氯水发生取代反应,B选项错误;
丙烷的3个碳原子呈锯齿形排列,不在同一直线上,C选项正确;
丙烷与强酸或强碱不反应,D选项错误。
2.光照条件下,将1 mol甲烷和1 mol氯气混合充分反应后,得到的产物为
A.CH3Cl、HCl
B.HCl、CCl4
C.CH3Cl、CH2Cl2
D.CH3Cl、CH2Cl2、CHCl3、CCl4、HCl
√
解析 虽然甲烷和氯气按等物质的量混合,但实际上反应不会只停留在生成CH3Cl的第一步取代,而是逐步发生四步取代反应,所以生成物就是CH3Cl、CH2Cl2、CHCl3、CCl4、HCl。
烷烃卤代反应需注意的5个方面
归纳总结
返回
(1)反应的条件——光照。
(2)反应物状态——卤素单质(F2、Cl2、Br2、I2)而不是其水溶液。
(3)反应的特点——氢原子被卤素原子逐步取代,多步反应同时进行。
(4)反应产物——混合物(多种卤代烃),不适宜制备卤代烃。
(5)定量关系——n(X2)=n(一卤代物)+2n(二卤代物)+3n(三卤代物)+…=n(HX)。
三、烃的燃烧规律
1.烃类(CxHy)完全燃烧的化学方程式:
。
2.烃完全燃烧耗氧量与生成CO2和H2O的规律
(1)等质量的烃(CxHy)完全燃烧时, 的值越大,则H元素的质量分数越 ,耗氧量越 ,生成的水越 ,生成的CO2 。
(2)等物质的量的烃(CxHy)完全燃烧时, 的值越大,耗氧量越多。其中 值越大,生成的CO2越多; 值越大,生成的水越多。
大
多
越少
多
x
y
x+
(3)最简式(实验式)相同的有机物不论以何种比例混合,只要混合物的总质量一定,则完全燃烧时生成的CO2的量 ,生成的H2O的量 ,耗氧量也 。
(4)不同的有机物完全燃烧时,若生成的CO2和H2O的物质的量之比相同,则它们分子中C原子与H原子的原子个数比也相同。
一定
一定
一定
3.同温同压下,气态烃(CxHy)完全燃烧前后气体体积变化规律
(1)燃烧后温度高于100 ℃时,水为气态
反应前后气体体积变化 V前=V后 V前>V后 V前<V后
x、y满足的条件 _____ _____ _____
(2)燃烧后温度低于100 ℃时,水为液态,反应后气体体积变化是 。
y=4
y<4
y>4
1.下列各组化合物中,不论两者以什么比例混合,只要总质量一定,则完全燃烧时消耗O2的质量和生成水或CO2的质量不变的是
A.CH4 C2H6 B.C2H6 C3H6
C.C2H4 C3H6 D.C2H4 C3H4
理解应用
√
解析 质量一定时,生成的水或CO2的质量不变,则两种有机物中C、H的质量分数分别相等。C项,由于两者的最简式相同,因此两种有机物中C和H的质量分数相同,故只要质量一定时,则完全燃烧时消耗O2的质量、生成水的质量和CO2的质量不变。
2.25 ℃时,10 mL某气态烃和50 mL氧气混合,完全燃烧后恢复到原来的温度和压强,体积变为35 mL,则该烃可能为
A.CH4 B.C2H4
C.C3H6 D.C4H6
√
解析 设该气态烃分子式为CxHy,
10 mL V mL(耗氧) 10 mL+50 mL
-35 mL=25 mL
利用烃类燃烧通式处理相关问题时的注意事项
归纳总结
返回
(1)水的状态是液态还是气态。
(2)气态烃完全燃烧前后,气体体积变化只与烃分子中氢原子个数有关。
(3)注意烃是否完全燃烧,也就是O2是否足量。
