四川省达州市万源中学2024-2025学年高二下学期期中考试化学试卷(含解析)
文档属性
| 名称 | 四川省达州市万源中学2024-2025学年高二下学期期中考试化学试卷(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-10 11:54:00 | ||
图片预览




文档简介
四川省万源中学高2026届期中考试试题(高二.下)
化学试卷
(考试时间75分钟,总分100分)
可能用到的相对原子质量: H-1 N- 14 O-16 Na-23 Si-28 Ti-48 Sr-88 Cu-64
一、单选题 (本题共 14 小题 ,每小题 3 分 ,共 42 分。在每小题给出的四个选项中 ,只有一项是最符合题目要求的。)
1.李时珍在《本草纲目》中写道:“烧酒非古法也,自元时始创其法。用浓酒和糟入甑,蒸令气上,用器承取滴露。”“凡酸坏之酒,皆可蒸烧”“以烧酒复烧二次,……,价值数倍也。”这里用到的方法可用于分离
A.硝酸钾和氯化钾 B.四氯化碳和水
C.甲醇和正丁醇 D.碘水
2.下列现代方法能够测定分子官能团和化学键的是
A.质谱法 B.红外光谱法 C.色谱法 D.核磁共振氢谱
3.下列化学用语或图示正确的是
A.p—p π键电子云轮廓图
B.基态磷原子的轨道表示式:
C.PH3的空间结构模型:
D.价层电子对互斥()模型:
4.解释下列现象的原因正确的是
选项 现象 原 因
A HF的稳定性强于HCl HF分子之间除了范德华力以外还存在氢键
B 碱金属中的熔点最高 碱金属中的价电子数最少,金属键最强
C 熔点: 、随着离子半径的增大,晶体的熔点降低
D 熔点: 熔化时要断开化学键,只需克服范德华力
A.A B.B C.C D.D
5.下列图示的仪器使用正确的是
A.甲:用于保存硅酸钠溶液
B.乙:用于将干海带灼烧成海带灰
C.丙:用于分离饱和碳酸钠溶液和乙酸乙酯
D.丁:用于量取8.00mL某浓度的硫酸铜溶液
6.下列实验有关操作不正确的是
选项 被提纯物(杂质) 除杂方法
A 苯甲酸(NaCl) 重结晶
B C2H5OH(H2O) 加入生石灰,蒸馏
C 乙烷(乙烯) 通入酸性高锰酸钾溶液
D 溴苯(Br2) 加入NaOH溶液
7.下列化学方程式、离子方程式书写以及原理分析错误的是
A.向硫酸铜溶液中加入过量氨水得到深蓝色透明溶液,再加入乙醇析出深蓝色晶体,其总反应为:4NH3 +H2O + CuSO4 =[Cu(NH3)4]SO4·H2O↓
B.镁条在干冰中燃烧:生成黑白两种固体
C.往AgCl浊液中滴入稀氨水后变澄清:
D.向含固态I2的碘水中加入KI固体,可以增大I2的溶解度:I2+KIKI3,溶质极性发生改变
8.用表示阿伏加德罗常数的值。下列说法正确的是
A.60gSiO2晶体中含共价键数目为4NA
B.标准状况下,22.4 LCCl4所含共价键数目为4NA
C.1.6g基态氧原子所含成对电子数为0.2NA
D.18gH2O中含氢键的数目为2NA
9.常用于治疗脑水肿及青光眼的山梨醇和异山梨醇结构如下,下列说法不正确的是
A.二者均含有相同类型和数目的σ键 B.山梨醇在水中的溶解度较大
C.二者碳原子均采用杂化 D.二者均含手性碳原子
10.某营养补充剂的结构如图所示。W、X、Y、Z为原子序数依次增大的短周期元素,X、Y、Z同周期,的电子总数为23,R是血红蛋白中重要的金属元素。下列说法正确的是
A.电负性:
B.第一电离能:
C.简单氢化物的热稳定性:
D.基态原子的未成对电子数:
11.利用脱除汽车尾气中CO和NO的反应过程如下图所示。下列说法错误的是
已知:①中部分转化成。
A.该反应的催化剂为
B.大力推广该技术可减少酸雨的发生
C.当时,中
D.过程②中,每脱除1molNO转移2mol电子
12.下列关于含氯微粒的说法不正确的是
A.ClO的空间构型为V形 B.ClO的键角为120°
C.ClO2属于共价化合物 D.ClO中心原子轨道杂化类型为sp3
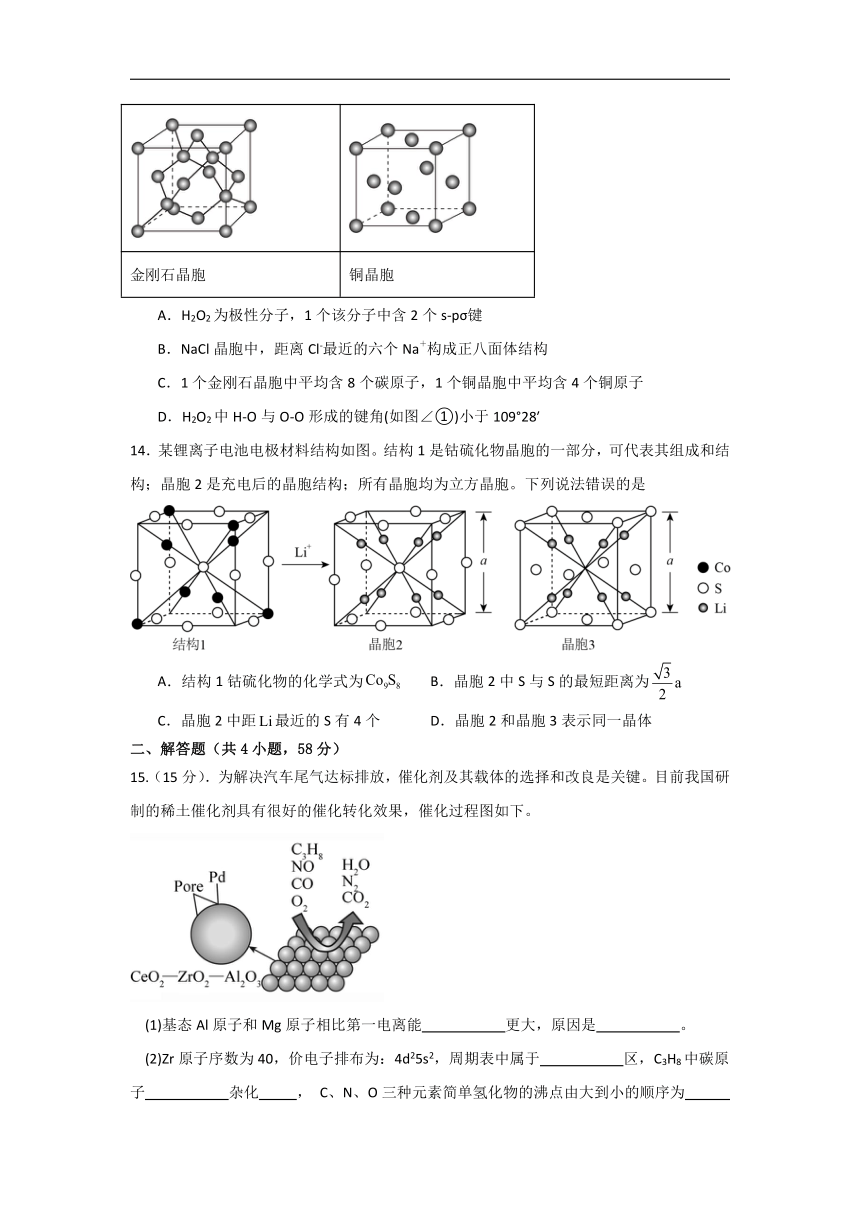
13.下图依次为H2O2空间结构、NaCl晶胞、金刚石晶胞、铜晶胞,下列说法不正确的是
H2O2空间结构 NaCl晶胞
金刚石晶胞 铜晶胞
A.H2O2为极性分子,1个该分子中含2个s-pσ键
B.NaCl晶胞中,距离Cl-最近的六个Na+构成正八面体结构
C.1个金刚石晶胞中平均含8个碳原子,1个铜晶胞中平均含4个铜原子
D.H2O2中H-O与O-O形成的键角(如图∠①)小于109°28′
14.某锂离子电池电极材料结构如图。结构1是钴硫化物晶胞的一部分,可代表其组成和结构;晶胞2是充电后的晶胞结构;所有晶胞均为立方晶胞。下列说法错误的是
A.结构1钴硫化物的化学式为 B.晶胞2中S与S的最短距离为
C.晶胞2中距最近的S有4个 D.晶胞2和晶胞3表示同一晶体
二、解答题(共4小题,58分)
15.(15分).为解决汽车尾气达标排放,催化剂及其载体的选择和改良是关键。目前我国研制的稀土催化剂具有很好的催化转化效果,催化过程图如下。
(1)基态Al原子和Mg原子相比第一电离能 更大,原因是 。
(2)Zr原子序数为40,价电子排布为:4d25s2,周期表中属于 区,C3H8中碳原子 杂化 , C、N、O三种元素简单氢化物的沸点由大到小的顺序为 (用相应分子式表示)。
(3)CO、NO均能够与血红蛋白(Hb)中Fe2+形成稳定的配合物使血红蛋白失去携氧能力,因而具有毒性。已知:CO进入血液后有如下平衡:CO+HbO2 O2+HbCO,基态Fe2+中未成对电子数为 ,在CO、NO结构中,C、N、O原子均含有孤电子对,与Fe2+配位时,配位原子均不是O原子,理由是 。
(4)为节省贵金属并降低成本,常用某些复合型物质作催化剂。一种复合型物质的立方体晶胞结构如上图所示。
①该复合型物质的化学式为 。
②已知阿伏加德罗常数值为NA,该晶体的密度为ρ g/cm3,则该晶胞的边长为 pm(用含NA和ρ表达式表示)。
16.(16分).金属铟()广泛应用于生产液晶显示器和平板屏幕,以闪锌矿(主要成分是ZnS,还有等元素)为原料生产Zn并提取铟,工艺流程如图所示。回答下列问题:
已知:i.CuCl难溶于水,不溶于稀酸。 ii.常温下数据如下:
物质 In(OH)3 Fe(OH)2 Fe(OH)3
1.4×10-33 8.0×10-16 4.0×10-38
(1)基态Cu的价电子排布图(轨道表示式) ,“焙烧”时还产生难溶于H2SO4的ZnFe2O4和In2(Fe2O4)3,其中In2(Fe2O4)3中的化合价为 ,H2SO4中的杂化轨道模型为 (用文字描述)。
(2)上清液中钴以Co2+存在,“除钴”时Na2S2O8作 (填“氧化剂”或“还原剂”);“脱氯”时发生反应,脱氯率与时间关系如下图所示,最适宜的反应时间为 ,上述流程可循环利用的物质除铜外有 (填化学式)。
写出酸性条件下SO2还原In2(Fe2O4)3得到In3+和Fe2+的离子方程式 ;要水解得到In(OH)3,需先将ZnFe2O4和In2(Fe2O4)3中的Fe“还原”为+2价,原因是 。
17.(12分).X仅含C、H、O三种元素,取6.00g X与纯氧在加热条件下充分反应,实验如图所示:
(1)实验结束后,发现B装置增重3.60g,C装置增重15.84g,X的实验式为 。
(2)D装置中盛装的药品为 ,若省去装置D,会导致测得的X分子中, 原子质量分数偏高(写元素符号)。
(3)通过质谱法获得X的分子量为150,测得X分子的红外光谱如图所示,且该化合物X能使石蕊变红,则X中官能团的名称是 ,根据以上证据推断该分子有 种可能的结构。
若X分子在核磁共振氢谱上的峰面积之比为1:1:2:6,可推知X的结构简式可能为 。(任写一种)
18.(15分).学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:
(1)铜与浓硝酸反应的装置如下图,仪器A的名称为 ,装置B的作用为 。
(2)铜与过量反应的探究如下:
实验②中Cu溶解溶液变蓝的离子方程式为 ;产生的气体为 。比较实验①和②,从氧化还原角度说明H+的作用是 。
(3)用足量NaOH处理实验②新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,其中原子个数比为1:2,离子个数比1:1。X的化学式为 。
(4)取含X粗品0.0960g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用标准溶液滴定,滴定终点时消耗标准溶液20.00mL。(已知:,)标志滴定终点的现象是 ,粗品中X的相对含量为
参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 C B A C C C D A A D
题号 11 12 13 14
答案 C B A B
2.B
【详解】A.质谱法用于测定有机物的相对分子质量,不能测定出有机物的化学键和官能团,A错误;
B.红外光谱仪能测定出有机物的官能团和化学键,B正确;
C.色谱法(chromatography)又称“色谱分析”、“色谱分析法”、“层析法”,是一种分离和分析方法,在分析化 学、有机化学、生物化学等领域有着非常广泛的应用,C错误;
D.核磁共振氢谱用于测定有机物分子中氢原子的种类和数目,不能测定出有机物的化学键和官能团,故D错误;
故选B。
3.A
【详解】
A.P-Pπ键的原子轨道以肩并肩方式重叠形成π键,故其电子云轮廓图为,故A正确;
B.P的原子序数为15,根据泡利原理和洪特规则,基态磷原子的轨道表示式:,故B错误;
C.PH3与NH3的空间结构模型相同,均为三角锥形,为其VSEPR 模型,故C错误;
D.B价层电子对:=3,价层电子对互斥(VSEPR)模型为:,故D错误;
答案选A。
6.D
【详解】A.氢键使冰晶体中的水分子呈一定规则的排列,空间利用率低,体积变大,密度变小,所以密度:冰<水,故A不符合题意;
B.邻羟基苯甲醛可以形成分子内氢键,对羟基苯甲醛可以形成分子间氢键,分子间氢键对物质熔沸点的影响更大,所以沸点:邻羟基苯甲醛<对羟基苯甲醛,故B不符合题意;
C.含有氢键的氢化物易液化,NH3分子间存在氢键,PH3分子间不存在氢键,所以氨气易液化,此性质和氢键有关,故C不符合题意;
D.原子半径:N<P,键长N-H<P-H,键能:N-H>P-H,分子稳定性:NH3>PH3,与氢键无关,故D符合题意;
故选:D。
8.A
【详解】A.是,硅原子通过共价键连接个氧原子,形成个键,所以共价键数目为,A正确;
B.标准状况下,是液体,不能计算其物质的量,B错误;
C.氧原子是,基态氧原子的电子排布式为:,上有两个未成对电子,一共有6个电子成对,含成对电子数为,C错误;
D.常温下,水为液态,分子中含有的氢键数目不能确定,所以无法计算水分子中含有的氢键数目,其中所含的键为,D错误;
故选A。
9.A
【详解】A.山梨醇中σ键数目为25,异山梨醇中σ键数目为21,故A错误;
B.山梨醇含有羟基数目多,在水中的溶解度较大,故B正确;
C.二者碳原子均为单键碳,均采用杂化,故C正确;
D.连有4个不同原子或原子团的碳原子为手性碳,、均含手性碳原子(*号标出),故D正确;
选A。
13.A
【详解】A.H2O2中O采用sp3杂化,1个该分子中含2个s-sp3σ键,H2O2为极性分子,故A错误;
B.根据图示,NaCl晶胞中,距Cl-最近的Na+是6个,距离Cl-最近的六个Na+构成正八面体结构,故B正确;
C.根据均摊原则,1个金刚石晶胞中平均含碳原子数为 ,1个铜晶胞中平含铜原子数,故C正确;
D.H2O2中O采用sp3杂化,O原子有2个孤电子对,所以H-O与O-O形成的键角(如图∠①)小于109°28′,故D正确;
选A。
14.B
【详解】.A.由均摊法得,结构1中含有Co的数目为,含有S的数目为,Co与S的原子个数比为9:8,因此结构1的化学式为Co9S8,故A正确;
B.由图可知,晶胞2中S与S的最短距离为面对角线的,晶胞边长为a,即S与S的最短距离为:,故B错误;
C.如图:,以图中的Li为例,与其最近的S共4个,故C正确;
D.如图,当2个晶胞2放在一起时,图中红框截取的部分就是晶胞3,晶胞2和晶胞3表示同一晶体,故D正确;
故选B。
15(15分).(1) Mg 镁原子价电子为3s2全满稳定状态,电离能较大,故Al的第一电离能比Mg小(2分)
(2) d sp3 (2分) H2O>NH3>CH4(2分)
(3) 4 O电负性比N和C大 ,成键时不易给出孤电子对,不易和Fe2+配位(2分)
(4) SrTiO3(2分) ×1010(2分)
【详解】(1)同一周期随着原子序数变大,第一电离能变大,但是镁原子价电子为3s2全满稳定状态,电离能较大,故Al的第一电离能比Mg小;
(2)Zr原子序数为40,价电子排布为:4d25s2,电子层数为5,Zr位于第五周期第ⅣB族,在周期表中属于d区,C3H8中碳原子形成4个共价键,为sp3杂化;C、N、O三种元素的简单氢化物分别为CH4、NH3、H2O,NH3和H2O分子间有氢键,其沸点高于CH4,水分子间的氢键比NH3分子间的氢键强且多,所以水的沸点高于NH3,所以C、N、O三种元素简单氢化物的沸点由大到小的顺序为H2O>NH3>CH4;
(3)铁失去2个电子形成亚铁离子,基态Fe2+原子核外电子排布为1s22s22p63s23p63d6,基态Fe2+中未成对电子数为4;在CO、NO结构中,C、N、O原子均含有孤电子对,与Fe2+配位时,配位原子均不是O原子,理由是O电负性比N和C大 ,成键时不易给出孤电子对,不易和Fe2+配位;
(4)据“均摊法”,晶胞中含个Ti、个O、1个Sr,该复合型物质的化学式为SrTiO3,则晶体密度为,a=×1010pm。
16(16分).(1) +3 正四面体形
(2) 氧化剂 1.5h H2SO4、SO2
(3) 12H++3SO2+In2(Fe2O4)3=2 In3++6 Fe2++3+6H2O Fe(OH)3的Ksp小于In(OH)3,将Fe由+3价还原为Fe2+,可以在调节pH时,In3+沉淀析出而Fe2+仍留在溶液中而分离
【分析】闪锌矿(主要成分是ZnS,还有In、Fe、Co、Cl等元素)焙烧产生气体和焙烧产物,焙烧产物用H SO “溶浸”得到上 清液和浸渣,上清液中用 “除钴”得到,然后加入铜渣“脱氯”得到,接着加入Zn将Cu 转化成 Cu而除去,最后电解溶液得到Zn;浸渣用还原的产物水解得到。
【详解】(1)
①基态Cu的价电子排布图:,轨道表示式为;
②中Fe、O元素的化合价分别为+3、-2价,根据化合物中元素的正负化合价代数和为0,In元素的化合价为 +3价;
③中中心S原子的价层电子对数=,无孤电子对,杂化轨道模型为正四面体。
(2)①上清液中钴以Co 存在,“除钴”时加入将转化成,Co元素的化合价升高,则被还原、 作氧化剂;
②从脱氯率与时间关系图可知,最适宜反应时间为1.5h,此时脱氯率最高;
③“脱氯”反应生成,“除铜”时又转化为Cu,参与还原步骤后又可通过水解步骤生成,电解溶液得到Zn,同时生成和所以可循环利用的物质除铜外还有和。
(3)①酸性条件下还原得到和,被氧化为,根据得失电子守恒、电荷守恒和原子守恒,离子方程式为: ;
②要水解得到,需先将和中的Fe还原为+2价,因为的小于,将Fe由还原为,可以在调节pH时,沉淀析出而仍留在溶液中而分离。
17(12分).(1)C9H10O2
(2) 碱石灰 C
(3) 羧基 14
(4)或
【分析】X仅含C、H、O三种元素,与氧气充分反应后,生产二氧化碳和水,装置B使用无水氯化钙吸收水蒸气,装置C吸收二氧化碳,装置D是防止空气进入装置干扰实验。
【详解】(1)装置B增重的质量是生成水的质量,为3.6g,物质的量为0.2mol,装置C增重的质量是二氧化碳的质量,为15.84g,0.36mol,以上可知,有机物中含氢元素的质量是0.4g,含碳元素的质量是4.32g,X的总质量是6.00g,则含氧质量为(6.00-0.4-4.32)g=1.28,为0.08mol,则化学式中C、H、O个数比为0.36:0.4:0.08=9:10:2,X的实验式是C9H10O2。
(2)装置D是防止空气中水和二氧化碳进入装置干扰实验,盛装的药品是碱石灰。若省去装置D,装置C中可能会吸收空气成分,导致测得CO2质量增加,会导致测得的X分子中,C原子质量分数偏高,故答案是碱石灰、C。
(3)
根据红外光谱,且X能使石蕊变红,X的结构中含苯环、羧基。X中官能团的名称是羧基故答案是羧基、14。
(4)
若X分子在核磁共振氢谱上的峰面积之比为1:1:2:6,可推知X的结构简式可能为或 。
18.(15分 )(1) 具支试管1分 防倒吸
(2) Cu+H2O2+2H+= Cu2++2H2O O2 既不是氧化剂,又不是还原剂,能增强过氧化氢的氧化性
(3)CuO2
(4) 当滴入最后半滴Na2S2O3标准溶液后,溶液蓝色刚好褪去,且半分钟不恢复原来的颜色 66.67%或2/3
【详解】(1)由图可知,仪器A的名称为具支试管;铜和浓硝酸反应生成硝酸铜和二氧化氮,其中二氧化氮易溶于水,需要防倒吸,则装置B的作用为防倒吸;
(2)根据实验现象,铜片溶解,溶液变蓝,可知在酸性条件下铜和过氧化氢发生反应,生成硫酸铜,离子方程式为:Cu+H2O2+2H+= Cu2++2H2O;硫酸铜可以催化过氧化氢分解生成氧气,则产生的气体为O2;在铜和过氧化氢的反应过程中,氢元素的化合价没有发生变化,但反应现象明显,故从氧化还原角度说明的作用是:既不是氧化剂,又不是还原剂,但可增强H2O2氧化性;
(3)离子个数比1:1,原子个数比为1:2,铜的化合价为+1、+2,氧的化合价可以为-2或-1(过氧根离子),根据化合价代数和为零,则X为CuO2;
(4)滴定结束的时候,单质碘消耗完,则标志滴定终点的现象是:当滴入最后半滴Na2S2O3标准溶液后,溶液蓝色刚好褪去,且半分钟不恢复原来的颜色;在CuO2中铜为+2价,氧为-1价,根据,可以得到关系式:,则n(CuO2)=×0.1mol/L×0.02L= mol,粗品中X的相对含量为。
化学试卷
(考试时间75分钟,总分100分)
可能用到的相对原子质量: H-1 N- 14 O-16 Na-23 Si-28 Ti-48 Sr-88 Cu-64
一、单选题 (本题共 14 小题 ,每小题 3 分 ,共 42 分。在每小题给出的四个选项中 ,只有一项是最符合题目要求的。)
1.李时珍在《本草纲目》中写道:“烧酒非古法也,自元时始创其法。用浓酒和糟入甑,蒸令气上,用器承取滴露。”“凡酸坏之酒,皆可蒸烧”“以烧酒复烧二次,……,价值数倍也。”这里用到的方法可用于分离
A.硝酸钾和氯化钾 B.四氯化碳和水
C.甲醇和正丁醇 D.碘水
2.下列现代方法能够测定分子官能团和化学键的是
A.质谱法 B.红外光谱法 C.色谱法 D.核磁共振氢谱
3.下列化学用语或图示正确的是
A.p—p π键电子云轮廓图
B.基态磷原子的轨道表示式:
C.PH3的空间结构模型:
D.价层电子对互斥()模型:
4.解释下列现象的原因正确的是
选项 现象 原 因
A HF的稳定性强于HCl HF分子之间除了范德华力以外还存在氢键
B 碱金属中的熔点最高 碱金属中的价电子数最少,金属键最强
C 熔点: 、随着离子半径的增大,晶体的熔点降低
D 熔点: 熔化时要断开化学键,只需克服范德华力
A.A B.B C.C D.D
5.下列图示的仪器使用正确的是
A.甲:用于保存硅酸钠溶液
B.乙:用于将干海带灼烧成海带灰
C.丙:用于分离饱和碳酸钠溶液和乙酸乙酯
D.丁:用于量取8.00mL某浓度的硫酸铜溶液
6.下列实验有关操作不正确的是
选项 被提纯物(杂质) 除杂方法
A 苯甲酸(NaCl) 重结晶
B C2H5OH(H2O) 加入生石灰,蒸馏
C 乙烷(乙烯) 通入酸性高锰酸钾溶液
D 溴苯(Br2) 加入NaOH溶液
7.下列化学方程式、离子方程式书写以及原理分析错误的是
A.向硫酸铜溶液中加入过量氨水得到深蓝色透明溶液,再加入乙醇析出深蓝色晶体,其总反应为:4NH3 +H2O + CuSO4 =[Cu(NH3)4]SO4·H2O↓
B.镁条在干冰中燃烧:生成黑白两种固体
C.往AgCl浊液中滴入稀氨水后变澄清:
D.向含固态I2的碘水中加入KI固体,可以增大I2的溶解度:I2+KIKI3,溶质极性发生改变
8.用表示阿伏加德罗常数的值。下列说法正确的是
A.60gSiO2晶体中含共价键数目为4NA
B.标准状况下,22.4 LCCl4所含共价键数目为4NA
C.1.6g基态氧原子所含成对电子数为0.2NA
D.18gH2O中含氢键的数目为2NA
9.常用于治疗脑水肿及青光眼的山梨醇和异山梨醇结构如下,下列说法不正确的是
A.二者均含有相同类型和数目的σ键 B.山梨醇在水中的溶解度较大
C.二者碳原子均采用杂化 D.二者均含手性碳原子
10.某营养补充剂的结构如图所示。W、X、Y、Z为原子序数依次增大的短周期元素,X、Y、Z同周期,的电子总数为23,R是血红蛋白中重要的金属元素。下列说法正确的是
A.电负性:
B.第一电离能:
C.简单氢化物的热稳定性:
D.基态原子的未成对电子数:
11.利用脱除汽车尾气中CO和NO的反应过程如下图所示。下列说法错误的是
已知:①中部分转化成。
A.该反应的催化剂为
B.大力推广该技术可减少酸雨的发生
C.当时,中
D.过程②中,每脱除1molNO转移2mol电子
12.下列关于含氯微粒的说法不正确的是
A.ClO的空间构型为V形 B.ClO的键角为120°
C.ClO2属于共价化合物 D.ClO中心原子轨道杂化类型为sp3
13.下图依次为H2O2空间结构、NaCl晶胞、金刚石晶胞、铜晶胞,下列说法不正确的是
H2O2空间结构 NaCl晶胞
金刚石晶胞 铜晶胞
A.H2O2为极性分子,1个该分子中含2个s-pσ键
B.NaCl晶胞中,距离Cl-最近的六个Na+构成正八面体结构
C.1个金刚石晶胞中平均含8个碳原子,1个铜晶胞中平均含4个铜原子
D.H2O2中H-O与O-O形成的键角(如图∠①)小于109°28′
14.某锂离子电池电极材料结构如图。结构1是钴硫化物晶胞的一部分,可代表其组成和结构;晶胞2是充电后的晶胞结构;所有晶胞均为立方晶胞。下列说法错误的是
A.结构1钴硫化物的化学式为 B.晶胞2中S与S的最短距离为
C.晶胞2中距最近的S有4个 D.晶胞2和晶胞3表示同一晶体
二、解答题(共4小题,58分)
15.(15分).为解决汽车尾气达标排放,催化剂及其载体的选择和改良是关键。目前我国研制的稀土催化剂具有很好的催化转化效果,催化过程图如下。
(1)基态Al原子和Mg原子相比第一电离能 更大,原因是 。
(2)Zr原子序数为40,价电子排布为:4d25s2,周期表中属于 区,C3H8中碳原子 杂化 , C、N、O三种元素简单氢化物的沸点由大到小的顺序为 (用相应分子式表示)。
(3)CO、NO均能够与血红蛋白(Hb)中Fe2+形成稳定的配合物使血红蛋白失去携氧能力,因而具有毒性。已知:CO进入血液后有如下平衡:CO+HbO2 O2+HbCO,基态Fe2+中未成对电子数为 ,在CO、NO结构中,C、N、O原子均含有孤电子对,与Fe2+配位时,配位原子均不是O原子,理由是 。
(4)为节省贵金属并降低成本,常用某些复合型物质作催化剂。一种复合型物质的立方体晶胞结构如上图所示。
①该复合型物质的化学式为 。
②已知阿伏加德罗常数值为NA,该晶体的密度为ρ g/cm3,则该晶胞的边长为 pm(用含NA和ρ表达式表示)。
16.(16分).金属铟()广泛应用于生产液晶显示器和平板屏幕,以闪锌矿(主要成分是ZnS,还有等元素)为原料生产Zn并提取铟,工艺流程如图所示。回答下列问题:
已知:i.CuCl难溶于水,不溶于稀酸。 ii.常温下数据如下:
物质 In(OH)3 Fe(OH)2 Fe(OH)3
1.4×10-33 8.0×10-16 4.0×10-38
(1)基态Cu的价电子排布图(轨道表示式) ,“焙烧”时还产生难溶于H2SO4的ZnFe2O4和In2(Fe2O4)3,其中In2(Fe2O4)3中的化合价为 ,H2SO4中的杂化轨道模型为 (用文字描述)。
(2)上清液中钴以Co2+存在,“除钴”时Na2S2O8作 (填“氧化剂”或“还原剂”);“脱氯”时发生反应,脱氯率与时间关系如下图所示,最适宜的反应时间为 ,上述流程可循环利用的物质除铜外有 (填化学式)。
写出酸性条件下SO2还原In2(Fe2O4)3得到In3+和Fe2+的离子方程式 ;要水解得到In(OH)3,需先将ZnFe2O4和In2(Fe2O4)3中的Fe“还原”为+2价,原因是 。
17.(12分).X仅含C、H、O三种元素,取6.00g X与纯氧在加热条件下充分反应,实验如图所示:
(1)实验结束后,发现B装置增重3.60g,C装置增重15.84g,X的实验式为 。
(2)D装置中盛装的药品为 ,若省去装置D,会导致测得的X分子中, 原子质量分数偏高(写元素符号)。
(3)通过质谱法获得X的分子量为150,测得X分子的红外光谱如图所示,且该化合物X能使石蕊变红,则X中官能团的名称是 ,根据以上证据推断该分子有 种可能的结构。
若X分子在核磁共振氢谱上的峰面积之比为1:1:2:6,可推知X的结构简式可能为 。(任写一种)
18.(15分).学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:
(1)铜与浓硝酸反应的装置如下图,仪器A的名称为 ,装置B的作用为 。
(2)铜与过量反应的探究如下:
实验②中Cu溶解溶液变蓝的离子方程式为 ;产生的气体为 。比较实验①和②,从氧化还原角度说明H+的作用是 。
(3)用足量NaOH处理实验②新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,其中原子个数比为1:2,离子个数比1:1。X的化学式为 。
(4)取含X粗品0.0960g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用标准溶液滴定,滴定终点时消耗标准溶液20.00mL。(已知:,)标志滴定终点的现象是 ,粗品中X的相对含量为
参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 C B A C C C D A A D
题号 11 12 13 14
答案 C B A B
2.B
【详解】A.质谱法用于测定有机物的相对分子质量,不能测定出有机物的化学键和官能团,A错误;
B.红外光谱仪能测定出有机物的官能团和化学键,B正确;
C.色谱法(chromatography)又称“色谱分析”、“色谱分析法”、“层析法”,是一种分离和分析方法,在分析化 学、有机化学、生物化学等领域有着非常广泛的应用,C错误;
D.核磁共振氢谱用于测定有机物分子中氢原子的种类和数目,不能测定出有机物的化学键和官能团,故D错误;
故选B。
3.A
【详解】
A.P-Pπ键的原子轨道以肩并肩方式重叠形成π键,故其电子云轮廓图为,故A正确;
B.P的原子序数为15,根据泡利原理和洪特规则,基态磷原子的轨道表示式:,故B错误;
C.PH3与NH3的空间结构模型相同,均为三角锥形,为其VSEPR 模型,故C错误;
D.B价层电子对:=3,价层电子对互斥(VSEPR)模型为:,故D错误;
答案选A。
6.D
【详解】A.氢键使冰晶体中的水分子呈一定规则的排列,空间利用率低,体积变大,密度变小,所以密度:冰<水,故A不符合题意;
B.邻羟基苯甲醛可以形成分子内氢键,对羟基苯甲醛可以形成分子间氢键,分子间氢键对物质熔沸点的影响更大,所以沸点:邻羟基苯甲醛<对羟基苯甲醛,故B不符合题意;
C.含有氢键的氢化物易液化,NH3分子间存在氢键,PH3分子间不存在氢键,所以氨气易液化,此性质和氢键有关,故C不符合题意;
D.原子半径:N<P,键长N-H<P-H,键能:N-H>P-H,分子稳定性:NH3>PH3,与氢键无关,故D符合题意;
故选:D。
8.A
【详解】A.是,硅原子通过共价键连接个氧原子,形成个键,所以共价键数目为,A正确;
B.标准状况下,是液体,不能计算其物质的量,B错误;
C.氧原子是,基态氧原子的电子排布式为:,上有两个未成对电子,一共有6个电子成对,含成对电子数为,C错误;
D.常温下,水为液态,分子中含有的氢键数目不能确定,所以无法计算水分子中含有的氢键数目,其中所含的键为,D错误;
故选A。
9.A
【详解】A.山梨醇中σ键数目为25,异山梨醇中σ键数目为21,故A错误;
B.山梨醇含有羟基数目多,在水中的溶解度较大,故B正确;
C.二者碳原子均为单键碳,均采用杂化,故C正确;
D.连有4个不同原子或原子团的碳原子为手性碳,、均含手性碳原子(*号标出),故D正确;
选A。
13.A
【详解】A.H2O2中O采用sp3杂化,1个该分子中含2个s-sp3σ键,H2O2为极性分子,故A错误;
B.根据图示,NaCl晶胞中,距Cl-最近的Na+是6个,距离Cl-最近的六个Na+构成正八面体结构,故B正确;
C.根据均摊原则,1个金刚石晶胞中平均含碳原子数为 ,1个铜晶胞中平含铜原子数,故C正确;
D.H2O2中O采用sp3杂化,O原子有2个孤电子对,所以H-O与O-O形成的键角(如图∠①)小于109°28′,故D正确;
选A。
14.B
【详解】.A.由均摊法得,结构1中含有Co的数目为,含有S的数目为,Co与S的原子个数比为9:8,因此结构1的化学式为Co9S8,故A正确;
B.由图可知,晶胞2中S与S的最短距离为面对角线的,晶胞边长为a,即S与S的最短距离为:,故B错误;
C.如图:,以图中的Li为例,与其最近的S共4个,故C正确;
D.如图,当2个晶胞2放在一起时,图中红框截取的部分就是晶胞3,晶胞2和晶胞3表示同一晶体,故D正确;
故选B。
15(15分).(1) Mg 镁原子价电子为3s2全满稳定状态,电离能较大,故Al的第一电离能比Mg小(2分)
(2) d sp3 (2分) H2O>NH3>CH4(2分)
(3) 4 O电负性比N和C大 ,成键时不易给出孤电子对,不易和Fe2+配位(2分)
(4) SrTiO3(2分) ×1010(2分)
【详解】(1)同一周期随着原子序数变大,第一电离能变大,但是镁原子价电子为3s2全满稳定状态,电离能较大,故Al的第一电离能比Mg小;
(2)Zr原子序数为40,价电子排布为:4d25s2,电子层数为5,Zr位于第五周期第ⅣB族,在周期表中属于d区,C3H8中碳原子形成4个共价键,为sp3杂化;C、N、O三种元素的简单氢化物分别为CH4、NH3、H2O,NH3和H2O分子间有氢键,其沸点高于CH4,水分子间的氢键比NH3分子间的氢键强且多,所以水的沸点高于NH3,所以C、N、O三种元素简单氢化物的沸点由大到小的顺序为H2O>NH3>CH4;
(3)铁失去2个电子形成亚铁离子,基态Fe2+原子核外电子排布为1s22s22p63s23p63d6,基态Fe2+中未成对电子数为4;在CO、NO结构中,C、N、O原子均含有孤电子对,与Fe2+配位时,配位原子均不是O原子,理由是O电负性比N和C大 ,成键时不易给出孤电子对,不易和Fe2+配位;
(4)据“均摊法”,晶胞中含个Ti、个O、1个Sr,该复合型物质的化学式为SrTiO3,则晶体密度为,a=×1010pm。
16(16分).(1) +3 正四面体形
(2) 氧化剂 1.5h H2SO4、SO2
(3) 12H++3SO2+In2(Fe2O4)3=2 In3++6 Fe2++3+6H2O Fe(OH)3的Ksp小于In(OH)3,将Fe由+3价还原为Fe2+,可以在调节pH时,In3+沉淀析出而Fe2+仍留在溶液中而分离
【分析】闪锌矿(主要成分是ZnS,还有In、Fe、Co、Cl等元素)焙烧产生气体和焙烧产物,焙烧产物用H SO “溶浸”得到上 清液和浸渣,上清液中用 “除钴”得到,然后加入铜渣“脱氯”得到,接着加入Zn将Cu 转化成 Cu而除去,最后电解溶液得到Zn;浸渣用还原的产物水解得到。
【详解】(1)
①基态Cu的价电子排布图:,轨道表示式为;
②中Fe、O元素的化合价分别为+3、-2价,根据化合物中元素的正负化合价代数和为0,In元素的化合价为 +3价;
③中中心S原子的价层电子对数=,无孤电子对,杂化轨道模型为正四面体。
(2)①上清液中钴以Co 存在,“除钴”时加入将转化成,Co元素的化合价升高,则被还原、 作氧化剂;
②从脱氯率与时间关系图可知,最适宜反应时间为1.5h,此时脱氯率最高;
③“脱氯”反应生成,“除铜”时又转化为Cu,参与还原步骤后又可通过水解步骤生成,电解溶液得到Zn,同时生成和所以可循环利用的物质除铜外还有和。
(3)①酸性条件下还原得到和,被氧化为,根据得失电子守恒、电荷守恒和原子守恒,离子方程式为: ;
②要水解得到,需先将和中的Fe还原为+2价,因为的小于,将Fe由还原为,可以在调节pH时,沉淀析出而仍留在溶液中而分离。
17(12分).(1)C9H10O2
(2) 碱石灰 C
(3) 羧基 14
(4)或
【分析】X仅含C、H、O三种元素,与氧气充分反应后,生产二氧化碳和水,装置B使用无水氯化钙吸收水蒸气,装置C吸收二氧化碳,装置D是防止空气进入装置干扰实验。
【详解】(1)装置B增重的质量是生成水的质量,为3.6g,物质的量为0.2mol,装置C增重的质量是二氧化碳的质量,为15.84g,0.36mol,以上可知,有机物中含氢元素的质量是0.4g,含碳元素的质量是4.32g,X的总质量是6.00g,则含氧质量为(6.00-0.4-4.32)g=1.28,为0.08mol,则化学式中C、H、O个数比为0.36:0.4:0.08=9:10:2,X的实验式是C9H10O2。
(2)装置D是防止空气中水和二氧化碳进入装置干扰实验,盛装的药品是碱石灰。若省去装置D,装置C中可能会吸收空气成分,导致测得CO2质量增加,会导致测得的X分子中,C原子质量分数偏高,故答案是碱石灰、C。
(3)
根据红外光谱,且X能使石蕊变红,X的结构中含苯环、羧基。X中官能团的名称是羧基故答案是羧基、14。
(4)
若X分子在核磁共振氢谱上的峰面积之比为1:1:2:6,可推知X的结构简式可能为或 。
18.(15分 )(1) 具支试管1分 防倒吸
(2) Cu+H2O2+2H+= Cu2++2H2O O2 既不是氧化剂,又不是还原剂,能增强过氧化氢的氧化性
(3)CuO2
(4) 当滴入最后半滴Na2S2O3标准溶液后,溶液蓝色刚好褪去,且半分钟不恢复原来的颜色 66.67%或2/3
【详解】(1)由图可知,仪器A的名称为具支试管;铜和浓硝酸反应生成硝酸铜和二氧化氮,其中二氧化氮易溶于水,需要防倒吸,则装置B的作用为防倒吸;
(2)根据实验现象,铜片溶解,溶液变蓝,可知在酸性条件下铜和过氧化氢发生反应,生成硫酸铜,离子方程式为:Cu+H2O2+2H+= Cu2++2H2O;硫酸铜可以催化过氧化氢分解生成氧气,则产生的气体为O2;在铜和过氧化氢的反应过程中,氢元素的化合价没有发生变化,但反应现象明显,故从氧化还原角度说明的作用是:既不是氧化剂,又不是还原剂,但可增强H2O2氧化性;
(3)离子个数比1:1,原子个数比为1:2,铜的化合价为+1、+2,氧的化合价可以为-2或-1(过氧根离子),根据化合价代数和为零,则X为CuO2;
(4)滴定结束的时候,单质碘消耗完,则标志滴定终点的现象是:当滴入最后半滴Na2S2O3标准溶液后,溶液蓝色刚好褪去,且半分钟不恢复原来的颜色;在CuO2中铜为+2价,氧为-1价,根据,可以得到关系式:,则n(CuO2)=×0.1mol/L×0.02L= mol,粗品中X的相对含量为。
同课章节目录
