化学与STSE常见考点 归纳练 2025年高考化学二轮复习备考
文档属性
| 名称 | 化学与STSE常见考点 归纳练 2025年高考化学二轮复习备考 |

|
|
| 格式 | docx | ||
| 文件大小 | 989.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-11 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
化学与STSE常见考点
归纳练 2025年高考化学二轮复习备考
一、单选题
1.2024年我国科学家在诸多领域取得新突破。下列说法错误的是
A.钠离子电池是新能源的重要组成部分
B.秸秆糖制得的乙二醇用作汽车防冻液
C.半导体石墨烯属于新型无机非金属材料
D.月球样品中的钍()属于非金属元素
2.化学在“三废”治理方面发挥着重要的作用。下列不属于治理“三废”应遵循的原则
A.无害化 B.差异化 C.减量化 D.资源化
3.化学和生活、科技、社会发展息息相关,下列说法错误的是
A.氢氟酸可在玻璃上蚀刻文字和花纹
B.可燃冰作为能源有利于实现碳达峰、碳中和
C.古书中记载的石胆“能化铁为铜”是物理变化
D.醋酸钠过饱和溶液和金属小圆片可制作“热袋”
4.辽宁博物馆是新中国建立的第一座博物馆,藏品总量达11.5万件,以辽宁地区考古出土文物和传世的历史艺术类文物为主体。下列藏品的主要成分属于有机材料的是
藏品
选项 A.商父乙铜爵 B.三联玉壁 C.中和木琴 D.饕餮纹彩绘陶鬲
A.A B.B C.C D.D
5.化学与人类的生活密切相关。下列叙述不正确的是
A.硝酸铵是一种高效氮肥,受热或经撞击易发生爆炸,因此必须作改性处理才能施用
B.青蒿素属于精细化学品,可依次通过萃取、柱色谱分离的方法提纯青蒿素
C.阿司匹林是一种合成药物,化学名称为水杨酸,具有解热镇痛的作用
D.医用软膏中的“凡士林”,其主要成分是含碳原子数较多的烷烃
6.科学技术推动社会进步。下列有关科技动态的化学解读错误的是
选项 科技动态 化学解读
A 开发新型铑基单原子催化体系,实现了水相加氢一步高效制乙醇 催化剂能提高加氢制乙醇的生产效率
B 利用钍靶成功制备和分离医用同位素 的中子数和质子数之差为47
C 自主研制的察打一体无人机“九天”首次亮相 使用的碳纤维材料属于有机高分子
D 开发高浓度葡萄糖高效异构化制备果糖的新催化体系 葡萄糖转化为果糖,原子利用率为100%
A.A B.B C.C D.D
7.高分子材料在各个领域中得到广泛应用。下列说法错误的是
A.聚乳酸可用于制造医用材料 B.聚丙烯酰胺可发生水解反应
C.聚丙烯可由丙烯通过缩聚反应合成 D.聚丙烯腈纤维可由丙烯腈通过加聚反应合成
8.下列成语涉及金属材料的是
A.洛阳纸贵 B.聚沙成塔 C.金戈铁马 D.甘之若饴
9.科技强国、科技强军,化学在建设现代化军队中起到了非常重要的作用,下列有关说法错误的是
A.单兵作战服所用的电致变色材料是聚苯胺,苯胺具有碱性
B.合成有机玻璃(聚甲基丙烯酸甲酯)的反应类型是缩聚反应
C.“福建舰”舰体材料为无磁镍铬钛合金钢,该合金钢的硬度高于纯铁
D.“99A”坦克装甲上可自动释放修复剂的微胶囊化环氧树脂属于有机高分子材料
10.某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3)、煤矿、石灰石和黏土。现拟在该地区建设大型炼铁厂,随着铁矿的开采和炼铁厂的建立,需要在该地区相对应建立焦化厂、发电厂、水泥厂等,形成一定规模的工业体系(如图所示)。
下列说法正确的是
A.甲为焦化厂,可以从煤的干馏产物中获取焦炭等一系列化学原料
B.乙为发电厂,存在着“化学能→热能→机械能→电能”的能量转化过程
C.丙为炼铁厂,高炉炼铁中得到生铁的化学方程式为Fe2O3+3CO2Fe+3CO2
D.丁为水泥厂,常用石灰石调节水泥硬化速率
11.材料是人类赖以生存和发展的物质基础,下列说法不正确的是
A.生铁的含碳量比钢高,使得生铁具有良好的延展性和柔韧性
B.橡胶与硫作用进行硫化处理,使其具有更好的强度
C.碳化硅(SiC)具有类似金刚石的结构,硬度大
D.植物油(含碳碳双键)能使溴的四氯化碳溶液褪色
12.下列有关化学概念或性质的判断正确的是
A.和是同一种物质
B.氯乙烷和氯乙烯中键的键能相等
C.的质谱图中,质荷比为46的峰归属于
D.石墨能导电是因为电子从一个相邻碳原子平面跳跃到另一个平面
13.三星堆博物馆展示的商代后期(公元前1205~前1100年)文物“金鸟形饰”是商代代表作品,形状如图所示。下列说法错误的是
A.金的配合物,广泛应用于电镀金工艺中
B.金的化学性质非常稳定,常温下不能与、硝酸、王水等发生反应
C.金在电子工业中有重要用途,原因是其具有良好的导电性和抗氧化性
D.“沙里淘金”这个成语体现了金在自然界中通常以单质形式存在,且密度较大
14.“光荣属于劳动者,幸福属于劳动者。”下列劳动项目与所述化学知识有关联的是
选项 劳动项目 化学知识
A 考古研究员:通过测定化石年代 与石墨烯互为同素异形体
B 化学实验员:检验是否失效
C 科研工作者:光谱仪分析月壤元素 原子核内存在质子
D 环保工程师:用净水 具有氧化性
A.A B.B C.C D.D
15.文物承载灿烂文明,传承历史文化。下列文物的主要材质属于硅酸盐的是
A.战国水晶杯 B.素纱单衣
C.兽首玛瑙杯 D.三彩载乐骆驼俑
16.化学与生活密切相关,下列涉及生产生活有关的化学原理的表述,错误的是
A.淀粉、蔗糖水解产生的葡萄糖发生还原反应为生物体提供能量
B.谷氨酸钠(味精)常用于增味剂,碳酸氢钠、碳酸氢铵用于食品膨松剂
C.聚酰胺纤维、聚对苯二甲酸乙二酯纤维等强度高、弹性好、耐磨,可用作渔网、绳索
D.在DNA的双螺旋结构中,依靠形成氢键实现碱基互补配对
二、解答题
17.金红石是一种重要的钛矿石,具有较高的稳定性和化学惰性,其主要成分为,还含有少量Fe、Cr的氧化物。金属钛具有高强度、低密度、耐腐蚀等优良性能,广泛应用于航空航天、化工、医疗器械等领域。工业上常采用氯化法和还原法相结合的工艺来制备金属钛。工艺流程如下:
(1)Ti原子的价层电子轨道排布式为 。
(2)金红石粉碎后遇浓硫酸加热酸浸,转化成了,加入大量水,水解成,水解过程的化学方程式为 。
(3)若氯化过程产生等物质的量的CO和,则该过程发生反应的化学方程式为 。
(4)还原过程用金属镁在高温下还原得到金属Ti.
①还原过程需在 气氛中进行(填字母)。
a.氩气 b. c. d.空气
②下列金属冶炼常用的方式和上述过程相似的是 (填字母)。
a.Al b.Fe c.Na d.Pt
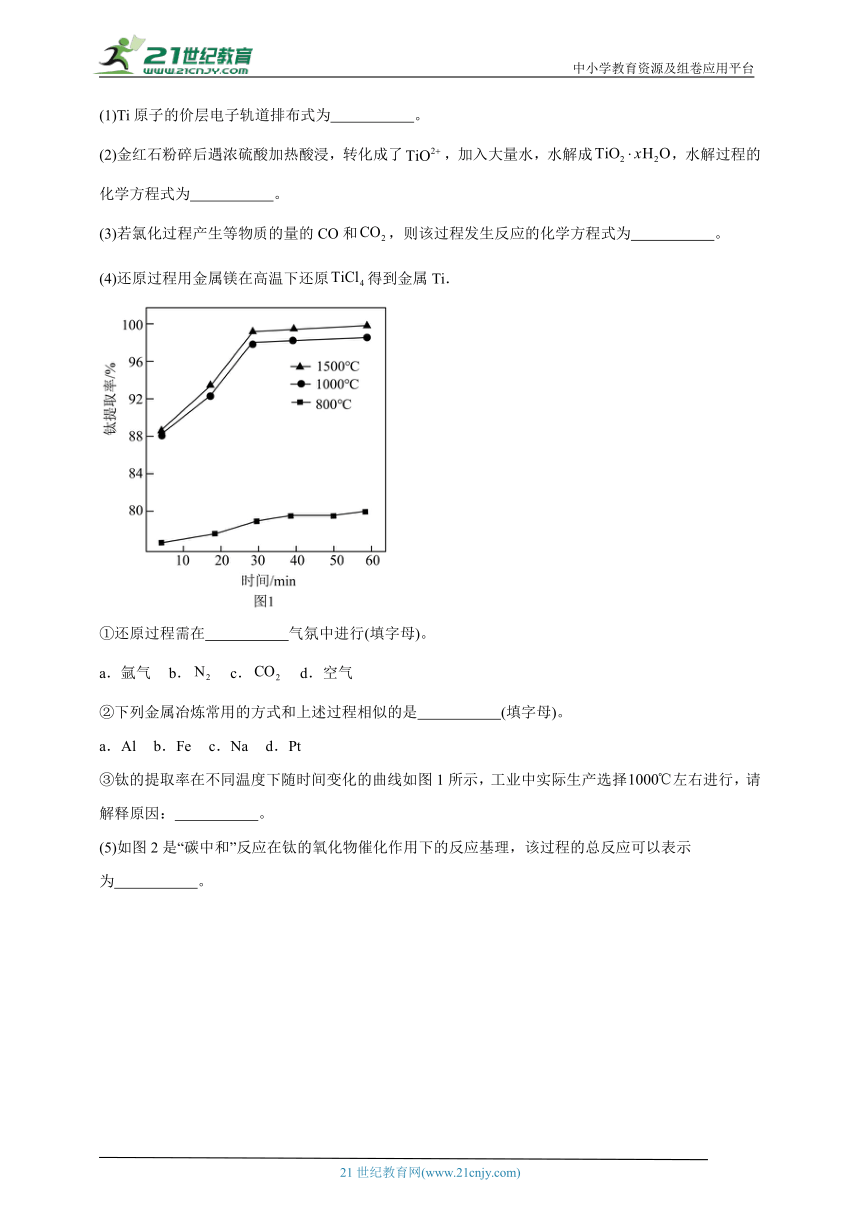
③钛的提取率在不同温度下随时间变化的曲线如图1所示,工业中实际生产选择左右进行,请解释原因: 。
(5)如图2是“碳中和”反应在钛的氧化物催化作用下的反应基理,该过程的总反应可以表示为 。
(6)四卤化钛熔点如下表所示,利用物质结构的知识解释熔点变化的原因: 。
物质
熔点/℃ 377 -25 38 150
参考答案
1.D
A.钠离子电池是化学电源,化学电池是新能源和可再生能源的重要组成部分,A正确;
B.乙二醇的熔点较低,可用作汽车防冻液,B正确;
C.石墨烯属于碳纳米材料,碳纳米材料是新型无机非金属材料,C正确;
D.钍是金属元素,D错误;
故选D。
2.B
“三废”治理的核心原则是减量化(减少废物产生量)、无害化(处理废物使其对环境和健康无害)和资源化(将废物转化为可利用资源),这三个原则是化学工业污染防治的常规要求,故本题选B。
3.C
A.氢氟酸能与玻璃中的二氧化硅发生反应,则氢氟酸可在玻璃上蚀刻文字和花纹,A正确;
B.可燃冰的主要成分是甲烷,甲烷燃烧生成,但与煤、石油等传统化石能源相比,碳排放强度相对较低,能在一定程度上降低碳排放总量,助力能源消费结构绿色低碳转型,则可燃冰作为能源有利于实现碳达峰、碳中和,B正确;
C.石胆“能化铁为铜”描述的是铁与硫酸铜发生置换反应,属于化学变化,C错误;
D.醋酸钠过饱和溶液结晶时会放热,金属片作为触发点引发结晶,则醋酸钠过饱和溶液和金属小圆片可制作“热袋”,D正确;
故选C。
4.C
A.商父乙铜爵主要材质属于金属,为金属材料,故A错误;
B.三联玉壁主要成分为透闪石等,为无机非金属材料,故B错误;
C.中和木琴的主要材质属于纤维素,属于有机材料,故C正确;
D.饕餮纹彩绘陶鬲主要材质属于硅酸盐,属于非金属材料,故D错误。
故选C。
5.C
A.硝酸铵不稳定,受热或撞击易发生分解爆炸,必须作改性处理后才能作氮肥施用,故A正确;
B.从天然产物中提纯青蒿素需通过萃取、柱色谱分离的方法,故B正确;
C.阿司匹林结构为,化学名称为乙酰水杨酸,故C错误;
D.凡士林是一种饱和烃类半液态的混合物,由石油分馏后制得,可用作药品和化妆品原料,也可用于机器润滑,故D正确;
故答案为C。
6.C
A.催化剂能降低反应的能垒,反应速率快,因而能提高生产效率,故A项正确;
B.的中子数与质子数之差为,故B项正确;
C.碳纤维材料主要成分是碳,不属于有机高分子,故C项错误;
D.葡萄糖和果糖互为同分异构体,二者相互转化,属于原子重排,原子利用率为100%,故D项正确;
故选C。
7.C
A.聚乳酸具有良好的生物相容性和生物可吸收性,可以用于制造手术缝合线、药物缓释材料等医用材料,A正确;
B.聚丙烯酰胺中含有酰胺基,可发生水解反应,B正确;
C.聚丙烯是由丙烯通过加聚反应合成的,C错误;
D.聚丙烯腈纤维是加聚产物,可由丙烯腈通过加聚反应合成,D正确;
故选C。
8.C
A.纸的主要成分是纤维素,不是金属材料,A错误;
B.沙的主要成分是硅酸盐,不是金属材料,B错误;
C.金和铁都是金属,C正确;
D.甘之若饴意思是把它看成像糖那样甜,糖类是有机物,不是金属材料,D错误;
故选C。
9.B
A.苯胺(C6H5NH2)分子中含有氨基(-NH2),氨基具有结合质子的能力,因此苯胺显弱碱性,聚苯胺作为电致变色材料应用合理,A正确;
B.有机玻璃(聚甲基丙烯酸甲酯,PMMA)的合成是通过甲基丙烯酸甲酯(含碳碳双键)的加聚反应实现的,B错误;
C.合金钢中掺入镍、铬、钛等元素后,金属原子排列更紧密,金属原子间更加难发生相对滑动,导致合金硬度高于纯铁,C正确;
D.环氧树脂是由多个重复单元通过共价键连接的高分子化合物,属于有机高分子材料,D正确;
故选B。
10.C
煤炭燃烧可以发电,甲为发电厂,煤的干馏制造煤焦油,乙为焦化厂,赤铁矿、碳酸钙是炼铁的原料,丙为炼铁厂,碳酸钙和黏土是生产水泥的原料,丁为水泥厂,据此分析判断;
A.根据分析,煤炭燃烧可以发电,甲为发电厂,A错误;
B.根据分析,煤的干馏制造煤焦油,乙为焦化厂,B错误;
C.根据分析,丙为炼铁厂,高炉炼铁中赤铁矿与焦炭反应得到生铁的化学方程式为Fe2O3+3CO2Fe+3CO2,C正确;
D.丁为水泥厂,常用硫酸钙调节水泥硬化速率,D错误;
故选C。
11.A
A.生铁的含碳量比钢高,使得生铁不具有良好的延展性和柔韧性,钢具有良好的延展性和柔韧性,故A错误;
B.硫化后,橡胶大分子被交联成网状结构,使橡胶具有更好的强度,故B正确;
C.碳化硅(SiC)具有类似金刚石的结构,属于原子晶体,硬度大,故C正确;
D.碳碳双键能和溴的四氯化碳溶液发生加成反应,使其褪色,故D正确;
答案选A。
12.A
A.苯分子中碳处于同一环境中,故和是同一种物质,A项正确;
B.氯乙烷中C采用杂化,氯乙烯中采用杂化,键所处环境不同,故碳氯键的键能不同,B项错误;
C.质荷比为46的峰只说明相对分子质量为46,可能是或,C项错误;
D.石墨能导电是因为在石墨层状结构中,每个碳原子有一个未参与杂化的2p电子,这些电子在层内可以自由移动 ,并非是电子在相邻碳原子平面间跳跃,D项错误;
综上,答案是A。
13.B
A.在阴极得到电子生成Au,广泛应用于电镀金工艺中,A正确;
B.金的化学性质很不活泼,常温下不与、硝酸等发生反应,但是它能溶于“王水”(浓硝酸、浓盐酸以体积比组成),B错误;
C.金应用在电子工业中,利用其良好的导电性和抗氧化性,C正确;
D.“沙里淘金”说明金在自然界中常以单质形式存在,且因为金的密度比沙大很多,所以可以通过淘洗的方法将金从沙中分离出来,D正确;
故选B。
14.B
A.通过测定化石年代是利用同位素的放射性,通过半衰期计算化石年代,与同素异形体无关,A错误;
B.利用过氧化钠和水生成氢氧化钠和氧气的反应可以检验是否失效,若失效则无法产生氧气,B正确;
C.光谱仪分析元素是因为不同元素原子的电子发生跃迁时会吸收或释放不同频率的光,与原子核内含有质子无关,C错误;
D.净水是利用水解生成的胶体能吸附杂质,而非其氧化性,D错误;
故选B。
15.D
A.战国水晶杯的主要成分是二氧化硅,故不选A;
B.素纱单衣的主要成分是蚕丝,蚕丝属于蛋白质,故不选B;
C.兽首玛瑙杯的主要成分是二氧化硅,故不选C;
D.三彩载乐骆驼俑属于陶瓷,主要成分是硅酸盐,故选D;
选D。
16.A
A.淀粉和蔗糖水解生成的葡萄糖在生物体内主要通过氧化反应转变为二氧化碳和水,同时释放能量为生物体供能,A错误;
B.谷氨酸钠(味精)是增味剂;碳酸氢钠、碳酸氢铵受热分解产生气体,用作膨松剂,B正确;
C.聚酰胺纤维(如尼龙)和聚对苯二甲酸乙二酯(涤纶)因具有极高的拉伸强度和耐磨性,适用于制造渔网、绳索,C正确;
D.DNA双螺旋中,碱基互补配对(如A-T、C-G)通过氢键实现,A-T间2个氢键,C-G间3个氢键,D正确;
故选A。
17.(1)
(2)
(3)
(4) a b 800℃时,转化率低;和的转化率相当,时能耗太高
(5)
(6)为离子晶体,熔点较高,都是分子晶体,相对分子质量逐渐增大,分子间作用力逐渐增大,熔点逐渐升高
“酸浸”后过滤,得到含TiOSO4、Fe2 (SO4)3等的溶液,加入大量水使TiOSO4水解,过滤后得到胶状;经煅烧得到TiO2,TiO2再与C、Cl2发生氧化还原反应生成TiCl4、CO、CO2,TiCl4经Mg热还原得到Ti。
(1)
Ti的价层电子排布式为3d24s2,故价层电子轨道排布式为;
(2)依题水解生成,水解方程式为;
(3)水解后的经煅烧得到TiO2,再与C、Cl2发生氧化还原反应生成TiCl4、CO、CO2,反应的化学方程式为;
(4)①Mg与氧气、氮气、二氧化碳均反应,故还原过程应在氩气氛围中进行;
②Mg还原TiCl4制Ti,属于热还原法,Fe也是用热还原法制备;Na、Al等活泼金属用电解法,Pt、Au等不活泼金属用富集法制备;
③800℃的提取率低,1000℃与1500℃提取率很高而且相差不大,故选择1000℃,可以节约生产成本;
(5)根据反应机理图可知,在催化剂作用下甲醇和二氧化碳转化甲酸甲酯、甲醛和水,总反应方程式为;
(6)TiF4是离子晶体,其余为分子晶体。离子晶体熔点较高,分子晶体熔点低,且分子晶体熔点随相对分子质量增大而升高。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
化学与STSE常见考点
归纳练 2025年高考化学二轮复习备考
一、单选题
1.2024年我国科学家在诸多领域取得新突破。下列说法错误的是
A.钠离子电池是新能源的重要组成部分
B.秸秆糖制得的乙二醇用作汽车防冻液
C.半导体石墨烯属于新型无机非金属材料
D.月球样品中的钍()属于非金属元素
2.化学在“三废”治理方面发挥着重要的作用。下列不属于治理“三废”应遵循的原则
A.无害化 B.差异化 C.减量化 D.资源化
3.化学和生活、科技、社会发展息息相关,下列说法错误的是
A.氢氟酸可在玻璃上蚀刻文字和花纹
B.可燃冰作为能源有利于实现碳达峰、碳中和
C.古书中记载的石胆“能化铁为铜”是物理变化
D.醋酸钠过饱和溶液和金属小圆片可制作“热袋”
4.辽宁博物馆是新中国建立的第一座博物馆,藏品总量达11.5万件,以辽宁地区考古出土文物和传世的历史艺术类文物为主体。下列藏品的主要成分属于有机材料的是
藏品
选项 A.商父乙铜爵 B.三联玉壁 C.中和木琴 D.饕餮纹彩绘陶鬲
A.A B.B C.C D.D
5.化学与人类的生活密切相关。下列叙述不正确的是
A.硝酸铵是一种高效氮肥,受热或经撞击易发生爆炸,因此必须作改性处理才能施用
B.青蒿素属于精细化学品,可依次通过萃取、柱色谱分离的方法提纯青蒿素
C.阿司匹林是一种合成药物,化学名称为水杨酸,具有解热镇痛的作用
D.医用软膏中的“凡士林”,其主要成分是含碳原子数较多的烷烃
6.科学技术推动社会进步。下列有关科技动态的化学解读错误的是
选项 科技动态 化学解读
A 开发新型铑基单原子催化体系,实现了水相加氢一步高效制乙醇 催化剂能提高加氢制乙醇的生产效率
B 利用钍靶成功制备和分离医用同位素 的中子数和质子数之差为47
C 自主研制的察打一体无人机“九天”首次亮相 使用的碳纤维材料属于有机高分子
D 开发高浓度葡萄糖高效异构化制备果糖的新催化体系 葡萄糖转化为果糖,原子利用率为100%
A.A B.B C.C D.D
7.高分子材料在各个领域中得到广泛应用。下列说法错误的是
A.聚乳酸可用于制造医用材料 B.聚丙烯酰胺可发生水解反应
C.聚丙烯可由丙烯通过缩聚反应合成 D.聚丙烯腈纤维可由丙烯腈通过加聚反应合成
8.下列成语涉及金属材料的是
A.洛阳纸贵 B.聚沙成塔 C.金戈铁马 D.甘之若饴
9.科技强国、科技强军,化学在建设现代化军队中起到了非常重要的作用,下列有关说法错误的是
A.单兵作战服所用的电致变色材料是聚苯胺,苯胺具有碱性
B.合成有机玻璃(聚甲基丙烯酸甲酯)的反应类型是缩聚反应
C.“福建舰”舰体材料为无磁镍铬钛合金钢,该合金钢的硬度高于纯铁
D.“99A”坦克装甲上可自动释放修复剂的微胶囊化环氧树脂属于有机高分子材料
10.某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3)、煤矿、石灰石和黏土。现拟在该地区建设大型炼铁厂,随着铁矿的开采和炼铁厂的建立,需要在该地区相对应建立焦化厂、发电厂、水泥厂等,形成一定规模的工业体系(如图所示)。
下列说法正确的是
A.甲为焦化厂,可以从煤的干馏产物中获取焦炭等一系列化学原料
B.乙为发电厂,存在着“化学能→热能→机械能→电能”的能量转化过程
C.丙为炼铁厂,高炉炼铁中得到生铁的化学方程式为Fe2O3+3CO2Fe+3CO2
D.丁为水泥厂,常用石灰石调节水泥硬化速率
11.材料是人类赖以生存和发展的物质基础,下列说法不正确的是
A.生铁的含碳量比钢高,使得生铁具有良好的延展性和柔韧性
B.橡胶与硫作用进行硫化处理,使其具有更好的强度
C.碳化硅(SiC)具有类似金刚石的结构,硬度大
D.植物油(含碳碳双键)能使溴的四氯化碳溶液褪色
12.下列有关化学概念或性质的判断正确的是
A.和是同一种物质
B.氯乙烷和氯乙烯中键的键能相等
C.的质谱图中,质荷比为46的峰归属于
D.石墨能导电是因为电子从一个相邻碳原子平面跳跃到另一个平面
13.三星堆博物馆展示的商代后期(公元前1205~前1100年)文物“金鸟形饰”是商代代表作品,形状如图所示。下列说法错误的是
A.金的配合物,广泛应用于电镀金工艺中
B.金的化学性质非常稳定,常温下不能与、硝酸、王水等发生反应
C.金在电子工业中有重要用途,原因是其具有良好的导电性和抗氧化性
D.“沙里淘金”这个成语体现了金在自然界中通常以单质形式存在,且密度较大
14.“光荣属于劳动者,幸福属于劳动者。”下列劳动项目与所述化学知识有关联的是
选项 劳动项目 化学知识
A 考古研究员:通过测定化石年代 与石墨烯互为同素异形体
B 化学实验员:检验是否失效
C 科研工作者:光谱仪分析月壤元素 原子核内存在质子
D 环保工程师:用净水 具有氧化性
A.A B.B C.C D.D
15.文物承载灿烂文明,传承历史文化。下列文物的主要材质属于硅酸盐的是
A.战国水晶杯 B.素纱单衣
C.兽首玛瑙杯 D.三彩载乐骆驼俑
16.化学与生活密切相关,下列涉及生产生活有关的化学原理的表述,错误的是
A.淀粉、蔗糖水解产生的葡萄糖发生还原反应为生物体提供能量
B.谷氨酸钠(味精)常用于增味剂,碳酸氢钠、碳酸氢铵用于食品膨松剂
C.聚酰胺纤维、聚对苯二甲酸乙二酯纤维等强度高、弹性好、耐磨,可用作渔网、绳索
D.在DNA的双螺旋结构中,依靠形成氢键实现碱基互补配对
二、解答题
17.金红石是一种重要的钛矿石,具有较高的稳定性和化学惰性,其主要成分为,还含有少量Fe、Cr的氧化物。金属钛具有高强度、低密度、耐腐蚀等优良性能,广泛应用于航空航天、化工、医疗器械等领域。工业上常采用氯化法和还原法相结合的工艺来制备金属钛。工艺流程如下:
(1)Ti原子的价层电子轨道排布式为 。
(2)金红石粉碎后遇浓硫酸加热酸浸,转化成了,加入大量水,水解成,水解过程的化学方程式为 。
(3)若氯化过程产生等物质的量的CO和,则该过程发生反应的化学方程式为 。
(4)还原过程用金属镁在高温下还原得到金属Ti.
①还原过程需在 气氛中进行(填字母)。
a.氩气 b. c. d.空气
②下列金属冶炼常用的方式和上述过程相似的是 (填字母)。
a.Al b.Fe c.Na d.Pt
③钛的提取率在不同温度下随时间变化的曲线如图1所示,工业中实际生产选择左右进行,请解释原因: 。
(5)如图2是“碳中和”反应在钛的氧化物催化作用下的反应基理,该过程的总反应可以表示为 。
(6)四卤化钛熔点如下表所示,利用物质结构的知识解释熔点变化的原因: 。
物质
熔点/℃ 377 -25 38 150
参考答案
1.D
A.钠离子电池是化学电源,化学电池是新能源和可再生能源的重要组成部分,A正确;
B.乙二醇的熔点较低,可用作汽车防冻液,B正确;
C.石墨烯属于碳纳米材料,碳纳米材料是新型无机非金属材料,C正确;
D.钍是金属元素,D错误;
故选D。
2.B
“三废”治理的核心原则是减量化(减少废物产生量)、无害化(处理废物使其对环境和健康无害)和资源化(将废物转化为可利用资源),这三个原则是化学工业污染防治的常规要求,故本题选B。
3.C
A.氢氟酸能与玻璃中的二氧化硅发生反应,则氢氟酸可在玻璃上蚀刻文字和花纹,A正确;
B.可燃冰的主要成分是甲烷,甲烷燃烧生成,但与煤、石油等传统化石能源相比,碳排放强度相对较低,能在一定程度上降低碳排放总量,助力能源消费结构绿色低碳转型,则可燃冰作为能源有利于实现碳达峰、碳中和,B正确;
C.石胆“能化铁为铜”描述的是铁与硫酸铜发生置换反应,属于化学变化,C错误;
D.醋酸钠过饱和溶液结晶时会放热,金属片作为触发点引发结晶,则醋酸钠过饱和溶液和金属小圆片可制作“热袋”,D正确;
故选C。
4.C
A.商父乙铜爵主要材质属于金属,为金属材料,故A错误;
B.三联玉壁主要成分为透闪石等,为无机非金属材料,故B错误;
C.中和木琴的主要材质属于纤维素,属于有机材料,故C正确;
D.饕餮纹彩绘陶鬲主要材质属于硅酸盐,属于非金属材料,故D错误。
故选C。
5.C
A.硝酸铵不稳定,受热或撞击易发生分解爆炸,必须作改性处理后才能作氮肥施用,故A正确;
B.从天然产物中提纯青蒿素需通过萃取、柱色谱分离的方法,故B正确;
C.阿司匹林结构为,化学名称为乙酰水杨酸,故C错误;
D.凡士林是一种饱和烃类半液态的混合物,由石油分馏后制得,可用作药品和化妆品原料,也可用于机器润滑,故D正确;
故答案为C。
6.C
A.催化剂能降低反应的能垒,反应速率快,因而能提高生产效率,故A项正确;
B.的中子数与质子数之差为,故B项正确;
C.碳纤维材料主要成分是碳,不属于有机高分子,故C项错误;
D.葡萄糖和果糖互为同分异构体,二者相互转化,属于原子重排,原子利用率为100%,故D项正确;
故选C。
7.C
A.聚乳酸具有良好的生物相容性和生物可吸收性,可以用于制造手术缝合线、药物缓释材料等医用材料,A正确;
B.聚丙烯酰胺中含有酰胺基,可发生水解反应,B正确;
C.聚丙烯是由丙烯通过加聚反应合成的,C错误;
D.聚丙烯腈纤维是加聚产物,可由丙烯腈通过加聚反应合成,D正确;
故选C。
8.C
A.纸的主要成分是纤维素,不是金属材料,A错误;
B.沙的主要成分是硅酸盐,不是金属材料,B错误;
C.金和铁都是金属,C正确;
D.甘之若饴意思是把它看成像糖那样甜,糖类是有机物,不是金属材料,D错误;
故选C。
9.B
A.苯胺(C6H5NH2)分子中含有氨基(-NH2),氨基具有结合质子的能力,因此苯胺显弱碱性,聚苯胺作为电致变色材料应用合理,A正确;
B.有机玻璃(聚甲基丙烯酸甲酯,PMMA)的合成是通过甲基丙烯酸甲酯(含碳碳双键)的加聚反应实现的,B错误;
C.合金钢中掺入镍、铬、钛等元素后,金属原子排列更紧密,金属原子间更加难发生相对滑动,导致合金硬度高于纯铁,C正确;
D.环氧树脂是由多个重复单元通过共价键连接的高分子化合物,属于有机高分子材料,D正确;
故选B。
10.C
煤炭燃烧可以发电,甲为发电厂,煤的干馏制造煤焦油,乙为焦化厂,赤铁矿、碳酸钙是炼铁的原料,丙为炼铁厂,碳酸钙和黏土是生产水泥的原料,丁为水泥厂,据此分析判断;
A.根据分析,煤炭燃烧可以发电,甲为发电厂,A错误;
B.根据分析,煤的干馏制造煤焦油,乙为焦化厂,B错误;
C.根据分析,丙为炼铁厂,高炉炼铁中赤铁矿与焦炭反应得到生铁的化学方程式为Fe2O3+3CO2Fe+3CO2,C正确;
D.丁为水泥厂,常用硫酸钙调节水泥硬化速率,D错误;
故选C。
11.A
A.生铁的含碳量比钢高,使得生铁不具有良好的延展性和柔韧性,钢具有良好的延展性和柔韧性,故A错误;
B.硫化后,橡胶大分子被交联成网状结构,使橡胶具有更好的强度,故B正确;
C.碳化硅(SiC)具有类似金刚石的结构,属于原子晶体,硬度大,故C正确;
D.碳碳双键能和溴的四氯化碳溶液发生加成反应,使其褪色,故D正确;
答案选A。
12.A
A.苯分子中碳处于同一环境中,故和是同一种物质,A项正确;
B.氯乙烷中C采用杂化,氯乙烯中采用杂化,键所处环境不同,故碳氯键的键能不同,B项错误;
C.质荷比为46的峰只说明相对分子质量为46,可能是或,C项错误;
D.石墨能导电是因为在石墨层状结构中,每个碳原子有一个未参与杂化的2p电子,这些电子在层内可以自由移动 ,并非是电子在相邻碳原子平面间跳跃,D项错误;
综上,答案是A。
13.B
A.在阴极得到电子生成Au,广泛应用于电镀金工艺中,A正确;
B.金的化学性质很不活泼,常温下不与、硝酸等发生反应,但是它能溶于“王水”(浓硝酸、浓盐酸以体积比组成),B错误;
C.金应用在电子工业中,利用其良好的导电性和抗氧化性,C正确;
D.“沙里淘金”说明金在自然界中常以单质形式存在,且因为金的密度比沙大很多,所以可以通过淘洗的方法将金从沙中分离出来,D正确;
故选B。
14.B
A.通过测定化石年代是利用同位素的放射性,通过半衰期计算化石年代,与同素异形体无关,A错误;
B.利用过氧化钠和水生成氢氧化钠和氧气的反应可以检验是否失效,若失效则无法产生氧气,B正确;
C.光谱仪分析元素是因为不同元素原子的电子发生跃迁时会吸收或释放不同频率的光,与原子核内含有质子无关,C错误;
D.净水是利用水解生成的胶体能吸附杂质,而非其氧化性,D错误;
故选B。
15.D
A.战国水晶杯的主要成分是二氧化硅,故不选A;
B.素纱单衣的主要成分是蚕丝,蚕丝属于蛋白质,故不选B;
C.兽首玛瑙杯的主要成分是二氧化硅,故不选C;
D.三彩载乐骆驼俑属于陶瓷,主要成分是硅酸盐,故选D;
选D。
16.A
A.淀粉和蔗糖水解生成的葡萄糖在生物体内主要通过氧化反应转变为二氧化碳和水,同时释放能量为生物体供能,A错误;
B.谷氨酸钠(味精)是增味剂;碳酸氢钠、碳酸氢铵受热分解产生气体,用作膨松剂,B正确;
C.聚酰胺纤维(如尼龙)和聚对苯二甲酸乙二酯(涤纶)因具有极高的拉伸强度和耐磨性,适用于制造渔网、绳索,C正确;
D.DNA双螺旋中,碱基互补配对(如A-T、C-G)通过氢键实现,A-T间2个氢键,C-G间3个氢键,D正确;
故选A。
17.(1)
(2)
(3)
(4) a b 800℃时,转化率低;和的转化率相当,时能耗太高
(5)
(6)为离子晶体,熔点较高,都是分子晶体,相对分子质量逐渐增大,分子间作用力逐渐增大,熔点逐渐升高
“酸浸”后过滤,得到含TiOSO4、Fe2 (SO4)3等的溶液,加入大量水使TiOSO4水解,过滤后得到胶状;经煅烧得到TiO2,TiO2再与C、Cl2发生氧化还原反应生成TiCl4、CO、CO2,TiCl4经Mg热还原得到Ti。
(1)
Ti的价层电子排布式为3d24s2,故价层电子轨道排布式为;
(2)依题水解生成,水解方程式为;
(3)水解后的经煅烧得到TiO2,再与C、Cl2发生氧化还原反应生成TiCl4、CO、CO2,反应的化学方程式为;
(4)①Mg与氧气、氮气、二氧化碳均反应,故还原过程应在氩气氛围中进行;
②Mg还原TiCl4制Ti,属于热还原法,Fe也是用热还原法制备;Na、Al等活泼金属用电解法,Pt、Au等不活泼金属用富集法制备;
③800℃的提取率低,1000℃与1500℃提取率很高而且相差不大,故选择1000℃,可以节约生产成本;
(5)根据反应机理图可知,在催化剂作用下甲醇和二氧化碳转化甲酸甲酯、甲醛和水,总反应方程式为;
(6)TiF4是离子晶体,其余为分子晶体。离子晶体熔点较高,分子晶体熔点低,且分子晶体熔点随相对分子质量增大而升高。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
