九年级化学上学期鲁教版 第一节 原子第3课时 原子与离子、分子课件(共16张PPT内嵌视频)
文档属性
| 名称 | 九年级化学上学期鲁教版 第一节 原子第3课时 原子与离子、分子课件(共16张PPT内嵌视频) |  | |
| 格式 | pptx | ||
| 文件大小 | 66.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-13 08:00:12 | ||
图片预览






文档简介
(共16张PPT)
九年级化学上学期鲁教版六三制第二单元 认识物质的构成
第一节 原子
第3课时 原子与离子、分子
原子(第三课时)
原子与离子、分子
+
+
+
面对困难和挑战时,潜心钻研,勤学笃志,扎扎实实打好基础,为祖国的发展贡献自己的一份力量。
学习目标
通过观看微观动画了解核外电子有能量的高低,知道核外电子的排布规律,认识核外电子排布示意图。
01
02
通过分析元素的原子结构示意图,初步认识核外电子在化学反应中的应用,知道离子的形成过程,认识离子符号
03
知道可以通过实验、想象、推理等方法探索物质的结构
04
通过探究活动认识到科学的严谨性,养成团结合作的精神
1913年,丹麦物理学家玻尔在卢瑟福“行星有核式模型”的基础上借助量子理论改进了原子结构的模型。
丹麦物理学家玻尔
(1885~1962)
卢瑟福行星有核式模型
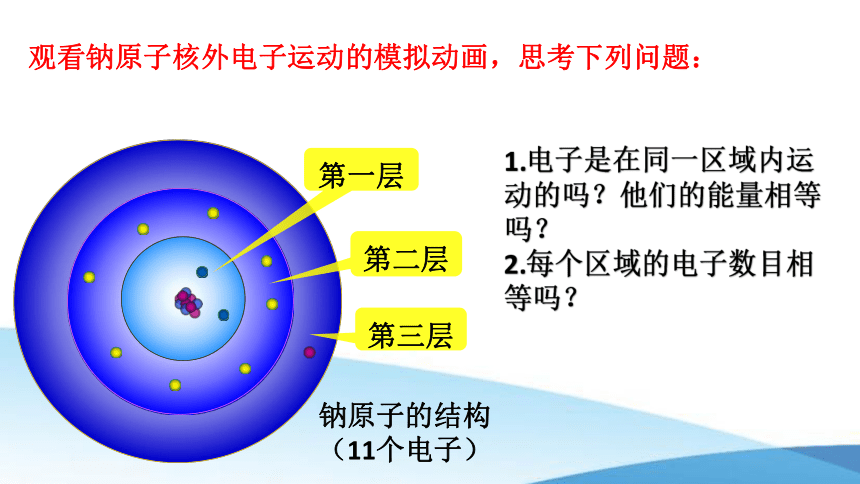
观看钠原子核外电子运动的模拟动画,思考下列问题:
第一层
第二层
第三层
钠原子的结构
(11个电子)
1.电子是在同一区域内运动的吗?他们的能量相等吗?
2.每个区域的电子数目相等吗?
核外电子排布规律
能量低的在离核近的区域运动,
能量高的在离核远的区域运动
电子是分层排布的:
第一层最多排2个电子
第二层最多排8个电子
最外层最多排8个电子
请同学们利用手中的彩泥和纸盘排出钠原子(11个电子)和氯原子(17个电子)的核外电子排布【只排电子】
+11
电子层
原子核
质子数
各电子层上的电子数
圆圈表示
圈内数字表示
弧线表示
原子核带正电
“+”表示
2 8 1
弧线上的数字表示
第一层
第二层
第三层(最外层)
用原子结构示意图简明便捷的表示核外电子排布
2
+3
1
2
+4
2
锂原子 铍原子
+2
2
氦原子
钠原子 镁原子 铝原子
+1
1
氢原子
8
+11
1
8
+12
2
8
+13
3
2
2
2
硼原子 碳原子 氮原子 氧原子 氟原子
氖原子
2
+5
3
2
+6
4
2
+7
5
2
+8
6
2
+9
7
2
+10
8
8
+18
8
2
8
+14
4
8
+15
5
8
+16
6
8
+17
7
2
2
2
2
硅原子 磷原子 硫原子 氯原子
氩原子
1.黑色原子的电子排列有什么相同点?
2.与黑色原子相比,红色和蓝色原子的电子排列有何不同?
稀有气体
原子结构示意图
构成
氦气
氖气
氩气
氪气
氙气
+2
2
8
+10
2
8
8
+18
2
18
8
+36
2
8
18
8
+54
2
18
8
氦原子
氖原子
氩原子
氪原子
氙原子
稀有气体原子最外层一般有8(氦是2个)电子,这样的结构被认为是稳定结构。
......
找规律
2
+3
1
2
+4
2
锂原子 铍原子
+2
2
氦原子
钠原子 镁原子 铝原子
+1
1
氢原子
8
+11
1
8
+12
2
8
+13
3
2
2
2
硼原子 碳原子 氮原子 氧原子 氟原子
氖原子
2
+5
3
2
+6
4
2
+7
5
2
+8
6
2
+9
7
2
+10
8
8
+18
8
2
8
+14
4
8
+15
5
8
+16
6
8
+17
7
2
2
2
2
硅原子 磷原子 硫原子 氯原子
氩原子
1.黑色原子的电子排列有什么相同点?
2.与黑色原子相比,红色和蓝色原子的电子排列有何不同?
金属原子最外层电子数一般小于4;在化学反应中易失去最外层电子,使次外层成为最外层,从而达到稳定结构。
非金属原子最外层电子数一般大于4; 在化学反应中易得到电子,使最外层达到稳定结构。
原子在化学变化中的表现,与核外电子有密切关系。
最外层电子数相同,化学性质相似。
请同学们以小组为单位,结合原子结构示意图,利用手中已经排好的钠原子和氯原子模型模拟氯化钠的形成过程
氯化钠的形成过程
一个电子
Na
Cl
钠离子Na+
氯离子Cl-
质子数
核外电子数
>
质子数
核外电子数
<
阳离子
阴离子
练习:镁(12个质子)离子的形成和书写
2+
Mg
+12
2
2
8
+12
2
8
离子符号的写法:离子符号歪戴帽,先写数字后写号
一个镁离子带2个单位的正电荷
离子是构成物质的一种基本粒子,如氧化镁、氯化钾等
有些原子不是先转化成离子再构成物质的,而是原子之间直接结合形成分子,再由分子构成物质的。例如,2个氢原子(H)能与1个氧原子(O)结合,形成1个水分子(H2O)。
氧原子的自我介绍
姓名:氧原子
年龄: 不详
原子内部结构:
体重:2.657×10-26Kg(相对原子质量计算式)
性格(化学性质):比较活泼
原因(用原子结构示意图表示):
+8
2
6
8
希望是隐藏在群山后的星星,
探索是人生道路上最倔执的旅人。
九年级化学上学期鲁教版六三制第二单元 认识物质的构成
第一节 原子
第3课时 原子与离子、分子
原子(第三课时)
原子与离子、分子
+
+
+
面对困难和挑战时,潜心钻研,勤学笃志,扎扎实实打好基础,为祖国的发展贡献自己的一份力量。
学习目标
通过观看微观动画了解核外电子有能量的高低,知道核外电子的排布规律,认识核外电子排布示意图。
01
02
通过分析元素的原子结构示意图,初步认识核外电子在化学反应中的应用,知道离子的形成过程,认识离子符号
03
知道可以通过实验、想象、推理等方法探索物质的结构
04
通过探究活动认识到科学的严谨性,养成团结合作的精神
1913年,丹麦物理学家玻尔在卢瑟福“行星有核式模型”的基础上借助量子理论改进了原子结构的模型。
丹麦物理学家玻尔
(1885~1962)
卢瑟福行星有核式模型
观看钠原子核外电子运动的模拟动画,思考下列问题:
第一层
第二层
第三层
钠原子的结构
(11个电子)
1.电子是在同一区域内运动的吗?他们的能量相等吗?
2.每个区域的电子数目相等吗?
核外电子排布规律
能量低的在离核近的区域运动,
能量高的在离核远的区域运动
电子是分层排布的:
第一层最多排2个电子
第二层最多排8个电子
最外层最多排8个电子
请同学们利用手中的彩泥和纸盘排出钠原子(11个电子)和氯原子(17个电子)的核外电子排布【只排电子】
+11
电子层
原子核
质子数
各电子层上的电子数
圆圈表示
圈内数字表示
弧线表示
原子核带正电
“+”表示
2 8 1
弧线上的数字表示
第一层
第二层
第三层(最外层)
用原子结构示意图简明便捷的表示核外电子排布
2
+3
1
2
+4
2
锂原子 铍原子
+2
2
氦原子
钠原子 镁原子 铝原子
+1
1
氢原子
8
+11
1
8
+12
2
8
+13
3
2
2
2
硼原子 碳原子 氮原子 氧原子 氟原子
氖原子
2
+5
3
2
+6
4
2
+7
5
2
+8
6
2
+9
7
2
+10
8
8
+18
8
2
8
+14
4
8
+15
5
8
+16
6
8
+17
7
2
2
2
2
硅原子 磷原子 硫原子 氯原子
氩原子
1.黑色原子的电子排列有什么相同点?
2.与黑色原子相比,红色和蓝色原子的电子排列有何不同?
稀有气体
原子结构示意图
构成
氦气
氖气
氩气
氪气
氙气
+2
2
8
+10
2
8
8
+18
2
18
8
+36
2
8
18
8
+54
2
18
8
氦原子
氖原子
氩原子
氪原子
氙原子
稀有气体原子最外层一般有8(氦是2个)电子,这样的结构被认为是稳定结构。
......
找规律
2
+3
1
2
+4
2
锂原子 铍原子
+2
2
氦原子
钠原子 镁原子 铝原子
+1
1
氢原子
8
+11
1
8
+12
2
8
+13
3
2
2
2
硼原子 碳原子 氮原子 氧原子 氟原子
氖原子
2
+5
3
2
+6
4
2
+7
5
2
+8
6
2
+9
7
2
+10
8
8
+18
8
2
8
+14
4
8
+15
5
8
+16
6
8
+17
7
2
2
2
2
硅原子 磷原子 硫原子 氯原子
氩原子
1.黑色原子的电子排列有什么相同点?
2.与黑色原子相比,红色和蓝色原子的电子排列有何不同?
金属原子最外层电子数一般小于4;在化学反应中易失去最外层电子,使次外层成为最外层,从而达到稳定结构。
非金属原子最外层电子数一般大于4; 在化学反应中易得到电子,使最外层达到稳定结构。
原子在化学变化中的表现,与核外电子有密切关系。
最外层电子数相同,化学性质相似。
请同学们以小组为单位,结合原子结构示意图,利用手中已经排好的钠原子和氯原子模型模拟氯化钠的形成过程
氯化钠的形成过程
一个电子
Na
Cl
钠离子Na+
氯离子Cl-
质子数
核外电子数
>
质子数
核外电子数
<
阳离子
阴离子
练习:镁(12个质子)离子的形成和书写
2+
Mg
+12
2
2
8
+12
2
8
离子符号的写法:离子符号歪戴帽,先写数字后写号
一个镁离子带2个单位的正电荷
离子是构成物质的一种基本粒子,如氧化镁、氯化钾等
有些原子不是先转化成离子再构成物质的,而是原子之间直接结合形成分子,再由分子构成物质的。例如,2个氢原子(H)能与1个氧原子(O)结合,形成1个水分子(H2O)。
氧原子的自我介绍
姓名:氧原子
年龄: 不详
原子内部结构:
体重:2.657×10-26Kg(相对原子质量计算式)
性格(化学性质):比较活泼
原因(用原子结构示意图表示):
+8
2
6
8
希望是隐藏在群山后的星星,
探索是人生道路上最倔执的旅人。
同课章节目录
