10.2 常见的酸和碱(第1课时)-课件(共27张PPT)--2024-2025学年九年级化学人教版(2024)下册
文档属性
| 名称 | 10.2 常见的酸和碱(第1课时)-课件(共27张PPT)--2024-2025学年九年级化学人教版(2024)下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 8.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-13 07:37:43 | ||
图片预览








文档简介
(共27张PPT)
课题2 常见的酸和碱
第十单元 常见的酸、碱、盐
人教版化学九年级下册
第一课时 常见的酸
1.认识盐酸、硫酸的特性及用途。
2.了解浓硫酸的腐蚀性及使用时的安全注意事项。
3.能利用盐酸和硫酸的性质,分析、解释一些简单的化学现象和事实。
核心素养
醋酸CH3COOH
碳酸
H2CO3
我们身边的“酸”
柠檬酸
胃酸
HCl
硫酸
H2SO4
导入新课
硫酸H2SO4
盐酸
HCl
常见的酸
导入新课
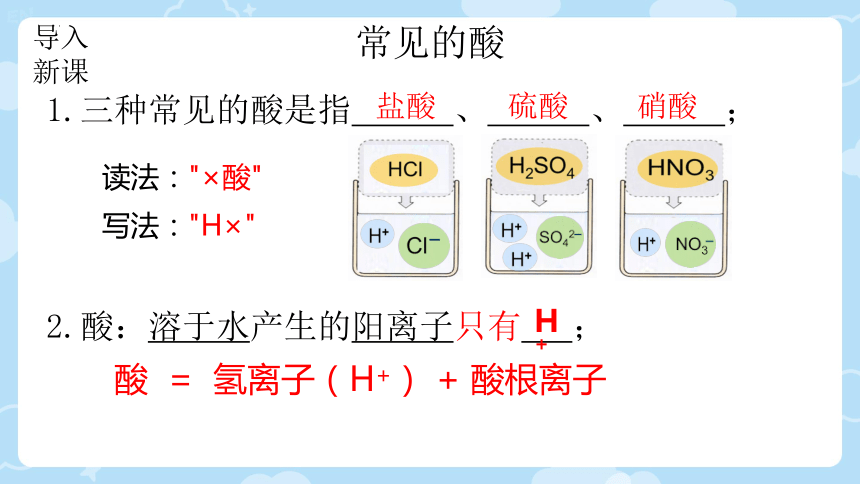
常见的酸
1.三种常见的酸是指 、 、 ;
盐酸
硝酸
硫酸
2.酸:溶于水产生的阳离子只有 ;
H+
酸 = 氢离子(H+) + 酸根离子
读法:"×酸"
写法:"H×"
导入新课
学习内容导览
01 盐酸和硫酸的性质
03 盐酸和硫酸的用途
02 浓硫酸的稀释
04 酸的化学性质
01
盐酸和硫酸的性质
一、盐酸和硫酸的性质
浓盐酸(HCl) 浓硫酸(H2SO4)
颜色、状态 无色、 液体 无色、粘稠油状、液体
打开试剂瓶后的现象
气 味 有刺激性气味 无味
密 度 常见浓盐酸(37%~38%) 1.19g/cm3 常见浓硫酸(98%)
1.84g/cm3
1、实验10-4 盐酸、硫酸的物理性质比较
瓶口出现白雾
无明显现象
(挥发性)
一、盐酸和硫酸的性质
2、实验10-3 浓硫酸的腐蚀性(脱水性)
实验 放置一会儿后的现象 结论
用玻璃棒蘸取浓硫酸 在纸上写字
用小木棍蘸少量浓硫酸 将浓硫酸滴到一小块布上 纸上显出黑色字迹
蘸有硫酸的部位变黑
滴有硫酸的部位变黑
甚至烧成洞
浓硫酸有很强的腐蚀性,能使木条等物质脱水发生炭化而腐蚀。
脱水性:使有机物中的氢、氧原子以2:1的比例脱出
02
浓硫酸的稀释
二、浓硫酸的稀释
正确操作:将浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里,用玻璃棒不断搅拌。
并用手轻轻触碰烧杯外壁,有什么感觉?
酸入水,不后悔!
浓硫酸溶解时___热
放
颠倒顺序后果:稀释时,水浮在浓硫酸上面,并迅速沸腾,
酸液向四周飞溅,造成危险!
事故处理:若浓硫酸沾到皮肤上,先用大量水冲洗,再涂上3%~5%的
碳酸氢钠溶液。
烫
杯壁下流
03
盐酸和硫酸的用途
三、盐酸和硫酸的用途
三、盐酸和硫酸的用途
浓硫酸的吸水性
气体干燥剂
物理性质
1.长进短出,导管要伸到液面下
3.不能干燥碱性气体:例如NH3
注意:
浓硫酸的特性
脱水性:
化学性质
2.常用作H2、O2和CO2的干燥剂
1、吸水性和脱水性性质的区别
吸水性:
性质
2、用途:
如果不小心将浓硫酸和浓盐酸露置于空气中很长时间,你能从溶液组成上(溶质、溶剂、溶质的质量分数)分析它们发生了哪些变化?
浓盐酸
浓硫酸
溶质 质量 溶剂 质量 溶液 质量 溶质
质量分数
浓盐酸
浓硫酸
通过思考可知:实验室浓硫酸、浓盐酸必须密封保存。
思考:
浓盐酸:
性质
浓硫酸:
挥发性
吸水性
减少
不变
不变
增加
减少
增加
变小
变小
三、盐酸和硫酸的主要用途
主要用途
盐酸
硫酸
①金属表面除锈、洁厕灵;
②人体胃液中含有盐酸,帮助消化;
①金属表面除锈;
②浓硫酸吸水性,常用于做干燥剂;
③汽车铅蓄电池中含有硫酸;
特性
(全品P45第九题)
04
酸的化学性质
四、酸的化学性质
紫色 石蕊试液 无色
酚酞试液
盐酸
硫酸
①紫色石蕊试液遇酸变 色;
②无色酚酞试液遇酸 色。
红
不变
变红色
变红色
不变色
不变色
【结论】
【性质1】酸使指示剂变色;
点滴板
点滴板优点:
节约药品
四、酸的化学性质
【性质2】酸与活泼金属单质反应;
化学反应 现 象 化学方程式
1、稀盐酸与镁
2、稀盐酸与锌
3、稀盐酸与铁
4、稀硫酸与镁
5、稀硫酸与锌
6、稀硫酸与铁
许多气泡
产生气泡,溶液变浅绿色
许多气泡
产生气泡,溶液变浅绿色
大量气泡
大量气泡
反应规律:
酸 + 活泼金属 盐 + 氢气
金属离子与酸根离子
【性质3】酸与金属氧化物反应:
四、酸的化学性质
稀盐酸
①铁锈消失;
②溶液由无色变为黄色
现象
反应规律:
酸+金属氧化物 → 盐 + 水
生锈的铁钉
【性质3】酸与金属氧化物反应:
四、酸的化学性质
反应规律:
酸+金属氧化物 → 盐 + 水
稀
硫
酸
①黑色固体消失;
②溶液由无色变为蓝色
现象
氧化铜
拓展:
【性质3】酸与金属氧化物反应:
四、酸的化学性质
思考:利用上面的反应可以清除金属制品表面的锈,除锈 时能否将金属制品长时间浸在酸中?为什么?
不能长时间浸在酸中,因为酸会与金属继续反应,造成金属制品的腐蚀。
铁制品长时间浸在酸中的现象:
①铁锈消失;
②溶液由无色变为黄色
③有气泡冒出
性质2:酸 + 活泼金属 = 盐 + 氢气
性质1:酸可以使指示剂变色
性质3:酸 + 金属氧化物 = 盐 + 水
【酸的通性】
【讨论】为什么不同的酸化学性质相似呢?
【解析】因为酸溶于水后都会产生相同的氢离子(H+)。
四、酸的化学性质
酸具有相似化学性质的原因
HCl → H+ + Cl-
H2SO4→ 2H+ + SO42-
酸 H+ + 酸根离子
在水溶液中
解 离
常温下,浓硫酸使铁表面生成一层致密的氧化膜,阻止铁与浓硫酸进一步反应,所以可以用铁罐车运输浓硫酸。某新上岗的工人违反操作规定,边吸烟边用水冲洗运输过浓硫酸的铁罐车,结果发生了爆炸事故。请以该厂技术员的身份分析一下发生爆炸的原因。
为什么发生了爆炸?
用水冲洗铁罐车时,浓硫酸被稀释成稀硫酸,稀硫酸与铁发生化学反应生成了氢气,氢气遇火发生爆炸。
兴趣拓展
课堂小结
课题2 常见的酸和碱
第十单元 常见的酸、碱、盐
人教版化学九年级下册
第一课时 常见的酸
1.认识盐酸、硫酸的特性及用途。
2.了解浓硫酸的腐蚀性及使用时的安全注意事项。
3.能利用盐酸和硫酸的性质,分析、解释一些简单的化学现象和事实。
核心素养
醋酸CH3COOH
碳酸
H2CO3
我们身边的“酸”
柠檬酸
胃酸
HCl
硫酸
H2SO4
导入新课
硫酸H2SO4
盐酸
HCl
常见的酸
导入新课
常见的酸
1.三种常见的酸是指 、 、 ;
盐酸
硝酸
硫酸
2.酸:溶于水产生的阳离子只有 ;
H+
酸 = 氢离子(H+) + 酸根离子
读法:"×酸"
写法:"H×"
导入新课
学习内容导览
01 盐酸和硫酸的性质
03 盐酸和硫酸的用途
02 浓硫酸的稀释
04 酸的化学性质
01
盐酸和硫酸的性质
一、盐酸和硫酸的性质
浓盐酸(HCl) 浓硫酸(H2SO4)
颜色、状态 无色、 液体 无色、粘稠油状、液体
打开试剂瓶后的现象
气 味 有刺激性气味 无味
密 度 常见浓盐酸(37%~38%) 1.19g/cm3 常见浓硫酸(98%)
1.84g/cm3
1、实验10-4 盐酸、硫酸的物理性质比较
瓶口出现白雾
无明显现象
(挥发性)
一、盐酸和硫酸的性质
2、实验10-3 浓硫酸的腐蚀性(脱水性)
实验 放置一会儿后的现象 结论
用玻璃棒蘸取浓硫酸 在纸上写字
用小木棍蘸少量浓硫酸 将浓硫酸滴到一小块布上 纸上显出黑色字迹
蘸有硫酸的部位变黑
滴有硫酸的部位变黑
甚至烧成洞
浓硫酸有很强的腐蚀性,能使木条等物质脱水发生炭化而腐蚀。
脱水性:使有机物中的氢、氧原子以2:1的比例脱出
02
浓硫酸的稀释
二、浓硫酸的稀释
正确操作:将浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里,用玻璃棒不断搅拌。
并用手轻轻触碰烧杯外壁,有什么感觉?
酸入水,不后悔!
浓硫酸溶解时___热
放
颠倒顺序后果:稀释时,水浮在浓硫酸上面,并迅速沸腾,
酸液向四周飞溅,造成危险!
事故处理:若浓硫酸沾到皮肤上,先用大量水冲洗,再涂上3%~5%的
碳酸氢钠溶液。
烫
杯壁下流
03
盐酸和硫酸的用途
三、盐酸和硫酸的用途
三、盐酸和硫酸的用途
浓硫酸的吸水性
气体干燥剂
物理性质
1.长进短出,导管要伸到液面下
3.不能干燥碱性气体:例如NH3
注意:
浓硫酸的特性
脱水性:
化学性质
2.常用作H2、O2和CO2的干燥剂
1、吸水性和脱水性性质的区别
吸水性:
性质
2、用途:
如果不小心将浓硫酸和浓盐酸露置于空气中很长时间,你能从溶液组成上(溶质、溶剂、溶质的质量分数)分析它们发生了哪些变化?
浓盐酸
浓硫酸
溶质 质量 溶剂 质量 溶液 质量 溶质
质量分数
浓盐酸
浓硫酸
通过思考可知:实验室浓硫酸、浓盐酸必须密封保存。
思考:
浓盐酸:
性质
浓硫酸:
挥发性
吸水性
减少
不变
不变
增加
减少
增加
变小
变小
三、盐酸和硫酸的主要用途
主要用途
盐酸
硫酸
①金属表面除锈、洁厕灵;
②人体胃液中含有盐酸,帮助消化;
①金属表面除锈;
②浓硫酸吸水性,常用于做干燥剂;
③汽车铅蓄电池中含有硫酸;
特性
(全品P45第九题)
04
酸的化学性质
四、酸的化学性质
紫色 石蕊试液 无色
酚酞试液
盐酸
硫酸
①紫色石蕊试液遇酸变 色;
②无色酚酞试液遇酸 色。
红
不变
变红色
变红色
不变色
不变色
【结论】
【性质1】酸使指示剂变色;
点滴板
点滴板优点:
节约药品
四、酸的化学性质
【性质2】酸与活泼金属单质反应;
化学反应 现 象 化学方程式
1、稀盐酸与镁
2、稀盐酸与锌
3、稀盐酸与铁
4、稀硫酸与镁
5、稀硫酸与锌
6、稀硫酸与铁
许多气泡
产生气泡,溶液变浅绿色
许多气泡
产生气泡,溶液变浅绿色
大量气泡
大量气泡
反应规律:
酸 + 活泼金属 盐 + 氢气
金属离子与酸根离子
【性质3】酸与金属氧化物反应:
四、酸的化学性质
稀盐酸
①铁锈消失;
②溶液由无色变为黄色
现象
反应规律:
酸+金属氧化物 → 盐 + 水
生锈的铁钉
【性质3】酸与金属氧化物反应:
四、酸的化学性质
反应规律:
酸+金属氧化物 → 盐 + 水
稀
硫
酸
①黑色固体消失;
②溶液由无色变为蓝色
现象
氧化铜
拓展:
【性质3】酸与金属氧化物反应:
四、酸的化学性质
思考:利用上面的反应可以清除金属制品表面的锈,除锈 时能否将金属制品长时间浸在酸中?为什么?
不能长时间浸在酸中,因为酸会与金属继续反应,造成金属制品的腐蚀。
铁制品长时间浸在酸中的现象:
①铁锈消失;
②溶液由无色变为黄色
③有气泡冒出
性质2:酸 + 活泼金属 = 盐 + 氢气
性质1:酸可以使指示剂变色
性质3:酸 + 金属氧化物 = 盐 + 水
【酸的通性】
【讨论】为什么不同的酸化学性质相似呢?
【解析】因为酸溶于水后都会产生相同的氢离子(H+)。
四、酸的化学性质
酸具有相似化学性质的原因
HCl → H+ + Cl-
H2SO4→ 2H+ + SO42-
酸 H+ + 酸根离子
在水溶液中
解 离
常温下,浓硫酸使铁表面生成一层致密的氧化膜,阻止铁与浓硫酸进一步反应,所以可以用铁罐车运输浓硫酸。某新上岗的工人违反操作规定,边吸烟边用水冲洗运输过浓硫酸的铁罐车,结果发生了爆炸事故。请以该厂技术员的身份分析一下发生爆炸的原因。
为什么发生了爆炸?
用水冲洗铁罐车时,浓硫酸被稀释成稀硫酸,稀硫酸与铁发生化学反应生成了氢气,氢气遇火发生爆炸。
兴趣拓展
课堂小结
同课章节目录
