大单元一 化学基础知识 第3讲 离子反应 学案 (含答案)2026届高三一轮大单元复习
文档属性
| 名称 | 大单元一 化学基础知识 第3讲 离子反应 学案 (含答案)2026届高三一轮大单元复习 |  | |
| 格式 | DOC | ||
| 文件大小 | 488.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-14 11:17:38 | ||
图片预览




文档简介
第3讲 离子反应
备考导航
复习目标 1. 了解电解质及其分类,掌握强电解质、弱电解质的本质区别。
2. 理解电解质在水溶液中的电离以及电解质溶液的导电性。
3. 了解离子反应的概念,了解离子反应发生的条件,能正确书写离子方程式。
4. 掌握离子共存的条件,会判断溶液中离子能否大量共存。
5. 掌握常见离子的检验,能根据实验现象推断溶液中所含离子的种类。
熟记网络
课前自测 判断正误(正确的打“√”,错误的打“×”)。
(1) (2017·江苏卷)无色透明的溶液中:Fe3+、Mg2+、SCN-、Cl-能大量共存( )
(2) (2018·江苏卷)0.1 mol/L HCl 溶液中:Ba2+、K+、CH3COO-、NO能大量共存( )
(3) (2019·江苏卷)0.1 mol/L FeCl2溶液中:K+、Mg2+、SO、MnO能大量共存( )
(4) (2022·辽宁卷)H2S电离:H2S??2H+ + S2-( )
(5) (2023·海门调研)H2O2氧化酸性废水中的Fe2+:2Fe2++H2O2===2Fe3++2OH-( )
(6) (2024·徐州模拟)向某溶液X中滴加少量稀盐酸,再滴加几滴Ba(NO3)2溶液,出现白色沉淀,该溶液中含有SO( )
(7) (2024·徐州模拟)K+的检验:用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,观察火焰颜色变化( )
(8) (2023·常熟)检验溶液X中含有CO或HCO:向溶液X中加入稀硫酸,并将产生的无色气体通入澄清石灰水中,观察是否有沉淀生成( )
(9) (2023·海门调研)检验溶液中是否存在NH:向某溶液中加入氢氧化钠溶液并加热,观察产生的气体能否使蓝色石蕊试纸变色( )
(10) 取少量某溶液于试管中,加稀盐酸酸化,再加入FeCl2溶液,若溶液变黄色且试管上部产生红棕色气体,则该溶液中含有NO( )
考点1 电解质与电离方程式
知 识 梳 理
电解质与非电解质
电离方程式的书写
1. 强电解质:完全电离,用“===”连接。
如:H2SO4===2H++SO
2. 弱电解质:部分电离,用“??”表示。
如:NH3·H2O?? NH+OH-
3. 多元弱酸:分步电离,以第一步电离为主。
如:H2SO3??H++HSO、
HSO??H++SO
4. 多元弱碱:分步电离,但一步书写。
如:Cu(OH)2??Cu2++2OH-
5. 酸式盐的书写方法
(1) 弱酸的酸式盐在溶液中完全电离,生成酸式酸根离子和阳离子。
如:NaHC2O4===Na++HC2O、
HC2O??H++C2O
(2) 强酸的酸式盐在水溶液中完全电离。
如:NaHSO4===Na++H++SO
典 题 悟 法
(2024·江苏各地模拟重组)下列能正确表示电离方程式的是______(填字母)。
A. NaHCO3在水溶液中的电离:NaHCO3===Na++H++CO
B. 硼酸在水中的电离方程式:H3BO3+H2O??[B(OH)4]-+H+
C. 草酸的电离方程式:H2C2O4??C2O+2H+
D. 液氨电离可表示为2NH3??NH+NH
考点2 离子方程式的书写
知 识 梳 理
离子方程式中物质的“拆分”
1. 单质、气体、氧化物、弱电解质(弱酸、弱碱、水等)、络合物{如Fe(SCN)3、[Ag(NH3)2]+}、弱酸的酸式根离子、难溶盐不能拆分成离子。
2. 强酸(如HCl、H2SO4、HNO3、HBr、HI、HClO4等)、强碱[如KOH、NaOH、Ca(OH)2、Ba(OH)2等]、绝大多数可溶性的盐拆分成离子。
(1) 钾盐、钠盐、铵盐、硝酸盐、磷酸二氢盐等都易溶于水。
(2) 氯化物中,AgCl难溶于水。硫酸盐中,PbSO4、BaSO4难溶于水,CaSO4、Ag2SO4微溶于水。
(3) 碳酸盐、亚硫酸盐、磷酸盐和硅酸盐,除钾盐、钠盐、铵盐外都难溶于水,如BaCO3、BaSO3、Ca3(PO4)2等难溶于水。
(4) 硫化物中,除K2S、Na2S、(NH4)2S、BaS外均难溶于水。
(5) 银盐中,AgCl、AgBr、AgI、Ag2S、Ag3PO4、Ag2CO3等都难溶。
3. 微溶物[如Ca(OH)2、CaSO4、MgCO3、Ag2SO4]的处理
(1) 生成物中有微溶物时,微溶物不拆。
(2) 反应物中微溶物处于溶液状态(稀溶液),拆成离子,如澄清石灰水中的“Ca(OH)2”拆成“Ca2++2OH-”。
(3) 反应物中微溶物处于固态或悬浊液状态时,仍写化学式。如石灰乳中的“Ca(OH)2”不拆分。
离子方程式的正误判断
1. 检查离子反应是否符合反应原理。
2. 检查化学式拆分是否正确。
3. 多重反应,检查是否漏写离子反应。
4. 检查物质的量的关系是否正确(少量与过量)。
5. 检查离子方程式左右两边是否符合原子守恒、电荷守恒、得失电子守恒。
6. 检查各项物质的化学计量数是否为最简整数比。
7. 检查反应是否完全进行(“===”“??”),反应条件、气体和沉淀符号是否遗漏等。
典 题 悟 法
离子方程式的正误判断
(2024·淮安期末)铁、钴、镍是元素周期表中第4周期Ⅷ族元素,物理性质和化学性质比较相似。一般情况下,在化合物中常见的价态为+2和+3,Co(Ⅲ)和Ni(Ⅲ)有强氧化性,酸性条件下能将Cl-氧化成Cl2。向Ni(Ⅱ)盐的溶液中加入过量的氨水,可以生成稳定的蓝色配离子[Ni(NH3)6]2+。下列指定反应的离子方程式正确的是( )
A. Co2O3溶于浓盐酸:Co2O3+6H+===2Co3++3H2O
B. 将Ni(OH)2溶于氨水:Ni(OH)2+6NH3·H2O===[Ni(NH3)6]2++2OH-+6H2O
C. 向FeCl3溶液中滴加少量NaHCO3溶液:2Fe3++3CO===Fe2(CO3)3↓
D. NaClO在浓碱溶液中将Fe(OH)3氧化成FeO:2Fe(OH)3+3ClO-===2FeO+3Cl-+H2O+4H+
离子方程式的书写
(1) (2023·江苏卷)V2O5-WO3/TiO2催化剂能催化NH3脱除烟气中的NO。将预先制备的一定量的WO3/TiO2粉末置于80 ℃的水中,在搅拌下加入一定量的NH4VO3溶液,经蒸发、焙烧等工序得到颗粒状V2O5-WO3/TiO2催化剂。在水溶液中VO水解为H3VO4沉淀的离子方程式为________________________ ______________________________________________________________________________________;反应选用NH4VO3溶液而不选用NaVO3溶液的原因是_________________________________________________ ____________________。
(2) (2023·镇江期中)用氯化铵溶液浸取ZnO生成[Zn(NH3)4]2+,离子方程式为_______________________ ___________________________________________________________________。
(3) (2024·扬州中学)(NH4)2Fe(SO4)2溶液与H3PO4溶液、LiOH溶液反应得到LiFePO4沉淀和NH4HSO4 ,该反应的离子方程式为________________________________________________________________________ __________________________________________________[已知Ka(HSO)=1.0×10-2]。
(4) (2023·镇江)MgCl2溶液中加入尿素[CO(NH2)2]生成Mg5(CO3)4(OH)2沉淀,同时有CO2气体产生,该反应的离子方程式为________________________________________________________________________ _____________________________________________________________________。
(5) (2024·连云港中学)含钴废料(主要成分为Co2O3)用硫酸和Na2SO3溶液浸出后,溶液中含有的阳离子是Na+、H+、Co2+等。
①写出“浸取”时Co2O3所发生反应的离子方程式:____________________________________________ ______________________________________________。
②“浸取”时含钴废料、硫酸和Na2SO3溶液混合的方式为______________________________________ __________________________________________________________。
深度指津
“定1法”书写离子方程式
1. 将少量物质定为“1 mol”,若少量物质有两种或两种以上离子参加反应,则参加反应离子的物质的量之比与物质组成之比相符。
2. 依据少量物质中离子的物质的量,确定过量物质中实际参加反应的离子的物质的量。
3. 依据“先中和后沉淀”的思路书写离子方程式。
(1) 澄清石灰水中加入少量NaHCO3溶液:____________________________________________________ ____________________。
(2) NaHCO3溶液中加入少量澄清石灰水:_____________________________________________________ _____________________________________。
考点3 离子共存
知 识 梳 理
离子不能共存的类型
1. 发生复分解反应的离子不能大量共存
(1) 生成难电离物质或生成气体及挥发性物质的离子不能大量共存
离子 不能大量共存的离子
H+ CO/HCO、SO/HSO、CH3COO-、SiO、ClO-、F-、S2-/HS-、C2O/HC2O、NO、PO/HPO/H2PO等(生成弱酸)
OH-(生成H2O)
OH- NH(生成NH3·H2O)
HCO、HSO、HC2O、HS-、HPO、H2PO等(生成H2O)
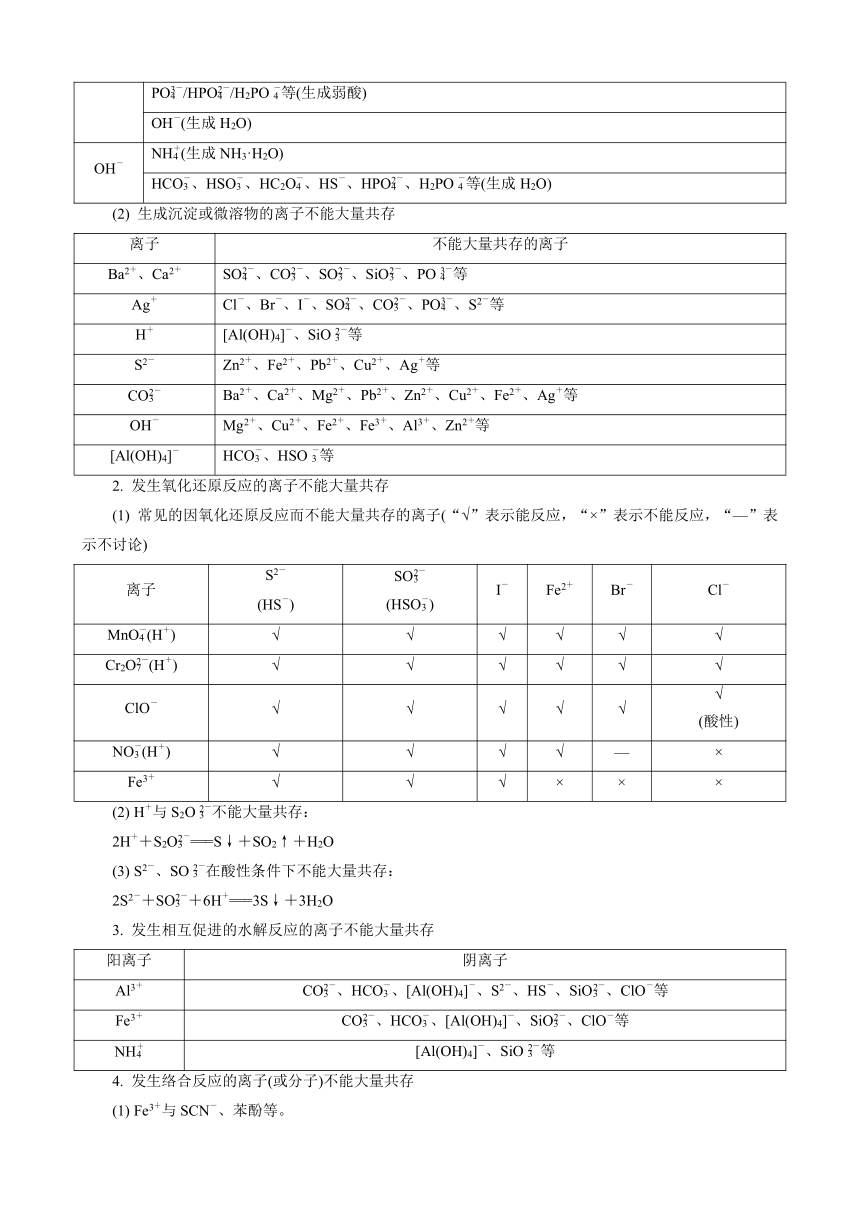
(2) 生成沉淀或微溶物的离子不能大量共存
离子 不能大量共存的离子
Ba2+、Ca2+ SO、CO、SO、SiO、PO等
Ag+ Cl-、Br-、I-、SO、CO、PO、S2-等
H+ [Al(OH)4]-、SiO等
S2- Zn2+、Fe2+、Pb2+、Cu2+、Ag+等
CO Ba2+、Ca2+、Mg2+、Pb2+、Zn2+、Cu2+、Fe2+、Ag+等
OH- Mg2+、Cu2+、Fe2+、Fe3+、Al3+、Zn2+等
[Al(OH)4]- HCO、HSO等
2. 发生氧化还原反应的离子不能大量共存
(1) 常见的因氧化还原反应而不能大量共存的离子(“√”表示能反应,“×”表示不能反应,“—”表示不讨论)
离子 S2-
(HS-) SO
(HSO) I- Fe2+ Br- Cl-
MnO(H+) √ √ √ √ √ √
Cr2O(H+) √ √ √ √ √ √
ClO- √ √ √ √ √ √
(酸性)
NO(H+) √ √ √ √ — ×
Fe3+ √ √ √ × × ×
(2) H+与S2O不能大量共存:
2H++S2O===S↓+SO2↑+H2O
(3) S2-、SO在酸性条件下不能大量共存:
2S2-+SO+6H+===3S↓+3H2O
3. 发生相互促进的水解反应的离子不能大量共存
阳离子 阴离子
Al3+ CO、HCO、[Al(OH)4]-、S2-、HS-、SiO、ClO-等
Fe3+ CO、HCO、[Al(OH)4]-、SiO、ClO-等
NH [Al(OH)4]-、SiO等
4. 发生络合反应的离子(或分子)不能大量共存
(1) Fe3+与SCN-、苯酚等。
(2) Ag+、Cu2+、Zn2+等与NH3·H2O。
有关离子共存的限定条件
1. 颜色
无色溶液中,在溶液中显色的离子不能大量存在。如MnO(紫红色)、Cu2+(蓝色)、Fe3+(黄色)、Fe2+(浅绿色)(注意:“透明溶液”不是指溶液无色,“无色”不是白色)。
2. 溶液酸碱性
溶液 限定条件表述
酸性 溶液 ①使紫色石蕊变红
②使甲基橙变红
③常温下,pH=1
④常温下,>1的溶液
⑤常温下,<1×10-7 mol/L的溶液
⑥常温下,>1×10-7 mol/L的溶液
中性溶液 c(H+)=的溶液
碱性 溶液 ①使紫色石蕊变蓝
②使酚酞变红
③常温下,pH=13
④常温下,<1的溶液
⑤常温下,>1×10-7 mol/L的溶液
⑥常温下,<1×10-7 mol/L的溶液
酸性或 碱性溶液 ①常温下由水电离出的c(H+)<1×10-7 mol/L 的溶液
②与Al反应能放出H2的溶液(若是酸性溶液中应不含有NO)
典 题 悟 法
(2024·浙江1月卷)在溶液中能大量共存的离子组是( )
A. H+、I-、Ba2+、NO
B. Fe3+、K+、CN-、Cl-
C. Na+、SiO、Br-、Ca2+
D. NH、SO、CH3COO-、HCO
考点4 常见离子的检验
知 识 梳 理
常见离子的检验
离子 检验方法 离子方程式
NH 该盐溶液与NaOH溶液共热发生反应,生成能使_____________________试纸变___的有刺激性气味的气体 _______________________________________
Na+ 做焰色试验,其火焰为___色 —
K+ 做焰色试验,透过_______________观察,火焰呈____________色 —
Fe2+ 方法一:先向溶液中加入____________溶液,不显红色,再加入少量新制的___________________________后,立即显红色
方法二:向溶液中加入____________溶液,生成特征蓝色沉淀 方法一:__________________________________________________________________
(或2Fe2++H2O2+2H+===2Fe3++2H2O)
____________________________________________________________;
方法二:
______________________________________________________________________________________________________
Fe3+ 方法一:向溶液中加入KSCN溶液,溶液变红;
方法二:向溶液中加入_______________溶液,生成蓝色沉淀 方法二:
______________________________________________________________________________________________________
Cl- 向溶液中先加入_________酸化,再滴加_______________溶液,有白色沉淀(AgCl)产生(若有SO存在,则要先加入过量的硝酸钡,取清液再检验Cl-) __________________________________________
SO 向溶液中先加入_________酸化,再滴加_______________溶液,有白色沉淀(BaSO4)产生(加稀盐酸排除CO、SO、Ag+的干扰;不能用稀硝酸酸化,防止SO被氧化造成干扰) ________________________________________________
解疑释惑4
离子检验中常见干扰离子的排除
待检离子 干扰离子 排除措施
Cl- SO 加入过量的Ba(NO3)2溶液
CO 加入稀硝酸酸化
OH-
SO CO 加入稀盐酸酸化
SO
Ag+
典 题 悟 法
(2024·南京二模)室温下, 探究0.1 mol/L NH4Fe(SO4)2溶液的性质。下列实验方案能达到探究目的的是( )
选项 探究目的 实验方案
A 验证溶液中含有NH 向2 mL NH4Fe(SO4)2溶液中滴加几滴0.1 mol/L NaOH溶液,将湿润的红色石蕊试纸靠近试管口,加热,观察试纸颜色变化
B 溶液中是否含有Fe2+ 向2 mL NH4Fe(SO4)2溶液中滴加几滴新制氯水,再滴加KSCN溶液,观察溶液的颜色变化
C NH是否发生水解 用玻璃棒蘸取NH4Fe(SO4)2溶液滴在干燥的广泛pH试纸上,将试纸显色的颜色与标准比色卡比较
D Fe3+是否具有氧化性 向2 mL NH4Fe(SO4)2溶液中滴加几滴0.1 mol/L KI溶液,再滴加淀粉溶液,观察溶液颜色变化
1. (2024·徐州沛县)下列离子方程式书写正确的是( )
A. 将H2O2滴入酸性KMnO4溶液中:2MnO+10H++3H2O2===2Mn2++3O2↑+8H2O
B. 将少量氯气通入NaHSO3溶液中:HSO+H2O+Cl2===2Cl-+3H++SO
C. 向Na2S2O3溶液中加入足量稀硝酸:S2O+2H+===S↓+SO2↑+H2O
D. 过量CO2通入饱和碳酸钠溶液:2Na++CO+CO2+H2O===2NaHCO3↓
2. (2024·南通、淮安部分学校联考)实验室以含锌废液(主要成分为ZnSO4,还含有少量的Fe2+、Mn2+,溶液pH≈5)为原料制备ZnCO3的实验流程如图所示。
已知:S2O结构为,S2O具有强氧化性,易被还原为SO。下列说法正确的是( )
A. “除锰”反应中每消耗1 mol S2O,其中硫原子共得到2 mol电子
B. 试剂X可以选用Zn、ZnO、ZnCO3等物质
C. “沉锌”反应的离子方程式为Zn2++NH3·H2O+HCO===NH+ZnCO3↓+H2O
D. 滤液中一定大量存在的阳离子有Na+、NH和[Zn(NH3)4]2+
3. (2023·苏锡常镇一模)铁铵矾晶体[NH4Fe(SO4)2·12H2O]常用于制备高铁酸盐。下列指定反应的离子方程式书写正确的是( )
A. 铁铵矾溶液与氨水混合反应:Fe3++3OH-===Fe(OH)3↓
B. 向铁铵矾溶液中通入H2S气体:2Fe3++H2S===2Fe2++S↓+2H+
C. 在强碱溶液中,铁铵矾与次氯酸钠反应生成Na2FeO4:3ClO-+2Fe3++6OH-===2FeO+3Cl-+H2O+4H+
D. 向铁铵矾溶液中加入过量Ba(OH)2溶液:Fe3++2SO+2Ba2++3OH-===Fe(OH)3↓+2BaSO4↓
4. 写出下列反应的离子方程式。
(1) 过量CO2通入Na[Al(OH)4]溶液:_________________________________________________________ ___________________________。
(2) 硫酸铝溶液中加入过量NaOH溶液:______________________________________________________ ____________。
(3) Na2CO3溶液中滴加少量稀盐酸:_________________________________。
(4) Na[Al(OH)4]溶液中滴加少量盐酸:________________________________________________________ _________________________。
(5) 过量Fe与稀硝酸反应:_________________________________________________________________ ___________________。
(6) NH4HSO4溶液中加入少量NaOH溶液:____________________________________。
(7) FeBr2溶液中通入足量Cl2:_______________________________________________________________ ____________________________________。
(8) Ca(HCO3)2溶液与少量NaOH溶液反应:___________________________________________________ _____________________。
(9) NaHSO4溶液与Ba(OH)2溶液反应至溶液呈中性:___________________________________________ ___________________________________________。
5. (2023·句容中学)将NiSO4与NaHCO3溶液混合反应得到NiCO3·Ni(OH)2沉淀,过滤,洗涤。
(1) 写出沉淀反应的离子方程式:____________________________________________________________ ___________________________________________。
(2) 检验NiCO3·Ni(OH)2沉淀已经洗涤完全的方法是___________________________________________ ___________________________________________________________________________________________________________。
第3讲 离子反应
[备考导航]
(1) × (2) × (3) × (4) × (5) × (6) × (7) × (8) × (9) × (10) ×
考点1
[典题悟法]
典例1 BD 【解析】 HCO不能拆开,A错误;H2C2O4是弱酸,分步电离,C错误。
考点2
[典题悟法]
典例2 B 【解析】 Co(Ⅲ)有强氧化性,酸性条件下能将Cl-氧化成Cl2,Co2O3溶于浓盐酸反应生成氯气和Co2+:Co2O3+6H++2Cl-===2Co2++3H2O+Cl2↑ ,A错误;Ni(OH)2溶于氨水得到[Ni(NH3)6]2+,B正确;向FeCl3溶液中滴加少量NaHCO3溶液,Fe3+和HCO发生双水解反应生成Fe(OH)3沉淀和CO2:Fe3++3HCO===Fe(OH)3↓+3CO2↑,C错误;碱性溶液中不会大量存在H+,D错误。
典例3 (1) VO+2H2OH3VO4↓+OH-或VO+ NH+H2OH3VO4↓+ NH3↑ NH促进VO的水解,且制得的催化剂中不含Na+
(2)ZnO+4NH===[Zn(NH3)4]2++H2O+2H+
(3) Fe2++Li++OH-+H3PO4+2SO===LiFePO4↓+H2O+2HSO (4) 5Mg2++5CO(NH2)2+11H2O===Mg5(CO3)4(OH)2↓+CO2↑+10NH
(5) ①Co2O3+ SO+4H+===2Co2++ SO+2H2O
②先将含钴废料与Na2SO3溶液混合,然后再向其中逐滴加入硫酸溶液
[深度指津]
3. (1) HCO+OH-+Ca2+===H2O+CaCO3↓
(2) Ca2++2OH-+2HCO===CaCO3↓+2H2O+CO
考点3
[典题悟法]
典例4 D 【解析】 H+、I-、NO发生氧化还原反应而不能大量共存,A错误;Fe3+与CN-络合生成[Fe(CN)6]3-而不能大量共存,B错误;SiO、Ca2+生成CaSiO3沉淀而不能大量共存,C错误。
考点4
[知识梳理]
湿润的红色石蕊 蓝 NH+OH-NH3↑+H2O 黄 蓝色钴玻璃 (浅)紫 KSCN 氯水(或H2O2) 铁氰化钾 2Fe2++Cl2===2Fe3++2Cl-(或2Fe2++H2O2+2H+===2Fe3++2H2O) Fe3++3SCN-??Fe(SCN)3
Fe2++K++[Fe(CN)6]3-===KFe[Fe(CN)6]↓
亚铁氰化钾 Fe3++K++[Fe(CN)6]4-===KFe[Fe(CN)6]↓
稀硝酸 AgNO3 Ag++Cl-===AgCl↓
稀盐酸 BaCl2 SO+Ba2+=== BaSO4↓
[典题悟法]
典例5 D 【解析】 滴加少量NaOH溶液时,NaOH优先与Fe3+反应,不会产生NH3,A错误;无论溶液中是否含有Fe2+,滴加新制氯水后再滴加KSCN溶液,溶液都会变红,无法检验原溶液中是否含有Fe2+,B错误;NH、Fe3+均能发生水解反应,且水解均生成H+,故测定溶液pH无法检验NH是否发生水解,C错误;向溶液中滴加几滴0.1 mol/L KI溶液,再滴加淀粉溶液,若溶液变蓝色,说明有碘单质生成,则能证明Fe3+将I-氧化为I2,体现了Fe3+的氧化性,D正确。
[质量评价]
1. D 【解析】 该离子方程式电荷不守恒、得失电子不相等,A错误;NaHSO3过量,生成物中不会有H+,B错误;稀硝酸具有强氧化性,将S2O氧化成SO,C错误。
2. C 【解析】 S2O中有2个O原子显-1价,将Mn2+氧化为MnO2,S2O作氧化剂,其中氧原子得到2mol电子,A错误;Zn会与Fe3+发生反应,试剂X不可以选用Zn,B错误;锌元素转化为ZnCO3,滤液中不会大量存在[Zn(NH3)4]2+,D错误。
3. B 【解析】 NH3·H2O为弱碱,不拆分为离子,A错误;强碱溶液中,离子方程式中不可能出现H+,C错误;向铁铵矾[NH4Fe(SO4)2·12H2O]溶液中加入过量Ba(OH)2溶液,NH也要参与反应,D错误。
4. (1) [Al(OH)4]-+CO2===Al(OH)3↓+HCO (2) Al3++4OH-===[Al(OH)4]-
(3) CO+H+===HCO
(4) [Al(OH)4]-+H+===Al(OH)3↓+H2O
(5) 3Fe+2NO+8H+===3Fe2++2NO↑+4H2O
(6) H++OH-===H2O
(7) 2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
(8) Ca2++HCO+OH-===CaCO3↓+H2O
(9) Ba2++2OH-+2H++SO===BaSO4↓+2H2O
5. (1) 2Ni2++4HCO===NiCO3·Ni(OH)2↓+3CO2↑+H2O (2) 取最后一次洗涤所得滤液,向其中滴加盐酸酸化的BaCl2溶液(或硝酸钡溶液),若无明显现象则已洗涤干净
【解析】 (2) 检验NiCO3·Ni(OH)2沉淀已经洗涤完全即检验洗涤液中无SO。
备考导航
复习目标 1. 了解电解质及其分类,掌握强电解质、弱电解质的本质区别。
2. 理解电解质在水溶液中的电离以及电解质溶液的导电性。
3. 了解离子反应的概念,了解离子反应发生的条件,能正确书写离子方程式。
4. 掌握离子共存的条件,会判断溶液中离子能否大量共存。
5. 掌握常见离子的检验,能根据实验现象推断溶液中所含离子的种类。
熟记网络
课前自测 判断正误(正确的打“√”,错误的打“×”)。
(1) (2017·江苏卷)无色透明的溶液中:Fe3+、Mg2+、SCN-、Cl-能大量共存( )
(2) (2018·江苏卷)0.1 mol/L HCl 溶液中:Ba2+、K+、CH3COO-、NO能大量共存( )
(3) (2019·江苏卷)0.1 mol/L FeCl2溶液中:K+、Mg2+、SO、MnO能大量共存( )
(4) (2022·辽宁卷)H2S电离:H2S??2H+ + S2-( )
(5) (2023·海门调研)H2O2氧化酸性废水中的Fe2+:2Fe2++H2O2===2Fe3++2OH-( )
(6) (2024·徐州模拟)向某溶液X中滴加少量稀盐酸,再滴加几滴Ba(NO3)2溶液,出现白色沉淀,该溶液中含有SO( )
(7) (2024·徐州模拟)K+的检验:用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,观察火焰颜色变化( )
(8) (2023·常熟)检验溶液X中含有CO或HCO:向溶液X中加入稀硫酸,并将产生的无色气体通入澄清石灰水中,观察是否有沉淀生成( )
(9) (2023·海门调研)检验溶液中是否存在NH:向某溶液中加入氢氧化钠溶液并加热,观察产生的气体能否使蓝色石蕊试纸变色( )
(10) 取少量某溶液于试管中,加稀盐酸酸化,再加入FeCl2溶液,若溶液变黄色且试管上部产生红棕色气体,则该溶液中含有NO( )
考点1 电解质与电离方程式
知 识 梳 理
电解质与非电解质
电离方程式的书写
1. 强电解质:完全电离,用“===”连接。
如:H2SO4===2H++SO
2. 弱电解质:部分电离,用“??”表示。
如:NH3·H2O?? NH+OH-
3. 多元弱酸:分步电离,以第一步电离为主。
如:H2SO3??H++HSO、
HSO??H++SO
4. 多元弱碱:分步电离,但一步书写。
如:Cu(OH)2??Cu2++2OH-
5. 酸式盐的书写方法
(1) 弱酸的酸式盐在溶液中完全电离,生成酸式酸根离子和阳离子。
如:NaHC2O4===Na++HC2O、
HC2O??H++C2O
(2) 强酸的酸式盐在水溶液中完全电离。
如:NaHSO4===Na++H++SO
典 题 悟 法
(2024·江苏各地模拟重组)下列能正确表示电离方程式的是______(填字母)。
A. NaHCO3在水溶液中的电离:NaHCO3===Na++H++CO
B. 硼酸在水中的电离方程式:H3BO3+H2O??[B(OH)4]-+H+
C. 草酸的电离方程式:H2C2O4??C2O+2H+
D. 液氨电离可表示为2NH3??NH+NH
考点2 离子方程式的书写
知 识 梳 理
离子方程式中物质的“拆分”
1. 单质、气体、氧化物、弱电解质(弱酸、弱碱、水等)、络合物{如Fe(SCN)3、[Ag(NH3)2]+}、弱酸的酸式根离子、难溶盐不能拆分成离子。
2. 强酸(如HCl、H2SO4、HNO3、HBr、HI、HClO4等)、强碱[如KOH、NaOH、Ca(OH)2、Ba(OH)2等]、绝大多数可溶性的盐拆分成离子。
(1) 钾盐、钠盐、铵盐、硝酸盐、磷酸二氢盐等都易溶于水。
(2) 氯化物中,AgCl难溶于水。硫酸盐中,PbSO4、BaSO4难溶于水,CaSO4、Ag2SO4微溶于水。
(3) 碳酸盐、亚硫酸盐、磷酸盐和硅酸盐,除钾盐、钠盐、铵盐外都难溶于水,如BaCO3、BaSO3、Ca3(PO4)2等难溶于水。
(4) 硫化物中,除K2S、Na2S、(NH4)2S、BaS外均难溶于水。
(5) 银盐中,AgCl、AgBr、AgI、Ag2S、Ag3PO4、Ag2CO3等都难溶。
3. 微溶物[如Ca(OH)2、CaSO4、MgCO3、Ag2SO4]的处理
(1) 生成物中有微溶物时,微溶物不拆。
(2) 反应物中微溶物处于溶液状态(稀溶液),拆成离子,如澄清石灰水中的“Ca(OH)2”拆成“Ca2++2OH-”。
(3) 反应物中微溶物处于固态或悬浊液状态时,仍写化学式。如石灰乳中的“Ca(OH)2”不拆分。
离子方程式的正误判断
1. 检查离子反应是否符合反应原理。
2. 检查化学式拆分是否正确。
3. 多重反应,检查是否漏写离子反应。
4. 检查物质的量的关系是否正确(少量与过量)。
5. 检查离子方程式左右两边是否符合原子守恒、电荷守恒、得失电子守恒。
6. 检查各项物质的化学计量数是否为最简整数比。
7. 检查反应是否完全进行(“===”“??”),反应条件、气体和沉淀符号是否遗漏等。
典 题 悟 法
离子方程式的正误判断
(2024·淮安期末)铁、钴、镍是元素周期表中第4周期Ⅷ族元素,物理性质和化学性质比较相似。一般情况下,在化合物中常见的价态为+2和+3,Co(Ⅲ)和Ni(Ⅲ)有强氧化性,酸性条件下能将Cl-氧化成Cl2。向Ni(Ⅱ)盐的溶液中加入过量的氨水,可以生成稳定的蓝色配离子[Ni(NH3)6]2+。下列指定反应的离子方程式正确的是( )
A. Co2O3溶于浓盐酸:Co2O3+6H+===2Co3++3H2O
B. 将Ni(OH)2溶于氨水:Ni(OH)2+6NH3·H2O===[Ni(NH3)6]2++2OH-+6H2O
C. 向FeCl3溶液中滴加少量NaHCO3溶液:2Fe3++3CO===Fe2(CO3)3↓
D. NaClO在浓碱溶液中将Fe(OH)3氧化成FeO:2Fe(OH)3+3ClO-===2FeO+3Cl-+H2O+4H+
离子方程式的书写
(1) (2023·江苏卷)V2O5-WO3/TiO2催化剂能催化NH3脱除烟气中的NO。将预先制备的一定量的WO3/TiO2粉末置于80 ℃的水中,在搅拌下加入一定量的NH4VO3溶液,经蒸发、焙烧等工序得到颗粒状V2O5-WO3/TiO2催化剂。在水溶液中VO水解为H3VO4沉淀的离子方程式为________________________ ______________________________________________________________________________________;反应选用NH4VO3溶液而不选用NaVO3溶液的原因是_________________________________________________ ____________________。
(2) (2023·镇江期中)用氯化铵溶液浸取ZnO生成[Zn(NH3)4]2+,离子方程式为_______________________ ___________________________________________________________________。
(3) (2024·扬州中学)(NH4)2Fe(SO4)2溶液与H3PO4溶液、LiOH溶液反应得到LiFePO4沉淀和NH4HSO4 ,该反应的离子方程式为________________________________________________________________________ __________________________________________________[已知Ka(HSO)=1.0×10-2]。
(4) (2023·镇江)MgCl2溶液中加入尿素[CO(NH2)2]生成Mg5(CO3)4(OH)2沉淀,同时有CO2气体产生,该反应的离子方程式为________________________________________________________________________ _____________________________________________________________________。
(5) (2024·连云港中学)含钴废料(主要成分为Co2O3)用硫酸和Na2SO3溶液浸出后,溶液中含有的阳离子是Na+、H+、Co2+等。
①写出“浸取”时Co2O3所发生反应的离子方程式:____________________________________________ ______________________________________________。
②“浸取”时含钴废料、硫酸和Na2SO3溶液混合的方式为______________________________________ __________________________________________________________。
深度指津
“定1法”书写离子方程式
1. 将少量物质定为“1 mol”,若少量物质有两种或两种以上离子参加反应,则参加反应离子的物质的量之比与物质组成之比相符。
2. 依据少量物质中离子的物质的量,确定过量物质中实际参加反应的离子的物质的量。
3. 依据“先中和后沉淀”的思路书写离子方程式。
(1) 澄清石灰水中加入少量NaHCO3溶液:____________________________________________________ ____________________。
(2) NaHCO3溶液中加入少量澄清石灰水:_____________________________________________________ _____________________________________。
考点3 离子共存
知 识 梳 理
离子不能共存的类型
1. 发生复分解反应的离子不能大量共存
(1) 生成难电离物质或生成气体及挥发性物质的离子不能大量共存
离子 不能大量共存的离子
H+ CO/HCO、SO/HSO、CH3COO-、SiO、ClO-、F-、S2-/HS-、C2O/HC2O、NO、PO/HPO/H2PO等(生成弱酸)
OH-(生成H2O)
OH- NH(生成NH3·H2O)
HCO、HSO、HC2O、HS-、HPO、H2PO等(生成H2O)
(2) 生成沉淀或微溶物的离子不能大量共存
离子 不能大量共存的离子
Ba2+、Ca2+ SO、CO、SO、SiO、PO等
Ag+ Cl-、Br-、I-、SO、CO、PO、S2-等
H+ [Al(OH)4]-、SiO等
S2- Zn2+、Fe2+、Pb2+、Cu2+、Ag+等
CO Ba2+、Ca2+、Mg2+、Pb2+、Zn2+、Cu2+、Fe2+、Ag+等
OH- Mg2+、Cu2+、Fe2+、Fe3+、Al3+、Zn2+等
[Al(OH)4]- HCO、HSO等
2. 发生氧化还原反应的离子不能大量共存
(1) 常见的因氧化还原反应而不能大量共存的离子(“√”表示能反应,“×”表示不能反应,“—”表示不讨论)
离子 S2-
(HS-) SO
(HSO) I- Fe2+ Br- Cl-
MnO(H+) √ √ √ √ √ √
Cr2O(H+) √ √ √ √ √ √
ClO- √ √ √ √ √ √
(酸性)
NO(H+) √ √ √ √ — ×
Fe3+ √ √ √ × × ×
(2) H+与S2O不能大量共存:
2H++S2O===S↓+SO2↑+H2O
(3) S2-、SO在酸性条件下不能大量共存:
2S2-+SO+6H+===3S↓+3H2O
3. 发生相互促进的水解反应的离子不能大量共存
阳离子 阴离子
Al3+ CO、HCO、[Al(OH)4]-、S2-、HS-、SiO、ClO-等
Fe3+ CO、HCO、[Al(OH)4]-、SiO、ClO-等
NH [Al(OH)4]-、SiO等
4. 发生络合反应的离子(或分子)不能大量共存
(1) Fe3+与SCN-、苯酚等。
(2) Ag+、Cu2+、Zn2+等与NH3·H2O。
有关离子共存的限定条件
1. 颜色
无色溶液中,在溶液中显色的离子不能大量存在。如MnO(紫红色)、Cu2+(蓝色)、Fe3+(黄色)、Fe2+(浅绿色)(注意:“透明溶液”不是指溶液无色,“无色”不是白色)。
2. 溶液酸碱性
溶液 限定条件表述
酸性 溶液 ①使紫色石蕊变红
②使甲基橙变红
③常温下,pH=1
④常温下,>1的溶液
⑤常温下,<1×10-7 mol/L的溶液
⑥常温下,>1×10-7 mol/L的溶液
中性溶液 c(H+)=的溶液
碱性 溶液 ①使紫色石蕊变蓝
②使酚酞变红
③常温下,pH=13
④常温下,<1的溶液
⑤常温下,>1×10-7 mol/L的溶液
⑥常温下,<1×10-7 mol/L的溶液
酸性或 碱性溶液 ①常温下由水电离出的c(H+)<1×10-7 mol/L 的溶液
②与Al反应能放出H2的溶液(若是酸性溶液中应不含有NO)
典 题 悟 法
(2024·浙江1月卷)在溶液中能大量共存的离子组是( )
A. H+、I-、Ba2+、NO
B. Fe3+、K+、CN-、Cl-
C. Na+、SiO、Br-、Ca2+
D. NH、SO、CH3COO-、HCO
考点4 常见离子的检验
知 识 梳 理
常见离子的检验
离子 检验方法 离子方程式
NH 该盐溶液与NaOH溶液共热发生反应,生成能使_____________________试纸变___的有刺激性气味的气体 _______________________________________
Na+ 做焰色试验,其火焰为___色 —
K+ 做焰色试验,透过_______________观察,火焰呈____________色 —
Fe2+ 方法一:先向溶液中加入____________溶液,不显红色,再加入少量新制的___________________________后,立即显红色
方法二:向溶液中加入____________溶液,生成特征蓝色沉淀 方法一:__________________________________________________________________
(或2Fe2++H2O2+2H+===2Fe3++2H2O)
____________________________________________________________;
方法二:
______________________________________________________________________________________________________
Fe3+ 方法一:向溶液中加入KSCN溶液,溶液变红;
方法二:向溶液中加入_______________溶液,生成蓝色沉淀 方法二:
______________________________________________________________________________________________________
Cl- 向溶液中先加入_________酸化,再滴加_______________溶液,有白色沉淀(AgCl)产生(若有SO存在,则要先加入过量的硝酸钡,取清液再检验Cl-) __________________________________________
SO 向溶液中先加入_________酸化,再滴加_______________溶液,有白色沉淀(BaSO4)产生(加稀盐酸排除CO、SO、Ag+的干扰;不能用稀硝酸酸化,防止SO被氧化造成干扰) ________________________________________________
解疑释惑4
离子检验中常见干扰离子的排除
待检离子 干扰离子 排除措施
Cl- SO 加入过量的Ba(NO3)2溶液
CO 加入稀硝酸酸化
OH-
SO CO 加入稀盐酸酸化
SO
Ag+
典 题 悟 法
(2024·南京二模)室温下, 探究0.1 mol/L NH4Fe(SO4)2溶液的性质。下列实验方案能达到探究目的的是( )
选项 探究目的 实验方案
A 验证溶液中含有NH 向2 mL NH4Fe(SO4)2溶液中滴加几滴0.1 mol/L NaOH溶液,将湿润的红色石蕊试纸靠近试管口,加热,观察试纸颜色变化
B 溶液中是否含有Fe2+ 向2 mL NH4Fe(SO4)2溶液中滴加几滴新制氯水,再滴加KSCN溶液,观察溶液的颜色变化
C NH是否发生水解 用玻璃棒蘸取NH4Fe(SO4)2溶液滴在干燥的广泛pH试纸上,将试纸显色的颜色与标准比色卡比较
D Fe3+是否具有氧化性 向2 mL NH4Fe(SO4)2溶液中滴加几滴0.1 mol/L KI溶液,再滴加淀粉溶液,观察溶液颜色变化
1. (2024·徐州沛县)下列离子方程式书写正确的是( )
A. 将H2O2滴入酸性KMnO4溶液中:2MnO+10H++3H2O2===2Mn2++3O2↑+8H2O
B. 将少量氯气通入NaHSO3溶液中:HSO+H2O+Cl2===2Cl-+3H++SO
C. 向Na2S2O3溶液中加入足量稀硝酸:S2O+2H+===S↓+SO2↑+H2O
D. 过量CO2通入饱和碳酸钠溶液:2Na++CO+CO2+H2O===2NaHCO3↓
2. (2024·南通、淮安部分学校联考)实验室以含锌废液(主要成分为ZnSO4,还含有少量的Fe2+、Mn2+,溶液pH≈5)为原料制备ZnCO3的实验流程如图所示。
已知:S2O结构为,S2O具有强氧化性,易被还原为SO。下列说法正确的是( )
A. “除锰”反应中每消耗1 mol S2O,其中硫原子共得到2 mol电子
B. 试剂X可以选用Zn、ZnO、ZnCO3等物质
C. “沉锌”反应的离子方程式为Zn2++NH3·H2O+HCO===NH+ZnCO3↓+H2O
D. 滤液中一定大量存在的阳离子有Na+、NH和[Zn(NH3)4]2+
3. (2023·苏锡常镇一模)铁铵矾晶体[NH4Fe(SO4)2·12H2O]常用于制备高铁酸盐。下列指定反应的离子方程式书写正确的是( )
A. 铁铵矾溶液与氨水混合反应:Fe3++3OH-===Fe(OH)3↓
B. 向铁铵矾溶液中通入H2S气体:2Fe3++H2S===2Fe2++S↓+2H+
C. 在强碱溶液中,铁铵矾与次氯酸钠反应生成Na2FeO4:3ClO-+2Fe3++6OH-===2FeO+3Cl-+H2O+4H+
D. 向铁铵矾溶液中加入过量Ba(OH)2溶液:Fe3++2SO+2Ba2++3OH-===Fe(OH)3↓+2BaSO4↓
4. 写出下列反应的离子方程式。
(1) 过量CO2通入Na[Al(OH)4]溶液:_________________________________________________________ ___________________________。
(2) 硫酸铝溶液中加入过量NaOH溶液:______________________________________________________ ____________。
(3) Na2CO3溶液中滴加少量稀盐酸:_________________________________。
(4) Na[Al(OH)4]溶液中滴加少量盐酸:________________________________________________________ _________________________。
(5) 过量Fe与稀硝酸反应:_________________________________________________________________ ___________________。
(6) NH4HSO4溶液中加入少量NaOH溶液:____________________________________。
(7) FeBr2溶液中通入足量Cl2:_______________________________________________________________ ____________________________________。
(8) Ca(HCO3)2溶液与少量NaOH溶液反应:___________________________________________________ _____________________。
(9) NaHSO4溶液与Ba(OH)2溶液反应至溶液呈中性:___________________________________________ ___________________________________________。
5. (2023·句容中学)将NiSO4与NaHCO3溶液混合反应得到NiCO3·Ni(OH)2沉淀,过滤,洗涤。
(1) 写出沉淀反应的离子方程式:____________________________________________________________ ___________________________________________。
(2) 检验NiCO3·Ni(OH)2沉淀已经洗涤完全的方法是___________________________________________ ___________________________________________________________________________________________________________。
第3讲 离子反应
[备考导航]
(1) × (2) × (3) × (4) × (5) × (6) × (7) × (8) × (9) × (10) ×
考点1
[典题悟法]
典例1 BD 【解析】 HCO不能拆开,A错误;H2C2O4是弱酸,分步电离,C错误。
考点2
[典题悟法]
典例2 B 【解析】 Co(Ⅲ)有强氧化性,酸性条件下能将Cl-氧化成Cl2,Co2O3溶于浓盐酸反应生成氯气和Co2+:Co2O3+6H++2Cl-===2Co2++3H2O+Cl2↑ ,A错误;Ni(OH)2溶于氨水得到[Ni(NH3)6]2+,B正确;向FeCl3溶液中滴加少量NaHCO3溶液,Fe3+和HCO发生双水解反应生成Fe(OH)3沉淀和CO2:Fe3++3HCO===Fe(OH)3↓+3CO2↑,C错误;碱性溶液中不会大量存在H+,D错误。
典例3 (1) VO+2H2OH3VO4↓+OH-或VO+ NH+H2OH3VO4↓+ NH3↑ NH促进VO的水解,且制得的催化剂中不含Na+
(2)ZnO+4NH===[Zn(NH3)4]2++H2O+2H+
(3) Fe2++Li++OH-+H3PO4+2SO===LiFePO4↓+H2O+2HSO (4) 5Mg2++5CO(NH2)2+11H2O===Mg5(CO3)4(OH)2↓+CO2↑+10NH
(5) ①Co2O3+ SO+4H+===2Co2++ SO+2H2O
②先将含钴废料与Na2SO3溶液混合,然后再向其中逐滴加入硫酸溶液
[深度指津]
3. (1) HCO+OH-+Ca2+===H2O+CaCO3↓
(2) Ca2++2OH-+2HCO===CaCO3↓+2H2O+CO
考点3
[典题悟法]
典例4 D 【解析】 H+、I-、NO发生氧化还原反应而不能大量共存,A错误;Fe3+与CN-络合生成[Fe(CN)6]3-而不能大量共存,B错误;SiO、Ca2+生成CaSiO3沉淀而不能大量共存,C错误。
考点4
[知识梳理]
湿润的红色石蕊 蓝 NH+OH-NH3↑+H2O 黄 蓝色钴玻璃 (浅)紫 KSCN 氯水(或H2O2) 铁氰化钾 2Fe2++Cl2===2Fe3++2Cl-(或2Fe2++H2O2+2H+===2Fe3++2H2O) Fe3++3SCN-??Fe(SCN)3
Fe2++K++[Fe(CN)6]3-===KFe[Fe(CN)6]↓
亚铁氰化钾 Fe3++K++[Fe(CN)6]4-===KFe[Fe(CN)6]↓
稀硝酸 AgNO3 Ag++Cl-===AgCl↓
稀盐酸 BaCl2 SO+Ba2+=== BaSO4↓
[典题悟法]
典例5 D 【解析】 滴加少量NaOH溶液时,NaOH优先与Fe3+反应,不会产生NH3,A错误;无论溶液中是否含有Fe2+,滴加新制氯水后再滴加KSCN溶液,溶液都会变红,无法检验原溶液中是否含有Fe2+,B错误;NH、Fe3+均能发生水解反应,且水解均生成H+,故测定溶液pH无法检验NH是否发生水解,C错误;向溶液中滴加几滴0.1 mol/L KI溶液,再滴加淀粉溶液,若溶液变蓝色,说明有碘单质生成,则能证明Fe3+将I-氧化为I2,体现了Fe3+的氧化性,D正确。
[质量评价]
1. D 【解析】 该离子方程式电荷不守恒、得失电子不相等,A错误;NaHSO3过量,生成物中不会有H+,B错误;稀硝酸具有强氧化性,将S2O氧化成SO,C错误。
2. C 【解析】 S2O中有2个O原子显-1价,将Mn2+氧化为MnO2,S2O作氧化剂,其中氧原子得到2mol电子,A错误;Zn会与Fe3+发生反应,试剂X不可以选用Zn,B错误;锌元素转化为ZnCO3,滤液中不会大量存在[Zn(NH3)4]2+,D错误。
3. B 【解析】 NH3·H2O为弱碱,不拆分为离子,A错误;强碱溶液中,离子方程式中不可能出现H+,C错误;向铁铵矾[NH4Fe(SO4)2·12H2O]溶液中加入过量Ba(OH)2溶液,NH也要参与反应,D错误。
4. (1) [Al(OH)4]-+CO2===Al(OH)3↓+HCO (2) Al3++4OH-===[Al(OH)4]-
(3) CO+H+===HCO
(4) [Al(OH)4]-+H+===Al(OH)3↓+H2O
(5) 3Fe+2NO+8H+===3Fe2++2NO↑+4H2O
(6) H++OH-===H2O
(7) 2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
(8) Ca2++HCO+OH-===CaCO3↓+H2O
(9) Ba2++2OH-+2H++SO===BaSO4↓+2H2O
5. (1) 2Ni2++4HCO===NiCO3·Ni(OH)2↓+3CO2↑+H2O (2) 取最后一次洗涤所得滤液,向其中滴加盐酸酸化的BaCl2溶液(或硝酸钡溶液),若无明显现象则已洗涤干净
【解析】 (2) 检验NiCO3·Ni(OH)2沉淀已经洗涤完全即检验洗涤液中无SO。
同课章节目录
