大单元一 化学基础知识 第5讲 化学键与分子的性质 学案 (含答案)2026届高三一轮大单元复习
文档属性
| 名称 | 大单元一 化学基础知识 第5讲 化学键与分子的性质 学案 (含答案)2026届高三一轮大单元复习 |  | |
| 格式 | DOC | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-14 11:17:59 | ||
图片预览




文档简介
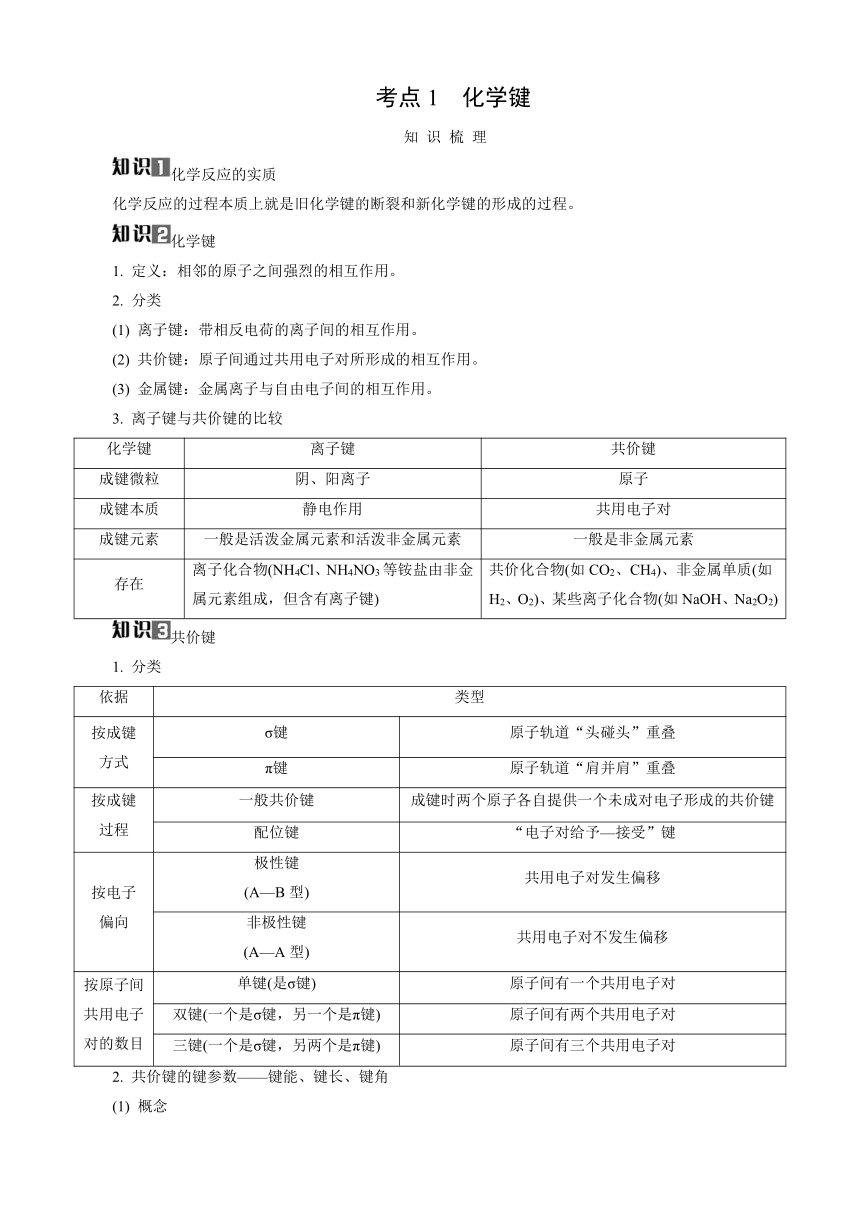
第5讲 化学键与分子的性质
备考导航
复习目标 1. 认识化学键的含义,了解离子键和共价键的形成,了解常见离子化合物和共价化合物的形成过程,能识别典型的离子化合物和共价化合物。
2. 能从化学键变化的角度认识化学反应的实质。
3. 了解共价键的主要类型,能用键能、键长、键角等数据说明简单分子的某些性质。
4. 能根据分子结构特点和键的极性来判断分子的极性。
5. 能利用杂化轨道理论和价层电子对互斥模型判断简单分子或离子的空间结构。
6. 能说明分子间作用力(含氢键)对物质熔、沸点等性质的影响。
7. 掌握常见的化学用语。
熟记网络
课前自测 判断正误(正确的打“√”,错误的打“×”)。
(1) (2023·江苏卷)H2O2分子中的化学键均为极性共价键( )
(2) (2024·南通二模)1 mol [Co(NO2)6]3- 中含有12 mol σ键( )
(3) (2023·江苏卷)CaH2晶体中存在Ca与H2之间的强烈相互作用( )
(4) (2023·连云港一调)HClO的电子式为 ( )
(5) (2024·南京二模)CO的空间结构为三角锥形( )
(6) (2024·南通三模)SO2的中心原子杂化轨道类型为sp3( )
(7) (2024·南京、盐城期末)分子中键角大小:SO2>SO3( )
(8) (2022·江苏卷)SiH4、SiCl4都是由极性键构成的非极性分子( )
(9) (2023·江苏卷)H2O分子之间形成氢键,故H2O(g)的热稳定性比H2S(g)的高( )
(10) (2023·高邮期初)在水中的溶解度比小( )
(11) (2024·盐城模拟)与HBr反应可产生一种无手性的副产物( )
考点1 化学键
知 识 梳 理
化学反应的实质
化学反应的过程本质上就是旧化学键的断裂和新化学键的形成的过程。
化学键
1. 定义:相邻的原子之间强烈的相互作用。
2. 分类
(1) 离子键:带相反电荷的离子间的相互作用。
(2) 共价键:原子间通过共用电子对所形成的相互作用。
(3) 金属键:金属离子与自由电子间的相互作用。
3. 离子键与共价键的比较
化学键 离子键 共价键
成键微粒 阴、阳离子 原子
成键本质 静电作用 共用电子对
成键元素 一般是活泼金属元素和活泼非金属元素 一般是非金属元素
存在 离子化合物(NH4Cl、NH4NO3等铵盐由非金属元素组成,但含有离子键) 共价化合物(如CO2、CH4)、非金属单质(如H2、O2)、某些离子化合物(如NaOH、Na2O2)
共价键
1. 分类
依据 类型
按成键 方式 σ键 原子轨道“头碰头”重叠
π键 原子轨道“肩并肩”重叠
按成键 过程 一般共价键 成键时两个原子各自提供一个未成对电子形成的共价键
配位键 “电子对给予—接受”键
按电子 偏向 极性键
(A—B型) 共用电子对发生偏移
非极性键
(A—A型) 共用电子对不发生偏移
按原子间 共用电子
对的数目 单键(是σ键) 原子间有一个共用电子对
双键(一个是σ键,另一个是π键) 原子间有两个共用电子对
三键(一个是σ键,另两个是π键) 原子间有三个共用电子对
2. 共价键的键参数——键能、键长、键角
(1) 概念
键能:在标准状况下,气态分子中1 mol化学键解离成气态原子所吸收的能量,单位为kJ/mol。
键长:构成共价键的两个原子的核间距。
键角:两个共价键之间的夹角。
(2) 键参数与分子稳定性的关系
一般来说,键能越大,分子越稳定;键长越短,分子越稳定。
(3) 键参数对分子性质的影响
离子化合物和共价化合物
1. 定义
(1) 离子化合物:由离子键构成的化合物。
(2) 共价化合物:以共用电子对形成的化合物。如HCl分子、SiO2晶体。
2. 判断方法
(1) 根据化学键类型:含离子键的化合物,一定是离子化合物;只含共价键的化合物,一定是共价化合物。
(2) 根据化合物类型:大多数金属氧化物、强碱、大多数盐是离子化合物;一般非金属氢化物、非金属氧化物、有机物(有机盐除外)为共价化合物。
(3) 根据化合物性质:熔融状态能导电的为离子化合物;熔融状态不能导电的为共价化合物。
电子式
1. 定义:在元素符号周围用“·”或“×”来表示原子的最外层电子的式子。
2. 写出下列物质的电子式:
NaCl____________;NaH____________;
NaOH____________;
MgCl2____________;
NH4Cl____________;
Na2O____________;
Na2O2____________;
CaC2____________;
HCl____________;CO2____________;
NH3____________;H2O____________;
N2H4____________;HClO____________;
H2O2____________;N2_____________;
CCl4_______________。
结构式
1. 定义:用一根短线“—”表示一个共用电子对的式子。
2. 写出下列物质的结构式:
N2____________________;H2O_____________;
NH3____________;CO2______________________________;
CS2______________________________;HClO____________;
HCN_______________;N2H4____________;
(CN)2__________________;
(SCN)2______________________________。
化学用语
1. 两种模型
(1) 空间填充模型,如甲烷:。
(2) 球棍模型,如甲烷:。
2. 三种符号
(1) 元素符号:O、Na等。
(2) 离子符号:Al3+、SO等。
(3) 核素符号:H、U等。
3. 七种表达式
(1) 化学方程式:
如HCl+NaOH===NaCl+H2O。
(2) 离子方程式:如H++OH-===H2O。
(3) 热化学方程式:如H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol。
(4) 电离方程式:如BaSO4===Ba2++SO。
(5) 水解方程式:
如S2-+H2O??HS-+OH-。
(6) 电极反应式:
如O2+2H2O+4e-===4OH-。
(7) 沉淀溶解平衡式:
如BaSO4(s)?? Ba2+(aq)+SO(aq)。
[注意事项]
①区分电离方程式和水解方程式。
如HS-电离方程式:
HS-+H2O??H3O++S2-,
HS-水解方程式:
HS-+H2O??H2S+OH-。
②区分难溶物的电离方程式与沉淀溶解平衡式[如3.(4)和(7)]。
4. 十种图式
(1) 化学式:KAl(SO4)2·12H2O、SiO2等。
(2) 分子式:NH3、C6H12O6等。
(3) 最简式(实验式):CH2、CH2O等。
(4) 电子式:等。
(5) 结构式:、 等。
(6) 结构简式:CH2===CH2、CH3COOH等。
(7) 键线式:、等。
(8) 微粒结构示意图:
Cl 、Na+ 等。
(9) 电子排布式:如29Cu的基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1。
(10) 电子排布图(轨道表示式):
如基态N原子核外电子排布图为
;
基态Fe原子的价层电子排布图为
。
[注意事项]
a. 分子晶体的化学式可表示分子式,如C6H6、H2O2等。离子晶体和共价晶体的化学式不表示分子式,只表示原子最简整数比。
b. 书写结构简式一定要突出官能团,如乙烯的结构简式不能写成CH2CH2,应写成CH2===CH2。
c. 书写官能团时不能忽视“—”,如将羧基(—COOH)错写成COOH。官能团的书写方向变化时,原子的书写顺序要随之变化,如醛基可写成—CHO或OHC—,但不能写成HOC—;硝基可写成—NO2或O2N—,但不能写成NO2—。
解疑释惑6
σ键和π键的识别
1. σ键和π键的识别
(1) 键线式呈现的结构,不能忽略省去的碳氢键。
(2) 含有苯环的结构,不能忽略苯环中的碳氢键。
1 mol苯分子中含有σ键的物质的量为12 mol。乙炔分子中σ键和π键的数目之比是3∶2。HCOONa中σ键和π键的数目之比是3∶1。
2. 配合物中的σ键和π键(一般,配位键是σ键)
(1) 由内界与外界组成的配合物:内界和外界之间一般存在离子键,如[Cu(NH3)4]SO4中,[Cu(NH3)4]2+与SO之间是离子键,内界与外界中均含有σ键。1 mol [Cu(NH3)4]SO4中含有σ键的物质的量为20 mol。
(2) 无外界的配合物,直接计算内界中的σ键数目。1 mol [Fe(CO)5]中含有σ键的物质的量为10 mol,π键的物质的量为10 mol。
典 题 悟 法
化学用语
(2023·如皋中学)反应SiO2+4HF ===SiF4↑+2H2O应用于玻璃雕刻。下列说法正确的是( )
A. SiO2属于共价化合物
B. HF的电子式为
C. SiF4是由极性键形成的极性分子
D. H2O中基态氧原子价层电子轨道表达式为
σ键和 π 键的计算
(2024·江苏各地模拟重组)下列说法正确的是( )
A. 1 mol [Fe(NO)(H2O)5]2+中含有6 mol σ键
B. 二甲双胍()分子中碳原子与氮原子间σ键与π键的数目之比为4∶1
C. 1 mol 中含3 mol碳氧π键
D. 1 mol 中含有5 mol碳氧σ键
(1) (2024·南通三模) 中σ键与π键数目之比为_________。
(2) (2023·高邮期初)S8是由8个硫原子形成的环状结构,每个硫原子以sp3杂化轨道中的两个轨道与相邻的两个硫原子形成σ键。1 mol S8中含有的σ键为___mol。
(3) (2023·镇江期中)1 mol [Cu(NH3)4]Cl2中σ键的数目为_________________________________。
(4) (2023·海门调研)硫脲(结构为)是一种常见的还原剂,易被氧化为(SCN2H3)2。1 mol (SCN2H3)2中含有σ键的数目为______________________________________________________。
结构式的书写
(1) (2023·江苏卷)已知H4V4O12具有八元环结构,其结构式可表示为____________。
(2) (2024·南通一模)在α-FeOOH的结构中,每个Fe(Ⅲ)与羟基氧和非羟基氧构成了FeO3(OH)3八面体,相同环境的氧原子之间构成正三角形。请在图中补充完整该八面体的结构。
(3) (2024·宿迁二模)两分子CO(NH2)2通过羰基氧原子形成分子间氢键,得到具有八元环的二聚分子。二聚分子的结构式为_________________。
(4) (2023·苏州期中)某配离子[Ge(OH)2(C2O4)2]2-中含有两个五元环,Ge为六配位,配位原子均为氧,画出该离子的结构式:____________。
(5) (2024·扬州模拟)FeC2O4·2H2O晶体为片层结构,层内每个Fe2+与2个C2O和2个H2O相连,形成1个铁氧八面体。在图中补全该结构。
FeC2O4·2H2O晶体层与层之间的作用力为________________________________________________。
考点2 常见分子(或离子)的空间结构及中心原子的杂化类型
知 识 梳 理
价层电子对互斥(VSEPR)模型
1. 理论要点
(1) 价层电子对在空间上彼此相距最远时,排斥力最小,体系的能量最低。
(2) 孤电子对的排斥力较大,孤电子对越多,排斥力越强,键角越小。
2. 用价层电子对互斥模型推测分子的空间结构
3. 常见分子(或离子)的价层电子互斥模型和空间结构
价层电子 对数 σ键电
子对数 孤电子
对数 电子对的
排列方式 VSEPR
模型名称 分子或离子的空间结构名称 实例
2 2 0
______形 ______形 CO2、CS2、BeCl2
3 3 0
________形 _________形 BF3 、SO3、NO、CO
2 1
_________形 _______形 SO2、O3、NO
4 4 0
_________形 _________形 CH4 、CCl4、NH
3 1
_________形 _________形 NH3
2 2
_________形 ________形 H2O
注意:VSEPR模型与分子或离子的空间结构不一定一致
杂化轨道理论
1. 杂化轨道与分子空间结构的关系
杂化类型 杂化轨道数目 杂化轨道间夹角 空间结构 实例
sp 2 180° 直线形 BeCl2
sp2 3 120° 平面三角形 BF3
sp3 4 109°28′ 正四面体形 CH4
2. 分子(或离子)的空间结构分析示例
示例 中心原子杂化方式 分子(或离子)空间结构名称
CH4、NH、PO、SO、AlH _________ ____________形
SiHCl3、CH3Br
_________形
NH3、H3O+、PCl3、PO、ClO
_________形
H2O、NH
___形
HCHO、SO3、NO、CO _________ ____________形
SO2、O3、NO
___形
C2H2、BeCl2、CO2、HCN ______ ______形
解疑释惑7
影响键角大小的因素
1. 杂化类型不同
键角:sp3杂化(1) CH4、BF3、CO2,中心原子分别为sp3、sp2和sp杂化,它们对应的键角分别为109°28′、120°、180°。
(2) ClO2和Cl2O均为V形结构,但ClO2中存在大π键(Π),ClO2中Cl原子采取sp2杂化,Cl2O中O原子采取sp3杂化,键角:O—Cl—O>Cl—O—Cl。
2. 杂化类型相同
(1) 孤电子对数越多,键角越小,如键角:H2O(2) 孤电子对数相同,中心原子不同,中心原子电负性越大,键角越大,如键角:H2O>H2S。
(3) 孤电子对数相同,中心原子相同,配位原子电负性越大,键角越小,如键角:NF3典 题 悟 法
中心原子杂化类型与微粒空间结构
判断正误(正确的打“√”,错误的打“×”)。
(1) (2023·江苏卷)NH和H2O的中心原子轨道杂化类型均为sp2( )
(2) (2024·扬州中学)H3O+和SOCl2的中心原子轨道杂化类型均为sp3( )
(3) (2023·海安中学)[Be(OH)4]2-中Be原子轨道杂化类型为sp3( )
(4) (2024·盐城模拟)中有2个碳原子采取sp3杂化( )
(5) (2023·南京二模)CH3H2中碳负离子的轨道杂化类型为sp3( )
(6) (2023·如皋一中)分子中C原子轨道杂化类型有2种( )
(7) (2023·常州期中)NH3分子的VSEPR模型为( )
(8) (2023·扬州中学)NO和NH的空间结构模型相同,NO和NH3的空间结构模型相同( )
(9) (2024·泰州一模)已知XeF2分子是非极性分子,可推测XeF2的空间结构为Ⅴ形( )
(10) (2024·扬州中学)FNO的空间结构为直线形( )
(11) (2024·镇江期初)COCl2分子中4个原子不共面( )
(12) (2024·海安中学)[Be(OH)4]2-的空间结构为平面正方形( )
(1) (2023·扬州中学)化合物分子中碳原子轨道杂化类型为_____________________,氮原子轨道杂化类型为_____________________。
(2) (2024·苏锡常镇一模)中采取sp、sp2杂化的碳原子数目之比为__________。
(3) (2023·如皋期初)化合物中,碳原子有_______种不同的轨道杂化方式。
(4) 吡啶()中N原子轨道杂化类型为_________。
(5) (2023·南菁、梁丰中学期初)1 mol 中sp3杂化的原子数目为_______mol。
(6) SiCl4是生产高纯硅的前驱体,其中Si原子轨道杂化类型为_________。SiCl4可发生水解反应,机理如下:
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si原子轨道杂化类型为___(填序号)。
键角大小比较
(2024·江苏各地模拟重组)下列说法正确的是( )
A. 键角:Cl2O>OF2
B. ClO、ClO和ClO中O—Cl—O键角依次逐渐减小
C. NH3、PH3、AsH3的键角逐渐增大
D. [Ni(NH3)6]SO4、NH3中的H—N—H键角:前者小于后者
深度指津
中心原子杂化类型的判断
1. 根据中心原子价层电子对数判断
中心原子的价层电子对数依次为4、3、2,杂化类型依次为sp3、 sp2、sp。
2. 根据“杂化轨道数=σ键数+孤电子对数”进行判断
(1) C:2个σ键——sp,3个σ键——sp2,4个σ键——sp3。
如CH3CH3中的碳原子采取sp3杂化;乙烯和甲醛中的碳原子采取sp2杂化;苯环中的碳原子采取sp2杂化;乙炔分子中碳原子采取sp杂化。
(2) N:2个σ键——sp2,3个σ键——sp3。
如H—N===N—H中N形成2个σ键,还有1个孤电子对,N原子的杂化类型为sp2。
(3) O(S):2个σ键——sp3。如H2O2的分子结构式为H—O—O—H,O形成2个σ键,还有2个孤电子对,O原子的杂化类型为sp3。
考点3 共价键的极性
知 识 梳 理
键的极性与分子的极性
分子类型 典型分子 键的极性 空间结构 分子极性
三原子分子 H2O、H2S、SO2 极性键 ___形 ______分子
CS2、CO2 极性键 ______形 _________分子
四原子分子 NH3 极性键 _________形 ______分子
BF3、SO3 极性键 ____________形 _________分子
P4 非极性键 ____________形 _________分子
五原子分子 CH3Cl 极性键 _________形 ______分子
CH4、CCl4 极性键 ____________形 _________分子
非极性分子与极性分子的判断
键的极性对化学性质的影响
比较酸性(填“>”或“<”):
(1) CF3COOH___CCl3COOH___CHCl2COOH___CH2ClCOOH。
(2) HCOOH___CH3COOH___CH3CH2COOH。
典 题 悟 法
键的极性与分子的极性
(2024·江苏各地模拟重组)下列说法正确的是( )
A. O3是由极性键构成的极性分子
B. 共价键的极性:Si—Cl>Al—Cl
C. IF3是由极性键构成的非极性分子
D. N2O5的结构如图,N2O5是非极性分子
键的极性对化学性质的影响
(1) (2023·江苏卷)化合物的酸性比环己醇的___(填“强”“弱”或“无差别”)。
(2) (2024·南外、金陵、海安中学联考)圈出下图中酸性最强的氢原子。
(3) (2024·苏州模拟)—SO3H(其结构表示为)中羟基的氢氧键断裂,且极性越强,氢氧键越易断裂。下列物质的酸性由强到弱的顺序是_________(填序号)。
(4) (2023·如皋期初)吡啶()和其衍生物(、)的碱性随N原子电子云密度的增大而增强,其中碱性最强的是___。
深度指津
分子极性的判断
1. 判断分子极性的方法
(1) ABm型分子中,若中心原子化合价的绝对值等于该元素的价电子数(最高正价),则该分子为非极性分子。如PCl3、PCl5分别为极性分子和非极性分子。
(2) 根据中心原子是否有孤电子对。对于ABm型分子,A为中心原子,若A上有孤电子对,则分子为极性分子,如H2O、NH3中O、N原子上分别有2个、1个孤电子对;若A上无孤电子对,则分子为非极性分子,如CH4、CO2、BF3中C、C、B原子上均无孤电子对。
2. 共价键极性和分子极性的关系
考点4 分子间作用力
知 识 梳 理
范德华力及其对物质性质的影响
1. 相对分子质量越大,范德华力越大
组成和结构相似的物质,随着相对分子质量的增加,物质的熔、沸点升高。如熔、沸点:F2[注意]烷烃同分异构体中,支链越多,熔、沸点越低。如熔、沸点:正丁烷>异丁烷。
2. 分子的极性越大,范德华力也越大
如CO是极性分子,N2是非极性分子,CO分子间的作用力大于N2,因此熔、沸点:CO>N2。
氢键及其对物质性质的影响
1. 氢键的定义
已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间的作用力叫作氢键。
2. 氢键形成条件
氢原子两边的A原子和B原子所属元素通常具有很强的电负性和很小的原子半径。A、B的电负性越强、半径越小,形成的氢键就越强。
3. 氢键表示方法及分类
(1) 表示方法:X—H…Y(X、Y 为N、O、F原子,可以相同,也可不同)。
(2) 分类:分子内氢键、分子间氢键。如下表:
分子间氢键
HF分子间的氢键
冰醋酸以分子间氢键缔合成的二聚体结构
分子内氢键
HNO3分子内形成了氢键
邻羟基苯甲醛分子内形成了氢键
4. 氢键对物质物理性质的影响
(1) 同主族氢化物分子间氢键使NH3、H2O、HF的沸点反常的高,如图所示。
(2) 使物质易溶于水。
如NH3、C2H5OH、CH3COOH、H2O2等易溶于水(这些分子与水分子之间形成了氢键)。
(3) 解释一些特殊现象。
①接近水的沸点时水蒸气的相对分子质量测定值比按化学式H2O计算出来的相对分子质量大一些(解释:接近水的沸点的蒸气中存在一定量的水分子因氢键而相互缔合,形成所谓的缔合分子)。
②HF分子的相对分子质量测定结果比理论值偏大(解释:HF分子间通过氢键形成缔合分子,使测定结果偏大)。
①氢键不是化学键,是一种较弱的作用力。
②形成分子内氢键,形成分子间氢键,因此,的沸点低于的沸点。
③沸点:C2H5—OH>H3C—O—CH3(解释:C2H5—OH形成了分子间氢键)。
溶解性
1. “相似相溶”规律:一般非极性溶质能溶于非极性溶剂,极性溶质能溶于极性溶剂。如乙醇(极性溶剂)易溶解乙酸、乙酸乙酯(极性溶质),苯、四氯化碳等(非极性溶剂)易溶解Br2、I2等(非极性溶质)。
2. 若存在氢键,则溶质和溶剂之间的氢键作用力越大,溶解性越好。如NH3极易溶于水。
3. “相似相溶”还适用于分子结构的相似性。如乙醇能与水互溶,而戊醇中烃基较大,戊醇在水中的溶解度明显减小。
深度指津
影响分子溶解性的因素
1. 首先考虑有无氢键,如氨气极易溶于水,主要是氨气分子与水分子之间形成了氢键。
2. 若无氢键,则考虑“相似相溶”规律,如HCl极易溶于水,HCl分子与水分子之间不存在氢键,所以考虑HCl分子与水分子均为极性分子,根据“相似相溶”,HCl易溶于水。
3. 最后考虑分子是否与水反应,如Cl2既不是极性分子,也不能与水分子形成氢键,但氯气能溶于水,原因是氯气能与水发生反应。
典 题 悟 法
(2024·江苏各地模拟重组)下列说法错误的是( )
A. 二甲双胍()易溶于水
B. ⅥA族元素氢化物的沸点从上到下依次增大
C. 向I2的CCl4溶液中加入等体积KI溶液,振荡后静置,观察两层溶液颜色变化,比较I2在KI浓溶液与CCl4中的溶解能力
D. 在水中的溶解度比在水中的溶解度大
(1) (2024·南通一模)工业可使用四氯乙烯(C2Cl4)溶解S8()。四氯乙烯能溶解S8的原因是____________________________________________________________________。
(2) (2023·如东期中)NH2OH在水中溶解度较大的原因是______________________________________。
(3) (2023·南京期初)室温下,在水中的溶解度比的___(填“大”或“小”或“无差别”)。
(4) (2023·连云港期中) 的熔点比的高,主要原因是__________________________ ________________________。
(5) 用质谱仪检测气态乙酸时,谱图中出现质荷比(相对分子质量)为120的峰,原因是_____________________________________________。
考点5 手性分子
知 识 梳 理
手性异构
具有完全相同的组成和原子排列的一对分子,如同左手和右手一样互为镜像,在三维空间里不能重叠的现象。具有手性异构体的分子称为手性分子。
手性碳原子
有机物分子中,连有4个不同原子或原子团的碳原子是手性碳原子。
如分子中标“*”碳原子类手性碳原子有手性异物体的分子是手性分子中,标“*”碳原子为手性碳原子,该分子存在对映异构:
典 题 悟 法
(2024·江苏各地模拟重组)下列说法错误的是( )
A. 分子中不含有手性碳原子
B. 分子存在对映异构现象
C. 化合物完全水解所得有机产物中含有1个手性碳原子
D. 化合物与足量H2加成后有3个手性碳原子
1. 判断正误(正确的打“√”,错误的打“×”)。
(1) (2022·重庆卷)BCl3的电子式为 ( )
(2) (2024·南通一模)CaSO4·2H2O中既有离子键又有非极性共价键( )
(3) (2023·河北卷)不存在稳定的NF5分子,因为N原子价层只有4个原子轨道,不能形成5个N—F键( )
(4) (2024·苏锡常镇一模)N2H4的结构式为( )
(5) (2023·兴化中学)胍()中σ键与π键的数目之比为3∶1( )
(6) (2023·镇江期初)Si—Si的键能大于Si—O的键能( )
(7) (2023·广东卷) 中,氧原子采取sp3杂化,并且存在手性碳原子( )
(8) (2023·广东卷)CO属于极性分子,分子中存在由p轨道“头碰头”形成的π键( )
(9) (2023·南京二模)OF2是非极性分子( )
(10) (2024·南京二模)沸点大小顺序:CH4(11) (2023·南通一模)NH3易液化是由于NH3与H2O分子间形成氢键( )
(12) (2023·湖南卷)邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点( )
(13) (2023·湖南卷)含有手性碳原子的分子叫作手性分子( )
2. (2023·苏锡常镇二模)反应2NH3+NaClO===N2H4+NaCl+H2O用于合成N2H4。下列说法不正确的是( )
A. NH3的空间结构为平面三角形
B. NaClO的电子式为
C. N2H4中含有极性键和非极性键
D. H2O和N2H4之间可以形成氢键
3. (2023·海安中学)在光照下,螺呲喃发生开、闭环转换而变色,过程如下。下列关于开、闭环螺吡喃说法正确的是( )
A. 均有手性
B. 互为同分异构体
C. N原子杂化方式相同
D. 闭环螺吡喃亲水性更好
4. (2024·邗江中学)SO3和O2的混合气体经光解作用可生成一种新分子。
(1) SO3中S的_________杂化轨道与O的2p轨道重叠形成σ键。
(2) 下列分子属于非极性分子的是_________(填字母)。
a. SO3 b. O3 c.
d. CH3F e. SOCl2 f. CH3OH
g. NCl3 h. COCl2 i. HCHO
j. CO2 k. H2O l. CO
m. SiF4
5. Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为___,下列对XeF2中心原子杂化方式推断合理的是___(填字母)。
A. sp B. sp2
C. sp3 D. sp3d
第5讲 化学键与分子的性质
[备考导航]
(1) × (2) × (3) × (4) × (5) × (6) × (7) × (8) √ (9) × (10) × (11) √
考点1
[知识梳理]
知识5 2.
知识6
2. N≡N O===C===O S===C===S
H—C≡N
N≡C—C≡N N≡C—S—S—C≡N
[典题悟法]
典例1 A 【解析】 SiO2中原子间以共价键结合,SiO2为共价化合物,A正确;HF是共价化合物,电子式为,B错误;SiF4是正四面体形结构,结构对称,为非极性分子,C错误;基态氧原子价层电子轨道表示式为,D错误。
典例2 B 【解析】 1 mol[Fe(NO)(H2O)5]2+含有σ键物质的量为1 mol×(6+1+2×5)=17 mol,A错误;二甲双胍分子中C与N之间σ键数为8,π键数为2,σ键与π键数目之比为4∶1,B正确;醛基和酯基中均含有碳氧π键,1 mol 中含有2 mol碳氧π键,C错误;单键均为σ键,双键中含有1个σ键和1个π键,1 mol 中碳氧σ键有6 mol,D错误。
典例3 (1) 16∶1 (2) 8 (3) 16 mol或16×6.02×1023 (4) 13 mol 或13×6.02×1023
【解析】 (3) 1个[Cu(NH3)4]Cl2中含有12个N—H σ键,Cu2+与NH3形成4个配位键,σ键一共有16 个。
(4) (SCN2H3)2结构为,其中含有13个σ键。
典例4 (1) (2)
或 (3) (4)
(5) 或
范德华力和氢键(或分子间作用力)
【解析】 (3) 羰基氧原子与氨基中的H形成分子间氢键,得到具有八元环的二聚分子。(4) 根据题目中的“五元环”“六配位”可得出配离子的结构。(5) FeC2O4·2H2O晶体层与层之间的作用力为范德华力,因其含结晶水,所以还含有氢键。
考点2
[知识梳理]
知识1 3. 直线 直线 平面三角 平面三角 平面三角 V 四面体 正四面体 四面体 三角锥 四面体 V
知识2 2. sp3 正四面体 四面体 三角锥 V sp2 平面三角 V sp 直线
[典题悟法]
典例5 (1) × (2) √ (3) √ (4) × (5) √ (6) × (7) × (8) × (9) × (10) × (11) × (12) ×
典例6 (1) sp2和sp3 sp2和sp3 (2) 1∶9 (3) 3 (4) sp2 (5) 9 (6) sp3 ②
【解析】 (2) —CN中的C原子采取sp杂化,数目为2,苯环上的C原子均为sp2杂化,共18个。(5) 该分子中除苯环以外的C原子均采取sp3杂化,还有羟基中O原子采取sp3杂化,总计为9。(6) SiCl4中Si的价层电子对数为4,Si采取sp3杂化;根据SiCl4(H2O)的结构式可知Si的价层电子对数为5,采取sp3d杂化。
典例7 A 【解析】 氧的电负性大于氯,Cl2O中成键电子对偏向氧,氟电负性强于氧,OF2中成键电子对偏向氟,两对成键电子对排斥力较小,键角:Cl2O>OF2,A正确;ClO、ClO、ClO三种离子中心Cl原子孤电子对数分别为2、1、0,价层电子对数均为4,由于孤电子对与成键电子对间的斥力更大,使得ClO、ClO、ClO中O—Cl—O键角依次逐渐增大,B错误;同主族元素从上到下电负性减小,NH3、PH3、AsH3中的成键电子对离中心原子越来越远,成键电子对之间的排斥力越来越小,键角越来越小,C错误; NH3分子中N原子有一个孤电子对,[Ni(NH3)6]SO4中N原子孤电子对与Ni形成配位键,斥力减小,键角增大,所以键角:前者大于后者,D错误。
考点3
[知识梳理]
知识1
V 极性 直线 非极性 三角锥 极性 平面三角 非极性 正四面体 非极性 四面体 极性 正四面体 非极性
知识3
(1) > > > (2) > >
[典题悟法]
典例8 A 【解析】 元素电负性差值越大,共价键极性越强,共价键的极性:Si—Cl<Al—Cl,B错误;IF3中心原子有孤电子对,IF3是极性分子,C错误;N2O5分子中间的O原子有孤电子对,N2O5为极性分子,D错误。
典例9 (1) 强 (2) (3)③①② (4)
【解析】 (3 )—CF3为吸电子基团,使得—SO3H中羟基的氢氧键极性较大,—CH3为推电子基团,使得—SO3H中羟基的氢氧键极性较小,酸性由强到弱的顺序为③①②。(4) —CF3为吸电子基团,—CH3为推电子基团,N原子电子云密度:>>,碱性随N原子电子云密度的增大而增强,碱性最强的是。
考点4
[典题悟法]
典例10 B 【解析】 二甲双胍为极性分子且能与水形成分子间氢键,A正确;沸点:H2O>H2Te>H2Se>H2S,B错误;I2+I-??I,C正确;羟基为亲水基,酯基为憎水基,D正确。
典例11 (1) 四氯乙烯与S8都是非极性分子,符合“相似相溶”规律 (2) NH2OH和水分子之间能形成氢键 (3) 大 (4) 分子间能形成氢键,分子间作用力较大 (5) 2个乙酸分子通过氢键形成二聚体
考点5
[典题悟法]
典例12 D 【解析】 该分子中不含手性碳原子,A正确; 该分子中与—OH相连的碳原子为手性碳原子,存在对映异构现象,B正确; 该化合物完全水解所得有机产物为,其中与—NH2相连碳原子为手性碳原子,有1个手性碳原子,C正确;该化合物与足量H2加成得到(标序号碳原子为手性碳原子),共有5个手性碳原子,D错误。
[质量评价]
1. (1) × (2) × (3) √ (4) × (5) × (6) × (7) × (8) × (9) × (10) √ (11) × (12) √ (13) ×
2. A 【解析】 NH3的空间结构为三角锥形,A错误。
3. B 【解析】 (标“*”碳原子为手性碳原子)分子中含有一个手性碳原子,具有手性,开环螺吡喃分子中不含手性碳原子,A错误;分子式均为C19H19NO,结构不同,互为同分异构体,B正确;闭环螺吡喃中N原子杂化方式为sp3,开环螺吡喃中N原子杂化方式为sp2,C错误;开环螺吡喃中氧原子带负电荷,容易与水分子形成分子间氢键,水溶性增大,故开环螺吡喃亲水性更好,D错误。
4. (1) sp2 (2) ajm
5. 5 D 【解析】 XeF2中心原子的价层电子对数为5,中心原子的杂化方式应为sp3d。
备考导航
复习目标 1. 认识化学键的含义,了解离子键和共价键的形成,了解常见离子化合物和共价化合物的形成过程,能识别典型的离子化合物和共价化合物。
2. 能从化学键变化的角度认识化学反应的实质。
3. 了解共价键的主要类型,能用键能、键长、键角等数据说明简单分子的某些性质。
4. 能根据分子结构特点和键的极性来判断分子的极性。
5. 能利用杂化轨道理论和价层电子对互斥模型判断简单分子或离子的空间结构。
6. 能说明分子间作用力(含氢键)对物质熔、沸点等性质的影响。
7. 掌握常见的化学用语。
熟记网络
课前自测 判断正误(正确的打“√”,错误的打“×”)。
(1) (2023·江苏卷)H2O2分子中的化学键均为极性共价键( )
(2) (2024·南通二模)1 mol [Co(NO2)6]3- 中含有12 mol σ键( )
(3) (2023·江苏卷)CaH2晶体中存在Ca与H2之间的强烈相互作用( )
(4) (2023·连云港一调)HClO的电子式为 ( )
(5) (2024·南京二模)CO的空间结构为三角锥形( )
(6) (2024·南通三模)SO2的中心原子杂化轨道类型为sp3( )
(7) (2024·南京、盐城期末)分子中键角大小:SO2>SO3( )
(8) (2022·江苏卷)SiH4、SiCl4都是由极性键构成的非极性分子( )
(9) (2023·江苏卷)H2O分子之间形成氢键,故H2O(g)的热稳定性比H2S(g)的高( )
(10) (2023·高邮期初)在水中的溶解度比小( )
(11) (2024·盐城模拟)与HBr反应可产生一种无手性的副产物( )
考点1 化学键
知 识 梳 理
化学反应的实质
化学反应的过程本质上就是旧化学键的断裂和新化学键的形成的过程。
化学键
1. 定义:相邻的原子之间强烈的相互作用。
2. 分类
(1) 离子键:带相反电荷的离子间的相互作用。
(2) 共价键:原子间通过共用电子对所形成的相互作用。
(3) 金属键:金属离子与自由电子间的相互作用。
3. 离子键与共价键的比较
化学键 离子键 共价键
成键微粒 阴、阳离子 原子
成键本质 静电作用 共用电子对
成键元素 一般是活泼金属元素和活泼非金属元素 一般是非金属元素
存在 离子化合物(NH4Cl、NH4NO3等铵盐由非金属元素组成,但含有离子键) 共价化合物(如CO2、CH4)、非金属单质(如H2、O2)、某些离子化合物(如NaOH、Na2O2)
共价键
1. 分类
依据 类型
按成键 方式 σ键 原子轨道“头碰头”重叠
π键 原子轨道“肩并肩”重叠
按成键 过程 一般共价键 成键时两个原子各自提供一个未成对电子形成的共价键
配位键 “电子对给予—接受”键
按电子 偏向 极性键
(A—B型) 共用电子对发生偏移
非极性键
(A—A型) 共用电子对不发生偏移
按原子间 共用电子
对的数目 单键(是σ键) 原子间有一个共用电子对
双键(一个是σ键,另一个是π键) 原子间有两个共用电子对
三键(一个是σ键,另两个是π键) 原子间有三个共用电子对
2. 共价键的键参数——键能、键长、键角
(1) 概念
键能:在标准状况下,气态分子中1 mol化学键解离成气态原子所吸收的能量,单位为kJ/mol。
键长:构成共价键的两个原子的核间距。
键角:两个共价键之间的夹角。
(2) 键参数与分子稳定性的关系
一般来说,键能越大,分子越稳定;键长越短,分子越稳定。
(3) 键参数对分子性质的影响
离子化合物和共价化合物
1. 定义
(1) 离子化合物:由离子键构成的化合物。
(2) 共价化合物:以共用电子对形成的化合物。如HCl分子、SiO2晶体。
2. 判断方法
(1) 根据化学键类型:含离子键的化合物,一定是离子化合物;只含共价键的化合物,一定是共价化合物。
(2) 根据化合物类型:大多数金属氧化物、强碱、大多数盐是离子化合物;一般非金属氢化物、非金属氧化物、有机物(有机盐除外)为共价化合物。
(3) 根据化合物性质:熔融状态能导电的为离子化合物;熔融状态不能导电的为共价化合物。
电子式
1. 定义:在元素符号周围用“·”或“×”来表示原子的最外层电子的式子。
2. 写出下列物质的电子式:
NaCl____________;NaH____________;
NaOH____________;
MgCl2____________;
NH4Cl____________;
Na2O____________;
Na2O2____________;
CaC2____________;
HCl____________;CO2____________;
NH3____________;H2O____________;
N2H4____________;HClO____________;
H2O2____________;N2_____________;
CCl4_______________。
结构式
1. 定义:用一根短线“—”表示一个共用电子对的式子。
2. 写出下列物质的结构式:
N2____________________;H2O_____________;
NH3____________;CO2______________________________;
CS2______________________________;HClO____________;
HCN_______________;N2H4____________;
(CN)2__________________;
(SCN)2______________________________。
化学用语
1. 两种模型
(1) 空间填充模型,如甲烷:。
(2) 球棍模型,如甲烷:。
2. 三种符号
(1) 元素符号:O、Na等。
(2) 离子符号:Al3+、SO等。
(3) 核素符号:H、U等。
3. 七种表达式
(1) 化学方程式:
如HCl+NaOH===NaCl+H2O。
(2) 离子方程式:如H++OH-===H2O。
(3) 热化学方程式:如H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol。
(4) 电离方程式:如BaSO4===Ba2++SO。
(5) 水解方程式:
如S2-+H2O??HS-+OH-。
(6) 电极反应式:
如O2+2H2O+4e-===4OH-。
(7) 沉淀溶解平衡式:
如BaSO4(s)?? Ba2+(aq)+SO(aq)。
[注意事项]
①区分电离方程式和水解方程式。
如HS-电离方程式:
HS-+H2O??H3O++S2-,
HS-水解方程式:
HS-+H2O??H2S+OH-。
②区分难溶物的电离方程式与沉淀溶解平衡式[如3.(4)和(7)]。
4. 十种图式
(1) 化学式:KAl(SO4)2·12H2O、SiO2等。
(2) 分子式:NH3、C6H12O6等。
(3) 最简式(实验式):CH2、CH2O等。
(4) 电子式:等。
(5) 结构式:、 等。
(6) 结构简式:CH2===CH2、CH3COOH等。
(7) 键线式:、等。
(8) 微粒结构示意图:
Cl 、Na+ 等。
(9) 电子排布式:如29Cu的基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1。
(10) 电子排布图(轨道表示式):
如基态N原子核外电子排布图为
;
基态Fe原子的价层电子排布图为
。
[注意事项]
a. 分子晶体的化学式可表示分子式,如C6H6、H2O2等。离子晶体和共价晶体的化学式不表示分子式,只表示原子最简整数比。
b. 书写结构简式一定要突出官能团,如乙烯的结构简式不能写成CH2CH2,应写成CH2===CH2。
c. 书写官能团时不能忽视“—”,如将羧基(—COOH)错写成COOH。官能团的书写方向变化时,原子的书写顺序要随之变化,如醛基可写成—CHO或OHC—,但不能写成HOC—;硝基可写成—NO2或O2N—,但不能写成NO2—。
解疑释惑6
σ键和π键的识别
1. σ键和π键的识别
(1) 键线式呈现的结构,不能忽略省去的碳氢键。
(2) 含有苯环的结构,不能忽略苯环中的碳氢键。
1 mol苯分子中含有σ键的物质的量为12 mol。乙炔分子中σ键和π键的数目之比是3∶2。HCOONa中σ键和π键的数目之比是3∶1。
2. 配合物中的σ键和π键(一般,配位键是σ键)
(1) 由内界与外界组成的配合物:内界和外界之间一般存在离子键,如[Cu(NH3)4]SO4中,[Cu(NH3)4]2+与SO之间是离子键,内界与外界中均含有σ键。1 mol [Cu(NH3)4]SO4中含有σ键的物质的量为20 mol。
(2) 无外界的配合物,直接计算内界中的σ键数目。1 mol [Fe(CO)5]中含有σ键的物质的量为10 mol,π键的物质的量为10 mol。
典 题 悟 法
化学用语
(2023·如皋中学)反应SiO2+4HF ===SiF4↑+2H2O应用于玻璃雕刻。下列说法正确的是( )
A. SiO2属于共价化合物
B. HF的电子式为
C. SiF4是由极性键形成的极性分子
D. H2O中基态氧原子价层电子轨道表达式为
σ键和 π 键的计算
(2024·江苏各地模拟重组)下列说法正确的是( )
A. 1 mol [Fe(NO)(H2O)5]2+中含有6 mol σ键
B. 二甲双胍()分子中碳原子与氮原子间σ键与π键的数目之比为4∶1
C. 1 mol 中含3 mol碳氧π键
D. 1 mol 中含有5 mol碳氧σ键
(1) (2024·南通三模) 中σ键与π键数目之比为_________。
(2) (2023·高邮期初)S8是由8个硫原子形成的环状结构,每个硫原子以sp3杂化轨道中的两个轨道与相邻的两个硫原子形成σ键。1 mol S8中含有的σ键为___mol。
(3) (2023·镇江期中)1 mol [Cu(NH3)4]Cl2中σ键的数目为_________________________________。
(4) (2023·海门调研)硫脲(结构为)是一种常见的还原剂,易被氧化为(SCN2H3)2。1 mol (SCN2H3)2中含有σ键的数目为______________________________________________________。
结构式的书写
(1) (2023·江苏卷)已知H4V4O12具有八元环结构,其结构式可表示为____________。
(2) (2024·南通一模)在α-FeOOH的结构中,每个Fe(Ⅲ)与羟基氧和非羟基氧构成了FeO3(OH)3八面体,相同环境的氧原子之间构成正三角形。请在图中补充完整该八面体的结构。
(3) (2024·宿迁二模)两分子CO(NH2)2通过羰基氧原子形成分子间氢键,得到具有八元环的二聚分子。二聚分子的结构式为_________________。
(4) (2023·苏州期中)某配离子[Ge(OH)2(C2O4)2]2-中含有两个五元环,Ge为六配位,配位原子均为氧,画出该离子的结构式:____________。
(5) (2024·扬州模拟)FeC2O4·2H2O晶体为片层结构,层内每个Fe2+与2个C2O和2个H2O相连,形成1个铁氧八面体。在图中补全该结构。
FeC2O4·2H2O晶体层与层之间的作用力为________________________________________________。
考点2 常见分子(或离子)的空间结构及中心原子的杂化类型
知 识 梳 理
价层电子对互斥(VSEPR)模型
1. 理论要点
(1) 价层电子对在空间上彼此相距最远时,排斥力最小,体系的能量最低。
(2) 孤电子对的排斥力较大,孤电子对越多,排斥力越强,键角越小。
2. 用价层电子对互斥模型推测分子的空间结构
3. 常见分子(或离子)的价层电子互斥模型和空间结构
价层电子 对数 σ键电
子对数 孤电子
对数 电子对的
排列方式 VSEPR
模型名称 分子或离子的空间结构名称 实例
2 2 0
______形 ______形 CO2、CS2、BeCl2
3 3 0
________形 _________形 BF3 、SO3、NO、CO
2 1
_________形 _______形 SO2、O3、NO
4 4 0
_________形 _________形 CH4 、CCl4、NH
3 1
_________形 _________形 NH3
2 2
_________形 ________形 H2O
注意:VSEPR模型与分子或离子的空间结构不一定一致
杂化轨道理论
1. 杂化轨道与分子空间结构的关系
杂化类型 杂化轨道数目 杂化轨道间夹角 空间结构 实例
sp 2 180° 直线形 BeCl2
sp2 3 120° 平面三角形 BF3
sp3 4 109°28′ 正四面体形 CH4
2. 分子(或离子)的空间结构分析示例
示例 中心原子杂化方式 分子(或离子)空间结构名称
CH4、NH、PO、SO、AlH _________ ____________形
SiHCl3、CH3Br
_________形
NH3、H3O+、PCl3、PO、ClO
_________形
H2O、NH
___形
HCHO、SO3、NO、CO _________ ____________形
SO2、O3、NO
___形
C2H2、BeCl2、CO2、HCN ______ ______形
解疑释惑7
影响键角大小的因素
1. 杂化类型不同
键角:sp3杂化
(2) ClO2和Cl2O均为V形结构,但ClO2中存在大π键(Π),ClO2中Cl原子采取sp2杂化,Cl2O中O原子采取sp3杂化,键角:O—Cl—O>Cl—O—Cl。
2. 杂化类型相同
(1) 孤电子对数越多,键角越小,如键角:H2O
(3) 孤电子对数相同,中心原子相同,配位原子电负性越大,键角越小,如键角:NF3
中心原子杂化类型与微粒空间结构
判断正误(正确的打“√”,错误的打“×”)。
(1) (2023·江苏卷)NH和H2O的中心原子轨道杂化类型均为sp2( )
(2) (2024·扬州中学)H3O+和SOCl2的中心原子轨道杂化类型均为sp3( )
(3) (2023·海安中学)[Be(OH)4]2-中Be原子轨道杂化类型为sp3( )
(4) (2024·盐城模拟)中有2个碳原子采取sp3杂化( )
(5) (2023·南京二模)CH3H2中碳负离子的轨道杂化类型为sp3( )
(6) (2023·如皋一中)分子中C原子轨道杂化类型有2种( )
(7) (2023·常州期中)NH3分子的VSEPR模型为( )
(8) (2023·扬州中学)NO和NH的空间结构模型相同,NO和NH3的空间结构模型相同( )
(9) (2024·泰州一模)已知XeF2分子是非极性分子,可推测XeF2的空间结构为Ⅴ形( )
(10) (2024·扬州中学)FNO的空间结构为直线形( )
(11) (2024·镇江期初)COCl2分子中4个原子不共面( )
(12) (2024·海安中学)[Be(OH)4]2-的空间结构为平面正方形( )
(1) (2023·扬州中学)化合物分子中碳原子轨道杂化类型为_____________________,氮原子轨道杂化类型为_____________________。
(2) (2024·苏锡常镇一模)中采取sp、sp2杂化的碳原子数目之比为__________。
(3) (2023·如皋期初)化合物中,碳原子有_______种不同的轨道杂化方式。
(4) 吡啶()中N原子轨道杂化类型为_________。
(5) (2023·南菁、梁丰中学期初)1 mol 中sp3杂化的原子数目为_______mol。
(6) SiCl4是生产高纯硅的前驱体,其中Si原子轨道杂化类型为_________。SiCl4可发生水解反应,机理如下:
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si原子轨道杂化类型为___(填序号)。
键角大小比较
(2024·江苏各地模拟重组)下列说法正确的是( )
A. 键角:Cl2O>OF2
B. ClO、ClO和ClO中O—Cl—O键角依次逐渐减小
C. NH3、PH3、AsH3的键角逐渐增大
D. [Ni(NH3)6]SO4、NH3中的H—N—H键角:前者小于后者
深度指津
中心原子杂化类型的判断
1. 根据中心原子价层电子对数判断
中心原子的价层电子对数依次为4、3、2,杂化类型依次为sp3、 sp2、sp。
2. 根据“杂化轨道数=σ键数+孤电子对数”进行判断
(1) C:2个σ键——sp,3个σ键——sp2,4个σ键——sp3。
如CH3CH3中的碳原子采取sp3杂化;乙烯和甲醛中的碳原子采取sp2杂化;苯环中的碳原子采取sp2杂化;乙炔分子中碳原子采取sp杂化。
(2) N:2个σ键——sp2,3个σ键——sp3。
如H—N===N—H中N形成2个σ键,还有1个孤电子对,N原子的杂化类型为sp2。
(3) O(S):2个σ键——sp3。如H2O2的分子结构式为H—O—O—H,O形成2个σ键,还有2个孤电子对,O原子的杂化类型为sp3。
考点3 共价键的极性
知 识 梳 理
键的极性与分子的极性
分子类型 典型分子 键的极性 空间结构 分子极性
三原子分子 H2O、H2S、SO2 极性键 ___形 ______分子
CS2、CO2 极性键 ______形 _________分子
四原子分子 NH3 极性键 _________形 ______分子
BF3、SO3 极性键 ____________形 _________分子
P4 非极性键 ____________形 _________分子
五原子分子 CH3Cl 极性键 _________形 ______分子
CH4、CCl4 极性键 ____________形 _________分子
非极性分子与极性分子的判断
键的极性对化学性质的影响
比较酸性(填“>”或“<”):
(1) CF3COOH___CCl3COOH___CHCl2COOH___CH2ClCOOH。
(2) HCOOH___CH3COOH___CH3CH2COOH。
典 题 悟 法
键的极性与分子的极性
(2024·江苏各地模拟重组)下列说法正确的是( )
A. O3是由极性键构成的极性分子
B. 共价键的极性:Si—Cl>Al—Cl
C. IF3是由极性键构成的非极性分子
D. N2O5的结构如图,N2O5是非极性分子
键的极性对化学性质的影响
(1) (2023·江苏卷)化合物的酸性比环己醇的___(填“强”“弱”或“无差别”)。
(2) (2024·南外、金陵、海安中学联考)圈出下图中酸性最强的氢原子。
(3) (2024·苏州模拟)—SO3H(其结构表示为)中羟基的氢氧键断裂,且极性越强,氢氧键越易断裂。下列物质的酸性由强到弱的顺序是_________(填序号)。
(4) (2023·如皋期初)吡啶()和其衍生物(、)的碱性随N原子电子云密度的增大而增强,其中碱性最强的是___。
深度指津
分子极性的判断
1. 判断分子极性的方法
(1) ABm型分子中,若中心原子化合价的绝对值等于该元素的价电子数(最高正价),则该分子为非极性分子。如PCl3、PCl5分别为极性分子和非极性分子。
(2) 根据中心原子是否有孤电子对。对于ABm型分子,A为中心原子,若A上有孤电子对,则分子为极性分子,如H2O、NH3中O、N原子上分别有2个、1个孤电子对;若A上无孤电子对,则分子为非极性分子,如CH4、CO2、BF3中C、C、B原子上均无孤电子对。
2. 共价键极性和分子极性的关系
考点4 分子间作用力
知 识 梳 理
范德华力及其对物质性质的影响
1. 相对分子质量越大,范德华力越大
组成和结构相似的物质,随着相对分子质量的增加,物质的熔、沸点升高。如熔、沸点:F2
2. 分子的极性越大,范德华力也越大
如CO是极性分子,N2是非极性分子,CO分子间的作用力大于N2,因此熔、沸点:CO>N2。
氢键及其对物质性质的影响
1. 氢键的定义
已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间的作用力叫作氢键。
2. 氢键形成条件
氢原子两边的A原子和B原子所属元素通常具有很强的电负性和很小的原子半径。A、B的电负性越强、半径越小,形成的氢键就越强。
3. 氢键表示方法及分类
(1) 表示方法:X—H…Y(X、Y 为N、O、F原子,可以相同,也可不同)。
(2) 分类:分子内氢键、分子间氢键。如下表:
分子间氢键
HF分子间的氢键
冰醋酸以分子间氢键缔合成的二聚体结构
分子内氢键
HNO3分子内形成了氢键
邻羟基苯甲醛分子内形成了氢键
4. 氢键对物质物理性质的影响
(1) 同主族氢化物分子间氢键使NH3、H2O、HF的沸点反常的高,如图所示。
(2) 使物质易溶于水。
如NH3、C2H5OH、CH3COOH、H2O2等易溶于水(这些分子与水分子之间形成了氢键)。
(3) 解释一些特殊现象。
①接近水的沸点时水蒸气的相对分子质量测定值比按化学式H2O计算出来的相对分子质量大一些(解释:接近水的沸点的蒸气中存在一定量的水分子因氢键而相互缔合,形成所谓的缔合分子)。
②HF分子的相对分子质量测定结果比理论值偏大(解释:HF分子间通过氢键形成缔合分子,使测定结果偏大)。
①氢键不是化学键,是一种较弱的作用力。
②形成分子内氢键,形成分子间氢键,因此,的沸点低于的沸点。
③沸点:C2H5—OH>H3C—O—CH3(解释:C2H5—OH形成了分子间氢键)。
溶解性
1. “相似相溶”规律:一般非极性溶质能溶于非极性溶剂,极性溶质能溶于极性溶剂。如乙醇(极性溶剂)易溶解乙酸、乙酸乙酯(极性溶质),苯、四氯化碳等(非极性溶剂)易溶解Br2、I2等(非极性溶质)。
2. 若存在氢键,则溶质和溶剂之间的氢键作用力越大,溶解性越好。如NH3极易溶于水。
3. “相似相溶”还适用于分子结构的相似性。如乙醇能与水互溶,而戊醇中烃基较大,戊醇在水中的溶解度明显减小。
深度指津
影响分子溶解性的因素
1. 首先考虑有无氢键,如氨气极易溶于水,主要是氨气分子与水分子之间形成了氢键。
2. 若无氢键,则考虑“相似相溶”规律,如HCl极易溶于水,HCl分子与水分子之间不存在氢键,所以考虑HCl分子与水分子均为极性分子,根据“相似相溶”,HCl易溶于水。
3. 最后考虑分子是否与水反应,如Cl2既不是极性分子,也不能与水分子形成氢键,但氯气能溶于水,原因是氯气能与水发生反应。
典 题 悟 法
(2024·江苏各地模拟重组)下列说法错误的是( )
A. 二甲双胍()易溶于水
B. ⅥA族元素氢化物的沸点从上到下依次增大
C. 向I2的CCl4溶液中加入等体积KI溶液,振荡后静置,观察两层溶液颜色变化,比较I2在KI浓溶液与CCl4中的溶解能力
D. 在水中的溶解度比在水中的溶解度大
(1) (2024·南通一模)工业可使用四氯乙烯(C2Cl4)溶解S8()。四氯乙烯能溶解S8的原因是____________________________________________________________________。
(2) (2023·如东期中)NH2OH在水中溶解度较大的原因是______________________________________。
(3) (2023·南京期初)室温下,在水中的溶解度比的___(填“大”或“小”或“无差别”)。
(4) (2023·连云港期中) 的熔点比的高,主要原因是__________________________ ________________________。
(5) 用质谱仪检测气态乙酸时,谱图中出现质荷比(相对分子质量)为120的峰,原因是_____________________________________________。
考点5 手性分子
知 识 梳 理
手性异构
具有完全相同的组成和原子排列的一对分子,如同左手和右手一样互为镜像,在三维空间里不能重叠的现象。具有手性异构体的分子称为手性分子。
手性碳原子
有机物分子中,连有4个不同原子或原子团的碳原子是手性碳原子。
如分子中标“*”碳原子类手性碳原子有手性异物体的分子是手性分子中,标“*”碳原子为手性碳原子,该分子存在对映异构:
典 题 悟 法
(2024·江苏各地模拟重组)下列说法错误的是( )
A. 分子中不含有手性碳原子
B. 分子存在对映异构现象
C. 化合物完全水解所得有机产物中含有1个手性碳原子
D. 化合物与足量H2加成后有3个手性碳原子
1. 判断正误(正确的打“√”,错误的打“×”)。
(1) (2022·重庆卷)BCl3的电子式为 ( )
(2) (2024·南通一模)CaSO4·2H2O中既有离子键又有非极性共价键( )
(3) (2023·河北卷)不存在稳定的NF5分子,因为N原子价层只有4个原子轨道,不能形成5个N—F键( )
(4) (2024·苏锡常镇一模)N2H4的结构式为( )
(5) (2023·兴化中学)胍()中σ键与π键的数目之比为3∶1( )
(6) (2023·镇江期初)Si—Si的键能大于Si—O的键能( )
(7) (2023·广东卷) 中,氧原子采取sp3杂化,并且存在手性碳原子( )
(8) (2023·广东卷)CO属于极性分子,分子中存在由p轨道“头碰头”形成的π键( )
(9) (2023·南京二模)OF2是非极性分子( )
(10) (2024·南京二模)沸点大小顺序:CH4
(12) (2023·湖南卷)邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点( )
(13) (2023·湖南卷)含有手性碳原子的分子叫作手性分子( )
2. (2023·苏锡常镇二模)反应2NH3+NaClO===N2H4+NaCl+H2O用于合成N2H4。下列说法不正确的是( )
A. NH3的空间结构为平面三角形
B. NaClO的电子式为
C. N2H4中含有极性键和非极性键
D. H2O和N2H4之间可以形成氢键
3. (2023·海安中学)在光照下,螺呲喃发生开、闭环转换而变色,过程如下。下列关于开、闭环螺吡喃说法正确的是( )
A. 均有手性
B. 互为同分异构体
C. N原子杂化方式相同
D. 闭环螺吡喃亲水性更好
4. (2024·邗江中学)SO3和O2的混合气体经光解作用可生成一种新分子。
(1) SO3中S的_________杂化轨道与O的2p轨道重叠形成σ键。
(2) 下列分子属于非极性分子的是_________(填字母)。
a. SO3 b. O3 c.
d. CH3F e. SOCl2 f. CH3OH
g. NCl3 h. COCl2 i. HCHO
j. CO2 k. H2O l. CO
m. SiF4
5. Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为___,下列对XeF2中心原子杂化方式推断合理的是___(填字母)。
A. sp B. sp2
C. sp3 D. sp3d
第5讲 化学键与分子的性质
[备考导航]
(1) × (2) × (3) × (4) × (5) × (6) × (7) × (8) √ (9) × (10) × (11) √
考点1
[知识梳理]
知识5 2.
知识6
2. N≡N O===C===O S===C===S
H—C≡N
N≡C—C≡N N≡C—S—S—C≡N
[典题悟法]
典例1 A 【解析】 SiO2中原子间以共价键结合,SiO2为共价化合物,A正确;HF是共价化合物,电子式为,B错误;SiF4是正四面体形结构,结构对称,为非极性分子,C错误;基态氧原子价层电子轨道表示式为,D错误。
典例2 B 【解析】 1 mol[Fe(NO)(H2O)5]2+含有σ键物质的量为1 mol×(6+1+2×5)=17 mol,A错误;二甲双胍分子中C与N之间σ键数为8,π键数为2,σ键与π键数目之比为4∶1,B正确;醛基和酯基中均含有碳氧π键,1 mol 中含有2 mol碳氧π键,C错误;单键均为σ键,双键中含有1个σ键和1个π键,1 mol 中碳氧σ键有6 mol,D错误。
典例3 (1) 16∶1 (2) 8 (3) 16 mol或16×6.02×1023 (4) 13 mol 或13×6.02×1023
【解析】 (3) 1个[Cu(NH3)4]Cl2中含有12个N—H σ键,Cu2+与NH3形成4个配位键,σ键一共有16 个。
(4) (SCN2H3)2结构为,其中含有13个σ键。
典例4 (1) (2)
或 (3) (4)
(5) 或
范德华力和氢键(或分子间作用力)
【解析】 (3) 羰基氧原子与氨基中的H形成分子间氢键,得到具有八元环的二聚分子。(4) 根据题目中的“五元环”“六配位”可得出配离子的结构。(5) FeC2O4·2H2O晶体层与层之间的作用力为范德华力,因其含结晶水,所以还含有氢键。
考点2
[知识梳理]
知识1 3. 直线 直线 平面三角 平面三角 平面三角 V 四面体 正四面体 四面体 三角锥 四面体 V
知识2 2. sp3 正四面体 四面体 三角锥 V sp2 平面三角 V sp 直线
[典题悟法]
典例5 (1) × (2) √ (3) √ (4) × (5) √ (6) × (7) × (8) × (9) × (10) × (11) × (12) ×
典例6 (1) sp2和sp3 sp2和sp3 (2) 1∶9 (3) 3 (4) sp2 (5) 9 (6) sp3 ②
【解析】 (2) —CN中的C原子采取sp杂化,数目为2,苯环上的C原子均为sp2杂化,共18个。(5) 该分子中除苯环以外的C原子均采取sp3杂化,还有羟基中O原子采取sp3杂化,总计为9。(6) SiCl4中Si的价层电子对数为4,Si采取sp3杂化;根据SiCl4(H2O)的结构式可知Si的价层电子对数为5,采取sp3d杂化。
典例7 A 【解析】 氧的电负性大于氯,Cl2O中成键电子对偏向氧,氟电负性强于氧,OF2中成键电子对偏向氟,两对成键电子对排斥力较小,键角:Cl2O>OF2,A正确;ClO、ClO、ClO三种离子中心Cl原子孤电子对数分别为2、1、0,价层电子对数均为4,由于孤电子对与成键电子对间的斥力更大,使得ClO、ClO、ClO中O—Cl—O键角依次逐渐增大,B错误;同主族元素从上到下电负性减小,NH3、PH3、AsH3中的成键电子对离中心原子越来越远,成键电子对之间的排斥力越来越小,键角越来越小,C错误; NH3分子中N原子有一个孤电子对,[Ni(NH3)6]SO4中N原子孤电子对与Ni形成配位键,斥力减小,键角增大,所以键角:前者大于后者,D错误。
考点3
[知识梳理]
知识1
V 极性 直线 非极性 三角锥 极性 平面三角 非极性 正四面体 非极性 四面体 极性 正四面体 非极性
知识3
(1) > > > (2) > >
[典题悟法]
典例8 A 【解析】 元素电负性差值越大,共价键极性越强,共价键的极性:Si—Cl<Al—Cl,B错误;IF3中心原子有孤电子对,IF3是极性分子,C错误;N2O5分子中间的O原子有孤电子对,N2O5为极性分子,D错误。
典例9 (1) 强 (2) (3)③①② (4)
【解析】 (3 )—CF3为吸电子基团,使得—SO3H中羟基的氢氧键极性较大,—CH3为推电子基团,使得—SO3H中羟基的氢氧键极性较小,酸性由强到弱的顺序为③①②。(4) —CF3为吸电子基团,—CH3为推电子基团,N原子电子云密度:>>,碱性随N原子电子云密度的增大而增强,碱性最强的是。
考点4
[典题悟法]
典例10 B 【解析】 二甲双胍为极性分子且能与水形成分子间氢键,A正确;沸点:H2O>H2Te>H2Se>H2S,B错误;I2+I-??I,C正确;羟基为亲水基,酯基为憎水基,D正确。
典例11 (1) 四氯乙烯与S8都是非极性分子,符合“相似相溶”规律 (2) NH2OH和水分子之间能形成氢键 (3) 大 (4) 分子间能形成氢键,分子间作用力较大 (5) 2个乙酸分子通过氢键形成二聚体
考点5
[典题悟法]
典例12 D 【解析】 该分子中不含手性碳原子,A正确; 该分子中与—OH相连的碳原子为手性碳原子,存在对映异构现象,B正确; 该化合物完全水解所得有机产物为,其中与—NH2相连碳原子为手性碳原子,有1个手性碳原子,C正确;该化合物与足量H2加成得到(标序号碳原子为手性碳原子),共有5个手性碳原子,D错误。
[质量评价]
1. (1) × (2) × (3) √ (4) × (5) × (6) × (7) × (8) × (9) × (10) √ (11) × (12) √ (13) ×
2. A 【解析】 NH3的空间结构为三角锥形,A错误。
3. B 【解析】 (标“*”碳原子为手性碳原子)分子中含有一个手性碳原子,具有手性,开环螺吡喃分子中不含手性碳原子,A错误;分子式均为C19H19NO,结构不同,互为同分异构体,B正确;闭环螺吡喃中N原子杂化方式为sp3,开环螺吡喃中N原子杂化方式为sp2,C错误;开环螺吡喃中氧原子带负电荷,容易与水分子形成分子间氢键,水溶性增大,故开环螺吡喃亲水性更好,D错误。
4. (1) sp2 (2) ajm
5. 5 D 【解析】 XeF2中心原子的价层电子对数为5,中心原子的杂化方式应为sp3d。
同课章节目录
