大单元一 化学基础知识 第6讲 晶体 配合物 学案 (含答案)2026届高三一轮大单元复习
文档属性
| 名称 | 大单元一 化学基础知识 第6讲 晶体 配合物 学案 (含答案)2026届高三一轮大单元复习 |  | |
| 格式 | DOC | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-14 11:18:14 | ||
图片预览



文档简介
第6讲 晶体 配合物
备考导航
复习目标 1. 了解晶体类型及不同类型晶体中微粒间作用力的区别。
2. 了解分子晶体、共价晶体、离子晶体、金属晶体的结构与性质的关系。
3. 了解晶胞的概念,能根据晶胞确定晶体的组成并进行相关的计算。
4. 认识简单配合物的成键特征,了解配合物的存在与应用。
熟记网络
课前自测 判断正误(正确的打“√”,错误的打“×”)。
(1) (2023·江苏卷)碳单质、晶体硅、SiC均为共价晶体( )
(2) (2022·江苏卷)ⅣA族元素单质的晶体类型相同( )
(3) (2022·江苏卷)金刚石与石墨烯中的C—C—C夹角都为120°( )
(4) (2023·常州期中)1 mol金刚石含C—C数目约为2×6.02×1023( )
(5) (2023·河北卷)碱金属中Li的熔点最高,原因是碱金属中Li的价层电子数最少,金属键最强( )
(6) (2023·江苏卷)N2H4中的N原子与H+形成配位键,故N2H4具有还原性( )
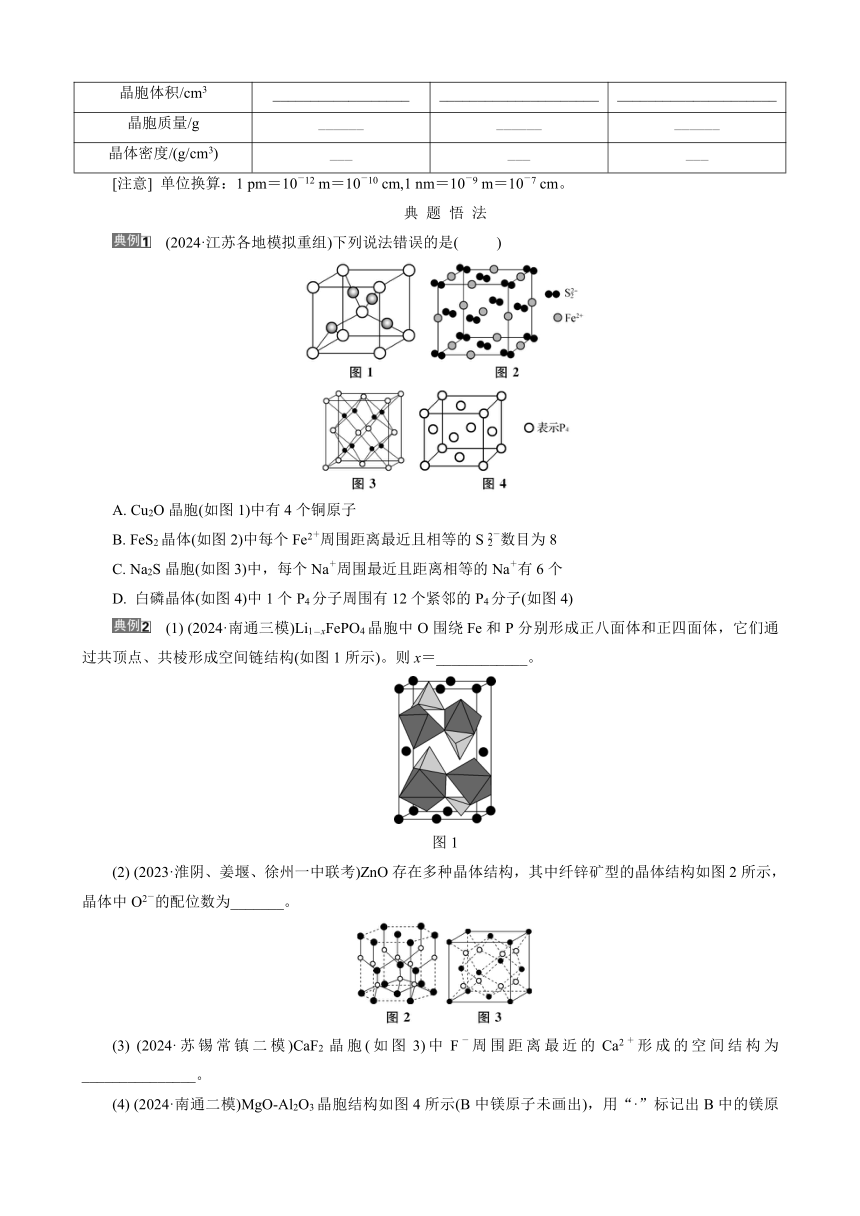
(7) (2024·苏锡常镇二模)S2O(结构如图1)中2个S原子均可作配位原子( )
(8) (2023·扬州期中)可用图2表示Fe2Cl6的结构( )
(9) (2023·海南卷)图3制备[Cu(NH3)4]SO4·H2O晶体( )
(10) (2023·湖南卷)冠醚(18-冠-6)的空穴与K+尺寸适配,二者能通过弱相互作用形成超分子( )
考点1 晶胞微粒数的计算
知 识 梳 理
长方体(含立方体)晶胞中微粒数计算
晶胞中粒子配位数的计算
一个粒子周围最邻近的粒子的数目称为配位数。
1. 晶体中原子(或分子)的配位数:若晶体中的微粒为同种原子或同种分子,则某原子(或分子)的配位数指的是该原子(或分子)等距离且紧邻的原子(或分子)的数目。常见晶胞的配位数如表:
晶胞
配位数 ___ ___ ______
2. 离子晶体的配位数:指一个离子周围等距离且紧邻的异种电性离子的数目。
(1) NaCl晶体中,Cl-的配位数指的是每个Cl-周围等距离且紧邻的Na+的个数,Cl-的配位数为___,6个Na+所围成的图形为____________。Na+的配位数为___。
(2) 由图2可知,CaF2晶胞内黑球共有___个,白球共有___个,说明白球是____________,黑球是______。F-的配位数为___,Ca2+的配位数为___。
晶体密度的计算
1. 确定晶胞中各原子的个数和化学式。
2. 计算晶胞的质量:m=×N,其中M为晶体的摩尔质量,N为晶胞拥有的粒子数,NA为阿伏加德罗常数。
3. 计算晶胞的体积。
4. 计算密度(常见晶胞的密度计算)。
晶胞
(铁)
(NaCl)
(干冰)
晶胞边长 a nm a pm a pm
晶胞体积/cm3 __________________ _____________________ _____________________
晶胞质量/g ______ ______ ______
晶体密度/(g/cm3) ___ ___ ___
[注意] 单位换算:1 pm=10-12 m=10-10 cm,1 nm=10-9 m=10-7 cm。
典 题 悟 法
(2024·江苏各地模拟重组)下列说法错误的是( )
A. Cu2O晶胞(如图1)中有4个铜原子
B. FeS2晶体(如图2)中每个Fe2+周围距离最近且相等的S数目为8
C. Na2S晶胞(如图3)中,每个Na+周围最近且距离相等的Na+有6个
D. 白磷晶体(如图4)中1个P4分子周围有12个紧邻的P4分子(如图4)
(1) (2024·南通三模)Li1-xFePO4晶胞中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构(如图1所示)。则x=____________。
图1
(2) (2023·淮阴、姜堰、徐州一中联考)ZnO存在多种晶体结构,其中纤锌矿型的晶体结构如图2所示,晶体中O2-的配位数为_______。
(3) (2024·苏锡常镇二模)CaF2晶胞(如图3)中F-周围距离最近的Ca2+形成的空间结构为_______________。
(4) (2024·南通二模)MgO-Al2O3晶胞结构如图4所示(B中镁原子未画出),用“·”标记出B中的镁原子。
图4
(5) (2024·如皋适应性一)VO2是一种相变材料,其一种晶胞(部分O原子未标出)的结构如图5所示,在图中合适位置补充其余O原子。
(6) (2024·扬州模拟)Cu2O晶胞投影如图6左图所示(沿x轴、y轴和z轴的投影都相同)。
图6
请在图6右图相应位置补全该晶胞图,晶胞内部距离最近的原子之间用虚线相连接。
(7) (2024·南京二模)β-FeSO4的晶胞沿c轴(c轴垂直于a、b轴)方向投影的平面图如图7所示,其中硫原子的杂化方式为_________;已知该晶胞中S原子的数目为4,试预测Fe2+是否占据该晶胞的所有顶点、面心和体心,并说明理由:_____________________________________________________________________ _______________________________________________________________________________________________________________。
(8) (2024·如东、前黄、姜堰中学联考)钾铁蓝的重复单元的结构如图8。
①K+周围距离相等且最近的CN-的个数为____________。
②设NA为阿伏加德罗常数的值,则晶体的密度为_______g/cm3(列出计算式,用含a、NA的代数式表示)。
考点2 晶体类型、结构与性质
知 识 梳 理
四种晶体类型比较
晶体类型 共价晶体 离子晶体 分子晶体 金属晶体
构成粒子 原子 阴、阳离子 分子 金属离子和自由电子
粒子间的作用力 共价键 离子键 范德华力(有些含氢键) 金属键
硬度 大 较大 较小 有的较小,有的较大
熔、沸点 高 较高 较低 有的较低,有的较高
导电、导热性 一般不具有导电性 晶体不导电,水溶液或熔融状态导电 一般不导电,溶于水后有的导电 电和热的良导体
物质类别及举例 金刚石、硅、硼、SiC、SiO2等 金属氧化物(如Na2O)、强碱(如KOH)、绝大部分盐(如NaCl) 大多数非金属单质、气态氢化物、酸、非金属氧化物(SiO2除外)、绝大多数有机物(有机盐除外) 金属单质(如Na、Al等)
晶体熔、沸点的比较
1. 不同类型晶体的熔、沸点高低的一般规律:共价晶体>离子晶体>分子晶体。如熔点:SiO2>NaCl>CO2。
2. 相同类型晶体
(1) 共价晶体:原子半径越小,键长越短,熔、沸点越高。如熔点:金刚石>碳化硅>硅。
(2) 离子晶体:阴、阳离子所带电荷数越多、离子半径越小,离子键越强,晶体的熔、沸点越高,如熔点:MgO>NaCl>KCl。
(3) 分子晶体:
①组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高;具有分子间氢键的分子晶体的熔、沸点反常的高。如沸点:GeH4>SiH4>CH4,但H2O>H2Se>H2S;NH3>AsH3>PH3、HF>HI>HBr>HCl。
②组成和结构不相似的分子晶体(相对分子质量接近),分子的极性越大,其熔、沸点越高。如沸点:CO>N2。
(4) 金属晶体:金属离子半径越小、离子所带电荷数越多,金属键越强,金属的熔、沸点越高,如熔点:Na<Mg<Al。
解疑释惑8
晶体类型的判断
1. 依据构成晶体的微粒和微粒间的作用判断。
2. 依据物质的分类判断。
3. 依据晶体的熔点判断。
(1) 共价晶体的熔点高(如金刚石的熔点为3 550 ℃)。
(2) 离子晶体的熔点较高(如MgO的熔点为2 800 ℃,NaCl的熔点为801 ℃)。
(3) 分子晶体的熔点低(如硫的熔点为112 ℃,沸点为444.6 ℃)。
(4) 金属晶体的熔点差异大,如金属钨的熔点为3 380 ℃,金属铯的熔点为28 ℃。
4. 依据导电性判断。
5. 依据硬度判断。
常见晶体结构模型
晶体 晶体结构 说明
离子晶体 NaCl
(型)
①Na+和Cl-之间的作用力为离子键,NaCl溶于水或熔融状态时,破坏离子键;
②每个晶胞中含___个Na+和___个Cl-;
③Na+的配位数为___,Cl-的配位数为___;
④每个Na+周围等距离且紧邻的Na+有______个,每个Cl-周围等距离且紧邻的Cl-有______个
CsCl
(型)
⑤每个晶胞中含___个Cs+、___个Cl-;
⑥Cs+的配位数为___,Cl-的配位数为___;
⑦每个Cs+周围等距离且紧邻的Cs+有___个,每个Cl-周围等距离且紧邻的Cl-有___个
离子晶体 立方ZnS
⑧S2-位于立方晶胞顶点和面心,Zn2+位于四条体对角线的处;
⑨每个晶胞中含___个Zn2+和___个S2-;
⑩Zn2+的配位数为___,Zn2+周围等距离且紧邻的S2-所围成的图形为正四面体形;
?S2-的配位数为___
分子晶体 干冰
①干冰中CO2分子之间的作用力为范德华力,CO2分子中C原子和O原子之间的作用力为_________,干冰升华时,克服的作用力是____________;
②CO2分子占据8个顶点和6个面心位置;
③每个CO2分子周围等距离且紧邻的CO2分子有______个
冰
④每个水分子与相邻的___个水分子以氢键相连接;
⑤含1 mol H2O的冰中,最多可形成___ mol氢键
共价晶体 金刚石
①每个碳原子与相邻4个碳原子以共价键结合,形成____________形结构,C原子为_________杂化,键长相等,键角为_____________________;
②最小碳环由6个碳原子构成,且6个碳原子不在同一平面内;
③C原子数与C—C数目之比为________,1 mol金刚石中含有___ mol C—C;
④晶体硅的结构与金刚石类似
共价晶体 SiO2
⑤每个Si原子与___个O原子以共价键结合,形成正四面体形结构;每个O原子与___个Si原子相连;
⑥1 mol SiO2中含有___ mol硅氧键
金属晶体 Po
①配位数为___
Cu、Ag、Au
②配位数为______
金属晶体 Na、K、Fe
③配位数为___ ⑤熔融时破坏_________
Mg、Zn、Ti
④配位数为______
混合型 晶体 石墨
①石墨层状晶体中,层内碳原子之间以_________结合,碳原子采取的杂化方式是_________。层与层之间的作用力是__________________。
②平均每个正六边形含有的碳原子个数是___,1 mol石墨中含有_________ mol碳碳键。
③石墨导电的原因:未参与杂化的2p电子的原子轨道相互平行且相互重叠,使p轨道的电子可在整个碳原子平面中运动
典 题 悟 法
(2024·江苏各地模拟重组)下列说法正确的是( )
A. H2、Li、NaH晶体类型相同
B. 硼、石墨、固态氮的晶体类型相同
C. Na2O、Mg的晶体类型相同
D. 前四周期的ⅦA族元素单质的晶体类型相同
(2024·如皋适应性二)BN是一种无机非金属材料,立方BN的硬度仅次于金刚石,其晶胞如图所示。下列说法错误的是( )
A. 立方BN属于共价晶体
B. 1个晶胞中含有4个B和4个N
C. 距离每个B最近的N有4个
D. 1 mol立方BN中含有2 mol共价键
考点3 配合物
知 识 梳 理
配位键
1. “电子对给予—接受”键称为配位键。常用“→”来表示配位键,箭头指向接受孤电子对的原子,如NH可表示为(NH中虽然有1个N—H形成过程与其他3个N—H形成过程不同,但是一旦形成之后,4个共价键完全相同。
2. 配位键也是σ键。
配位化合物
1. 定义:通常把金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物称为配位化合物,简称配合物。
2. 配合物的组成{以[Cu(NH3)4]SO4为例}
(1) 常见过渡金属中心原子(或离子):提供空轨道接受孤电子对的原子(或离子)。 如Co3+、Fe3+、Cu2+、Zn2+、Ag+等离子,Fe、Ni等原子。
(2) 常见配体:提供孤电子对的阴离子或分子。阴离子如F-、Cl-、OH-、CN-、SCN-、CO、C2O等;分子如H2O、NH3、CO、乙二胺(H2NCH2CH2NH2)等。
(3) 配位数:配位原子总的数目称为配位数,配位数与配离子所带电荷数之间的关系一般如下:
中心离子所带电荷 配位数 实例
+1 2 [Ag(NH3)2]+
2 [Cu(CN)2]-
+2 4 [Cu(NH3)4]2+
4 [Cu(OH)4]2-
4 [Zn(NH3)4]2+
+3 6 [Fe(SCN)6]3-
6 [Fe(H2O)6]3+
6 [Co(NH3)6]3+
单核配体的确认要注意是否带有电荷,如配合物[CoCl(NH3)5]Cl2的中心离子为Co3+,配体是Cl-和NH3,而不是氯原子。
配合物的制备
1. CuSO4溶液Cu(OH)2(蓝色沉淀)[Cu(NH3)4]2+(深蓝色),反应的离子方程式为____________________________________________________________、______________________________ __________________________________________________________________。
2. FeCl3溶液红色溶液,若所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数之比1∶1配合所得离子显红色,反应的离子方程式为______________________________________________________ ____________。
3. NaCl溶液AgCl(白色沉淀)[Ag(NH3)2]+,反应的离子方程式为_____________________ _____________________、_____________________________________________________________________。
特殊的配位体形成的配合物
1. 螯合配位体:一个配位体中的几个配位原子能直接和同一个金属离子配位,形成具有环状结构的配合物。如:
(1) 乙二胺与Cu2+形成的配离子如图1,该配离子中配位数为___,σ键数为______。
(2) EDTA(乙二胺四乙酸或乙二胺四乙酸二钠盐,见图2)配体中有___个配位原子。
图1
2. π键配位体:CO、环戊二烯基(C5H5—)等含有π键的配位体,常和过渡金属结合形成配合物。如金属羰基化合物(见图3)等。
典 题 悟 法
(2024·如东期中)由硫酸铜溶液制取[Cu(NH3)4]SO4·H2O的实验如下:
步骤1. 向盛有4 mL 0.1 mol/L蓝色CuSO4溶液的试管中,滴加几滴1 mol/L氨水,有蓝色沉淀生成;
步骤2. 继续滴加氨水并振荡试管,沉淀溶解,得到深蓝色溶液;
步骤3. 向试管中加入8 mL 95%乙醇,并用玻璃棒摩擦试管壁,有深蓝色晶体析出。
下列说法错误的是( )
A. CuSO4溶液呈蓝色的原因是因溶液中含有[Cu(H2O)4]2+
B. 步骤2发生反应的离子方程式为4NH3+Cu(OH)2===[Cu(NH3)4]2++2OH-
C. 步骤3中加入8 mL 95%乙醇是因为乙醇与水可形成分子间氢键,易溶于水
D. H2O与Cu2+的配位能力弱于NH3
考点4 超分子
知 识 梳 理
超分子
1. 定义:超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。
2. 重要特征:分子识别和自组装。
3. 实例
(1) “杯酚”分离C60和C70。
(2) 冠醚识别碱金属离子(如K+)。
典 题 悟 法
(2024·南通三模)一种杯酚的合成过程如图所示。该杯酚盛装C60后形成超分子。下列说法正确的是( )
A. 该杯酚的合成过程中发生了消去反应
B. 每合成1 mol该杯酚,消耗4 mol HCHO
C. 杯酚盛装C60形成的超分子中,存在范德华力和氢键
D. 该杯酚具有“分子识别”特性,能盛装多种碳单质
1. (2023·如皋期初)某太阳能光伏电池的有机半导材料晶胞结构如图所示,其中A为CH3NH,另两种离子为I-和Pb2+。下列说法正确的是( )
A. CH3NH中C和N的轨道杂化方式相同
B. X为Pb2+
C. 晶胞中距离A最近的X有6个
D. 该晶胞中含有8个A
2. (2024·苏锡常镇二模)实验室在如图所示的装置中制取NH3,将NH3通入CuSO4溶液,当生成的蓝色沉淀溶解为深蓝色溶液,再滴加乙醇可获得[Cu(NH3)4]SO4·H2O晶体。已知:[Cu(H2O)4]2+呈蓝色。下列说法不正确的是( )
A. 在装置甲试管中装入NH4Cl固体和Ca(OH)2固体加热制取NH3
B. 装置乙中的a和装置丙中的b均可防止倒吸
C. [Cu(NH3)4]SO4·H2O晶体在乙醇中的溶解度小于在水中的溶解度
D. 与NH3相比,H2O更易与Cu2+形成配位键
3. (2024·南外二模)冠醚是一种超分子,它能否适配碱金属离子与其空腔直径和离子直径有关。二苯并-18-冠-6与K+形成的螯合离子的结构如图所示。下列说法错误的是( )
A. 冠醚可以用来识别碱金属离子
B. 二苯并-18-冠-6也能适配Li+
C. 该冠醚分子中碳原子杂化方式有2种
D. 该鳌合离子中配位键的数目为6
4. (1) (2023·徐州期中)如图1所示晶胞中,阴、阳离子的个数之比为__________。
(2) (2024·扬州期末)GaN具有优异的光电性能,可由NH3与Ga(CH3)3发生反应制得。
①制得GaN时生成一种有机物的化学式为_________。
②GaN的一种晶胞如图2所示。晶体中距离Ga最近且相等的N原子数目为___。
第6讲 晶体 配合物
[备考导航]
(1) × (2) × (3) × (4) √ (5) × (6) × (7) × (8) × (9) √ (10) √
考点1
[知识梳理]
知识2 1. 6 8 12
2. (1) 6 正八面体 6 (2) 8 4 Ca2+ F- 4 8
知识3 4. (a×10-7)3 (a×10-10)3 (a×10-10)3
×2 ×4 ×4
[典题悟法]
典例1 B 【解析】 图1晶胞中灰球个数为4,白球个数为8×+1=2,根据化学式可知灰球为Cu,A正确;FeS2晶体中每个Fe2+周围距离最近且相等的S数目为6,B错误;图3晶胞中黑球个数为8,白球个数为8×+6×=4,根据化学式可知黑球表示Na+,每个Na+周围最近且距离相等的Na+有6个,C正确;由白磷晶胞结构图可知,与晶胞顶点距离最近且相等的白磷分子有3个,分别位于3个面心,为2个晶胞所共用,而晶胞顶点上的白磷分子为8个晶胞所共用,则晶体中与1个P4分子紧邻的P4分子有3×8×=12个,D正确。
典例2 (1) 0.25 (2) 4 (3) 正四面体形
(4) (5) (6)
(7) sp3 否,若Fe2+占据晶胞所有顶点、面心和体心,则Fe2+的数目为8×+6×+1=5,而S原子只有4个,不符合FeSO4的化学式 (8) ①4 ②
【解析】 (1) 由图示看出,Fe原子和P原子都位于O原子形成的空隙中,且该结构中含有4个正八面体和4个正四面体,故含有4个P原子、4个Fe原子、16个O原子,Li+的个数=8×+2×+4×=3,即1-x=, x=0.25。(2) ZnO中O2-与Zn2+配位数相等,由图可知,Zn2+与O2-的配位数均为4。(3) 由图可知,小黑点代表Ca2+,小白球代表F-,每个F-与4个Ca2+相连形成正四面体形结构。(4) A中含有Mg原子的个数=4×+1=1.5,O原子全部位于体内,故为4个,在B中Al原子、O原子都为4个,这样在A、B中共含有Mg原子1.5个、Al原子4个、O原子8个,结合晶胞化学式为MgO-Al2O3可知,在B中还应该含有0.5个Mg原子,故Mg原子位于立方体B的4个互不相邻的顶点上。(5) 晶胞中V的个数为1+8×=2,根据化学式VO2可知晶胞中O的个数为4,图中O的个数为2+2×=3,根据上下底面的对称性可知上下底面各还应有1个氧原子,晶胞图见答案。(6) 晶胞沿x轴、y轴、z轴的投影相同,晶胞的体心有一个小黑球,晶胞体内有4个白球,化学式为Cu2O,利用均摊法可知,小黑球代表O,白球代表Cu,晶胞图见答案。(7) 由图示看出,每个S原子形成4个共价键,故S原子采用sp3杂化。(8) ①K+位于体心,K+周围距离相等且最近的CN-个数为4。②晶胞中含有1个K+、1个Fe2+、1个Fe3+和6个CN-,晶胞质量为 g,体积为2a3×10-30 cm3,晶体的密度为 g/cm3。
考点2
[知识梳理] 知识3
[离子晶体] ②4 4 ③6 6 ④12 12 ⑤1 1 ⑥8 8 ⑦6 6 ⑨4 4 ⑩4 ?4
[分子晶体] ①共价键 范德华力 ③12 ④4 ⑤2
[共价晶体]
①正四面体 sp3 109°28′ ③1∶2 2 ⑤4 2 ⑥4
[金属晶体] ①6 ②12 ③8 ④12 ⑤金属键
[混合型晶体] ①共价键 sp2 分子间作用力 ②2 1.5
[典题悟法]
典例3 D 【解析】 H2、Li、NaH分别属于分子晶体、金属晶体、离子晶体,A错误;硼、石墨、固态氮分别属于共价晶体、混合型晶体、分子晶体,B错误;Na2O、Mg分别属于离子晶体、金属晶体,C错误;前四周期的ⅦA族元素单质都是分子晶体,D正确。
典例4 D 【解析】 立方BN的硬度仅次于金刚石,属于共价晶体,A正确;晶胞中位于顶点和面心的原子个数为8×+6×=4,位于内部的原子个数为4,1个晶胞中含有4个B和4个N,B正确;距离每个B最近的N有4个、距离每个N最近的B有4个,C正确;1 mol立方BN中含有4 mol共价键,D错误。
考点3
[知识梳理]
知识3
1. Cu2++2NH3·H2O===Cu(OH)2↓+2NH、Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-
2. Fe3++SCN-??[Fe(SCN)]2+
3. Cl-+Ag+===AgCl↓
AgCl+2NH3===[Ag(NH3)2]++Cl-
知识4 1. (1) 4 26 (2) 6
[典题悟法]
典例5 C 【解析】 含[Cu(H2O)4]2+的溶液呈蓝色,A正确;步骤3中加入乙醇的目的是降低溶剂的极性,促使[Cu(NH3)4]SO4·H2O晶体析出,C错误;CuSO4溶液加入过量氨水,[Cu(H2O)4]2+转化为[Cu(NH3)4]2+,则H2O与Cu2+的配位能力弱于NH3,D正确。
考点4
[典题悟法]
典例6 C 【解析】 该杯酚的合成过程中发生了缩聚反应,A错误;每合成1 mol该杯酚,消耗8 mol HCHO,B错误;杯酚盛装C60形成的超分子中,存在范德华力和氢键,C正确;该杯酚具有“分子识别”特性,只能盛装C60分子,而不能盛装其他碳单质,D错误。
[质量评价]
1. A 【解析】 CH3NH中C和N均采取sp3杂化,A正确;晶胞中A个数为8×=1,B个数为1,X个数为6×=3,根据化合物各元素化合价代数和为0可知,X为I-,B错误、D错误;晶胞中距离A最近的X有12个,C错误。
2. D 【解析】 NH3通入CuSO4溶液中生成深蓝色溶液,说明[Cu(H2O)4]2+转变为[Cu(NH3)4]2+,故NH3更易与Cu2+形成配位键,D错误。
3. B 【解析】 二苯并-18-冠-6与K+形成螯合离子,冠醚可以用来识别碱金属离子,A正确;冠醚能否适配碱金属离子与其空腔直径和离子直径有关,二苯并-18-冠-6能适配K+,而Li+半径明显小于K+,故不能适配Li+,B错误;该冠醚分子中苯环上碳采取sp2杂化,饱和碳原子采取sp3杂化,碳原子杂化方式有2种,C正确;由图可知,一个离子中配位键的数目为6,D正确。
4. (1) 1∶1 (2) ①CH4 ②4
【解析】 (1) 晶胞中Fe2+个数为12×+1=4,S个数为8×+6×=4,阴、阳离子的个数之比为1∶1。(2) ①由NH3与Ga(CH3)3发生反应制得GaN,根据原子守恒可知,另一种有机产物为CH4。②由晶胞结构可知,白球代表的原子个数=1+8×=2,黑球代表的原子个数=1+4×=2,该晶胞中两种原子个数之比为1∶1,若以晶胞内部白球为例,距离其最近且等距的黑球有4个,故距离Ga最近且相等的N的数目也为4。
备考导航
复习目标 1. 了解晶体类型及不同类型晶体中微粒间作用力的区别。
2. 了解分子晶体、共价晶体、离子晶体、金属晶体的结构与性质的关系。
3. 了解晶胞的概念,能根据晶胞确定晶体的组成并进行相关的计算。
4. 认识简单配合物的成键特征,了解配合物的存在与应用。
熟记网络
课前自测 判断正误(正确的打“√”,错误的打“×”)。
(1) (2023·江苏卷)碳单质、晶体硅、SiC均为共价晶体( )
(2) (2022·江苏卷)ⅣA族元素单质的晶体类型相同( )
(3) (2022·江苏卷)金刚石与石墨烯中的C—C—C夹角都为120°( )
(4) (2023·常州期中)1 mol金刚石含C—C数目约为2×6.02×1023( )
(5) (2023·河北卷)碱金属中Li的熔点最高,原因是碱金属中Li的价层电子数最少,金属键最强( )
(6) (2023·江苏卷)N2H4中的N原子与H+形成配位键,故N2H4具有还原性( )
(7) (2024·苏锡常镇二模)S2O(结构如图1)中2个S原子均可作配位原子( )
(8) (2023·扬州期中)可用图2表示Fe2Cl6的结构( )
(9) (2023·海南卷)图3制备[Cu(NH3)4]SO4·H2O晶体( )
(10) (2023·湖南卷)冠醚(18-冠-6)的空穴与K+尺寸适配,二者能通过弱相互作用形成超分子( )
考点1 晶胞微粒数的计算
知 识 梳 理
长方体(含立方体)晶胞中微粒数计算
晶胞中粒子配位数的计算
一个粒子周围最邻近的粒子的数目称为配位数。
1. 晶体中原子(或分子)的配位数:若晶体中的微粒为同种原子或同种分子,则某原子(或分子)的配位数指的是该原子(或分子)等距离且紧邻的原子(或分子)的数目。常见晶胞的配位数如表:
晶胞
配位数 ___ ___ ______
2. 离子晶体的配位数:指一个离子周围等距离且紧邻的异种电性离子的数目。
(1) NaCl晶体中,Cl-的配位数指的是每个Cl-周围等距离且紧邻的Na+的个数,Cl-的配位数为___,6个Na+所围成的图形为____________。Na+的配位数为___。
(2) 由图2可知,CaF2晶胞内黑球共有___个,白球共有___个,说明白球是____________,黑球是______。F-的配位数为___,Ca2+的配位数为___。
晶体密度的计算
1. 确定晶胞中各原子的个数和化学式。
2. 计算晶胞的质量:m=×N,其中M为晶体的摩尔质量,N为晶胞拥有的粒子数,NA为阿伏加德罗常数。
3. 计算晶胞的体积。
4. 计算密度(常见晶胞的密度计算)。
晶胞
(铁)
(NaCl)
(干冰)
晶胞边长 a nm a pm a pm
晶胞体积/cm3 __________________ _____________________ _____________________
晶胞质量/g ______ ______ ______
晶体密度/(g/cm3) ___ ___ ___
[注意] 单位换算:1 pm=10-12 m=10-10 cm,1 nm=10-9 m=10-7 cm。
典 题 悟 法
(2024·江苏各地模拟重组)下列说法错误的是( )
A. Cu2O晶胞(如图1)中有4个铜原子
B. FeS2晶体(如图2)中每个Fe2+周围距离最近且相等的S数目为8
C. Na2S晶胞(如图3)中,每个Na+周围最近且距离相等的Na+有6个
D. 白磷晶体(如图4)中1个P4分子周围有12个紧邻的P4分子(如图4)
(1) (2024·南通三模)Li1-xFePO4晶胞中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构(如图1所示)。则x=____________。
图1
(2) (2023·淮阴、姜堰、徐州一中联考)ZnO存在多种晶体结构,其中纤锌矿型的晶体结构如图2所示,晶体中O2-的配位数为_______。
(3) (2024·苏锡常镇二模)CaF2晶胞(如图3)中F-周围距离最近的Ca2+形成的空间结构为_______________。
(4) (2024·南通二模)MgO-Al2O3晶胞结构如图4所示(B中镁原子未画出),用“·”标记出B中的镁原子。
图4
(5) (2024·如皋适应性一)VO2是一种相变材料,其一种晶胞(部分O原子未标出)的结构如图5所示,在图中合适位置补充其余O原子。
(6) (2024·扬州模拟)Cu2O晶胞投影如图6左图所示(沿x轴、y轴和z轴的投影都相同)。
图6
请在图6右图相应位置补全该晶胞图,晶胞内部距离最近的原子之间用虚线相连接。
(7) (2024·南京二模)β-FeSO4的晶胞沿c轴(c轴垂直于a、b轴)方向投影的平面图如图7所示,其中硫原子的杂化方式为_________;已知该晶胞中S原子的数目为4,试预测Fe2+是否占据该晶胞的所有顶点、面心和体心,并说明理由:_____________________________________________________________________ _______________________________________________________________________________________________________________。
(8) (2024·如东、前黄、姜堰中学联考)钾铁蓝的重复单元的结构如图8。
①K+周围距离相等且最近的CN-的个数为____________。
②设NA为阿伏加德罗常数的值,则晶体的密度为_______g/cm3(列出计算式,用含a、NA的代数式表示)。
考点2 晶体类型、结构与性质
知 识 梳 理
四种晶体类型比较
晶体类型 共价晶体 离子晶体 分子晶体 金属晶体
构成粒子 原子 阴、阳离子 分子 金属离子和自由电子
粒子间的作用力 共价键 离子键 范德华力(有些含氢键) 金属键
硬度 大 较大 较小 有的较小,有的较大
熔、沸点 高 较高 较低 有的较低,有的较高
导电、导热性 一般不具有导电性 晶体不导电,水溶液或熔融状态导电 一般不导电,溶于水后有的导电 电和热的良导体
物质类别及举例 金刚石、硅、硼、SiC、SiO2等 金属氧化物(如Na2O)、强碱(如KOH)、绝大部分盐(如NaCl) 大多数非金属单质、气态氢化物、酸、非金属氧化物(SiO2除外)、绝大多数有机物(有机盐除外) 金属单质(如Na、Al等)
晶体熔、沸点的比较
1. 不同类型晶体的熔、沸点高低的一般规律:共价晶体>离子晶体>分子晶体。如熔点:SiO2>NaCl>CO2。
2. 相同类型晶体
(1) 共价晶体:原子半径越小,键长越短,熔、沸点越高。如熔点:金刚石>碳化硅>硅。
(2) 离子晶体:阴、阳离子所带电荷数越多、离子半径越小,离子键越强,晶体的熔、沸点越高,如熔点:MgO>NaCl>KCl。
(3) 分子晶体:
①组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高;具有分子间氢键的分子晶体的熔、沸点反常的高。如沸点:GeH4>SiH4>CH4,但H2O>H2Se>H2S;NH3>AsH3>PH3、HF>HI>HBr>HCl。
②组成和结构不相似的分子晶体(相对分子质量接近),分子的极性越大,其熔、沸点越高。如沸点:CO>N2。
(4) 金属晶体:金属离子半径越小、离子所带电荷数越多,金属键越强,金属的熔、沸点越高,如熔点:Na<Mg<Al。
解疑释惑8
晶体类型的判断
1. 依据构成晶体的微粒和微粒间的作用判断。
2. 依据物质的分类判断。
3. 依据晶体的熔点判断。
(1) 共价晶体的熔点高(如金刚石的熔点为3 550 ℃)。
(2) 离子晶体的熔点较高(如MgO的熔点为2 800 ℃,NaCl的熔点为801 ℃)。
(3) 分子晶体的熔点低(如硫的熔点为112 ℃,沸点为444.6 ℃)。
(4) 金属晶体的熔点差异大,如金属钨的熔点为3 380 ℃,金属铯的熔点为28 ℃。
4. 依据导电性判断。
5. 依据硬度判断。
常见晶体结构模型
晶体 晶体结构 说明
离子晶体 NaCl
(型)
①Na+和Cl-之间的作用力为离子键,NaCl溶于水或熔融状态时,破坏离子键;
②每个晶胞中含___个Na+和___个Cl-;
③Na+的配位数为___,Cl-的配位数为___;
④每个Na+周围等距离且紧邻的Na+有______个,每个Cl-周围等距离且紧邻的Cl-有______个
CsCl
(型)
⑤每个晶胞中含___个Cs+、___个Cl-;
⑥Cs+的配位数为___,Cl-的配位数为___;
⑦每个Cs+周围等距离且紧邻的Cs+有___个,每个Cl-周围等距离且紧邻的Cl-有___个
离子晶体 立方ZnS
⑧S2-位于立方晶胞顶点和面心,Zn2+位于四条体对角线的处;
⑨每个晶胞中含___个Zn2+和___个S2-;
⑩Zn2+的配位数为___,Zn2+周围等距离且紧邻的S2-所围成的图形为正四面体形;
?S2-的配位数为___
分子晶体 干冰
①干冰中CO2分子之间的作用力为范德华力,CO2分子中C原子和O原子之间的作用力为_________,干冰升华时,克服的作用力是____________;
②CO2分子占据8个顶点和6个面心位置;
③每个CO2分子周围等距离且紧邻的CO2分子有______个
冰
④每个水分子与相邻的___个水分子以氢键相连接;
⑤含1 mol H2O的冰中,最多可形成___ mol氢键
共价晶体 金刚石
①每个碳原子与相邻4个碳原子以共价键结合,形成____________形结构,C原子为_________杂化,键长相等,键角为_____________________;
②最小碳环由6个碳原子构成,且6个碳原子不在同一平面内;
③C原子数与C—C数目之比为________,1 mol金刚石中含有___ mol C—C;
④晶体硅的结构与金刚石类似
共价晶体 SiO2
⑤每个Si原子与___个O原子以共价键结合,形成正四面体形结构;每个O原子与___个Si原子相连;
⑥1 mol SiO2中含有___ mol硅氧键
金属晶体 Po
①配位数为___
Cu、Ag、Au
②配位数为______
金属晶体 Na、K、Fe
③配位数为___ ⑤熔融时破坏_________
Mg、Zn、Ti
④配位数为______
混合型 晶体 石墨
①石墨层状晶体中,层内碳原子之间以_________结合,碳原子采取的杂化方式是_________。层与层之间的作用力是__________________。
②平均每个正六边形含有的碳原子个数是___,1 mol石墨中含有_________ mol碳碳键。
③石墨导电的原因:未参与杂化的2p电子的原子轨道相互平行且相互重叠,使p轨道的电子可在整个碳原子平面中运动
典 题 悟 法
(2024·江苏各地模拟重组)下列说法正确的是( )
A. H2、Li、NaH晶体类型相同
B. 硼、石墨、固态氮的晶体类型相同
C. Na2O、Mg的晶体类型相同
D. 前四周期的ⅦA族元素单质的晶体类型相同
(2024·如皋适应性二)BN是一种无机非金属材料,立方BN的硬度仅次于金刚石,其晶胞如图所示。下列说法错误的是( )
A. 立方BN属于共价晶体
B. 1个晶胞中含有4个B和4个N
C. 距离每个B最近的N有4个
D. 1 mol立方BN中含有2 mol共价键
考点3 配合物
知 识 梳 理
配位键
1. “电子对给予—接受”键称为配位键。常用“→”来表示配位键,箭头指向接受孤电子对的原子,如NH可表示为(NH中虽然有1个N—H形成过程与其他3个N—H形成过程不同,但是一旦形成之后,4个共价键完全相同。
2. 配位键也是σ键。
配位化合物
1. 定义:通常把金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物称为配位化合物,简称配合物。
2. 配合物的组成{以[Cu(NH3)4]SO4为例}
(1) 常见过渡金属中心原子(或离子):提供空轨道接受孤电子对的原子(或离子)。 如Co3+、Fe3+、Cu2+、Zn2+、Ag+等离子,Fe、Ni等原子。
(2) 常见配体:提供孤电子对的阴离子或分子。阴离子如F-、Cl-、OH-、CN-、SCN-、CO、C2O等;分子如H2O、NH3、CO、乙二胺(H2NCH2CH2NH2)等。
(3) 配位数:配位原子总的数目称为配位数,配位数与配离子所带电荷数之间的关系一般如下:
中心离子所带电荷 配位数 实例
+1 2 [Ag(NH3)2]+
2 [Cu(CN)2]-
+2 4 [Cu(NH3)4]2+
4 [Cu(OH)4]2-
4 [Zn(NH3)4]2+
+3 6 [Fe(SCN)6]3-
6 [Fe(H2O)6]3+
6 [Co(NH3)6]3+
单核配体的确认要注意是否带有电荷,如配合物[CoCl(NH3)5]Cl2的中心离子为Co3+,配体是Cl-和NH3,而不是氯原子。
配合物的制备
1. CuSO4溶液Cu(OH)2(蓝色沉淀)[Cu(NH3)4]2+(深蓝色),反应的离子方程式为____________________________________________________________、______________________________ __________________________________________________________________。
2. FeCl3溶液红色溶液,若所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数之比1∶1配合所得离子显红色,反应的离子方程式为______________________________________________________ ____________。
3. NaCl溶液AgCl(白色沉淀)[Ag(NH3)2]+,反应的离子方程式为_____________________ _____________________、_____________________________________________________________________。
特殊的配位体形成的配合物
1. 螯合配位体:一个配位体中的几个配位原子能直接和同一个金属离子配位,形成具有环状结构的配合物。如:
(1) 乙二胺与Cu2+形成的配离子如图1,该配离子中配位数为___,σ键数为______。
(2) EDTA(乙二胺四乙酸或乙二胺四乙酸二钠盐,见图2)配体中有___个配位原子。
图1
2. π键配位体:CO、环戊二烯基(C5H5—)等含有π键的配位体,常和过渡金属结合形成配合物。如金属羰基化合物(见图3)等。
典 题 悟 法
(2024·如东期中)由硫酸铜溶液制取[Cu(NH3)4]SO4·H2O的实验如下:
步骤1. 向盛有4 mL 0.1 mol/L蓝色CuSO4溶液的试管中,滴加几滴1 mol/L氨水,有蓝色沉淀生成;
步骤2. 继续滴加氨水并振荡试管,沉淀溶解,得到深蓝色溶液;
步骤3. 向试管中加入8 mL 95%乙醇,并用玻璃棒摩擦试管壁,有深蓝色晶体析出。
下列说法错误的是( )
A. CuSO4溶液呈蓝色的原因是因溶液中含有[Cu(H2O)4]2+
B. 步骤2发生反应的离子方程式为4NH3+Cu(OH)2===[Cu(NH3)4]2++2OH-
C. 步骤3中加入8 mL 95%乙醇是因为乙醇与水可形成分子间氢键,易溶于水
D. H2O与Cu2+的配位能力弱于NH3
考点4 超分子
知 识 梳 理
超分子
1. 定义:超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。
2. 重要特征:分子识别和自组装。
3. 实例
(1) “杯酚”分离C60和C70。
(2) 冠醚识别碱金属离子(如K+)。
典 题 悟 法
(2024·南通三模)一种杯酚的合成过程如图所示。该杯酚盛装C60后形成超分子。下列说法正确的是( )
A. 该杯酚的合成过程中发生了消去反应
B. 每合成1 mol该杯酚,消耗4 mol HCHO
C. 杯酚盛装C60形成的超分子中,存在范德华力和氢键
D. 该杯酚具有“分子识别”特性,能盛装多种碳单质
1. (2023·如皋期初)某太阳能光伏电池的有机半导材料晶胞结构如图所示,其中A为CH3NH,另两种离子为I-和Pb2+。下列说法正确的是( )
A. CH3NH中C和N的轨道杂化方式相同
B. X为Pb2+
C. 晶胞中距离A最近的X有6个
D. 该晶胞中含有8个A
2. (2024·苏锡常镇二模)实验室在如图所示的装置中制取NH3,将NH3通入CuSO4溶液,当生成的蓝色沉淀溶解为深蓝色溶液,再滴加乙醇可获得[Cu(NH3)4]SO4·H2O晶体。已知:[Cu(H2O)4]2+呈蓝色。下列说法不正确的是( )
A. 在装置甲试管中装入NH4Cl固体和Ca(OH)2固体加热制取NH3
B. 装置乙中的a和装置丙中的b均可防止倒吸
C. [Cu(NH3)4]SO4·H2O晶体在乙醇中的溶解度小于在水中的溶解度
D. 与NH3相比,H2O更易与Cu2+形成配位键
3. (2024·南外二模)冠醚是一种超分子,它能否适配碱金属离子与其空腔直径和离子直径有关。二苯并-18-冠-6与K+形成的螯合离子的结构如图所示。下列说法错误的是( )
A. 冠醚可以用来识别碱金属离子
B. 二苯并-18-冠-6也能适配Li+
C. 该冠醚分子中碳原子杂化方式有2种
D. 该鳌合离子中配位键的数目为6
4. (1) (2023·徐州期中)如图1所示晶胞中,阴、阳离子的个数之比为__________。
(2) (2024·扬州期末)GaN具有优异的光电性能,可由NH3与Ga(CH3)3发生反应制得。
①制得GaN时生成一种有机物的化学式为_________。
②GaN的一种晶胞如图2所示。晶体中距离Ga最近且相等的N原子数目为___。
第6讲 晶体 配合物
[备考导航]
(1) × (2) × (3) × (4) √ (5) × (6) × (7) × (8) × (9) √ (10) √
考点1
[知识梳理]
知识2 1. 6 8 12
2. (1) 6 正八面体 6 (2) 8 4 Ca2+ F- 4 8
知识3 4. (a×10-7)3 (a×10-10)3 (a×10-10)3
×2 ×4 ×4
[典题悟法]
典例1 B 【解析】 图1晶胞中灰球个数为4,白球个数为8×+1=2,根据化学式可知灰球为Cu,A正确;FeS2晶体中每个Fe2+周围距离最近且相等的S数目为6,B错误;图3晶胞中黑球个数为8,白球个数为8×+6×=4,根据化学式可知黑球表示Na+,每个Na+周围最近且距离相等的Na+有6个,C正确;由白磷晶胞结构图可知,与晶胞顶点距离最近且相等的白磷分子有3个,分别位于3个面心,为2个晶胞所共用,而晶胞顶点上的白磷分子为8个晶胞所共用,则晶体中与1个P4分子紧邻的P4分子有3×8×=12个,D正确。
典例2 (1) 0.25 (2) 4 (3) 正四面体形
(4) (5) (6)
(7) sp3 否,若Fe2+占据晶胞所有顶点、面心和体心,则Fe2+的数目为8×+6×+1=5,而S原子只有4个,不符合FeSO4的化学式 (8) ①4 ②
【解析】 (1) 由图示看出,Fe原子和P原子都位于O原子形成的空隙中,且该结构中含有4个正八面体和4个正四面体,故含有4个P原子、4个Fe原子、16个O原子,Li+的个数=8×+2×+4×=3,即1-x=, x=0.25。(2) ZnO中O2-与Zn2+配位数相等,由图可知,Zn2+与O2-的配位数均为4。(3) 由图可知,小黑点代表Ca2+,小白球代表F-,每个F-与4个Ca2+相连形成正四面体形结构。(4) A中含有Mg原子的个数=4×+1=1.5,O原子全部位于体内,故为4个,在B中Al原子、O原子都为4个,这样在A、B中共含有Mg原子1.5个、Al原子4个、O原子8个,结合晶胞化学式为MgO-Al2O3可知,在B中还应该含有0.5个Mg原子,故Mg原子位于立方体B的4个互不相邻的顶点上。(5) 晶胞中V的个数为1+8×=2,根据化学式VO2可知晶胞中O的个数为4,图中O的个数为2+2×=3,根据上下底面的对称性可知上下底面各还应有1个氧原子,晶胞图见答案。(6) 晶胞沿x轴、y轴、z轴的投影相同,晶胞的体心有一个小黑球,晶胞体内有4个白球,化学式为Cu2O,利用均摊法可知,小黑球代表O,白球代表Cu,晶胞图见答案。(7) 由图示看出,每个S原子形成4个共价键,故S原子采用sp3杂化。(8) ①K+位于体心,K+周围距离相等且最近的CN-个数为4。②晶胞中含有1个K+、1个Fe2+、1个Fe3+和6个CN-,晶胞质量为 g,体积为2a3×10-30 cm3,晶体的密度为 g/cm3。
考点2
[知识梳理] 知识3
[离子晶体] ②4 4 ③6 6 ④12 12 ⑤1 1 ⑥8 8 ⑦6 6 ⑨4 4 ⑩4 ?4
[分子晶体] ①共价键 范德华力 ③12 ④4 ⑤2
[共价晶体]
①正四面体 sp3 109°28′ ③1∶2 2 ⑤4 2 ⑥4
[金属晶体] ①6 ②12 ③8 ④12 ⑤金属键
[混合型晶体] ①共价键 sp2 分子间作用力 ②2 1.5
[典题悟法]
典例3 D 【解析】 H2、Li、NaH分别属于分子晶体、金属晶体、离子晶体,A错误;硼、石墨、固态氮分别属于共价晶体、混合型晶体、分子晶体,B错误;Na2O、Mg分别属于离子晶体、金属晶体,C错误;前四周期的ⅦA族元素单质都是分子晶体,D正确。
典例4 D 【解析】 立方BN的硬度仅次于金刚石,属于共价晶体,A正确;晶胞中位于顶点和面心的原子个数为8×+6×=4,位于内部的原子个数为4,1个晶胞中含有4个B和4个N,B正确;距离每个B最近的N有4个、距离每个N最近的B有4个,C正确;1 mol立方BN中含有4 mol共价键,D错误。
考点3
[知识梳理]
知识3
1. Cu2++2NH3·H2O===Cu(OH)2↓+2NH、Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-
2. Fe3++SCN-??[Fe(SCN)]2+
3. Cl-+Ag+===AgCl↓
AgCl+2NH3===[Ag(NH3)2]++Cl-
知识4 1. (1) 4 26 (2) 6
[典题悟法]
典例5 C 【解析】 含[Cu(H2O)4]2+的溶液呈蓝色,A正确;步骤3中加入乙醇的目的是降低溶剂的极性,促使[Cu(NH3)4]SO4·H2O晶体析出,C错误;CuSO4溶液加入过量氨水,[Cu(H2O)4]2+转化为[Cu(NH3)4]2+,则H2O与Cu2+的配位能力弱于NH3,D正确。
考点4
[典题悟法]
典例6 C 【解析】 该杯酚的合成过程中发生了缩聚反应,A错误;每合成1 mol该杯酚,消耗8 mol HCHO,B错误;杯酚盛装C60形成的超分子中,存在范德华力和氢键,C正确;该杯酚具有“分子识别”特性,只能盛装C60分子,而不能盛装其他碳单质,D错误。
[质量评价]
1. A 【解析】 CH3NH中C和N均采取sp3杂化,A正确;晶胞中A个数为8×=1,B个数为1,X个数为6×=3,根据化合物各元素化合价代数和为0可知,X为I-,B错误、D错误;晶胞中距离A最近的X有12个,C错误。
2. D 【解析】 NH3通入CuSO4溶液中生成深蓝色溶液,说明[Cu(H2O)4]2+转变为[Cu(NH3)4]2+,故NH3更易与Cu2+形成配位键,D错误。
3. B 【解析】 二苯并-18-冠-6与K+形成螯合离子,冠醚可以用来识别碱金属离子,A正确;冠醚能否适配碱金属离子与其空腔直径和离子直径有关,二苯并-18-冠-6能适配K+,而Li+半径明显小于K+,故不能适配Li+,B错误;该冠醚分子中苯环上碳采取sp2杂化,饱和碳原子采取sp3杂化,碳原子杂化方式有2种,C正确;由图可知,一个离子中配位键的数目为6,D正确。
4. (1) 1∶1 (2) ①CH4 ②4
【解析】 (1) 晶胞中Fe2+个数为12×+1=4,S个数为8×+6×=4,阴、阳离子的个数之比为1∶1。(2) ①由NH3与Ga(CH3)3发生反应制得GaN,根据原子守恒可知,另一种有机产物为CH4。②由晶胞结构可知,白球代表的原子个数=1+8×=2,黑球代表的原子个数=1+4×=2,该晶胞中两种原子个数之比为1∶1,若以晶胞内部白球为例,距离其最近且等距的黑球有4个,故距离Ga最近且相等的N的数目也为4。
同课章节目录
