4.3化学方程式---2024-2025学年2024科粤版化学九年级上册教学同步课件
文档属性
| 名称 | 4.3化学方程式---2024-2025学年2024科粤版化学九年级上册教学同步课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-15 16:37:03 | ||
图片预览










文档简介
(共45张PPT)
4.3化学方程式
第四单元 化学式与化学方程式
科粤2024版化学九年级上册【精做课件】
授课教师:********
班 级:********
时 间:********
、教学方法
讲授法:系统讲解化学方程式的概念、意义、书写原则和计算方法等重要知识,确保学生理解基础知识。
讨论法:组织学生分组讨论化学方程式的书写和计算过程中遇到的问题,激发学生的思维,促进学生之间的交流与合作。
练习法:通过课堂练习和课后作业,让学生巩固所学的化学方程式知识,熟练掌握书写和计算技能,提高解题能力。
多媒体辅助教学法:运用图片、动画、视频等多媒体资源,展示化学反应的微观过程、化学方程式的书写步骤等,将抽象知识直观化,帮助学生理解和记忆。
四、教学准备
多媒体设备:电脑、投影仪。
教学资料:制作关于化学方程式的 PPT,包括化学反应的微观示意图、化学方程式书写和计算的例题及练习题等。
学习资料:为学生准备导学案,包含学习目标、知识点梳理、课堂练习和课后作业等内容。
五、教学过程
(一)情境导入(5 分钟)
通过 PPT 展示氢气在氧气中燃烧的实验图片,提问学生:“同学们,我们之前学习过氢气燃烧生成水的反应,那么如何用一种简洁、准确的方式来表示这个化学反应呢?” 引导学生思考化学反应的表达方式,激发学生的学习兴趣。
展示用文字表达式和符号表达式表示氢气燃烧反应的内容,对比分析它们的优缺点,引出本节课的主题 —— 化学方程式。
(二)化学方程式的概念与意义(10 分钟)
概念讲解:展示氢气燃烧的化学方程式
2H
2
+O
2
===
c
\c
1
c
\c
2H
2
O
,讲解化学方程式的概念:用化学式来表示化学反应的式子,叫做化学方程式。强调化学方程式不仅表明了反应物、生成物和反应条件,还体现了各物质之间的质量关系。
意义分析:从质和量两个方面分析化学方程式的意义。
质的方面:表示反应物、生成物和反应条件。如
2H
2
+O
2
===
c
\c
1
c
\c
2H
2
O
表示氢气和氧气在点燃的条件下反应生成水。
量的方面:微观上,表示各物质之间的粒子个数比。在该化学方程式中,氢气、氧气和水的分子个数比为
2:1:2
;宏观上,表示各物质之间的质量比。通过相对分子质量计算,氢气、氧气和水的质量比为
(2
A
~
2):32:(2
A
~
18)=1:8:9
。
互动讨论:展示几个常见的化学方程式,如
C+O
2
===
c
\c
1
c
\c
CO
2
、
2KMnO
4
===
△
K
2
MnO
4
+MnO
2
+O
2
a
^
,让学生分组讨论这些化学方程式所表达的意义,邀请小组代表发言,分享讨论结果,教师进行点评和补充。
(三)化学方程式的书写(15 分钟)
书写原则:讲解书写化学方程式需要遵循的两个原则:一是必须以客观事实为基础,绝不能凭空臆想、臆造事实上不存在的物质和化学反应;二是要遵守质量守恒定律,等号两边各原子的种类与数目必须相等。
书写步骤:以磷在氧气中燃烧生成五氧化二磷的反应为例,详细讲解化学方程式的书写步骤。
写:根据实验事实,写出反应物和生成物的化学式,中间用短线连接。
P+O
2
a
^
a
^
P
2
O
5
配:配平化学方程式,在化学式前面配上适当的化学计量数,使等号两边各原子的种类和数目相等。
4P+5O
2
a
^
a
^
2P
2
O
5
注:注明反应条件和生成物的状态。如果反应物中没有气体,而生成物中有气体,在气体物质的化学式右边要注 “↑” 号;溶液中的反应如果生成物中有固体,在固体物质的化学式右边要注 “↓” 号。
4P+5O
2
===
c
\c
1
c
\c
2P
2
O
5
查:检查化学式是否正确,化学方程式是否配平,条件和物质状态是否标注正确。
练习巩固:让学生书写几个常见化学反应的化学方程式,如铁在氧气中燃烧、过氧化氢分解制取氧气等,教师巡视指导,及时纠正学生在书写过程中出现的错误。
(四)利用化学方程式的简单计算(20 分钟)
例题讲解:展示例题:加热分解 6.3g 高锰酸钾,可以得到氧气的质量是多少?讲解解题步骤:
设:设未知量。设可以得到氧气的质量为
x
。
写:写出反应的化学方程式。
2KMnO
4
===
△
K
2
MnO
4
+MnO
2
+O
2
a
^
算:算出相关物质的相对分子质量总和以及已知量和未知量的相对质量比。
2KMnO
4
的相对分子质量总和为
2
A
~
(39+55+16
A
~
4)=316
,
O
2
的相对分子质量为
16
A
~
2=32
。
列:列出比例式求解。
32
316
=
x
6.3g
解:解比例式,求出未知量。
x=
316
32
A
~
6.3g
a
^
0.6g
答:简明地写出答案。答:可以得到氧气的质量约为 0.6g。
规范强调:强调解题过程中的规范要求,如设未知数时不带单位,计算过程中要带单位,结果要按照题目要求保留适当的小数位数等。
小组练习:将学生分成小组,每个小组给定一个化学方程式计算问题,如实验室用锌和稀硫酸反应制取氢气,若要制取 0.4g 氢气,需要锌的质量是多少?让学生按照解题步骤进行计算,各小组完成后,进行组间交流和评价,教师进行指导和总结。
(五)课堂小结(5 分钟)
请学生回顾本节课的主要内容,包括化学方程式的概念、意义、书写原则和步骤,以及利用化学方程式进行计算的方法和步骤。
教师进行总结和补充,强调重点和难点知识,帮助学生梳理知识脉络,形成完整的知识体系。
(六)课堂练习(5 分钟)
展示几道与本节课内容相关的练习题,如关于化学方程式意义理解的选择题、化学方程式书写正误判断的题目、利用化学方程式进行计算的填空题等。
选择题:化学方程式
2H
2
O
===
e
ˊ
c
\c
2H
2
a
^
+O
2
a
^
不能表示的意义是( )
A. 水在通电的条件下分解生成氢气和氧气
B. 每 36 份质量的水完全分解生成 4 份质量的氢气和 32 份质量的氧气
C. 每 2 个水分子在通电的条件下生成 2 个氢分子和 1 个氧分子
D. 氢气和氧气在点燃的条件下反应生成水
判断题:判断下列化学方程式书写是否正确,错误的请改正。
①
Mg+O
2
===
c
\c
1
c
\c
MgO
2
②
C+O
2
=CO
2
计算题:工业上,高温煅烧石灰石(主要成分是
CaCO
3
)可制得生石灰(
CaO
)和二氧化碳。如果要制取 5.6t 氧化钙,需要碳酸钙的质量是多少?
让学生独立完成练习,教师进行点评和讲解,及时反馈学生的学习情况,强化学生对知识的掌握。
六、板书设计
4.3 化学方程式
化学方程式的概念:用化学式表示化学反应的式子。
化学方程式的意义
质的方面:反应物、生成物、反应条件。
量的方面:微观粒子个数比、宏观质量比。
化学方程式的书写
原则:以客观事实为基础,遵守质量守恒定律。
步骤:写、配、注、查。
利用化学方程式的计算
步骤:设、写、算、列、解、答。
七、教学反思
通过本节课的教学,学生对化学方程式的知识有了较为系统的认识,掌握了化学方程式的书写和计算方法。在教学过程中,通过多媒体展示、例题讲解、小组练习等多种教学方法,提高了学生的学习效果。但部分学生在化学方程式的配平以及计算过程中仍存在一些问题,需要在后续的教学中加强练习和指导,进一步帮助学生理解和掌握化学方程式知识,提高学生的化学应用能力和学科素养。
5
课堂检测
4
新知讲解
6
变式训练
7
考试考法
8
小结梳理
学习目录
1
复习引入
2
新知讲解
3
典例讲解
问题探讨
这个化学反应有没有一个国际通用的表达方法
What do these words mean?
新课探究
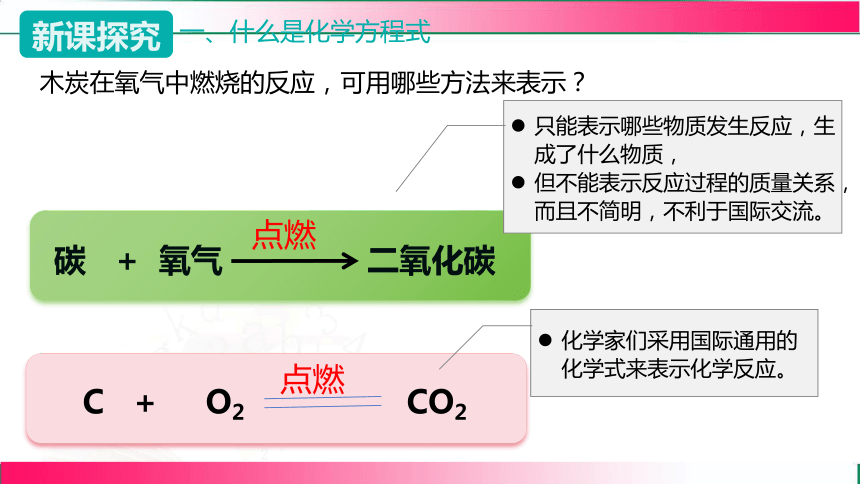
一、什么是化学方程式
木炭在氧气中燃烧的反应,可用哪些方法来表示?
碳 + 氧气 二氧化碳
点燃
C + O2 CO2
点燃
只能表示哪些物质发生反应,生成了什么物质,
但不能表示反应过程的质量关系,而且不简明,不利于国际交流。
化学家们采用国际通用的化学式来表示化学反应。
新课探究
一、什么是化学方程式
C + O2 CO2
点燃
1.定义
用化学式表示化学反应的式子,叫作化学方程式
又叫反应方程式
简称反应式
反应物
生成物
反应条件
化学方程式有什么意义呢?
新课探究
一、什么是化学方程式
2.化学方程式的意义
化学方程式表明了反应物、生成物和反应条件。
宏观
表示碳和氧气在点燃的条件下,生成二氧化碳
定性视角
C + O2 CO2
点燃
反应物
反应条件
生成物
化学方程式表示了反应中构成各物质的微观粒子间的数量关系
微观
表示在点燃的条件下,每1个碳原子和1个氧分子生成1个二氧化碳分子
构成各物质的微观粒子
C + O2 CO2
1
1
1
一个碳原子
微粒个数比 1 : 1 : 1
一个氧分子
一个二氧化碳分子
化学计量数为1,省略
定量视角
新课探究
一、什么是化学方程式
2.化学方程式的意义
表示各物质之间的质量关系
宏观
表示在点燃的条件下,每12份质量的碳和32份质量的氧气生成44份质量的二氧化碳
微粒个数比 1 : 1 : 1
C + O2 CO2
物质质量比 12 : 32 : 44
(质量比=化学计量数×相对分子质量)
相对分子质量12 2×16 12+2×16
定量视角
1
1
1
化学计量数:表示反应中分子个数比,1可以省略
新课探究
一、什么是化学方程式
讨论与交流 >>>
①根据电解水的化学方程式:2H2O === 2H2↑+O2↑,说出该反应式可以表示哪些含义。
通电
2个水分子通电条件下,分解生成2个氢分子和1个氧分子;
每36份质量的水完全反应生成4份质量的氢气和32份质量的氧气。
定性:
定量:
微观粒子个数比
2 : 2 : 1
物质质量比
2×18
2×2
32
:
:
36 : 4 : 32
质量守恒
36 = 4 + 32
水在通电条件下生成氢气和氧气
反应物总质量等于生成物总质量
新课探究
一、什么是化学方程式
讨论与交流 >>>
②你认为书写化学方程式的依据是什么?
书写化学方程式应以客观事实为依据,并遵循质量守恒定律。
新课探究
一、什么是化学方程式
总结
表示反应物、生成物之间的微观粒子个数比
表示反应物、生成物、反应条件
定性
表示反应物和生成物间的质量比
定量
即化学式前面的化学计量数之比
各物质之间的质量比=相对分子质量(或相对原子质量)与化学计量数的乘积之比
遵循质量守恒定律:反应物和生成物的质量相等
新课探究
二、怎样书写化学方程式
①以科学实验的事实为根据
写出反应物和生成物的化学式,以及反应条件
②以质量守恒定律为根据
等号两边各种原子的种类和数目必须相同
1. 原 则
新课探究
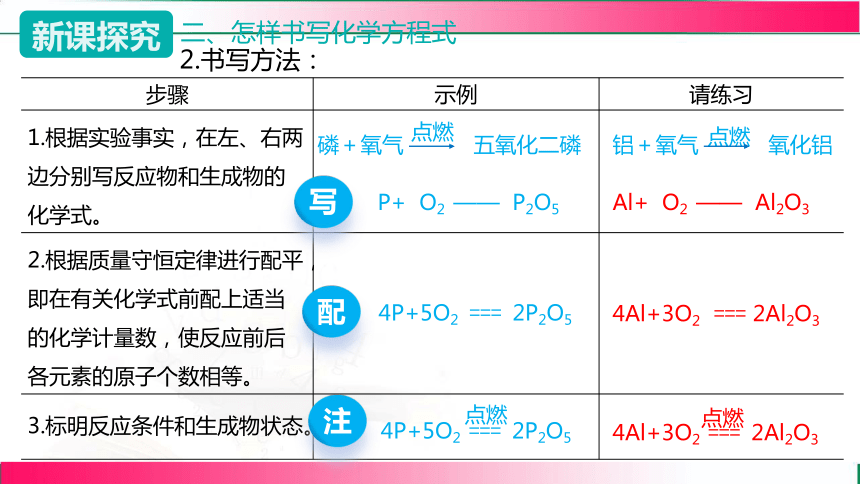
二、怎样书写化学方程式
步骤 示例 请练习
1.根据实验事实,在左、右两边分别写反应物和生成物的化学式。
2.根据质量守恒定律进行配平,即在有关化学式前配上适当的化学计量数,使反应前后各元素的原子个数相等。
3.标明反应条件和生成物状态。
磷+氧气 五氧化二磷
点燃
P+ O2 —— P2O5
4P+5O2 === 2P2O5
4P+5O2 === 2P2O5
点燃
铝+氧气 氧化铝
点燃
Al+ O2 —— Al2O3
4Al+3O2 === 2Al2O3
4Al+3O2 === 2Al2O3
点燃
写
配
注
2.书写方法:
新课探究
二、怎样书写化学方程式
最小公倍数法配平化学方程式
4P + 5O2 === 2P2O5
4P + 5O2 === 2P2O5
点燃
P2O5前配2,O2前配5
P + O2 —— P2O5
①左边写反应物化学式,右边写生成物化学式
②配平
③标明反应条件
适用范围
式子两边个数最多,相差大的原子
方法指导
求最小公倍数: 2×5=10
求化学计量数
配平其它化学计量数
右边是5个O原子,左边是2个O原子,最小公倍数是10
因而P前配4。
新课探究
二、怎样书写化学方程式
拓展:观察法
观察等式两边化学式构成上的变化
入手点
方法指导
Fe3O4 + CO Fe+ CO2
高温
CO和CO2相差1个O
Fe3O4失去4个O
3
4
4
CO CO2
得到1个O
新课探究
二、怎样书写化学方程式
拓展:设一法
找到等式两边原子个数最多的化学式
入手点
方法指导
C2H2 + O2 CO2 + H2O
点燃
设其化学式的系数为1
先暂定分数,再去分母
2
配平顺序:C、H、O
2
5
2
5
4
2
新课探究
二、怎样书写化学方程式
如果反应物中没有气体,而生成物有气体,则后者用“↑”号标明;
2KMnO4 === K2MnO4 + MnO2 + O2↑
2NaOH+ CuSO4===Na2SO4 + Cu(OH)2↓
溶液中的反应,如果反应物中没有难溶物质,而在生成物中有沉淀,则后者用“↓”号标明。
3. 注:符号“↑” 和“↓” 的使用
“无中生有”才标
两边都有不用标
新课探究
二、怎样书写化学方程式
用化学式表示化学反应的式子,可以表示反应中的质量关系、比例关系。
书写时要根据事实并注意配平,适当标明反应条件和生成物状态。
符号 + === ↑ ↓
意义 与、和或跟 反应生成 加热 该生成物是气体 该生成物是沉淀
表4-2 化学方程式所用符号
化学方程式
书写化学方程式
新课探究
二、怎样书写化学方程式
1. 写出KClO3在 MnO2催化下加热分解成KCl和O2的化学方程式:_____________________________
2、在化学方程式2XY2+Y2==2Z中,代号Z的化学式是( )
A. XY B. XY2 C. X2Y D. XY3
2KClO3 ==== 2KCl+3O2↑
MnO2
D
新课探究
三、怎样根据化学方程式进行计算
进行化学计算,从质量关系与比例关系的角度探究化学变化。
例如:投入一定质量的原料(反应物),可以生产多少产品(生成物),
或反过来计算要生产一定质量的产品,应投放多少原料等。
化学方程式计算依据:
还能表示各反应物与生成物之间的质量关系;
质量守恒定律:
注意:按化学方程式的反应物或生成物进行计算时都必须是纯净物的质量。
反应物的质量总和与生成物质量总和相等的规律
质量比:
新课探究
三、怎样根据化学方程式进行计算
1. 根据反应物的质量求生成物的质量
例1 在实验室中,将含有13.6 g过氧化氢的溶液与少量二氧化锰混合,求过氧化氢完全分解生成的氧气质量是多少。
解题步骤
(1)设未知量
(2)确定根据,即写出化学方程式
(3)找相关量,即列出与计算相关的量
(4)列比例式
(5)求未知量
(6)回答问题
答:可生成6.4 g氧气。
解:设生成氧气的质量为x。
2×34 32
13.6 g x
2×34
32
13.6g
x
———=——
2H2O2 === 2H2O+O2↑
MnO2
x=—————= 6.4 g
32×13.6 g
2×34
书写格式
新课探究
三、怎样根据化学方程式进行计算
2、根据生成物的质量求反应物的质量
例2 用加热氯酸钾与少量二氧化锰混合物的方法,制得氧气9.6 g,求被分解的氯酸钾的质量是多少。
解题步骤
(1)设未知量
(2)写反应式
(3)找相关量
(4)列比例式
(5)求未知量
(6)回答问题
答:被分解的氯酸钾的质量为24.5 g。
解:设被分解的氯酸钾的质量为x。
245 96
x 9.6 g
245
96
x
9.6 g
———=——
2KClO3 === 2KCl + 3O2↑
MnO2
△
x=—————= 24.5 g
245×9.6 g
96
练习解答
新课探究
三、怎样根据化学方程式进行计算
3. 反应物(或生成物)之间质量互求
例3 工业上高温煅烧石灰石(按CaCO3纯净物计算),可制得生石灰(按CaO纯净物计算),同时会产生大量的二氧化碳。试计算每制得100 t 氧化钙的同时会产生二氧化碳多少吨。
解题步骤
(1)设未知量
(2)写反应式
(3)找相关量
(4)列比例式
(5)求未知量
(6)回答问题
解:产生二氧化碳多少吨的质量为x。
56 44
100 t x
56
44
100 t
x
———=——
CaCO3 === CaO + CO2↑
高温
x=————— ≈ 78.6 t
44×100 t
56
练习解答
答:产生二氧化碳多少吨的质量为78.6 t。
新课探究
三、怎样根据化学方程式进行计算
拓展: 含杂质的质量计算
例4 工业上,煅烧含有杂质10%CaCO3可制得生石灰(CaO)和二氧化碳。如果要制取 5.6t 氧化钙,需要碳酸钙的质量是多少?
在实际生产和科学研究中,所用原料很多是不纯的,在进行计算时应考虑杂质问题。
物质的纯度(质量分数)=
纯物质的质量
含杂质的物质的质量
×100%
纯物质的质量=含杂质的物质的质量×物质的纯度(质量分数)
新课探究
三、怎样根据化学方程式进行计算
拓展: 含杂质的质量计算
例4 工业上,煅烧含有杂质10%CaCO3可制得生石灰(CaO)和二氧化碳。如果要制取 5.6t 氧化钙,需要碳酸钙的质量是多少?
解:设需要含有杂质10%碳酸钙的质量为x。
高温
CaCO3 CaO + CO2↑
56
100
(1-10%)x
5.6t
100
(1-10%)x
=
5.6t
56
x=11.1t
答:需要11.1t的碳酸钙。
新课探究
三、怎样根据化学方程式进行计算
根据化学方程式的计算
设未知量为x(不带单位)
回答问题
写出反应的方程式(注意配平)
列出比例式
找出已知量和未知量的质量关系
设
写
找
列
答
求未知量
求
新课探究
三、怎样根据化学方程式进行计算
注意问题
①设未知量时一定要写上“质量”二字,未知数后面不带单位;
②写出化学方程式一定要注意配平,注意化学方程式的完整;
③一定要注意用相关物质的化学计量数乘以相对分子质量,写在相应化学式的下面;
④求解出未知数的值后要带上单位。
名师点金
1. 化学方程式的意义:(1)宏观视角:表示反应物、生成物
及反应条件。(2)微观视角:①表示反应物、生成物各物
质之间的质量比,即相对分子质量与化学计量数乘积之
比;②表示反应物、生成物各物质之间的粒子个数比。
2. 书写化学方程式要遵循两个原则:(1)科学实验的事实。
(2)质量守恒定律。
知识点1 化学方程式的意义与读法
1. 下图中四名同学正在讨论某一个化学方程式的意义,他们
所描述的化学方程式是( C )
1
2
3
4
5
6
7
8
9
10
11
12
【答案】 C
1
2
3
4
5
6
7
8
9
10
11
12
返回
2. [2023·东营改编]下列关于3Fe+2O2 Fe3O4的叙述
中,正确的是( C )
A. 该反应可读作铁加氧气等于四氧化三铁
B. 参加反应的铁和氧气的质量比为3∶2
C. 如果把反应条件“点燃”去掉,这个反应不符合客观
事实
D. 上述反应中10 g Fe和10 g O2反应,能生成20 g Fe3O4
1
2
3
4
5
6
7
8
9
10
11
12
【点拨】该反应读作铁和氧气在点燃条件下生成四氧化三铁,A错误;参加反应的铁和氧气的质量比为(3×56)∶(2×32)=21∶8,B错误;如果把反应条件“点燃”去掉,反应不符合客观事实,C正确;每168份质量的铁和64份质量的氧气在点燃条件下恰好反应生成232份质量的四氧化三铁,上述反应中10 g Fe和10 g O2反应,氧气有剩余,不能生成20 g Fe3O4,D错误。
【答案】 C
1
2
3
4
5
6
7
8
9
10
11
12
返回
知识点2 化学方程式的书写
3. 下列化学方程式书写正确的是( D )
1
2
3
4
5
6
7
8
9
10
11
12
【点拨】A项化学方程式缺少反应条件,正确的化学方程
式应为4P+5O2 2P2O5,A错误;铝粉在空气中燃
烧生成氧化铝,正确的化学方程式应为4Al+3O2
2Al2O3,B错误;铁丝在氧气中燃烧生成四氧化三铁,正
确的化学方程式应为3Fe+2O2 Fe3O4,C错误。
【答案】 D
1
2
3
4
5
6
7
8
9
10
11
12
返回
4. [2024·昆明一模]汽车通常采用催化净化装置将尾气中的有
害物质转化为无毒物质再排放。其主要反应原理为2NO+
2CO X+2CO2,其中X的化学式为( B )
A. O2 B. N2
C. H2O D. H2
1
2
3
4
5
6
7
8
9
10
11
12
【点拨】由反应的化学方程式2NO+2CO X+
2CO2可知,反应前N、C、O原子的个数分别为2、2、4,
反应后已知的生成物中N、C、O原子的个数分别为0、
2、4。根据质量守恒定律,化学反应前后原子的种类和数
目不变,则1个X分子中含有2个氮原子,所以X的化学式
为N2。
【答案】 B
1
2
3
4
5
6
7
8
9
10
11
12
返回
5. [2022·天津]写出下列反应的化学方程式。
(1)碳在氧气中充分燃烧: 。
(2)锌与稀硫酸反应(生成硫酸锌和氢气):
。
(3)高锰酸钾制氧气:
。
C+O2 CO2
Zn + H2SO4
ZnSO4 + H2↑
2KMnO4 K2MnO4+MnO2+
O2↑
1
2
3
4
5
6
7
8
9
10
11
12
返回
知识点3 化学方程式的配平
6. 将下列化学方程式补充完整。
(1) Al+ O2 Al2O3
(2) Fe2O3+ H2SO4 Fe2(SO4)3
+ H2O
(3) C3H8+ O2 CO2+ H2O
4
3
2
1
3
1
3
1
5
3
4
1
2
3
4
5
6
7
8
9
10
11
12
(4) CO+ Fe3O4 Fe+ CO2
(5) FeS2+ O2 Fe2O3+ SO2
4
1
3
4
4
11
2
8
1
2
3
4
5
6
7
8
9
10
11
12
返回
纠易错 不能正确计算化学方程式中各物质的质量比
7. [2023·海南期末]在反应C2H4+3O2 2CO2+2H2O
中,各物质间的质量比为( C )
A. 1∶3∶2∶2 B. 28∶48∶44∶18
C. 28∶96∶88∶36 D. 6∶3∶4∶4
1
2
3
4
5
6
7
8
9
10
11
12
C2H4+3O2 2CO2+2H2O
28 96 88 36
在此反应中C2H4、O2、CO2和H2O的质量比为28∶96∶88∶36
=7∶24∶22∶9。
【点易错】在求算反应物和生成物的质量比时,是化学计
量数与相对分子(原子)质量乘积之比,而非相对分子(原
子)质量之比。
【点拨】由反应的化学方程式可知,
【答案】 C
1
2
3
4
5
6
7
8
9
10
11
12
返回
8. [2022·黄石]下列化学方程式书写完全正确的是( C )
1
2
3
4
5
6
7
8
9
10
11
12
【点拨】硫在氧气中燃烧生成二氧化硫,反应的化学方程式为S+O2 SO2,A错误;氧化汞受热分解生成汞和氧气,反应的化学方程式为2HgO 2Hg+O2↑,B错误;硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,反应的化学方程式为CuSO4+2NaOH Na2SO4+Cu(OH)2↓,D错误。
【答案】 C
1
2
3
4
5
6
7
8
9
10
11
12
返回
9. [情境题][2023·包头改编]芯片是当今科技的核心,也是国
家竞争力的重要标志。制取芯片的主要材料是硅,其生产
过程涉及的主要化学反应为2C+SiO2 Si+2CO↑。
关于该反应叙述正确的是( B )
A. 2C表示2个碳元素
B. 化学反应前后原子数目不变
C. 反应前后硅元素的化合价不变
D. 参加反应的C和SiO2的质量比为2∶1
1
2
3
4
5
6
7
8
9
10
11
12
课堂小结
谢谢观看!
4.3化学方程式
第四单元 化学式与化学方程式
科粤2024版化学九年级上册【精做课件】
授课教师:********
班 级:********
时 间:********
、教学方法
讲授法:系统讲解化学方程式的概念、意义、书写原则和计算方法等重要知识,确保学生理解基础知识。
讨论法:组织学生分组讨论化学方程式的书写和计算过程中遇到的问题,激发学生的思维,促进学生之间的交流与合作。
练习法:通过课堂练习和课后作业,让学生巩固所学的化学方程式知识,熟练掌握书写和计算技能,提高解题能力。
多媒体辅助教学法:运用图片、动画、视频等多媒体资源,展示化学反应的微观过程、化学方程式的书写步骤等,将抽象知识直观化,帮助学生理解和记忆。
四、教学准备
多媒体设备:电脑、投影仪。
教学资料:制作关于化学方程式的 PPT,包括化学反应的微观示意图、化学方程式书写和计算的例题及练习题等。
学习资料:为学生准备导学案,包含学习目标、知识点梳理、课堂练习和课后作业等内容。
五、教学过程
(一)情境导入(5 分钟)
通过 PPT 展示氢气在氧气中燃烧的实验图片,提问学生:“同学们,我们之前学习过氢气燃烧生成水的反应,那么如何用一种简洁、准确的方式来表示这个化学反应呢?” 引导学生思考化学反应的表达方式,激发学生的学习兴趣。
展示用文字表达式和符号表达式表示氢气燃烧反应的内容,对比分析它们的优缺点,引出本节课的主题 —— 化学方程式。
(二)化学方程式的概念与意义(10 分钟)
概念讲解:展示氢气燃烧的化学方程式
2H
2
+O
2
===
c
\c
1
c
\c
2H
2
O
,讲解化学方程式的概念:用化学式来表示化学反应的式子,叫做化学方程式。强调化学方程式不仅表明了反应物、生成物和反应条件,还体现了各物质之间的质量关系。
意义分析:从质和量两个方面分析化学方程式的意义。
质的方面:表示反应物、生成物和反应条件。如
2H
2
+O
2
===
c
\c
1
c
\c
2H
2
O
表示氢气和氧气在点燃的条件下反应生成水。
量的方面:微观上,表示各物质之间的粒子个数比。在该化学方程式中,氢气、氧气和水的分子个数比为
2:1:2
;宏观上,表示各物质之间的质量比。通过相对分子质量计算,氢气、氧气和水的质量比为
(2
A
~
2):32:(2
A
~
18)=1:8:9
。
互动讨论:展示几个常见的化学方程式,如
C+O
2
===
c
\c
1
c
\c
CO
2
、
2KMnO
4
===
△
K
2
MnO
4
+MnO
2
+O
2
a
^
,让学生分组讨论这些化学方程式所表达的意义,邀请小组代表发言,分享讨论结果,教师进行点评和补充。
(三)化学方程式的书写(15 分钟)
书写原则:讲解书写化学方程式需要遵循的两个原则:一是必须以客观事实为基础,绝不能凭空臆想、臆造事实上不存在的物质和化学反应;二是要遵守质量守恒定律,等号两边各原子的种类与数目必须相等。
书写步骤:以磷在氧气中燃烧生成五氧化二磷的反应为例,详细讲解化学方程式的书写步骤。
写:根据实验事实,写出反应物和生成物的化学式,中间用短线连接。
P+O
2
a
^
a
^
P
2
O
5
配:配平化学方程式,在化学式前面配上适当的化学计量数,使等号两边各原子的种类和数目相等。
4P+5O
2
a
^
a
^
2P
2
O
5
注:注明反应条件和生成物的状态。如果反应物中没有气体,而生成物中有气体,在气体物质的化学式右边要注 “↑” 号;溶液中的反应如果生成物中有固体,在固体物质的化学式右边要注 “↓” 号。
4P+5O
2
===
c
\c
1
c
\c
2P
2
O
5
查:检查化学式是否正确,化学方程式是否配平,条件和物质状态是否标注正确。
练习巩固:让学生书写几个常见化学反应的化学方程式,如铁在氧气中燃烧、过氧化氢分解制取氧气等,教师巡视指导,及时纠正学生在书写过程中出现的错误。
(四)利用化学方程式的简单计算(20 分钟)
例题讲解:展示例题:加热分解 6.3g 高锰酸钾,可以得到氧气的质量是多少?讲解解题步骤:
设:设未知量。设可以得到氧气的质量为
x
。
写:写出反应的化学方程式。
2KMnO
4
===
△
K
2
MnO
4
+MnO
2
+O
2
a
^
算:算出相关物质的相对分子质量总和以及已知量和未知量的相对质量比。
2KMnO
4
的相对分子质量总和为
2
A
~
(39+55+16
A
~
4)=316
,
O
2
的相对分子质量为
16
A
~
2=32
。
列:列出比例式求解。
32
316
=
x
6.3g
解:解比例式,求出未知量。
x=
316
32
A
~
6.3g
a
^
0.6g
答:简明地写出答案。答:可以得到氧气的质量约为 0.6g。
规范强调:强调解题过程中的规范要求,如设未知数时不带单位,计算过程中要带单位,结果要按照题目要求保留适当的小数位数等。
小组练习:将学生分成小组,每个小组给定一个化学方程式计算问题,如实验室用锌和稀硫酸反应制取氢气,若要制取 0.4g 氢气,需要锌的质量是多少?让学生按照解题步骤进行计算,各小组完成后,进行组间交流和评价,教师进行指导和总结。
(五)课堂小结(5 分钟)
请学生回顾本节课的主要内容,包括化学方程式的概念、意义、书写原则和步骤,以及利用化学方程式进行计算的方法和步骤。
教师进行总结和补充,强调重点和难点知识,帮助学生梳理知识脉络,形成完整的知识体系。
(六)课堂练习(5 分钟)
展示几道与本节课内容相关的练习题,如关于化学方程式意义理解的选择题、化学方程式书写正误判断的题目、利用化学方程式进行计算的填空题等。
选择题:化学方程式
2H
2
O
===
e
ˊ
c
\c
2H
2
a
^
+O
2
a
^
不能表示的意义是( )
A. 水在通电的条件下分解生成氢气和氧气
B. 每 36 份质量的水完全分解生成 4 份质量的氢气和 32 份质量的氧气
C. 每 2 个水分子在通电的条件下生成 2 个氢分子和 1 个氧分子
D. 氢气和氧气在点燃的条件下反应生成水
判断题:判断下列化学方程式书写是否正确,错误的请改正。
①
Mg+O
2
===
c
\c
1
c
\c
MgO
2
②
C+O
2
=CO
2
计算题:工业上,高温煅烧石灰石(主要成分是
CaCO
3
)可制得生石灰(
CaO
)和二氧化碳。如果要制取 5.6t 氧化钙,需要碳酸钙的质量是多少?
让学生独立完成练习,教师进行点评和讲解,及时反馈学生的学习情况,强化学生对知识的掌握。
六、板书设计
4.3 化学方程式
化学方程式的概念:用化学式表示化学反应的式子。
化学方程式的意义
质的方面:反应物、生成物、反应条件。
量的方面:微观粒子个数比、宏观质量比。
化学方程式的书写
原则:以客观事实为基础,遵守质量守恒定律。
步骤:写、配、注、查。
利用化学方程式的计算
步骤:设、写、算、列、解、答。
七、教学反思
通过本节课的教学,学生对化学方程式的知识有了较为系统的认识,掌握了化学方程式的书写和计算方法。在教学过程中,通过多媒体展示、例题讲解、小组练习等多种教学方法,提高了学生的学习效果。但部分学生在化学方程式的配平以及计算过程中仍存在一些问题,需要在后续的教学中加强练习和指导,进一步帮助学生理解和掌握化学方程式知识,提高学生的化学应用能力和学科素养。
5
课堂检测
4
新知讲解
6
变式训练
7
考试考法
8
小结梳理
学习目录
1
复习引入
2
新知讲解
3
典例讲解
问题探讨
这个化学反应有没有一个国际通用的表达方法
What do these words mean?
新课探究
一、什么是化学方程式
木炭在氧气中燃烧的反应,可用哪些方法来表示?
碳 + 氧气 二氧化碳
点燃
C + O2 CO2
点燃
只能表示哪些物质发生反应,生成了什么物质,
但不能表示反应过程的质量关系,而且不简明,不利于国际交流。
化学家们采用国际通用的化学式来表示化学反应。
新课探究
一、什么是化学方程式
C + O2 CO2
点燃
1.定义
用化学式表示化学反应的式子,叫作化学方程式
又叫反应方程式
简称反应式
反应物
生成物
反应条件
化学方程式有什么意义呢?
新课探究
一、什么是化学方程式
2.化学方程式的意义
化学方程式表明了反应物、生成物和反应条件。
宏观
表示碳和氧气在点燃的条件下,生成二氧化碳
定性视角
C + O2 CO2
点燃
反应物
反应条件
生成物
化学方程式表示了反应中构成各物质的微观粒子间的数量关系
微观
表示在点燃的条件下,每1个碳原子和1个氧分子生成1个二氧化碳分子
构成各物质的微观粒子
C + O2 CO2
1
1
1
一个碳原子
微粒个数比 1 : 1 : 1
一个氧分子
一个二氧化碳分子
化学计量数为1,省略
定量视角
新课探究
一、什么是化学方程式
2.化学方程式的意义
表示各物质之间的质量关系
宏观
表示在点燃的条件下,每12份质量的碳和32份质量的氧气生成44份质量的二氧化碳
微粒个数比 1 : 1 : 1
C + O2 CO2
物质质量比 12 : 32 : 44
(质量比=化学计量数×相对分子质量)
相对分子质量12 2×16 12+2×16
定量视角
1
1
1
化学计量数:表示反应中分子个数比,1可以省略
新课探究
一、什么是化学方程式
讨论与交流 >>>
①根据电解水的化学方程式:2H2O === 2H2↑+O2↑,说出该反应式可以表示哪些含义。
通电
2个水分子通电条件下,分解生成2个氢分子和1个氧分子;
每36份质量的水完全反应生成4份质量的氢气和32份质量的氧气。
定性:
定量:
微观粒子个数比
2 : 2 : 1
物质质量比
2×18
2×2
32
:
:
36 : 4 : 32
质量守恒
36 = 4 + 32
水在通电条件下生成氢气和氧气
反应物总质量等于生成物总质量
新课探究
一、什么是化学方程式
讨论与交流 >>>
②你认为书写化学方程式的依据是什么?
书写化学方程式应以客观事实为依据,并遵循质量守恒定律。
新课探究
一、什么是化学方程式
总结
表示反应物、生成物之间的微观粒子个数比
表示反应物、生成物、反应条件
定性
表示反应物和生成物间的质量比
定量
即化学式前面的化学计量数之比
各物质之间的质量比=相对分子质量(或相对原子质量)与化学计量数的乘积之比
遵循质量守恒定律:反应物和生成物的质量相等
新课探究
二、怎样书写化学方程式
①以科学实验的事实为根据
写出反应物和生成物的化学式,以及反应条件
②以质量守恒定律为根据
等号两边各种原子的种类和数目必须相同
1. 原 则
新课探究
二、怎样书写化学方程式
步骤 示例 请练习
1.根据实验事实,在左、右两边分别写反应物和生成物的化学式。
2.根据质量守恒定律进行配平,即在有关化学式前配上适当的化学计量数,使反应前后各元素的原子个数相等。
3.标明反应条件和生成物状态。
磷+氧气 五氧化二磷
点燃
P+ O2 —— P2O5
4P+5O2 === 2P2O5
4P+5O2 === 2P2O5
点燃
铝+氧气 氧化铝
点燃
Al+ O2 —— Al2O3
4Al+3O2 === 2Al2O3
4Al+3O2 === 2Al2O3
点燃
写
配
注
2.书写方法:
新课探究
二、怎样书写化学方程式
最小公倍数法配平化学方程式
4P + 5O2 === 2P2O5
4P + 5O2 === 2P2O5
点燃
P2O5前配2,O2前配5
P + O2 —— P2O5
①左边写反应物化学式,右边写生成物化学式
②配平
③标明反应条件
适用范围
式子两边个数最多,相差大的原子
方法指导
求最小公倍数: 2×5=10
求化学计量数
配平其它化学计量数
右边是5个O原子,左边是2个O原子,最小公倍数是10
因而P前配4。
新课探究
二、怎样书写化学方程式
拓展:观察法
观察等式两边化学式构成上的变化
入手点
方法指导
Fe3O4 + CO Fe+ CO2
高温
CO和CO2相差1个O
Fe3O4失去4个O
3
4
4
CO CO2
得到1个O
新课探究
二、怎样书写化学方程式
拓展:设一法
找到等式两边原子个数最多的化学式
入手点
方法指导
C2H2 + O2 CO2 + H2O
点燃
设其化学式的系数为1
先暂定分数,再去分母
2
配平顺序:C、H、O
2
5
2
5
4
2
新课探究
二、怎样书写化学方程式
如果反应物中没有气体,而生成物有气体,则后者用“↑”号标明;
2KMnO4 === K2MnO4 + MnO2 + O2↑
2NaOH+ CuSO4===Na2SO4 + Cu(OH)2↓
溶液中的反应,如果反应物中没有难溶物质,而在生成物中有沉淀,则后者用“↓”号标明。
3. 注:符号“↑” 和“↓” 的使用
“无中生有”才标
两边都有不用标
新课探究
二、怎样书写化学方程式
用化学式表示化学反应的式子,可以表示反应中的质量关系、比例关系。
书写时要根据事实并注意配平,适当标明反应条件和生成物状态。
符号 + === ↑ ↓
意义 与、和或跟 反应生成 加热 该生成物是气体 该生成物是沉淀
表4-2 化学方程式所用符号
化学方程式
书写化学方程式
新课探究
二、怎样书写化学方程式
1. 写出KClO3在 MnO2催化下加热分解成KCl和O2的化学方程式:_____________________________
2、在化学方程式2XY2+Y2==2Z中,代号Z的化学式是( )
A. XY B. XY2 C. X2Y D. XY3
2KClO3 ==== 2KCl+3O2↑
MnO2
D
新课探究
三、怎样根据化学方程式进行计算
进行化学计算,从质量关系与比例关系的角度探究化学变化。
例如:投入一定质量的原料(反应物),可以生产多少产品(生成物),
或反过来计算要生产一定质量的产品,应投放多少原料等。
化学方程式计算依据:
还能表示各反应物与生成物之间的质量关系;
质量守恒定律:
注意:按化学方程式的反应物或生成物进行计算时都必须是纯净物的质量。
反应物的质量总和与生成物质量总和相等的规律
质量比:
新课探究
三、怎样根据化学方程式进行计算
1. 根据反应物的质量求生成物的质量
例1 在实验室中,将含有13.6 g过氧化氢的溶液与少量二氧化锰混合,求过氧化氢完全分解生成的氧气质量是多少。
解题步骤
(1)设未知量
(2)确定根据,即写出化学方程式
(3)找相关量,即列出与计算相关的量
(4)列比例式
(5)求未知量
(6)回答问题
答:可生成6.4 g氧气。
解:设生成氧气的质量为x。
2×34 32
13.6 g x
2×34
32
13.6g
x
———=——
2H2O2 === 2H2O+O2↑
MnO2
x=—————= 6.4 g
32×13.6 g
2×34
书写格式
新课探究
三、怎样根据化学方程式进行计算
2、根据生成物的质量求反应物的质量
例2 用加热氯酸钾与少量二氧化锰混合物的方法,制得氧气9.6 g,求被分解的氯酸钾的质量是多少。
解题步骤
(1)设未知量
(2)写反应式
(3)找相关量
(4)列比例式
(5)求未知量
(6)回答问题
答:被分解的氯酸钾的质量为24.5 g。
解:设被分解的氯酸钾的质量为x。
245 96
x 9.6 g
245
96
x
9.6 g
———=——
2KClO3 === 2KCl + 3O2↑
MnO2
△
x=—————= 24.5 g
245×9.6 g
96
练习解答
新课探究
三、怎样根据化学方程式进行计算
3. 反应物(或生成物)之间质量互求
例3 工业上高温煅烧石灰石(按CaCO3纯净物计算),可制得生石灰(按CaO纯净物计算),同时会产生大量的二氧化碳。试计算每制得100 t 氧化钙的同时会产生二氧化碳多少吨。
解题步骤
(1)设未知量
(2)写反应式
(3)找相关量
(4)列比例式
(5)求未知量
(6)回答问题
解:产生二氧化碳多少吨的质量为x。
56 44
100 t x
56
44
100 t
x
———=——
CaCO3 === CaO + CO2↑
高温
x=————— ≈ 78.6 t
44×100 t
56
练习解答
答:产生二氧化碳多少吨的质量为78.6 t。
新课探究
三、怎样根据化学方程式进行计算
拓展: 含杂质的质量计算
例4 工业上,煅烧含有杂质10%CaCO3可制得生石灰(CaO)和二氧化碳。如果要制取 5.6t 氧化钙,需要碳酸钙的质量是多少?
在实际生产和科学研究中,所用原料很多是不纯的,在进行计算时应考虑杂质问题。
物质的纯度(质量分数)=
纯物质的质量
含杂质的物质的质量
×100%
纯物质的质量=含杂质的物质的质量×物质的纯度(质量分数)
新课探究
三、怎样根据化学方程式进行计算
拓展: 含杂质的质量计算
例4 工业上,煅烧含有杂质10%CaCO3可制得生石灰(CaO)和二氧化碳。如果要制取 5.6t 氧化钙,需要碳酸钙的质量是多少?
解:设需要含有杂质10%碳酸钙的质量为x。
高温
CaCO3 CaO + CO2↑
56
100
(1-10%)x
5.6t
100
(1-10%)x
=
5.6t
56
x=11.1t
答:需要11.1t的碳酸钙。
新课探究
三、怎样根据化学方程式进行计算
根据化学方程式的计算
设未知量为x(不带单位)
回答问题
写出反应的方程式(注意配平)
列出比例式
找出已知量和未知量的质量关系
设
写
找
列
答
求未知量
求
新课探究
三、怎样根据化学方程式进行计算
注意问题
①设未知量时一定要写上“质量”二字,未知数后面不带单位;
②写出化学方程式一定要注意配平,注意化学方程式的完整;
③一定要注意用相关物质的化学计量数乘以相对分子质量,写在相应化学式的下面;
④求解出未知数的值后要带上单位。
名师点金
1. 化学方程式的意义:(1)宏观视角:表示反应物、生成物
及反应条件。(2)微观视角:①表示反应物、生成物各物
质之间的质量比,即相对分子质量与化学计量数乘积之
比;②表示反应物、生成物各物质之间的粒子个数比。
2. 书写化学方程式要遵循两个原则:(1)科学实验的事实。
(2)质量守恒定律。
知识点1 化学方程式的意义与读法
1. 下图中四名同学正在讨论某一个化学方程式的意义,他们
所描述的化学方程式是( C )
1
2
3
4
5
6
7
8
9
10
11
12
【答案】 C
1
2
3
4
5
6
7
8
9
10
11
12
返回
2. [2023·东营改编]下列关于3Fe+2O2 Fe3O4的叙述
中,正确的是( C )
A. 该反应可读作铁加氧气等于四氧化三铁
B. 参加反应的铁和氧气的质量比为3∶2
C. 如果把反应条件“点燃”去掉,这个反应不符合客观
事实
D. 上述反应中10 g Fe和10 g O2反应,能生成20 g Fe3O4
1
2
3
4
5
6
7
8
9
10
11
12
【点拨】该反应读作铁和氧气在点燃条件下生成四氧化三铁,A错误;参加反应的铁和氧气的质量比为(3×56)∶(2×32)=21∶8,B错误;如果把反应条件“点燃”去掉,反应不符合客观事实,C正确;每168份质量的铁和64份质量的氧气在点燃条件下恰好反应生成232份质量的四氧化三铁,上述反应中10 g Fe和10 g O2反应,氧气有剩余,不能生成20 g Fe3O4,D错误。
【答案】 C
1
2
3
4
5
6
7
8
9
10
11
12
返回
知识点2 化学方程式的书写
3. 下列化学方程式书写正确的是( D )
1
2
3
4
5
6
7
8
9
10
11
12
【点拨】A项化学方程式缺少反应条件,正确的化学方程
式应为4P+5O2 2P2O5,A错误;铝粉在空气中燃
烧生成氧化铝,正确的化学方程式应为4Al+3O2
2Al2O3,B错误;铁丝在氧气中燃烧生成四氧化三铁,正
确的化学方程式应为3Fe+2O2 Fe3O4,C错误。
【答案】 D
1
2
3
4
5
6
7
8
9
10
11
12
返回
4. [2024·昆明一模]汽车通常采用催化净化装置将尾气中的有
害物质转化为无毒物质再排放。其主要反应原理为2NO+
2CO X+2CO2,其中X的化学式为( B )
A. O2 B. N2
C. H2O D. H2
1
2
3
4
5
6
7
8
9
10
11
12
【点拨】由反应的化学方程式2NO+2CO X+
2CO2可知,反应前N、C、O原子的个数分别为2、2、4,
反应后已知的生成物中N、C、O原子的个数分别为0、
2、4。根据质量守恒定律,化学反应前后原子的种类和数
目不变,则1个X分子中含有2个氮原子,所以X的化学式
为N2。
【答案】 B
1
2
3
4
5
6
7
8
9
10
11
12
返回
5. [2022·天津]写出下列反应的化学方程式。
(1)碳在氧气中充分燃烧: 。
(2)锌与稀硫酸反应(生成硫酸锌和氢气):
。
(3)高锰酸钾制氧气:
。
C+O2 CO2
Zn + H2SO4
ZnSO4 + H2↑
2KMnO4 K2MnO4+MnO2+
O2↑
1
2
3
4
5
6
7
8
9
10
11
12
返回
知识点3 化学方程式的配平
6. 将下列化学方程式补充完整。
(1) Al+ O2 Al2O3
(2) Fe2O3+ H2SO4 Fe2(SO4)3
+ H2O
(3) C3H8+ O2 CO2+ H2O
4
3
2
1
3
1
3
1
5
3
4
1
2
3
4
5
6
7
8
9
10
11
12
(4) CO+ Fe3O4 Fe+ CO2
(5) FeS2+ O2 Fe2O3+ SO2
4
1
3
4
4
11
2
8
1
2
3
4
5
6
7
8
9
10
11
12
返回
纠易错 不能正确计算化学方程式中各物质的质量比
7. [2023·海南期末]在反应C2H4+3O2 2CO2+2H2O
中,各物质间的质量比为( C )
A. 1∶3∶2∶2 B. 28∶48∶44∶18
C. 28∶96∶88∶36 D. 6∶3∶4∶4
1
2
3
4
5
6
7
8
9
10
11
12
C2H4+3O2 2CO2+2H2O
28 96 88 36
在此反应中C2H4、O2、CO2和H2O的质量比为28∶96∶88∶36
=7∶24∶22∶9。
【点易错】在求算反应物和生成物的质量比时,是化学计
量数与相对分子(原子)质量乘积之比,而非相对分子(原
子)质量之比。
【点拨】由反应的化学方程式可知,
【答案】 C
1
2
3
4
5
6
7
8
9
10
11
12
返回
8. [2022·黄石]下列化学方程式书写完全正确的是( C )
1
2
3
4
5
6
7
8
9
10
11
12
【点拨】硫在氧气中燃烧生成二氧化硫,反应的化学方程式为S+O2 SO2,A错误;氧化汞受热分解生成汞和氧气,反应的化学方程式为2HgO 2Hg+O2↑,B错误;硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,反应的化学方程式为CuSO4+2NaOH Na2SO4+Cu(OH)2↓,D错误。
【答案】 C
1
2
3
4
5
6
7
8
9
10
11
12
返回
9. [情境题][2023·包头改编]芯片是当今科技的核心,也是国
家竞争力的重要标志。制取芯片的主要材料是硅,其生产
过程涉及的主要化学反应为2C+SiO2 Si+2CO↑。
关于该反应叙述正确的是( B )
A. 2C表示2个碳元素
B. 化学反应前后原子数目不变
C. 反应前后硅元素的化合价不变
D. 参加反应的C和SiO2的质量比为2∶1
1
2
3
4
5
6
7
8
9
10
11
12
课堂小结
谢谢观看!
同课章节目录
