大单元二 金属元素及其化合物 第7讲 钠及其化合物 学案 (含答案)2026届高三化学一轮大单元复习
文档属性
| 名称 | 大单元二 金属元素及其化合物 第7讲 钠及其化合物 学案 (含答案)2026届高三化学一轮大单元复习 |  | |
| 格式 | DOC | ||
| 文件大小 | 561.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-14 21:18:16 | ||
图片预览




文档简介
大单元二 金属元素及其化合物
第7讲 钠及其化合物
备考导航
复习目标 1. 了解合金的概念及性质,了解金属冶炼的方法。2. 了解钠及其重要化合物的主要性质和应用。3. 知道碱金属及其化合物的通性,并能预测陌生碱金属及其化合物的性质。4. 了解焰色试验的操作并熟记几种常见金属的焰色。
熟记网络
课前自测 判断正误(正确的打“√”,错误的打“×”)。(1) (2022·浙江卷)不能将实验室用剩的金属钠块放回原试剂瓶( )(2) (2022·山东卷)氢氧化钠固体保存在广口塑料瓶中( )(3) (2024·如东中学)用图1装置证明:ρ(煤油)<ρ(钠)<ρ(水) ( )图1(4) (2023·重庆卷)Na2O2分别与H2O和CO2反应,生成的气体相同( )(5) (2024·南通三模)Na2O2晶体中阴阳离子数目之比为1∶2( )(6) Na2O在空气中加热可得固体Na2O2( )(7) (2024·盐城期末)取一小块金属钠,在空气中燃烧。取燃烧后的固体粉末加入2~3 mL蒸馏水,有气泡生成,该固体粉末为Na2O2( )(8) 用图2制备并收集CO2 ( )图2(9) 碳酸钠可用于去除餐具的油污( )(10) (2023·海安中学)检验NaCl溶液中是否存在KCl杂质:用洁净的铂丝蘸取该溶液,在酒精灯外焰上灼烧,观察火焰是否出现紫色( )(11) (2024·丹阳中学)在火焰上灼烧搅拌过某无色溶液的玻璃棒,火焰出现黄色,溶液中含Na元素( )
考点1 合金
知 识 梳 理
概念
合金是指两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
性能
1. 熔点:一般比它的各成分金属___。
2. 硬度和强度:一般比它的各成分金属___。
生铁与钢的含碳量大小
生铁和钢都属于合金,但是含碳量不同,含碳量:生铁>钢。
典 题 悟 法
(2024·江苏各地模拟重组)下列说法错误的是( )
A. “大克鼎” 的材料青铜属于合金
B. 生铁硬度大、抗压,故可用于铸造机器底座
C. “奋斗者”号潜水器外壳材料为钛合金,钛合金耐高压、耐腐蚀
D. 制造舰体所用的耐腐蚀低磁钢的熔点高于纯铁
考点2 金属冶炼方法
知 识 梳 理
金属活动性顺序与金属冶炼的方法
金属冶炼的方法
电解法 2Al2O3(熔融)4Al+3O2↑
MgCl2(熔融)Mg+Cl2↑
2NaCl(熔融)2Na+Cl2↑
热还原法 焦炭还原法 C+2CuO2Cu+CO2↑
CO还原法 3CO+Fe2O32Fe+3CO2
H2还原法 3H2+WO3W+3H2O
活泼金属还原法 2Al+Cr2O3Al2O3+2Cr
热分解法 2HgO2Hg+O2↑
2Ag2O4Ag+O2↑
典 题 悟 法
(2022·湖南卷) Mg与TiCl4反应可冶炼Ti,下列金属冶炼方法与上述方法相似的有______(填字母)。
A. 高炉炼铁
B. 电解熔融氯化钠制钠
C. 铝热反应制锰
D. 氧化汞分解制汞
有关K、Rb的冶炼
工业上运用如下反应制K和Rb:
Na+KClK↑+NaCl
2RbCl+MgMgCl2+2Rb↑
上述两种方法主要运用化学平衡移动原理,利用K、Rb沸点低,汽化离开反应体系的性质,使反应正向进行。
考点3 钠 氧化钠 过氧化钠
知 识 梳 理
钠
1. 钠的物理性质
钠是银白色固体,硬度___,密度比煤油___、比水___,通常保存在______中。钠的熔点___于水的沸点,具有良好的导电、导热性。
2. 钠的化学性质(强还原性)(写化学方程式)
(1) 与非金属单质反应
①与O2
常温下:__________________________________________;
加热条件下:_________________________________;
②与Cl2:____________________________________;
③与S:___________________________。
(2) 与水反应:____________________________________________________________;
(3) 与乙醇反应:
_____________________________________________________________________
[Na沉在乙醇底部,反应速率比Na与水反应的___(填“慢”或“快”)]。
(4) 与盐反应
①与熔融盐:
4Na+TiCl4(熔融)4NaCl+Ti
②与盐溶液:Na先与水反应,生成的NaOH再与盐反应。
3. 钠的用途
(1) 制高压钠灯。
(2) 钠、钾合金(常温为液态)用作原子反应堆的导热剂。
(3) 从钛、锆、铌、钽等熔融氯化物中置换出金属单质。
氧化钠和过氧化钠
化学式 Na2O Na2O2
颜色
氧元素化合价
电子式
化学键类型
阴、阳离子个数之比
与水反应(写化学方程式)
与CO2反应(写化学方程式)
是否为碱性氧化物
转化关系 Na2O转化为Na2O2的化学方程式:___________________________________
重要用途 — 强氧化剂、漂白剂、供氧剂
[注意事项] 在防毒面具和潜水艇中经常用Na2O2作为CO2吸收剂,并供给氧气;宇航密封舱中则往往使用较轻的Li2O2。
典 题 悟 法
(2024·江苏各地模拟重组)下列有关钠及其化合物的性质与用途具有对应关系的是( )
A. Na能与水反应,可用于高压钠灯
B. Na具有强还原性,可用于制备金属Ti
C. Na有导电性,可用作快中子反应堆的热交换剂
D. Na2O2受热会分解,可用作呼吸面具中的供氧剂
下列说法正确的是( )
A. 向AlCl3溶液中加入金属Na,比较Na和Al的还原能力
B. 检验乙醇中含有水:用试管取少量的乙醇,加入一小块钠,产生无色气体
C. 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶,集气瓶中产生大量白烟,瓶内有黑色颗粒产生,说明CO2具有氧化性
D. 探究金属钠在氧气中燃烧所得固体粉末的成分:取少量固体粉末,加入2~3 mL蒸馏水,若无气体生成,则固体粉末为Na2O;若有气体生成,则固体粉末为Na2O2
过氧化钠的性质
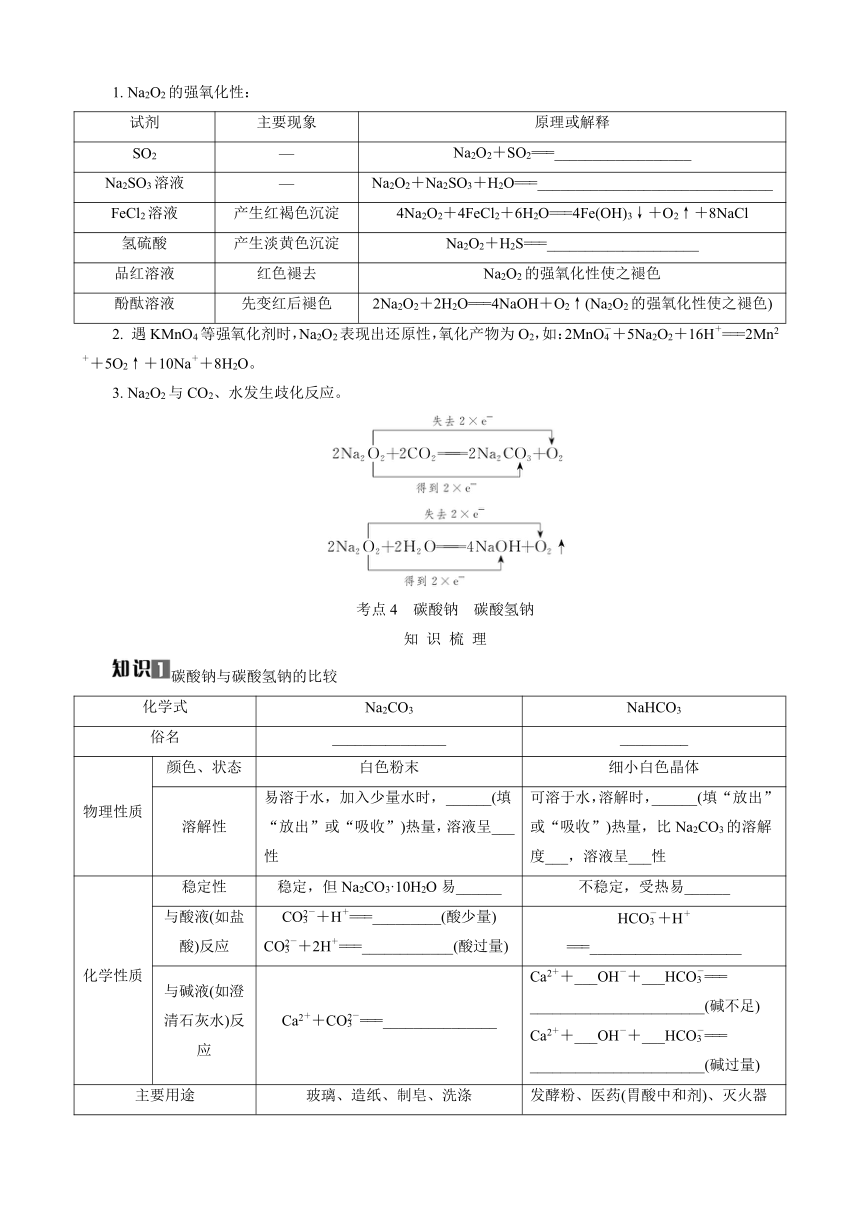
1. Na2O2的强氧化性:
试剂 主要现象 原理或解释
SO2 — Na2O2+SO2===__________________
Na2SO3溶液 — Na2O2+Na2SO3+H2O===_______________________________
FeCl2溶液 产生红褐色沉淀 4Na2O2+4FeCl2+6H2O===4Fe(OH)3↓+O2↑+8NaCl
氢硫酸 产生淡黄色沉淀 Na2O2+H2S===____________________
品红溶液 红色褪去 Na2O2的强氧化性使之褪色
酚酞溶液 先变红后褪色 2Na2O2+2H2O===4NaOH+O2↑(Na2O2的强氧化性使之褪色)
2. 遇KMnO4等强氧化剂时,Na2O2表现出还原性,氧化产物为O2,如:2MnO+5Na2O2+16H+===2Mn2++5O2↑+10Na++8H2O。
3. Na2O2与CO2、水发生歧化反应。
考点4 碳酸钠 碳酸氢钠
知 识 梳 理
碳酸钠与碳酸氢钠的比较
化学式 Na2CO3 NaHCO3
俗名 _______________ _________
物理性质 颜色、状态 白色粉末 细小白色晶体
溶解性 易溶于水,加入少量水时,______(填“放出”或“吸收”)热量,溶液呈___性 可溶于水,溶解时,______(填“放出”或“吸收”)热量,比Na2CO3的溶解度___,溶液呈___性
化学性质 稳定性 稳定,但Na2CO3·10H2O易______ 不稳定,受热易______
与酸液(如盐酸)反应 CO+H+===_________(酸少量)CO+2H+===____________(酸过量) HCO+H+===____________________
与碱液(如澄清石灰水)反应 Ca2++CO===_______________ Ca2++___OH-+___HCO===_______________________(碱不足)Ca2++___OH-+___HCO===_______________________(碱过量)
主要用途 玻璃、造纸、制皂、洗涤 发酵粉、医药(胃酸中和剂)、灭火器
相互转化 Na2CO3NaHCO3
特别提醒 碳酸氢钠能作胃酸中和剂,碳酸钠不能作胃酸中和剂
碳酸钠与碳酸氢钠的鉴别
性质 操作 结论(填化学式)
溶解性 取等质量的两种固体,加入少量(等量)水 溶解量大的是__________________
稳定性 取等质量的两种固体,分别加热 生成能使澄清石灰水变浑浊的气体的是__________________
碱性 取等物质的量的两种固体,加入等体积(足量)水,测定pH 碱性强的是__________________
与酸反应速率 取等体积、等物质的量浓度的两种盐溶液,分别逐滴加入等浓度的盐酸 产生气泡较快的是__________________
注意 ①不用Ca(OH)2[或Ba(OH)2]溶液鉴别Na2CO3和NaHCO3,因为都有白色沉淀生成,现象相同,无法鉴别;②不用CaCl2(或BaCl2)溶液鉴别Na2CO3和NaHCO3,因为CaCl2(或BaCl2)溶液与NaHCO3溶液也可能产生白色沉淀
侯氏制碱法
侯氏制碱法生产流程可简要表示如下:
1. 先在低温的条件下将NH3(要防倒吸)通入饱和食盐水中,再通入CO2。
2. 主要反应原理:
(1) 产生NaHCO3的反应(写化学方程式,下同):
________________________________________________________________________________。
(2) 产生Na2CO3的反应:
_______________________________________________________________。
3. 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品。通氨气的作用:增大NH的浓度,使NH4Cl更多地析出;使NaHCO3转化为Na2CO3(溶解度大),提高析出的NH4Cl纯度。
4. 绿色化学思想:
可循环使用的物质为________________________。
典 题 悟 法
(2023·泰州)下列物质性质与用途具有对应关系的是( )
A. Na2CO3溶液显碱性,可用作除油污剂
B. NaHCO3受热易分解,可用作抗酸药物
C. Na2O2具有还原性,可用作供氧剂
D. NaClO具有强氧化性,可用作混凝剂
阅读下列材料,完成典例6~7。
侯德榜是我国近代化学工业的奠基人之一,他将“合成氨”工艺和“氨碱法”联合起来,发明了联合制碱法:先用NH3、CO2和精制饱和NaCl溶液制得NaHCO3晶体和母液,NaHCO3加热得到Na2CO3。通过对母液依次采取通入NH3、降温、加NaCl等措施,获得高纯NH4Cl晶体,将食盐的利用率提高到了 98%,在制得纯碱的同时还能获得几乎等质量的NH4Cl,满足了当时农业生产的需要。“氨碱法”的部分工艺流程如下:
(2024·海安期末)下列有关实验室模拟“氨碱法”的实验原理和装置不正确的是( )
A. 制取NH3 B. 制取CO2
C. 净化CO2 D. 制取NaHCO3
(2024·海安期末)下列有关联合制碱法的说法错误的是( )
A. 向母液中通入NH3时,主要反应的离子方程式为HCO+ NH3=== CO+ NH
B. 若对母液直接采取降温的措施,也能获得高纯NH4Cl晶体
C. 加NaCl促进NH(aq)+Cl-(aq)??NH4Cl(s)平衡正向移动,进一步析出NH4Cl
D. 检验碳酸氢钠晶体中是否含有NH4Cl杂质的操作是:取适量晶体,加水溶解;滴加硝酸至无明显现象,再滴加2~3滴AgNO3溶液
(2024·南京、盐城期末)室温下,探究0.1 mol/L NaHCO3溶液的性质。下列实验方案能达到探究目的的是( )
选项 探究目的 实验方案
A HCO是否发生电离 向2 mL 0.1 mol/L NaHCO3溶液中加入一小块钠,观察溶液中是否有气泡产生
B HCO是否发生水解 用干燥洁净的玻璃棒蘸取0.1 mol/L NaHCO3溶液,点在干燥的pH试纸上,测出溶液的pH
C 溶液中是否存在Na+ 取一支洁净的铂丝,蘸取0.1 mol/L NaHCO3溶液后在煤气灯上灼烧,透过蓝色钴玻璃观察火焰颜色
D 溶液中是否存在CO 向2 mL 0.1 mol/L NaHCO3溶液中滴入几滴澄清石灰水,观察溶液是否变浑浊
考点5 碱金属 焰色试验
知 识 梳 理
碱金属(Li、Na、K、Rb、Cs)性质
性质 相似性 递变性(由Li→Cs)
原子结构 最外层均有___个电子 电子层数逐渐增多,核电荷数逐渐增大,原子半径逐渐______
元素性质 都具有较强的金属性,最高正价均为______ 金属性逐渐______
单质性质 物理性质 (除Cs外)都呈银白色,密度较小,熔点___ 密度逐渐增大(钾反常),熔点逐渐______
化学性质 都具有较强的还原性,还原性逐渐______ 与O2反应越来越剧烈,产物越来越复杂
碱金属的特性
1. 碱金属的密度一般随核电荷数的增大而增大,但钾的密度比钠小。
2. 碱金属一般都保存在煤油中,但锂的密度小于煤油,通常将锂密封在石蜡中。
3. 碱金属跟氢气反应生成的碱金属氢化物都是离子化合物,其中氢以H-形式存在,显-1价,碱金属氢化物是强______剂。
4. 试剂瓶中的试剂取出后,一般不能放回原瓶,但Na、K等试剂必须放回原瓶。
5. 锂与O2反应与钠不同,无论是常温还是加热,Li与O2反应只生成Li2O。
焰色试验
1. 焰色试验是物理变化,属于元素的性质。
2. 钠、钾元素的检验
(1) 焰色试验显黄色―→含钠元素。
(2) 焰色试验显紫色―→含钾元素。
3. 进行焰色试验前铂丝先用_________洗涤。
典 题 悟 法
(2024·江苏各地模拟重组)下列说法正确的是( )
A. 灼烧时火焰呈现紫色的物质一定是钾盐
B. 沸点:NaC. KO2与水的反应:
KO2+H2O ===K++OH-+O2↑
D. 在火焰上灼烧搅拌过某无色溶液的铁丝,火焰出现黄色,溶液中含Na元素
(2023·江苏卷)空气中CO2含量的控制和CO2资源的利用具有重要意义。燃煤烟气中CO2的捕集可通过如下所示的物质转化实现。
“吸收”后所得的KHCO3溶液与石灰乳反应的化学方程式为 __________________________________ _____________________________________________________;载人航天器内,常用LiOH固体而很少用KOH固体吸收空气中的CO2,其原因是__________________________________________________________ ___________。
情景创设
金属氢化物
1. 制备: 碱金属均可与H2直接作用,生成金属氢化物。金属氢化物属于离子化合物,如NaH的电子式为Na+[H]-。
2. 性质:强还原性(金属氢化物中H元素为-1价)。
①NaH+H2O===NaOH+H2↑(NaH为还原剂,水为氧化剂,H2既是氧化产物又是还原产物)
②CaH2+2H2O===Ca(OH)2+2H2↑
例 NaH和NaAlH4都是重要的还原剂,一定条件下,金属钠和H2反应生成NaH。NaH与水反应可生成H2,NaH与AlCl3反应可得到NaAlH4,请推测并回答:
(1) NaH与AlCl3反应得到NaAlH4的化学方程式为____________________________________________ _______________________________。
(2) NaH在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程中生成两种产物,写出该反应的化学方程式:______________________________________________________________。
(3) NaH能将CO2还原成碳并放出H2,该反应的化学方程式为___________________________________ ________________________________________。
1. (2024·江苏各地模拟重组)下列说法正确的是( )
A. 如图所示装置为观察纯碱的焰色试验
B. Li质量轻、比能量大,故可用作电池正极材料
C. Na和Li分别在O2中燃烧得到Na2O和Li2O
D. 用铂丝蘸取某溶液进行焰色试验,火焰呈黄色,说明溶液中无K+
2. (2023·南师附中)下列物质的性质与用途具有对应关系正确的是( )
A. Na2O2属于碱性氧化物,可用于制备少量氧气
B. NaClO有强氧化性,可用于对环境消毒
C. Na2CO3溶液显碱性,可用于去除矿物油(如煤油、柴油)的油污
D. Na2SO3具有还原性,可用于吸收含SO2的尾气
3. (2023·无锡期末)钠及其化合物的转化具有重要应用。下列说法错误的是( )
A. 金属钠与熔融的TiCl4反应可制备金属钛
B. 呼吸面具中的Na2O2吸收人体呼出的CO2和H2O,同时释放出O2
C. 侯氏制碱法的原理是将NH3通入含有CO2的饱和食盐水中制得NaHCO3
D. 泡沫灭火器的原理是利用NaHCO3溶液与Al2 (SO4) 3溶液混合制取CO2
4. (2023·如皋期初)侯氏制碱法的过程如图所示。下列说法正确的是( )
A. 气体X是CO2
B. “吸收 Ⅱ ”时反应的化学方程式为2NaCl+2NH3+CO2+H2O===Na2CO3↓+2NH4Cl
C. 向小苏打溶液中滴加过量Ca(OH)2溶液时反应的离子方程式为2HCO+Ca2++2OH-===CaCO3↓+CO+2H2O
D. 向滤液中加入一定量的NaCl固体并通入氨气可析出NH4Cl固体
第7讲 钠及其化合物
[备考导航]
(1) × (2) √ (3) √ (4) √ (5) √ (6) √ (7) × (8) × (9) √ (10) × (11) ×
考点1
[知识梳理]
知识2 1. 低 2. 大
[典题悟法]
典例1 D 【解析】 低磁钢是合金,合金的熔点低于其成分金属,故低磁钢的熔点低于纯铁,D错误。
考点2
[典题悟法]
典例2 AC 【解析】 Mg冶炼Ti的方法为热还原法。高炉炼铁的原理是用还原剂将铁从其氧化物中还原出来,属于热还原法,A正确;电解熔融氯化钠制钠的方法是电解法,B错误;铝热反应制锰是利用Al作还原剂,将锰从其氧化物中还原出来,为热还原法,C正确;加热分解氧化汞制汞为热分解法,D错误。
考点3
[知识梳理]
知识1 1. 小 大 小 煤油 低
2. (1)①4Na+O2===2Na2O 2Na+O2Na2O2
②2Na+Cl22NaCl ③2Na+SNa2S
(2) 2Na+2H2O===2NaOH+H2↑
(3) 2Na+2C2H5OH―→2C2H5ONa+H2↑ 慢
知识2 白色 淡黄色 -2 -1
离子键 离子键和非极性共价键 1∶2 1∶2
Na2O+H2O===2NaOH 2Na2O2+2H2O===4NaOH+O2↑ Na2O+CO2===Na2CO3 2Na2O2+2CO2===2Na2CO3+O2 是 否 2Na2O+O22Na2O2
[典题悟法]
典例3 B 【解析】 钠元素的焰色为黄色,黄光射程远,透雾力强,用作高压钠灯,与钠和水反应没有对应关系,A错误;钠用作快中子反应堆的热交换剂利用Na的导热性,C错误;Na2O2作供氧剂主要是因为Na2O2与CO2或H2O均能反应,且都有O2生成,D错误。
典例4 C 【解析】 向AlCl3溶液中加入金属Na,Na与水反应生成NaOH,NaOH再与AlCl3反应,不能置换出Al,A错误;乙醇和钠都能与水反应,B错误;Na在CO2中燃烧产生的黑色颗粒为C,说明CO2具有氧化性,C正确;Na也能与水产生气体,D错误。
[深度指津] 1. Na2SO4 Na2SO4+2NaOH S↓+2NaOH
考点4
[知识梳理]
知识1 纯碱或苏打 小苏打 放出 碱 吸收 小 碱
风化 分解 HCO H2O+CO2↑ H2O+CO2↑
CaCO3↓ 2 2 CaCO3↓+CO+2H2O
1 1 CaCO3↓+H2O
知识2 Na2CO3 NaHCO3 Na2CO3 NaHCO3
解疑释惑9
2. (1) NH3+H2O+CO2+NaCl===NaHCO3↓+NH4Cl
(2) 2NaHCO3Na2CO3+CO2↑+H2O
4. NaCl、CO2
[典题悟法]
典例5 A 【解析】 Na2CO3溶液显碱性,油污在碱性条件下水解,Na2CO3可以用作除油污剂,A正确;NaHCO3具有碱性,可以和胃酸反应,与其受热易分解没有对应关系,B错误;Na2O2用作供氧剂是由于Na2O2可与CO2或H2O反应产生O2,在此反应中,Na2O2既是氧化剂也是还原剂,C错误;NaClO具有强氧化性,可用作消毒剂,D错误。
典例6 D 【解析】 NH3的溶解度比CO2的大,应向饱和食盐水中先通入NH3再通入CO2,D错误。
典例7 B 【解析】 向母液中通入NH3,HCO和NH3反应转化为CO和NH,增大NH浓度,A正确;母液中NH4Cl浓度较小,直接采取降温的措施不能获得高纯NH4Cl晶体,B错误;加NaCl,Cl-浓度增大,NH(aq)+Cl-(aq)??NH4Cl(s)平衡正向移动,析出NH4Cl,C正确;滴加硝酸至无明显现象排除HCO的干扰,再滴加AgNO3溶液,若生成沉淀则含有NH4Cl杂质,D正确。
典例8 B 【解析】 Na能与水反应生成H2,对该实验探究产生干扰,A错误;观察Na元素的焰色时,不用透过蓝色钴玻璃观察,C错误; HCO、CO均能与澄清石灰水反应产生白色沉淀,无法检验溶液中是否存在CO,D错误。
考点5
知识1 1 增大 +1 增强 低 降低 增强
知识2 3. 还原
知识3 3. 稀盐酸
[典题悟法]
典例9 D 【解析】 含K+的也可能是KOH,A错误;Na半径小于K,金属键:Na>K,沸点:Na>K,B错误;KO2与水反应生成KOH和O2:4KO2+2H2O===4K++4OH-+3O2↑,C错误;钠的焰色呈黄色,D正确。
典例10 KHCO3+Ca(OH)2===CaCO3↓+KOH+H2O 相同质量时,LiOH吸收CO2的量比KOH的多
[情景创设]
例 (1) 4NaH+AlCl3===NaAlH4+3NaCl
(2) 3NaH+Fe2O3===2Fe+3NaOH
(3) 4NaH+3CO2===2Na2CO3+C+2H2
[质量评价]
1. A 【解析】 Li是活泼金属,可用作电池负极材料,B错误;Na在O2中燃烧生成Na2O2,C错误;应该透过蓝色钴玻璃观察钾元素的焰色,D错误。
2. B 【解析】 Na2O2不是碱性氧化物,A错误;NaClO具有强氧化性,能使蛋白质变性,可用于环境消毒,B正确;Na2CO3水解呈碱性,能促进油脂的水解,但是不能去除矿物油(如煤油、柴油)的油污,C错误;Na2SO3吸收SO2的化学方程式为Na2SO3+SO2+H2O===2NaHSO3,该反应不是氧化还原反应,D错误。
3. C 【解析】 侯氏制碱法的原理是将CO2通入含有NH3的饱和食盐水中制得NaHCO3,C错误。
4. D 【解析】 先向饱和氯化钠溶液中通NH3,再通CO2,X为NH3,Y为CO2,A错误;“吸收Ⅱ”的反应为NaCl+CO2+NH3+H2O===NaHCO3↓+NH4Cl,B错误;向小苏打溶液中滴加过量Ca(OH)2溶液,正确的离子方程式:HCO+Ca2++OH-===CaCO3↓+H2O,C错误;滤液中存在氯化铵和NaHCO3,向滤液中加入一定量的NaCl固体并通入氨气,使溶液中Cl-和NH浓度增大,析出NH4Cl固体,D正确。
第7讲 钠及其化合物
备考导航
复习目标 1. 了解合金的概念及性质,了解金属冶炼的方法。2. 了解钠及其重要化合物的主要性质和应用。3. 知道碱金属及其化合物的通性,并能预测陌生碱金属及其化合物的性质。4. 了解焰色试验的操作并熟记几种常见金属的焰色。
熟记网络
课前自测 判断正误(正确的打“√”,错误的打“×”)。(1) (2022·浙江卷)不能将实验室用剩的金属钠块放回原试剂瓶( )(2) (2022·山东卷)氢氧化钠固体保存在广口塑料瓶中( )(3) (2024·如东中学)用图1装置证明:ρ(煤油)<ρ(钠)<ρ(水) ( )图1(4) (2023·重庆卷)Na2O2分别与H2O和CO2反应,生成的气体相同( )(5) (2024·南通三模)Na2O2晶体中阴阳离子数目之比为1∶2( )(6) Na2O在空气中加热可得固体Na2O2( )(7) (2024·盐城期末)取一小块金属钠,在空气中燃烧。取燃烧后的固体粉末加入2~3 mL蒸馏水,有气泡生成,该固体粉末为Na2O2( )(8) 用图2制备并收集CO2 ( )图2(9) 碳酸钠可用于去除餐具的油污( )(10) (2023·海安中学)检验NaCl溶液中是否存在KCl杂质:用洁净的铂丝蘸取该溶液,在酒精灯外焰上灼烧,观察火焰是否出现紫色( )(11) (2024·丹阳中学)在火焰上灼烧搅拌过某无色溶液的玻璃棒,火焰出现黄色,溶液中含Na元素( )
考点1 合金
知 识 梳 理
概念
合金是指两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
性能
1. 熔点:一般比它的各成分金属___。
2. 硬度和强度:一般比它的各成分金属___。
生铁与钢的含碳量大小
生铁和钢都属于合金,但是含碳量不同,含碳量:生铁>钢。
典 题 悟 法
(2024·江苏各地模拟重组)下列说法错误的是( )
A. “大克鼎” 的材料青铜属于合金
B. 生铁硬度大、抗压,故可用于铸造机器底座
C. “奋斗者”号潜水器外壳材料为钛合金,钛合金耐高压、耐腐蚀
D. 制造舰体所用的耐腐蚀低磁钢的熔点高于纯铁
考点2 金属冶炼方法
知 识 梳 理
金属活动性顺序与金属冶炼的方法
金属冶炼的方法
电解法 2Al2O3(熔融)4Al+3O2↑
MgCl2(熔融)Mg+Cl2↑
2NaCl(熔融)2Na+Cl2↑
热还原法 焦炭还原法 C+2CuO2Cu+CO2↑
CO还原法 3CO+Fe2O32Fe+3CO2
H2还原法 3H2+WO3W+3H2O
活泼金属还原法 2Al+Cr2O3Al2O3+2Cr
热分解法 2HgO2Hg+O2↑
2Ag2O4Ag+O2↑
典 题 悟 法
(2022·湖南卷) Mg与TiCl4反应可冶炼Ti,下列金属冶炼方法与上述方法相似的有______(填字母)。
A. 高炉炼铁
B. 电解熔融氯化钠制钠
C. 铝热反应制锰
D. 氧化汞分解制汞
有关K、Rb的冶炼
工业上运用如下反应制K和Rb:
Na+KClK↑+NaCl
2RbCl+MgMgCl2+2Rb↑
上述两种方法主要运用化学平衡移动原理,利用K、Rb沸点低,汽化离开反应体系的性质,使反应正向进行。
考点3 钠 氧化钠 过氧化钠
知 识 梳 理
钠
1. 钠的物理性质
钠是银白色固体,硬度___,密度比煤油___、比水___,通常保存在______中。钠的熔点___于水的沸点,具有良好的导电、导热性。
2. 钠的化学性质(强还原性)(写化学方程式)
(1) 与非金属单质反应
①与O2
常温下:__________________________________________;
加热条件下:_________________________________;
②与Cl2:____________________________________;
③与S:___________________________。
(2) 与水反应:____________________________________________________________;
(3) 与乙醇反应:
_____________________________________________________________________
[Na沉在乙醇底部,反应速率比Na与水反应的___(填“慢”或“快”)]。
(4) 与盐反应
①与熔融盐:
4Na+TiCl4(熔融)4NaCl+Ti
②与盐溶液:Na先与水反应,生成的NaOH再与盐反应。
3. 钠的用途
(1) 制高压钠灯。
(2) 钠、钾合金(常温为液态)用作原子反应堆的导热剂。
(3) 从钛、锆、铌、钽等熔融氯化物中置换出金属单质。
氧化钠和过氧化钠
化学式 Na2O Na2O2
颜色
氧元素化合价
电子式
化学键类型
阴、阳离子个数之比
与水反应(写化学方程式)
与CO2反应(写化学方程式)
是否为碱性氧化物
转化关系 Na2O转化为Na2O2的化学方程式:___________________________________
重要用途 — 强氧化剂、漂白剂、供氧剂
[注意事项] 在防毒面具和潜水艇中经常用Na2O2作为CO2吸收剂,并供给氧气;宇航密封舱中则往往使用较轻的Li2O2。
典 题 悟 法
(2024·江苏各地模拟重组)下列有关钠及其化合物的性质与用途具有对应关系的是( )
A. Na能与水反应,可用于高压钠灯
B. Na具有强还原性,可用于制备金属Ti
C. Na有导电性,可用作快中子反应堆的热交换剂
D. Na2O2受热会分解,可用作呼吸面具中的供氧剂
下列说法正确的是( )
A. 向AlCl3溶液中加入金属Na,比较Na和Al的还原能力
B. 检验乙醇中含有水:用试管取少量的乙醇,加入一小块钠,产生无色气体
C. 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶,集气瓶中产生大量白烟,瓶内有黑色颗粒产生,说明CO2具有氧化性
D. 探究金属钠在氧气中燃烧所得固体粉末的成分:取少量固体粉末,加入2~3 mL蒸馏水,若无气体生成,则固体粉末为Na2O;若有气体生成,则固体粉末为Na2O2
过氧化钠的性质
1. Na2O2的强氧化性:
试剂 主要现象 原理或解释
SO2 — Na2O2+SO2===__________________
Na2SO3溶液 — Na2O2+Na2SO3+H2O===_______________________________
FeCl2溶液 产生红褐色沉淀 4Na2O2+4FeCl2+6H2O===4Fe(OH)3↓+O2↑+8NaCl
氢硫酸 产生淡黄色沉淀 Na2O2+H2S===____________________
品红溶液 红色褪去 Na2O2的强氧化性使之褪色
酚酞溶液 先变红后褪色 2Na2O2+2H2O===4NaOH+O2↑(Na2O2的强氧化性使之褪色)
2. 遇KMnO4等强氧化剂时,Na2O2表现出还原性,氧化产物为O2,如:2MnO+5Na2O2+16H+===2Mn2++5O2↑+10Na++8H2O。
3. Na2O2与CO2、水发生歧化反应。
考点4 碳酸钠 碳酸氢钠
知 识 梳 理
碳酸钠与碳酸氢钠的比较
化学式 Na2CO3 NaHCO3
俗名 _______________ _________
物理性质 颜色、状态 白色粉末 细小白色晶体
溶解性 易溶于水,加入少量水时,______(填“放出”或“吸收”)热量,溶液呈___性 可溶于水,溶解时,______(填“放出”或“吸收”)热量,比Na2CO3的溶解度___,溶液呈___性
化学性质 稳定性 稳定,但Na2CO3·10H2O易______ 不稳定,受热易______
与酸液(如盐酸)反应 CO+H+===_________(酸少量)CO+2H+===____________(酸过量) HCO+H+===____________________
与碱液(如澄清石灰水)反应 Ca2++CO===_______________ Ca2++___OH-+___HCO===_______________________(碱不足)Ca2++___OH-+___HCO===_______________________(碱过量)
主要用途 玻璃、造纸、制皂、洗涤 发酵粉、医药(胃酸中和剂)、灭火器
相互转化 Na2CO3NaHCO3
特别提醒 碳酸氢钠能作胃酸中和剂,碳酸钠不能作胃酸中和剂
碳酸钠与碳酸氢钠的鉴别
性质 操作 结论(填化学式)
溶解性 取等质量的两种固体,加入少量(等量)水 溶解量大的是__________________
稳定性 取等质量的两种固体,分别加热 生成能使澄清石灰水变浑浊的气体的是__________________
碱性 取等物质的量的两种固体,加入等体积(足量)水,测定pH 碱性强的是__________________
与酸反应速率 取等体积、等物质的量浓度的两种盐溶液,分别逐滴加入等浓度的盐酸 产生气泡较快的是__________________
注意 ①不用Ca(OH)2[或Ba(OH)2]溶液鉴别Na2CO3和NaHCO3,因为都有白色沉淀生成,现象相同,无法鉴别;②不用CaCl2(或BaCl2)溶液鉴别Na2CO3和NaHCO3,因为CaCl2(或BaCl2)溶液与NaHCO3溶液也可能产生白色沉淀
侯氏制碱法
侯氏制碱法生产流程可简要表示如下:
1. 先在低温的条件下将NH3(要防倒吸)通入饱和食盐水中,再通入CO2。
2. 主要反应原理:
(1) 产生NaHCO3的反应(写化学方程式,下同):
________________________________________________________________________________。
(2) 产生Na2CO3的反应:
_______________________________________________________________。
3. 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品。通氨气的作用:增大NH的浓度,使NH4Cl更多地析出;使NaHCO3转化为Na2CO3(溶解度大),提高析出的NH4Cl纯度。
4. 绿色化学思想:
可循环使用的物质为________________________。
典 题 悟 法
(2023·泰州)下列物质性质与用途具有对应关系的是( )
A. Na2CO3溶液显碱性,可用作除油污剂
B. NaHCO3受热易分解,可用作抗酸药物
C. Na2O2具有还原性,可用作供氧剂
D. NaClO具有强氧化性,可用作混凝剂
阅读下列材料,完成典例6~7。
侯德榜是我国近代化学工业的奠基人之一,他将“合成氨”工艺和“氨碱法”联合起来,发明了联合制碱法:先用NH3、CO2和精制饱和NaCl溶液制得NaHCO3晶体和母液,NaHCO3加热得到Na2CO3。通过对母液依次采取通入NH3、降温、加NaCl等措施,获得高纯NH4Cl晶体,将食盐的利用率提高到了 98%,在制得纯碱的同时还能获得几乎等质量的NH4Cl,满足了当时农业生产的需要。“氨碱法”的部分工艺流程如下:
(2024·海安期末)下列有关实验室模拟“氨碱法”的实验原理和装置不正确的是( )
A. 制取NH3 B. 制取CO2
C. 净化CO2 D. 制取NaHCO3
(2024·海安期末)下列有关联合制碱法的说法错误的是( )
A. 向母液中通入NH3时,主要反应的离子方程式为HCO+ NH3=== CO+ NH
B. 若对母液直接采取降温的措施,也能获得高纯NH4Cl晶体
C. 加NaCl促进NH(aq)+Cl-(aq)??NH4Cl(s)平衡正向移动,进一步析出NH4Cl
D. 检验碳酸氢钠晶体中是否含有NH4Cl杂质的操作是:取适量晶体,加水溶解;滴加硝酸至无明显现象,再滴加2~3滴AgNO3溶液
(2024·南京、盐城期末)室温下,探究0.1 mol/L NaHCO3溶液的性质。下列实验方案能达到探究目的的是( )
选项 探究目的 实验方案
A HCO是否发生电离 向2 mL 0.1 mol/L NaHCO3溶液中加入一小块钠,观察溶液中是否有气泡产生
B HCO是否发生水解 用干燥洁净的玻璃棒蘸取0.1 mol/L NaHCO3溶液,点在干燥的pH试纸上,测出溶液的pH
C 溶液中是否存在Na+ 取一支洁净的铂丝,蘸取0.1 mol/L NaHCO3溶液后在煤气灯上灼烧,透过蓝色钴玻璃观察火焰颜色
D 溶液中是否存在CO 向2 mL 0.1 mol/L NaHCO3溶液中滴入几滴澄清石灰水,观察溶液是否变浑浊
考点5 碱金属 焰色试验
知 识 梳 理
碱金属(Li、Na、K、Rb、Cs)性质
性质 相似性 递变性(由Li→Cs)
原子结构 最外层均有___个电子 电子层数逐渐增多,核电荷数逐渐增大,原子半径逐渐______
元素性质 都具有较强的金属性,最高正价均为______ 金属性逐渐______
单质性质 物理性质 (除Cs外)都呈银白色,密度较小,熔点___ 密度逐渐增大(钾反常),熔点逐渐______
化学性质 都具有较强的还原性,还原性逐渐______ 与O2反应越来越剧烈,产物越来越复杂
碱金属的特性
1. 碱金属的密度一般随核电荷数的增大而增大,但钾的密度比钠小。
2. 碱金属一般都保存在煤油中,但锂的密度小于煤油,通常将锂密封在石蜡中。
3. 碱金属跟氢气反应生成的碱金属氢化物都是离子化合物,其中氢以H-形式存在,显-1价,碱金属氢化物是强______剂。
4. 试剂瓶中的试剂取出后,一般不能放回原瓶,但Na、K等试剂必须放回原瓶。
5. 锂与O2反应与钠不同,无论是常温还是加热,Li与O2反应只生成Li2O。
焰色试验
1. 焰色试验是物理变化,属于元素的性质。
2. 钠、钾元素的检验
(1) 焰色试验显黄色―→含钠元素。
(2) 焰色试验显紫色―→含钾元素。
3. 进行焰色试验前铂丝先用_________洗涤。
典 题 悟 法
(2024·江苏各地模拟重组)下列说法正确的是( )
A. 灼烧时火焰呈现紫色的物质一定是钾盐
B. 沸点:Na
KO2+H2O ===K++OH-+O2↑
D. 在火焰上灼烧搅拌过某无色溶液的铁丝,火焰出现黄色,溶液中含Na元素
(2023·江苏卷)空气中CO2含量的控制和CO2资源的利用具有重要意义。燃煤烟气中CO2的捕集可通过如下所示的物质转化实现。
“吸收”后所得的KHCO3溶液与石灰乳反应的化学方程式为 __________________________________ _____________________________________________________;载人航天器内,常用LiOH固体而很少用KOH固体吸收空气中的CO2,其原因是__________________________________________________________ ___________。
情景创设
金属氢化物
1. 制备: 碱金属均可与H2直接作用,生成金属氢化物。金属氢化物属于离子化合物,如NaH的电子式为Na+[H]-。
2. 性质:强还原性(金属氢化物中H元素为-1价)。
①NaH+H2O===NaOH+H2↑(NaH为还原剂,水为氧化剂,H2既是氧化产物又是还原产物)
②CaH2+2H2O===Ca(OH)2+2H2↑
例 NaH和NaAlH4都是重要的还原剂,一定条件下,金属钠和H2反应生成NaH。NaH与水反应可生成H2,NaH与AlCl3反应可得到NaAlH4,请推测并回答:
(1) NaH与AlCl3反应得到NaAlH4的化学方程式为____________________________________________ _______________________________。
(2) NaH在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程中生成两种产物,写出该反应的化学方程式:______________________________________________________________。
(3) NaH能将CO2还原成碳并放出H2,该反应的化学方程式为___________________________________ ________________________________________。
1. (2024·江苏各地模拟重组)下列说法正确的是( )
A. 如图所示装置为观察纯碱的焰色试验
B. Li质量轻、比能量大,故可用作电池正极材料
C. Na和Li分别在O2中燃烧得到Na2O和Li2O
D. 用铂丝蘸取某溶液进行焰色试验,火焰呈黄色,说明溶液中无K+
2. (2023·南师附中)下列物质的性质与用途具有对应关系正确的是( )
A. Na2O2属于碱性氧化物,可用于制备少量氧气
B. NaClO有强氧化性,可用于对环境消毒
C. Na2CO3溶液显碱性,可用于去除矿物油(如煤油、柴油)的油污
D. Na2SO3具有还原性,可用于吸收含SO2的尾气
3. (2023·无锡期末)钠及其化合物的转化具有重要应用。下列说法错误的是( )
A. 金属钠与熔融的TiCl4反应可制备金属钛
B. 呼吸面具中的Na2O2吸收人体呼出的CO2和H2O,同时释放出O2
C. 侯氏制碱法的原理是将NH3通入含有CO2的饱和食盐水中制得NaHCO3
D. 泡沫灭火器的原理是利用NaHCO3溶液与Al2 (SO4) 3溶液混合制取CO2
4. (2023·如皋期初)侯氏制碱法的过程如图所示。下列说法正确的是( )
A. 气体X是CO2
B. “吸收 Ⅱ ”时反应的化学方程式为2NaCl+2NH3+CO2+H2O===Na2CO3↓+2NH4Cl
C. 向小苏打溶液中滴加过量Ca(OH)2溶液时反应的离子方程式为2HCO+Ca2++2OH-===CaCO3↓+CO+2H2O
D. 向滤液中加入一定量的NaCl固体并通入氨气可析出NH4Cl固体
第7讲 钠及其化合物
[备考导航]
(1) × (2) √ (3) √ (4) √ (5) √ (6) √ (7) × (8) × (9) √ (10) × (11) ×
考点1
[知识梳理]
知识2 1. 低 2. 大
[典题悟法]
典例1 D 【解析】 低磁钢是合金,合金的熔点低于其成分金属,故低磁钢的熔点低于纯铁,D错误。
考点2
[典题悟法]
典例2 AC 【解析】 Mg冶炼Ti的方法为热还原法。高炉炼铁的原理是用还原剂将铁从其氧化物中还原出来,属于热还原法,A正确;电解熔融氯化钠制钠的方法是电解法,B错误;铝热反应制锰是利用Al作还原剂,将锰从其氧化物中还原出来,为热还原法,C正确;加热分解氧化汞制汞为热分解法,D错误。
考点3
[知识梳理]
知识1 1. 小 大 小 煤油 低
2. (1)①4Na+O2===2Na2O 2Na+O2Na2O2
②2Na+Cl22NaCl ③2Na+SNa2S
(2) 2Na+2H2O===2NaOH+H2↑
(3) 2Na+2C2H5OH―→2C2H5ONa+H2↑ 慢
知识2 白色 淡黄色 -2 -1
离子键 离子键和非极性共价键 1∶2 1∶2
Na2O+H2O===2NaOH 2Na2O2+2H2O===4NaOH+O2↑ Na2O+CO2===Na2CO3 2Na2O2+2CO2===2Na2CO3+O2 是 否 2Na2O+O22Na2O2
[典题悟法]
典例3 B 【解析】 钠元素的焰色为黄色,黄光射程远,透雾力强,用作高压钠灯,与钠和水反应没有对应关系,A错误;钠用作快中子反应堆的热交换剂利用Na的导热性,C错误;Na2O2作供氧剂主要是因为Na2O2与CO2或H2O均能反应,且都有O2生成,D错误。
典例4 C 【解析】 向AlCl3溶液中加入金属Na,Na与水反应生成NaOH,NaOH再与AlCl3反应,不能置换出Al,A错误;乙醇和钠都能与水反应,B错误;Na在CO2中燃烧产生的黑色颗粒为C,说明CO2具有氧化性,C正确;Na也能与水产生气体,D错误。
[深度指津] 1. Na2SO4 Na2SO4+2NaOH S↓+2NaOH
考点4
[知识梳理]
知识1 纯碱或苏打 小苏打 放出 碱 吸收 小 碱
风化 分解 HCO H2O+CO2↑ H2O+CO2↑
CaCO3↓ 2 2 CaCO3↓+CO+2H2O
1 1 CaCO3↓+H2O
知识2 Na2CO3 NaHCO3 Na2CO3 NaHCO3
解疑释惑9
2. (1) NH3+H2O+CO2+NaCl===NaHCO3↓+NH4Cl
(2) 2NaHCO3Na2CO3+CO2↑+H2O
4. NaCl、CO2
[典题悟法]
典例5 A 【解析】 Na2CO3溶液显碱性,油污在碱性条件下水解,Na2CO3可以用作除油污剂,A正确;NaHCO3具有碱性,可以和胃酸反应,与其受热易分解没有对应关系,B错误;Na2O2用作供氧剂是由于Na2O2可与CO2或H2O反应产生O2,在此反应中,Na2O2既是氧化剂也是还原剂,C错误;NaClO具有强氧化性,可用作消毒剂,D错误。
典例6 D 【解析】 NH3的溶解度比CO2的大,应向饱和食盐水中先通入NH3再通入CO2,D错误。
典例7 B 【解析】 向母液中通入NH3,HCO和NH3反应转化为CO和NH,增大NH浓度,A正确;母液中NH4Cl浓度较小,直接采取降温的措施不能获得高纯NH4Cl晶体,B错误;加NaCl,Cl-浓度增大,NH(aq)+Cl-(aq)??NH4Cl(s)平衡正向移动,析出NH4Cl,C正确;滴加硝酸至无明显现象排除HCO的干扰,再滴加AgNO3溶液,若生成沉淀则含有NH4Cl杂质,D正确。
典例8 B 【解析】 Na能与水反应生成H2,对该实验探究产生干扰,A错误;观察Na元素的焰色时,不用透过蓝色钴玻璃观察,C错误; HCO、CO均能与澄清石灰水反应产生白色沉淀,无法检验溶液中是否存在CO,D错误。
考点5
知识1 1 增大 +1 增强 低 降低 增强
知识2 3. 还原
知识3 3. 稀盐酸
[典题悟法]
典例9 D 【解析】 含K+的也可能是KOH,A错误;Na半径小于K,金属键:Na>K,沸点:Na>K,B错误;KO2与水反应生成KOH和O2:4KO2+2H2O===4K++4OH-+3O2↑,C错误;钠的焰色呈黄色,D正确。
典例10 KHCO3+Ca(OH)2===CaCO3↓+KOH+H2O 相同质量时,LiOH吸收CO2的量比KOH的多
[情景创设]
例 (1) 4NaH+AlCl3===NaAlH4+3NaCl
(2) 3NaH+Fe2O3===2Fe+3NaOH
(3) 4NaH+3CO2===2Na2CO3+C+2H2
[质量评价]
1. A 【解析】 Li是活泼金属,可用作电池负极材料,B错误;Na在O2中燃烧生成Na2O2,C错误;应该透过蓝色钴玻璃观察钾元素的焰色,D错误。
2. B 【解析】 Na2O2不是碱性氧化物,A错误;NaClO具有强氧化性,能使蛋白质变性,可用于环境消毒,B正确;Na2CO3水解呈碱性,能促进油脂的水解,但是不能去除矿物油(如煤油、柴油)的油污,C错误;Na2SO3吸收SO2的化学方程式为Na2SO3+SO2+H2O===2NaHSO3,该反应不是氧化还原反应,D错误。
3. C 【解析】 侯氏制碱法的原理是将CO2通入含有NH3的饱和食盐水中制得NaHCO3,C错误。
4. D 【解析】 先向饱和氯化钠溶液中通NH3,再通CO2,X为NH3,Y为CO2,A错误;“吸收Ⅱ”的反应为NaCl+CO2+NH3+H2O===NaHCO3↓+NH4Cl,B错误;向小苏打溶液中滴加过量Ca(OH)2溶液,正确的离子方程式:HCO+Ca2++OH-===CaCO3↓+H2O,C错误;滤液中存在氯化铵和NaHCO3,向滤液中加入一定量的NaCl固体并通入氨气,使溶液中Cl-和NH浓度增大,析出NH4Cl固体,D正确。
同课章节目录
