大单元二 金属元素及其化合物 第8讲 铁及其化合物 学案 (含答案)2026届高三化学一轮大单元复习
文档属性
| 名称 | 大单元二 金属元素及其化合物 第8讲 铁及其化合物 学案 (含答案)2026届高三化学一轮大单元复习 |  | |
| 格式 | DOC | ||
| 文件大小 | 600.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-14 21:19:18 | ||
图片预览




文档简介
第8讲 铁及其化合物
备考导航
复习目标 1. 了解铁及其重要化合物的主要性质和应用。2. 了解Fe2+、Fe3+的检验方法及Fe2+、Fe3+的除杂方法。
熟记网络
课前自测 判断正误(正确的打“√”,错误的打“×”)。(1) (2024·丹阳中学)铁分别与氯气、碘反应生成的产物中,铁的化合价不同( )(2) (2023·如皋期初)将铁粉与硫粉混合后加热,生成黑色物质,说明有Fe2S3生成( )(3) 探究铁与水蒸气反应后固体物质:取少量固体粉末,用磁铁吸引,若磁铁能吸引,则固体物质为Fe3O4( )(4) FeO粉末在空气中受热,迅速被氧化成Fe3O4( )(5) 向酸性KMnO4溶液中加入Fe3O4粉末,紫色褪去,证明Fe3O4中含Fe(Ⅱ) ( )(6) (2023·华罗庚中学)Fe2O3Fe2(SO4)3(aq)无水Fe2(SO4)3( )(7) (2024·常熟中学)FeI2溶液中通入少量Cl2:Cl2+2I-===2Cl-+I2 ( )(8) (2024·南京、盐城一模)检验CO还原Fe2O3实验中,Fe2O3是否全部被还原:向CO还原Fe2O3所得到的产物中加入稀盐酸,再滴加KSCN溶液,观察颜色变化( )(9) (2023·无锡一中)将某补铁剂药片研磨后加入盐酸溶解,滴加KSCN溶液,溶液变红,说明补铁剂中不含Fe2+( )(10) (2024·如皋适应性三)检验Fe粉与Cl2反应后的产物:取一定量Fe粉,在加热条件下通入少量Cl2反应,将固体混合物溶于水后充分搅拌,向溶液中滴加KSCN溶液,观察现象( )
考点1 铁
知 识 梳 理
铁的原子结构
铁元素在元素周期表中处于第四周期___族,位于___区。基态Fe原子的电子排布式为__________________________________________________________________________________________,原子结构示意图为___,最外层有___个电子,在反应中易______电子,故铁单质的化学性质比较活泼,有较强的______性,主要化合价为+2和+3。
铁的性质
1. 物理性质
银白色固体,熔点较高,具有良好的导热、导电、延展性,能被磁铁吸引。
2. 化学性质
(1) 与非金属单质反应
①与氧气反应:
4Fe+3O2+2xH2O===_______________________________________
(现象:在潮湿的空气中生锈,生成______色固体);
3Fe+2O2_______________(现象:剧烈燃烧,火星四射,生成___色固体)。
②与氯气反应(写化学方程式,下同):
__________________________________________(现象:产生______色烟)。
注意:Fe的量无论多少,产物都是FeCl3。
③与溴反应:__________________________________________。
④与碘反应:__________________________。
⑤与硫反应:_____________________
(现象:生成黑色固体) 。
(2) 与水蒸气反应:
___________________________________________________________。
(3) 与酸反应
①非氧化性酸
Fe+2HCl===________________________;
Fe+H2SO4===________________________。
②氧化性酸
常温下,Fe在浓硫酸或浓硝酸中发生______,该变化属于______变化。
Fe+4HNO3(稀)===________________________________________________(Fe少量);
3Fe+8HNO3(稀)===______________________________________________________(Fe过量)。
(4) 与盐溶液反应
Fe+2FeCl3===__________________;
Fe+CuSO4===________________________。
典 题 悟 法
物质的转化
(2023·淮阴、姜堰、徐州一中联考)K2FeO4可用作净水剂。K2FeO4在水中不稳定,会生成Fe(OH)3胶体;碱性条件下KClO氧化性大于K2FeO4。下列有关铁及其化合物的相关转化,在指定条件下能实现的是( )
A. Fe Fe2O3Fe
B. Fe2O3 FeCl3 (aq) 无水FeCl3
C. FeFeCl3FeCl2
D. Fe2O3K2FeO4H2
物质的性质
(2024·江苏各地模拟重组)下列说法正确的是( )
A. 还原铁粉可用作食品干燥剂
B. 铁与碘反应易生成碘化铁
C. 铁分别与稀盐酸和氯气反应,产物中铁元素的化合价相同
D. Fe分别与水蒸气(高温)和氧气(点燃)反应,生成相同的固体产物
考点2 铁的氧化物与氢氧化物
知 识 梳 理
铁的氧化物
化学式 FeO Fe2O3 Fe3O4
俗名 — ______ _______________
颜色 黑色 ______色 黑色
铁元素价态 ______ ______ _______________
与盐酸反应生成的离子 ____________ ____________ —
与稀硝酸反应的离子方程式 FeO:___________________________________________________________Fe2O3:_________________________________________________________Fe3O4:________________________________________________________
与氢碘酸反应的离子方程式 FeO:______________________________________________________Fe2O3:________________________________________________________Fe3O4:________________________________________________________
共同点 高温时,都能被C、CO、H2、Al等还原剂还原,生成单质铁,如:FexOy+yCOxFe+yCO2
注意 FeO不稳定,在空气中受热易被氧化为Fe3O4:6FeO+ O22Fe3O4
铁的氢氧化物
化学式 Fe(OH)2 Fe(OH)3
颜色 ___色 ______色
与盐酸反应 Fe(OH)2+2H+===_______________________ Fe(OH)3+3H+===___________________
受热分解 — 2Fe(OH)3______________________
制法 可溶性亚铁盐与碱溶液反应:Fe2++2OH-===_____________________ 可溶性铁盐与碱溶液反应:Fe3++3OH-===_____________________
二者的关系 在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是___色絮状沉淀迅速变成______色,最后变成______色,化学方程式:4Fe(OH)2+O2+2H2O===________________________
典 题 悟 法
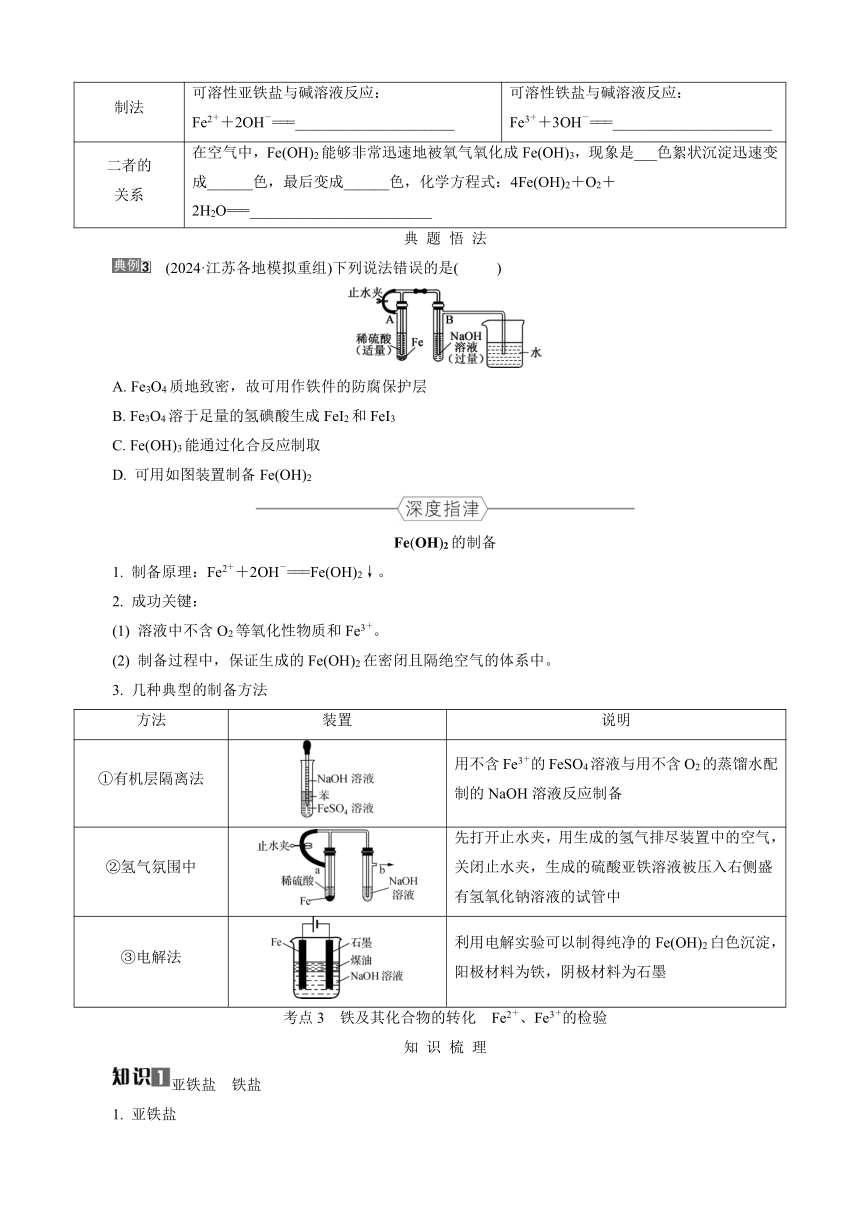
(2024·江苏各地模拟重组)下列说法错误的是( )
A. Fe3O4质地致密,故可用作铁件的防腐保护层
B. Fe3O4溶于足量的氢碘酸生成FeI2和FeI3
C. Fe(OH)3能通过化合反应制取
D. 可用如图装置制备Fe(OH)2
Fe(OH)2的制备
1. 制备原理:Fe2++2OH-===Fe(OH)2↓。
2. 成功关键:
(1) 溶液中不含O2等氧化性物质和Fe3+。
(2) 制备过程中,保证生成的Fe(OH)2在密闭且隔绝空气的体系中。
3. 几种典型的制备方法
方法 装置 说明
①有机层隔离法 用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备
②氢气氛围中 先打开止水夹,用生成的氢气排尽装置中的空气,关闭止水夹,生成的硫酸亚铁溶液被压入右侧盛有氢氧化钠溶液的试管中
③电解法 利用电解实验可以制得纯净的Fe(OH)2白色沉淀,阳极材料为铁,阴极材料为石墨
考点3 铁及其化合物的转化 Fe2+、Fe3+的检验
知 识 梳 理
亚铁盐 铁盐
1. 亚铁盐
(1) 基态Fe2+的简化电子排布式为_____________________。Fe2+既有氧化性,又有还原性,以_________为主,能被Cl2、Br2、O2、H2O2、ClO-、NO(H+)、MnO(H+)、Cr2O(H+)等氧化。
(2) 亚铁盐可水解。由Fe2+和强酸的酸根阴离子构成的盐(如硫酸亚铁)的水溶液呈酸性。配制硫酸亚铁溶液时,常加少量______抑制Fe2+的水解,加少量______防止Fe2+被氧化。
2. 铁盐
(1) 基态Fe3+的简化电子排布式为_____________________。Fe3+主要表现_________,能被Fe、Cu、I-、H2S、S2-(HS-)、SO、SO2等还原。
(2) 铁盐易水解。Fe3+极易水解,Fe3+只能存在于酸性较强的溶液中。
①实验室可将饱和FeCl3溶液滴入沸水中制取氢氧化铁胶体,写出该反应的化学方程式:
______________________________________________________________________________。
②工业上常用调节pH的方法除去溶液中的Fe3+。如可通过加入_________________________________ __________________调节pH来除去MgCl2溶液中的Fe3+。
③实验室配制氯化铁溶液,通常将氯化铁固体先溶于较浓的______中,然后再加水稀释至所需的浓度。
④在_________气流中加热蒸干FeCl3溶液制备无水FeCl3。
⑤Fe3+与CO、HCO、[Al(OH)4]-等水解呈碱性的离子不能大量共存。如:
Fe3++3HCO===____________________________________。
高铁酸盐(以K2FeO4为例)
1. 制备方法
(1) 高温熔融反应法
在苛性碱存在的条件下,KNO3或过氧化物等氧化剂在高温下可将铁盐或铁的氧化物氧化成高铁酸盐。如:
Fe2O3+3K2O22K2FeO4+K2O。
(2) 次氯酸盐氧化法
在NaOH溶液中,利用NaClO氧化Fe(Ⅲ)化合物,生成Na2FeO4。利用K2FeO4溶解度比Na2FeO4低,向Na2FeO4溶液中加入固体KOH或饱和KOH溶液,使Na2FeO4转化成K2FeO4,并从溶液中析出。
(3) 电解法
以铁作阳极,电解高浓度的KOH溶液生成K2FeO4。
2. 性质
酸性条件下,高铁酸盐因氧化性极强而不稳定:4FeO+20H+===4Fe3++3O2↑+10H2O。
3. 在水处理方面的应用
(1) K2FeO4中Fe元素呈+6价,具有强氧化性,可用于水体的杀菌、消毒。
(2) 原理:4K2FeO4+10H2O===8KOH+4Fe(OH)3(胶体)+3O2↑。
K2FeO4与水反应生成Fe(OH)3胶体,能吸附水体中的悬浮物,起到净水的作用。
铁及其化合物的转化
完成下列转化反应的化学(或离子)方程式。
1. FeFe2+
Fe+S_________;
Fe+Cu2+===_____________________;
Fe+2H+===________________________。
2. Fe2+Fe
Fe2++Zn===_____________________;
FeO+H2__________________;
3FeO+2Al___________________________。
3. FeFe3+
2Fe+3Cl2__________________;
Fe+4H++NO===____________________________________(稀硝酸)。
4. Fe3+Fe
Fe2O3+3CO________________________;
Fe2O3+2Al___________________________。
5. Fe2+Fe3+
2Fe2++Cl2===______________________________;
2Fe2++Br2===______________________________;
2Fe2++H2O2+2H+===______________________________;
4Fe2++O2+4H+===______________________________
(亚铁盐溶液在空气中易变质)
3Fe2++4H++NO===_______________________________________;
MnO+5Fe2++8H+===_____________________________________________;
Cr2O+6Fe2++14H+===________________________________________________。
6. Fe3+Fe2+
2Fe3++Zn===______________________________(Zn少量);
2Fe3++Fe===_______________(亚铁盐溶液中加入少量铁屑以防止Fe2+被氧化);
2Fe3++Cu===______________________________
(FeCl3溶液腐蚀电路板) ;
2Fe3++2I-===________________________;
2Fe3++H2S===_________________________________;
2Fe3++SO+H2O===____________________________________;
2Fe3++SO2+2H2O===____________________________________。
溶液中Fe2+、Fe3+的检验方法
1. Fe2+的检验
方法一:向待检液中滴加KSCN溶液,无明显现象,再滴加新制氯水(或H2O2溶液),溶液立即变红色。
方法二:向待检液中滴加K3[Fe(CN)6](铁氰化钾)溶液,生成蓝色沉淀。离子方程式:_________________ _____________________________________________________________________________________。
方法三:向待检液中滴加NaOH溶液,生成___色絮状沉淀,沉淀迅速变为______色,最后变为______色。
2. Fe3+的检验
方法一:向待检液中滴加KSCN(或NH4SCN)溶液,溶液立即变为___色。离子方程式:____________________________________________________________。
方法二:向待检液中滴加K4[Fe(CN)6](亚铁氰化钾)溶液,生成蓝色沉淀。
注意:Fe3+、Fe2+、Cl-同时存在时不能用酸性KMnO4溶液检验Fe2+(Cl-能还原酸性 KMnO4,有干扰)。
有关铁的除杂
主要成分 杂质 所加试剂及离子方程式
FeCl3(aq) FeCl2 _________,________________________________________________________
FeCl2(aq) FeCl3 ______,________________________________________________
FeCl2(aq) CuCl2 ______,___________________________________________________
Fe2(SO4)3(aq) FeSO4 __________________,__________________________________________
Fe2O3 Al2O3 ________________________,_______________________________________
典 题 悟 法
Fe3+、Fe3+的性质及检验
(2023·江苏卷)室温下,探究0.1 mol/L FeSO4溶液的性质。下列实验方案能达到探究目的的是( )
选项 探究目的 实验方案
A 溶液中是否含有Fe3+ 向2 mL FeSO4溶液中滴加几滴新制氯水,再滴加KSCN溶液,观察溶液颜色变化
B Fe2+是否有还原性 向2 mL FeSO4溶液中滴加几滴酸性KMnO4溶液,观察溶液颜色变化
C Fe2+是否水解 向2 mL FeSO4溶液中滴加2~3滴酚酞试液,观察溶液颜色变化
D Fe2+能否催化H2O2分解 向2 mL 5%H2O2溶液中滴加几滴FeSO4溶液,观察气泡产生情况
高铁酸盐
(2023·泰州中学)高铁酸钾(K2FeO4)是一种在强碱溶液中比较稳定、氧化性较强的氧化剂,在水处理领域有着巨大的应用前景。K2FeO4的制备方法有多种,最常见的是次氯酸盐氧化法和电化学氧化法。
(1) 次氯酸盐氧化法:用KClO碱性溶液与Fe(NO3)3饱和溶液可制备K2FeO4,两种溶液的混合方式为______________________________________________________________________________________。
(2) 电化学氧化法:用如图所示装置制得Na2FeO4,然后再通过饱和KOH溶液碱洗后得到K2FeO4。装置中两端隔室中离子不能进入中间隔室,则离子交换膜a为_________(填“阳离子”或“阴离子”)交换膜,含有Na2FeO4的溶液为___(填“甲”或“乙”)溶液。
情景创设
有关Fe3+、Fe2+的除杂方法
1. 除去Mg2+中混有的Fe3+的方法
向混合溶液中加入MgO或MgCO3或Mg(OH)2,与Fe3+水解产生的H+反应,促进Fe3+的水解,将Fe3+转化为Fe(OH)3沉淀而除去。
2. 除去Mg2+中混有的Fe2+的方法
先加入氧化剂(如H2O2)将溶液中的Fe2+氧化成Fe3+,然后再按“除去Mg2+中混有的Fe3+”的方法除去溶液中的Fe3+。
3. 除去Cu2+中混有的Fe3+的方法
向混合溶液中加入CuO或Cu(OH)2或Cu2(OH)2CO3,与Fe3+水解产生的H+反应,促进Fe3+的水解,将Fe3+转化为Fe(OH)3沉淀而除去。
4. 除去Cu2+中混有的Fe2+的方法
先加入氧化剂(如H2O2)将溶液中的Fe2+氧化成Fe3+,然后再按“除去Cu2+中混有的Fe3+”的方法除去溶液中的Fe3+。
1. (2023·苏州期初)下列有关铁及其化合物的性质与用途具有对应关系的是( )
A. 一定条件下,铁粉遇空气发生反应放热,可用于制作暖贴
B. Fe2O3能与酸反应,可用于制作红色颜料
C. FeCl3溶液显酸性,可用于腐蚀印刷电路板上的铜
D. FeS难溶于水,可用于去除废水中微量六价铬[Cr(Ⅵ)]
2. (2024·高邮检测)下列有关铁及其化合物的实验装置和操作能达到实验目的是( )
甲 乙 丙 丁
A. 用装置甲制备Fe(OH)2
B. 用装置乙制备NO2气体
C. 用装置丙制备Fe2(SO4)3晶体
D. 用装置丁制备Fe(OH)3胶体
3. (2024·宝应)下列说法正确的是( )
A. 工业制硫酸涉及的物质转化:FeS2SO3H2SO4
B. 实验室制溴苯涉及的物质转化:FeFeBr2,
C. 利用高温水蒸气处理铁器的化学方程式:3Fe+4H2O(g)Fe3O4+4H2
D. 利用铁粉从AgCl中获取Ag的离子方程式:Fe+2Ag+===Fe2++2Ag
4. (2025·常州一模)室温下,下列实验操作和现象能验证相应实验结论的是( )
选项 实验操作和现象 实验结论
A 向等质量的Na2CO3和NaHCO3固体中分别加入等体积蒸馏水,NaHCO3固体未完全溶解 溶解性:Na2CO3>NaHCO3
B 向Fe2O3粉末和Al粉的均匀混合物中插入点燃的Mg条,火星四射,有液态Fe从固体中流出 金属活动性:Mg>Fe
C 向2 mL 0.1 mol/L FeI2溶液中滴入几滴新制氯水,溶液变为黄色 还原性:I->Cl-
D 向2 mL 0.1 mol/L CuSO4溶液中滴入几滴饱和H2S溶液,产生黑色沉淀 酸性:H2SO4>H2S
第8讲 铁及其化合物
[备考导航]
(1) √ (2) × (3) × (4) √ (5) √ (6) √ (7) √ (8) × (9) × (10) ×
考点1
[知识梳理]
知识1 Ⅷ d 1s22s22p63s23p63d64s2或[Ar]3d64s2
2 失去 还原
知识2
2. (1) ①2(Fe2O3·xH2O) 红棕 Fe3O4 黑
②2Fe+3Cl22FeCl3 棕褐 ③2Fe+3Br22FeBr3
④Fe+I2FeI2 ⑤Fe+SFeS
(2) 3Fe+4H2O(g)Fe3O4+4H2
(3) ①FeCl2+H2↑ FeSO4+H2↑
②钝化 化学 Fe(NO3)3+NO↑+2H2O
3Fe(NO3)2+2NO↑+4H2O (4) 3FeCl2 FeSO4+Cu
[典题悟法]
典例1 C 【解析】 铁与水蒸气高温反应生成Fe3O4,不是Fe2O3,A错误;FeCl3水解生成Fe(OH)3和盐酸,加热促进水解,盐酸挥发,蒸发FeCl3溶液得到Fe(OH)3,得不到无水FeCl3,B错误;K2FeO4有氧化性,K2FeO4与水反应生成的气体为O2,D错误。
典例2 D 【解析】 还原铁粉可用作食品抗氧化剂,A错误;铁与碘反应生成FeI2,B错误;Fe与盐酸生成FeCl2,Fe与Cl2一定条件下反应生成FeCl3,C错误;Fe与水蒸气高温条件下反应生成Fe3O4和H2,Fe在氧气中燃烧生成Fe3O4,D正确。
考点2
知识1
铁红 磁性氧化铁 红棕 +2 +3 +2、+3 Fe2+ Fe3+ 3FeO+10H++NO===3Fe3++NO↑+5H2O Fe2O3+6H+===2Fe3++3H2O
3Fe3O4+28H++NO===9Fe3++NO↑+14H2O
FeO+2H+===Fe2++H2O
Fe2O3+6H++2I-===2Fe2++I2+3H2O
Fe3O4+8H++2I-===3Fe2++I2+4H2O
知识2
白 红褐 Fe2++2H2O Fe3++3H2O Fe2O3+3H2O
Fe(OH)2↓ Fe(OH)3↓ 白 灰绿 红褐 4Fe(OH)3
[典题悟法]
典例3 B 【解析】 Fe3O4为磁性氧化铁,质地致密,可阻止内部Fe与空气、水接触,故可用作铁件的防腐保护层,A正确;由氧化性:Fe3+>I2知,Fe3+可将I-氧化为I2,故Fe3O4溶于足量氢碘酸不能生成FeI3,B错误;由4Fe(OH)2+O2+2H2O=== 4Fe(OH)3知,Fe(OH)3能通过化合反应制取,C正确;可用该图制得Fe(OH)2,D正确。
考点3
知识1
1. (1) [Ar]3d6 还原性 (2) 硫酸 铁粉
2. (1) [Ar]3d5 氧化性
[常考归纳]
①FeCl3+3H2OFe(OH)3(胶体)+3HCl
②MgO或Mg(OH)2或MgCO3 ③盐酸 ④HCl
⑤Fe(OH)3↓+3CO2↑
知识3
1. FeS Fe2++Cu Fe2++H2↑
2. Fe+Zn2+ Fe+H2O 3Fe+Al2O3
3. 2FeCl3 Fe3++NO↑+2H2O
4. 2Fe+3CO2 2Fe+Al2O3
5. 2Fe3++2Cl- 2Fe3++2Br- 2Fe3++2H2O 4Fe3++2H2O 3Fe3++NO↑+2H2O 5Fe3++Mn2++4H2O
6Fe3++2Cr3++7H2O
6. 2Fe2++Zn2+ 3Fe2+ 2Fe2++Cu2+ 2Fe2++I2 2Fe2++S↓+2H+ 2Fe2++SO+2H+
2Fe2++SO+4H+
知识4
1. K++Fe2++[Fe(CN)6]3-===KFe[Fe(CN)6]↓ 白 灰绿 红褐 2. 红 Fe3++3SCN-??Fe(SCN)3
解疑释惑10
Cl2 2Fe2++Cl2===2Cl-+2Fe3+(或H2O2溶液 2Fe2++H2O2+2H+===2Fe3++2H2O)
铁粉 2Fe3++Fe===3Fe2+
铁粉 Cu2++Fe===Cu+Fe2+
H2O2溶液 2Fe2++H2O2+2H+===2Fe3++2H2O
过量NaOH溶液 Al2O3+2OH-+3H2O ===2[Al(OH)4]-
[典题悟法]
典例4 B 【解析】 取少量溶液于试管中,加入KSCN溶液,若溶液变红色,说明有Fe3+,不能先滴加新制的氯水,A错误;Fe2+水解显酸性,不能使酚酞变色,C错误;该方法没有对比实验,无法判断,D错误。
典例5 (1)在搅拌下将Fe(NO3)3饱和溶液缓慢滴加到KClO碱性溶液中 (2)阳离子 乙
【解析】 (1)K2FeO4在强碱溶液中比较稳定,应将Fe(NO3)3溶液逐滴加入KClO碱性溶液中。
[质量评价]
1. A 【解析】 铁的氧化反应为放热反应,A正确;Fe2O3为红棕色固体,可作红色颜料,与Fe2O3能与酸反应无关,B错误;氯化铁有氧化性,能将铜氧化生成Cu2+,不是因为FeCl3溶液有酸性,C错误;FeS具有还原性,可除去废水中的微量六价铬[Cr(Ⅵ)],与FeS难溶于水无关,D错误。
2. C 【解析】 四氯化碳的密度比水大,应在下层,不能起到隔绝氧气的作用,A错误;常温下Fe遇浓硝酸发生钝化,不能制备NO2,B错误;氢氧化钠溶液与氯化铁反应生成Fe(OH)3沉淀,应将饱和氯化铁溶液滴入沸水中制备Fe(OH)3胶体,D错误。
3. C 【解析】 FeS2高温下与氧气反应生成的是SO2,A错误;Fe与Br2反应生成FeBr3,B错误;水蒸气与铁在高温下反应生成Fe3O4和H2,C正确;AgCl难溶,离子方程式中不能拆开,D错误。
4. A 【解析】 该实验为铝热反应,反应为2Al+Fe2O32Fe+Al2O3,点燃的镁为反应提供高温的条件,生成液态的铁,该反应说明还原性:铝>铁,B错误;还原性:I->Fe2+,FeI2的溶液中滴入几滴氯水,溶液变黄色,说明少量的I-被氧化为单质碘,含少量单质碘的溶液呈现黄色,但是若Fe2+被氧化为Fe3+,含Fe3+的溶液颜色也是黄色,形成干扰,故该实验中,溶液呈现黄色,不能说明还原性:I->Cl-,C错误;CuSO4溶液中滴入H2S溶液发生反应,生成更难溶的CuS沉淀,不能得出酸性:H2SO4>H2S,D错误。
备考导航
复习目标 1. 了解铁及其重要化合物的主要性质和应用。2. 了解Fe2+、Fe3+的检验方法及Fe2+、Fe3+的除杂方法。
熟记网络
课前自测 判断正误(正确的打“√”,错误的打“×”)。(1) (2024·丹阳中学)铁分别与氯气、碘反应生成的产物中,铁的化合价不同( )(2) (2023·如皋期初)将铁粉与硫粉混合后加热,生成黑色物质,说明有Fe2S3生成( )(3) 探究铁与水蒸气反应后固体物质:取少量固体粉末,用磁铁吸引,若磁铁能吸引,则固体物质为Fe3O4( )(4) FeO粉末在空气中受热,迅速被氧化成Fe3O4( )(5) 向酸性KMnO4溶液中加入Fe3O4粉末,紫色褪去,证明Fe3O4中含Fe(Ⅱ) ( )(6) (2023·华罗庚中学)Fe2O3Fe2(SO4)3(aq)无水Fe2(SO4)3( )(7) (2024·常熟中学)FeI2溶液中通入少量Cl2:Cl2+2I-===2Cl-+I2 ( )(8) (2024·南京、盐城一模)检验CO还原Fe2O3实验中,Fe2O3是否全部被还原:向CO还原Fe2O3所得到的产物中加入稀盐酸,再滴加KSCN溶液,观察颜色变化( )(9) (2023·无锡一中)将某补铁剂药片研磨后加入盐酸溶解,滴加KSCN溶液,溶液变红,说明补铁剂中不含Fe2+( )(10) (2024·如皋适应性三)检验Fe粉与Cl2反应后的产物:取一定量Fe粉,在加热条件下通入少量Cl2反应,将固体混合物溶于水后充分搅拌,向溶液中滴加KSCN溶液,观察现象( )
考点1 铁
知 识 梳 理
铁的原子结构
铁元素在元素周期表中处于第四周期___族,位于___区。基态Fe原子的电子排布式为__________________________________________________________________________________________,原子结构示意图为___,最外层有___个电子,在反应中易______电子,故铁单质的化学性质比较活泼,有较强的______性,主要化合价为+2和+3。
铁的性质
1. 物理性质
银白色固体,熔点较高,具有良好的导热、导电、延展性,能被磁铁吸引。
2. 化学性质
(1) 与非金属单质反应
①与氧气反应:
4Fe+3O2+2xH2O===_______________________________________
(现象:在潮湿的空气中生锈,生成______色固体);
3Fe+2O2_______________(现象:剧烈燃烧,火星四射,生成___色固体)。
②与氯气反应(写化学方程式,下同):
__________________________________________(现象:产生______色烟)。
注意:Fe的量无论多少,产物都是FeCl3。
③与溴反应:__________________________________________。
④与碘反应:__________________________。
⑤与硫反应:_____________________
(现象:生成黑色固体) 。
(2) 与水蒸气反应:
___________________________________________________________。
(3) 与酸反应
①非氧化性酸
Fe+2HCl===________________________;
Fe+H2SO4===________________________。
②氧化性酸
常温下,Fe在浓硫酸或浓硝酸中发生______,该变化属于______变化。
Fe+4HNO3(稀)===________________________________________________(Fe少量);
3Fe+8HNO3(稀)===______________________________________________________(Fe过量)。
(4) 与盐溶液反应
Fe+2FeCl3===__________________;
Fe+CuSO4===________________________。
典 题 悟 法
物质的转化
(2023·淮阴、姜堰、徐州一中联考)K2FeO4可用作净水剂。K2FeO4在水中不稳定,会生成Fe(OH)3胶体;碱性条件下KClO氧化性大于K2FeO4。下列有关铁及其化合物的相关转化,在指定条件下能实现的是( )
A. Fe Fe2O3Fe
B. Fe2O3 FeCl3 (aq) 无水FeCl3
C. FeFeCl3FeCl2
D. Fe2O3K2FeO4H2
物质的性质
(2024·江苏各地模拟重组)下列说法正确的是( )
A. 还原铁粉可用作食品干燥剂
B. 铁与碘反应易生成碘化铁
C. 铁分别与稀盐酸和氯气反应,产物中铁元素的化合价相同
D. Fe分别与水蒸气(高温)和氧气(点燃)反应,生成相同的固体产物
考点2 铁的氧化物与氢氧化物
知 识 梳 理
铁的氧化物
化学式 FeO Fe2O3 Fe3O4
俗名 — ______ _______________
颜色 黑色 ______色 黑色
铁元素价态 ______ ______ _______________
与盐酸反应生成的离子 ____________ ____________ —
与稀硝酸反应的离子方程式 FeO:___________________________________________________________Fe2O3:_________________________________________________________Fe3O4:________________________________________________________
与氢碘酸反应的离子方程式 FeO:______________________________________________________Fe2O3:________________________________________________________Fe3O4:________________________________________________________
共同点 高温时,都能被C、CO、H2、Al等还原剂还原,生成单质铁,如:FexOy+yCOxFe+yCO2
注意 FeO不稳定,在空气中受热易被氧化为Fe3O4:6FeO+ O22Fe3O4
铁的氢氧化物
化学式 Fe(OH)2 Fe(OH)3
颜色 ___色 ______色
与盐酸反应 Fe(OH)2+2H+===_______________________ Fe(OH)3+3H+===___________________
受热分解 — 2Fe(OH)3______________________
制法 可溶性亚铁盐与碱溶液反应:Fe2++2OH-===_____________________ 可溶性铁盐与碱溶液反应:Fe3++3OH-===_____________________
二者的关系 在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是___色絮状沉淀迅速变成______色,最后变成______色,化学方程式:4Fe(OH)2+O2+2H2O===________________________
典 题 悟 法
(2024·江苏各地模拟重组)下列说法错误的是( )
A. Fe3O4质地致密,故可用作铁件的防腐保护层
B. Fe3O4溶于足量的氢碘酸生成FeI2和FeI3
C. Fe(OH)3能通过化合反应制取
D. 可用如图装置制备Fe(OH)2
Fe(OH)2的制备
1. 制备原理:Fe2++2OH-===Fe(OH)2↓。
2. 成功关键:
(1) 溶液中不含O2等氧化性物质和Fe3+。
(2) 制备过程中,保证生成的Fe(OH)2在密闭且隔绝空气的体系中。
3. 几种典型的制备方法
方法 装置 说明
①有机层隔离法 用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备
②氢气氛围中 先打开止水夹,用生成的氢气排尽装置中的空气,关闭止水夹,生成的硫酸亚铁溶液被压入右侧盛有氢氧化钠溶液的试管中
③电解法 利用电解实验可以制得纯净的Fe(OH)2白色沉淀,阳极材料为铁,阴极材料为石墨
考点3 铁及其化合物的转化 Fe2+、Fe3+的检验
知 识 梳 理
亚铁盐 铁盐
1. 亚铁盐
(1) 基态Fe2+的简化电子排布式为_____________________。Fe2+既有氧化性,又有还原性,以_________为主,能被Cl2、Br2、O2、H2O2、ClO-、NO(H+)、MnO(H+)、Cr2O(H+)等氧化。
(2) 亚铁盐可水解。由Fe2+和强酸的酸根阴离子构成的盐(如硫酸亚铁)的水溶液呈酸性。配制硫酸亚铁溶液时,常加少量______抑制Fe2+的水解,加少量______防止Fe2+被氧化。
2. 铁盐
(1) 基态Fe3+的简化电子排布式为_____________________。Fe3+主要表现_________,能被Fe、Cu、I-、H2S、S2-(HS-)、SO、SO2等还原。
(2) 铁盐易水解。Fe3+极易水解,Fe3+只能存在于酸性较强的溶液中。
①实验室可将饱和FeCl3溶液滴入沸水中制取氢氧化铁胶体,写出该反应的化学方程式:
______________________________________________________________________________。
②工业上常用调节pH的方法除去溶液中的Fe3+。如可通过加入_________________________________ __________________调节pH来除去MgCl2溶液中的Fe3+。
③实验室配制氯化铁溶液,通常将氯化铁固体先溶于较浓的______中,然后再加水稀释至所需的浓度。
④在_________气流中加热蒸干FeCl3溶液制备无水FeCl3。
⑤Fe3+与CO、HCO、[Al(OH)4]-等水解呈碱性的离子不能大量共存。如:
Fe3++3HCO===____________________________________。
高铁酸盐(以K2FeO4为例)
1. 制备方法
(1) 高温熔融反应法
在苛性碱存在的条件下,KNO3或过氧化物等氧化剂在高温下可将铁盐或铁的氧化物氧化成高铁酸盐。如:
Fe2O3+3K2O22K2FeO4+K2O。
(2) 次氯酸盐氧化法
在NaOH溶液中,利用NaClO氧化Fe(Ⅲ)化合物,生成Na2FeO4。利用K2FeO4溶解度比Na2FeO4低,向Na2FeO4溶液中加入固体KOH或饱和KOH溶液,使Na2FeO4转化成K2FeO4,并从溶液中析出。
(3) 电解法
以铁作阳极,电解高浓度的KOH溶液生成K2FeO4。
2. 性质
酸性条件下,高铁酸盐因氧化性极强而不稳定:4FeO+20H+===4Fe3++3O2↑+10H2O。
3. 在水处理方面的应用
(1) K2FeO4中Fe元素呈+6价,具有强氧化性,可用于水体的杀菌、消毒。
(2) 原理:4K2FeO4+10H2O===8KOH+4Fe(OH)3(胶体)+3O2↑。
K2FeO4与水反应生成Fe(OH)3胶体,能吸附水体中的悬浮物,起到净水的作用。
铁及其化合物的转化
完成下列转化反应的化学(或离子)方程式。
1. FeFe2+
Fe+S_________;
Fe+Cu2+===_____________________;
Fe+2H+===________________________。
2. Fe2+Fe
Fe2++Zn===_____________________;
FeO+H2__________________;
3FeO+2Al___________________________。
3. FeFe3+
2Fe+3Cl2__________________;
Fe+4H++NO===____________________________________(稀硝酸)。
4. Fe3+Fe
Fe2O3+3CO________________________;
Fe2O3+2Al___________________________。
5. Fe2+Fe3+
2Fe2++Cl2===______________________________;
2Fe2++Br2===______________________________;
2Fe2++H2O2+2H+===______________________________;
4Fe2++O2+4H+===______________________________
(亚铁盐溶液在空气中易变质)
3Fe2++4H++NO===_______________________________________;
MnO+5Fe2++8H+===_____________________________________________;
Cr2O+6Fe2++14H+===________________________________________________。
6. Fe3+Fe2+
2Fe3++Zn===______________________________(Zn少量);
2Fe3++Fe===_______________(亚铁盐溶液中加入少量铁屑以防止Fe2+被氧化);
2Fe3++Cu===______________________________
(FeCl3溶液腐蚀电路板) ;
2Fe3++2I-===________________________;
2Fe3++H2S===_________________________________;
2Fe3++SO+H2O===____________________________________;
2Fe3++SO2+2H2O===____________________________________。
溶液中Fe2+、Fe3+的检验方法
1. Fe2+的检验
方法一:向待检液中滴加KSCN溶液,无明显现象,再滴加新制氯水(或H2O2溶液),溶液立即变红色。
方法二:向待检液中滴加K3[Fe(CN)6](铁氰化钾)溶液,生成蓝色沉淀。离子方程式:_________________ _____________________________________________________________________________________。
方法三:向待检液中滴加NaOH溶液,生成___色絮状沉淀,沉淀迅速变为______色,最后变为______色。
2. Fe3+的检验
方法一:向待检液中滴加KSCN(或NH4SCN)溶液,溶液立即变为___色。离子方程式:____________________________________________________________。
方法二:向待检液中滴加K4[Fe(CN)6](亚铁氰化钾)溶液,生成蓝色沉淀。
注意:Fe3+、Fe2+、Cl-同时存在时不能用酸性KMnO4溶液检验Fe2+(Cl-能还原酸性 KMnO4,有干扰)。
有关铁的除杂
主要成分 杂质 所加试剂及离子方程式
FeCl3(aq) FeCl2 _________,________________________________________________________
FeCl2(aq) FeCl3 ______,________________________________________________
FeCl2(aq) CuCl2 ______,___________________________________________________
Fe2(SO4)3(aq) FeSO4 __________________,__________________________________________
Fe2O3 Al2O3 ________________________,_______________________________________
典 题 悟 法
Fe3+、Fe3+的性质及检验
(2023·江苏卷)室温下,探究0.1 mol/L FeSO4溶液的性质。下列实验方案能达到探究目的的是( )
选项 探究目的 实验方案
A 溶液中是否含有Fe3+ 向2 mL FeSO4溶液中滴加几滴新制氯水,再滴加KSCN溶液,观察溶液颜色变化
B Fe2+是否有还原性 向2 mL FeSO4溶液中滴加几滴酸性KMnO4溶液,观察溶液颜色变化
C Fe2+是否水解 向2 mL FeSO4溶液中滴加2~3滴酚酞试液,观察溶液颜色变化
D Fe2+能否催化H2O2分解 向2 mL 5%H2O2溶液中滴加几滴FeSO4溶液,观察气泡产生情况
高铁酸盐
(2023·泰州中学)高铁酸钾(K2FeO4)是一种在强碱溶液中比较稳定、氧化性较强的氧化剂,在水处理领域有着巨大的应用前景。K2FeO4的制备方法有多种,最常见的是次氯酸盐氧化法和电化学氧化法。
(1) 次氯酸盐氧化法:用KClO碱性溶液与Fe(NO3)3饱和溶液可制备K2FeO4,两种溶液的混合方式为______________________________________________________________________________________。
(2) 电化学氧化法:用如图所示装置制得Na2FeO4,然后再通过饱和KOH溶液碱洗后得到K2FeO4。装置中两端隔室中离子不能进入中间隔室,则离子交换膜a为_________(填“阳离子”或“阴离子”)交换膜,含有Na2FeO4的溶液为___(填“甲”或“乙”)溶液。
情景创设
有关Fe3+、Fe2+的除杂方法
1. 除去Mg2+中混有的Fe3+的方法
向混合溶液中加入MgO或MgCO3或Mg(OH)2,与Fe3+水解产生的H+反应,促进Fe3+的水解,将Fe3+转化为Fe(OH)3沉淀而除去。
2. 除去Mg2+中混有的Fe2+的方法
先加入氧化剂(如H2O2)将溶液中的Fe2+氧化成Fe3+,然后再按“除去Mg2+中混有的Fe3+”的方法除去溶液中的Fe3+。
3. 除去Cu2+中混有的Fe3+的方法
向混合溶液中加入CuO或Cu(OH)2或Cu2(OH)2CO3,与Fe3+水解产生的H+反应,促进Fe3+的水解,将Fe3+转化为Fe(OH)3沉淀而除去。
4. 除去Cu2+中混有的Fe2+的方法
先加入氧化剂(如H2O2)将溶液中的Fe2+氧化成Fe3+,然后再按“除去Cu2+中混有的Fe3+”的方法除去溶液中的Fe3+。
1. (2023·苏州期初)下列有关铁及其化合物的性质与用途具有对应关系的是( )
A. 一定条件下,铁粉遇空气发生反应放热,可用于制作暖贴
B. Fe2O3能与酸反应,可用于制作红色颜料
C. FeCl3溶液显酸性,可用于腐蚀印刷电路板上的铜
D. FeS难溶于水,可用于去除废水中微量六价铬[Cr(Ⅵ)]
2. (2024·高邮检测)下列有关铁及其化合物的实验装置和操作能达到实验目的是( )
甲 乙 丙 丁
A. 用装置甲制备Fe(OH)2
B. 用装置乙制备NO2气体
C. 用装置丙制备Fe2(SO4)3晶体
D. 用装置丁制备Fe(OH)3胶体
3. (2024·宝应)下列说法正确的是( )
A. 工业制硫酸涉及的物质转化:FeS2SO3H2SO4
B. 实验室制溴苯涉及的物质转化:FeFeBr2,
C. 利用高温水蒸气处理铁器的化学方程式:3Fe+4H2O(g)Fe3O4+4H2
D. 利用铁粉从AgCl中获取Ag的离子方程式:Fe+2Ag+===Fe2++2Ag
4. (2025·常州一模)室温下,下列实验操作和现象能验证相应实验结论的是( )
选项 实验操作和现象 实验结论
A 向等质量的Na2CO3和NaHCO3固体中分别加入等体积蒸馏水,NaHCO3固体未完全溶解 溶解性:Na2CO3>NaHCO3
B 向Fe2O3粉末和Al粉的均匀混合物中插入点燃的Mg条,火星四射,有液态Fe从固体中流出 金属活动性:Mg>Fe
C 向2 mL 0.1 mol/L FeI2溶液中滴入几滴新制氯水,溶液变为黄色 还原性:I->Cl-
D 向2 mL 0.1 mol/L CuSO4溶液中滴入几滴饱和H2S溶液,产生黑色沉淀 酸性:H2SO4>H2S
第8讲 铁及其化合物
[备考导航]
(1) √ (2) × (3) × (4) √ (5) √ (6) √ (7) √ (8) × (9) × (10) ×
考点1
[知识梳理]
知识1 Ⅷ d 1s22s22p63s23p63d64s2或[Ar]3d64s2
2 失去 还原
知识2
2. (1) ①2(Fe2O3·xH2O) 红棕 Fe3O4 黑
②2Fe+3Cl22FeCl3 棕褐 ③2Fe+3Br22FeBr3
④Fe+I2FeI2 ⑤Fe+SFeS
(2) 3Fe+4H2O(g)Fe3O4+4H2
(3) ①FeCl2+H2↑ FeSO4+H2↑
②钝化 化学 Fe(NO3)3+NO↑+2H2O
3Fe(NO3)2+2NO↑+4H2O (4) 3FeCl2 FeSO4+Cu
[典题悟法]
典例1 C 【解析】 铁与水蒸气高温反应生成Fe3O4,不是Fe2O3,A错误;FeCl3水解生成Fe(OH)3和盐酸,加热促进水解,盐酸挥发,蒸发FeCl3溶液得到Fe(OH)3,得不到无水FeCl3,B错误;K2FeO4有氧化性,K2FeO4与水反应生成的气体为O2,D错误。
典例2 D 【解析】 还原铁粉可用作食品抗氧化剂,A错误;铁与碘反应生成FeI2,B错误;Fe与盐酸生成FeCl2,Fe与Cl2一定条件下反应生成FeCl3,C错误;Fe与水蒸气高温条件下反应生成Fe3O4和H2,Fe在氧气中燃烧生成Fe3O4,D正确。
考点2
知识1
铁红 磁性氧化铁 红棕 +2 +3 +2、+3 Fe2+ Fe3+ 3FeO+10H++NO===3Fe3++NO↑+5H2O Fe2O3+6H+===2Fe3++3H2O
3Fe3O4+28H++NO===9Fe3++NO↑+14H2O
FeO+2H+===Fe2++H2O
Fe2O3+6H++2I-===2Fe2++I2+3H2O
Fe3O4+8H++2I-===3Fe2++I2+4H2O
知识2
白 红褐 Fe2++2H2O Fe3++3H2O Fe2O3+3H2O
Fe(OH)2↓ Fe(OH)3↓ 白 灰绿 红褐 4Fe(OH)3
[典题悟法]
典例3 B 【解析】 Fe3O4为磁性氧化铁,质地致密,可阻止内部Fe与空气、水接触,故可用作铁件的防腐保护层,A正确;由氧化性:Fe3+>I2知,Fe3+可将I-氧化为I2,故Fe3O4溶于足量氢碘酸不能生成FeI3,B错误;由4Fe(OH)2+O2+2H2O=== 4Fe(OH)3知,Fe(OH)3能通过化合反应制取,C正确;可用该图制得Fe(OH)2,D正确。
考点3
知识1
1. (1) [Ar]3d6 还原性 (2) 硫酸 铁粉
2. (1) [Ar]3d5 氧化性
[常考归纳]
①FeCl3+3H2OFe(OH)3(胶体)+3HCl
②MgO或Mg(OH)2或MgCO3 ③盐酸 ④HCl
⑤Fe(OH)3↓+3CO2↑
知识3
1. FeS Fe2++Cu Fe2++H2↑
2. Fe+Zn2+ Fe+H2O 3Fe+Al2O3
3. 2FeCl3 Fe3++NO↑+2H2O
4. 2Fe+3CO2 2Fe+Al2O3
5. 2Fe3++2Cl- 2Fe3++2Br- 2Fe3++2H2O 4Fe3++2H2O 3Fe3++NO↑+2H2O 5Fe3++Mn2++4H2O
6Fe3++2Cr3++7H2O
6. 2Fe2++Zn2+ 3Fe2+ 2Fe2++Cu2+ 2Fe2++I2 2Fe2++S↓+2H+ 2Fe2++SO+2H+
2Fe2++SO+4H+
知识4
1. K++Fe2++[Fe(CN)6]3-===KFe[Fe(CN)6]↓ 白 灰绿 红褐 2. 红 Fe3++3SCN-??Fe(SCN)3
解疑释惑10
Cl2 2Fe2++Cl2===2Cl-+2Fe3+(或H2O2溶液 2Fe2++H2O2+2H+===2Fe3++2H2O)
铁粉 2Fe3++Fe===3Fe2+
铁粉 Cu2++Fe===Cu+Fe2+
H2O2溶液 2Fe2++H2O2+2H+===2Fe3++2H2O
过量NaOH溶液 Al2O3+2OH-+3H2O ===2[Al(OH)4]-
[典题悟法]
典例4 B 【解析】 取少量溶液于试管中,加入KSCN溶液,若溶液变红色,说明有Fe3+,不能先滴加新制的氯水,A错误;Fe2+水解显酸性,不能使酚酞变色,C错误;该方法没有对比实验,无法判断,D错误。
典例5 (1)在搅拌下将Fe(NO3)3饱和溶液缓慢滴加到KClO碱性溶液中 (2)阳离子 乙
【解析】 (1)K2FeO4在强碱溶液中比较稳定,应将Fe(NO3)3溶液逐滴加入KClO碱性溶液中。
[质量评价]
1. A 【解析】 铁的氧化反应为放热反应,A正确;Fe2O3为红棕色固体,可作红色颜料,与Fe2O3能与酸反应无关,B错误;氯化铁有氧化性,能将铜氧化生成Cu2+,不是因为FeCl3溶液有酸性,C错误;FeS具有还原性,可除去废水中的微量六价铬[Cr(Ⅵ)],与FeS难溶于水无关,D错误。
2. C 【解析】 四氯化碳的密度比水大,应在下层,不能起到隔绝氧气的作用,A错误;常温下Fe遇浓硝酸发生钝化,不能制备NO2,B错误;氢氧化钠溶液与氯化铁反应生成Fe(OH)3沉淀,应将饱和氯化铁溶液滴入沸水中制备Fe(OH)3胶体,D错误。
3. C 【解析】 FeS2高温下与氧气反应生成的是SO2,A错误;Fe与Br2反应生成FeBr3,B错误;水蒸气与铁在高温下反应生成Fe3O4和H2,C正确;AgCl难溶,离子方程式中不能拆开,D错误。
4. A 【解析】 该实验为铝热反应,反应为2Al+Fe2O32Fe+Al2O3,点燃的镁为反应提供高温的条件,生成液态的铁,该反应说明还原性:铝>铁,B错误;还原性:I->Fe2+,FeI2的溶液中滴入几滴氯水,溶液变黄色,说明少量的I-被氧化为单质碘,含少量单质碘的溶液呈现黄色,但是若Fe2+被氧化为Fe3+,含Fe3+的溶液颜色也是黄色,形成干扰,故该实验中,溶液呈现黄色,不能说明还原性:I->Cl-,C错误;CuSO4溶液中滴入H2S溶液发生反应,生成更难溶的CuS沉淀,不能得出酸性:H2SO4>H2S,D错误。
同课章节目录
