大单元三 非金属元素及其化合物 第10讲 氯及其化合物 卤素 学案 (含答案)2026届高三化学一轮大单元复习
文档属性
| 名称 | 大单元三 非金属元素及其化合物 第10讲 氯及其化合物 卤素 学案 (含答案)2026届高三化学一轮大单元复习 |  | |
| 格式 | DOC | ||
| 文件大小 | 876.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-14 21:21:29 | ||
图片预览




文档简介
大单元三 非金属元素及其化合物
第10讲 氯及其化合物 卤素
备考导航
复习目标 1. 了解氯气的制备方法与性质,了解氯的重要化合物的性质与应用。2. 知道氯水的性质及其成分探究的方法,知道常见含氯消毒剂的种类并能合理使用。3. 了解氯、溴、碘的单质及其化合物的递变规律与用途。4. 了解从海水中提取溴的工艺流程及原理。
熟记网络
课前自测 判断正误(正确的打“√”,错误的打“×”)。(1) (2023·浙江卷)标准状况下,11.2 L Cl2通入水中,溶液中氯离子数为0.5NA( )(2) (2023·重庆卷)Cl2通入石灰乳中,发生反应的离子方程式为Cl2+2OH-===ClO-+Cl-+H2O( )(3) 氯气、臭氧、二氧化氯都可用于饮用水的消毒( )(4) (2023·盐城五校)电解NaCl饱和溶液,可制得烧碱和氯气( )(5) (2023·如皋中学)HClO的电离方程式:HClO===H++ClO-( )(6) MnO2和稀盐酸反应制取Cl2( )(7) “洁厕灵”(主要成分为盐酸)和“84”消毒液(主要成分为次氯酸钠)不能混用( )(8) (2022·全国乙卷)向NaBr溶液中滴加过量氯水,再加入淀粉碘化钾溶液,溶液先变橙色,后变蓝色,说明氧化性:Cl2>Br2>I2( ) 图1 图2(9) (2024·苏州中学)Cl2NH4Cl( )(10) (2023·湖南卷)HClO的电子式:H( )(11) (2023·北京卷)图1:实验室制Cl2 ( )(12) 图2:氯气的净化( )
考点1 氯气及含氯化合物的结构与性质
知 识 梳 理
氯原子的结构和氯气分子的结构
1. 氯原子与氯离子的结构示意图
2. 氯气分子的电子式和结构式
电子式:___________,结构式:_______________,是_________(填“极性”或“非极性”)分子,属于______晶体。
氯气的物理性质
氯气是具有刺激性气味的黄绿色有毒气体,密度比空气大,常温常压下,1体积水能溶解约2体积Cl2。
氯气的化学性质
1. 氯气的氧化性
(1) 与金属反应
2Fe+3Cl2__________________;
Cu+Cl2_______________。
注意:Cl2的氧化性强,与变价金属反应生成高价态的金属氯化物。
(2) 与H2反应
①H2+Cl22HCl(用于工业制盐酸)
现象:苍白色火焰,瓶口有白雾。
②H2+Cl22HCl(易发生爆炸)
(3) 与P反应
2P+3Cl22PCl3、PCl3+Cl2PCl5
(4) 与还原性物质反应(完成化学或离子方程式)
Cl2+___NaBr===___________________________;
Cl2+___KI===_____________________;
(检验Cl2:Cl2能使使湿润的淀粉碘化钾试纸变蓝)
Cl2+___Fe2+===______________________________;
Cl2+SO2+____________===____________________________________________________________;
Cl2+SO+_________===________________________________;
Cl2+H2S===_______________________________________________________(氧化性:Cl2>S)
Cl2+H2O2===_______________________________________________________________;
___Cl2+___NH3===___________________________
(检验输氯管道是否发生泄漏)。
2. 氯气的歧化反应(Cl2既显氧化性又显还原性)
(1) 与水反应
化学方程式:______________________________________________________
(离子方程式:_______________________________________________________________)。
(2) 与碱反应
①与NaOH反应(写化学方程式,下同):
______________________________________________________________________________
(吸收尾气或制漂白液)。
②与Ca(OH)2反应:___________________________________________________________________(工业制漂白粉或漂粉精)。
(1) 次氯酸(HClO,结构式为__________________,电子式为___________)
①HClO具有不稳定性,见光易分解:2HClO_____________________,久置的氯水会变成稀盐酸。
②HClO具有较强氧化性:作杀菌消毒剂、漂白剂。干燥的氯气不具有漂白性。
③HClO是弱酸,酸性比碳酸___(填“强”或“弱”)。
(2) NaClO
①NaClO(ClO-)具有强氧化性,能杀菌消毒,可以漂白棉、麻、纸张等。
②“84”消毒液(有效成分是NaClO)与洁厕灵(有效成分是HCl)混合立即会产生氯气,其离子方程式:
_________________________________________________________________。
(3) 漂白粉
①工业上制取漂白粉的原料是氯气与_________。
②漂白粉的漂白原理(写化学方程式):
_____________________________________________________________________________________。
③漂白粉露置于空气中发生反应的化学方程式为_____________________________________________ _____________________________________________、____________________________________。漂白粉,需要密封保存。
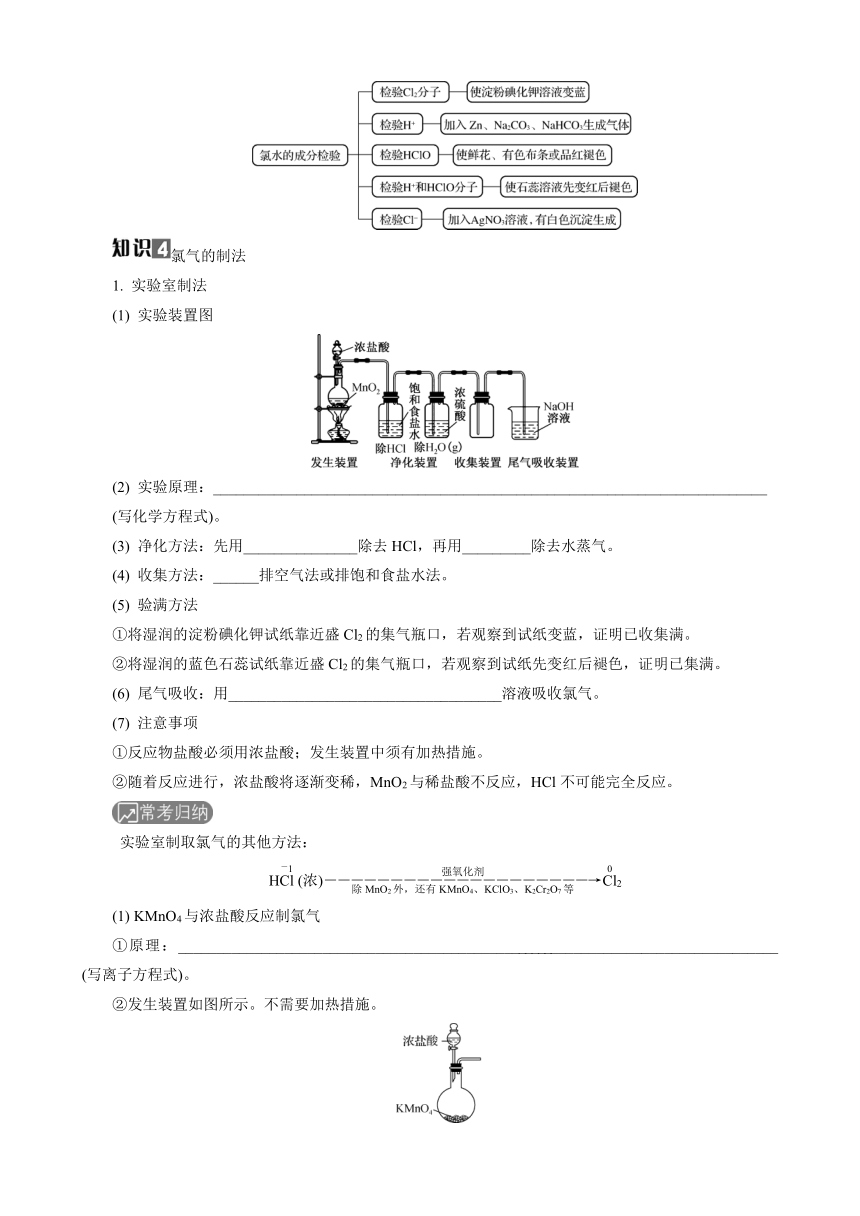
氯水及其成分的检验
氯水中含氯微粒主要为Cl2,只有少量Cl2与水反应生成HCl和HClO。氯水中存在三种平衡:①Cl2+H2O??HCl+HClO,②HClO??H++ClO-,③H2O??H++OH-。氯水中存在三种分子(Cl2、H2O、HClO)和四种离子(Cl-、ClO-、H+、OH-)。
氯气的制法
1. 实验室制法
(1) 实验装置图
(2) 实验原理:_________________________________________________________________________
(写化学方程式)。
(3) 净化方法:先用_______________除去HCl,再用_________除去水蒸气。
(4) 收集方法:______排空气法或排饱和食盐水法。
(5) 验满方法
①将湿润的淀粉碘化钾试纸靠近盛Cl2的集气瓶口,若观察到试纸变蓝,证明已收集满。
②将湿润的蓝色石蕊试纸靠近盛Cl2的集气瓶口,若观察到试纸先变红后褪色,证明已集满。
(6) 尾气吸收:用____________________________________溶液吸收氯气。
(7) 注意事项
①反应物盐酸必须用浓盐酸;发生装置中须有加热措施。
②随着反应进行,浓盐酸将逐渐变稀,MnO2与稀盐酸不反应,HCl不可能完全反应。
实验室制取氯气的其他方法:
H (浓)2
(1) KMnO4与浓盐酸反应制氯气
①原理:________________________________________________________________________________ (写离子方程式)。
②发生装置如图所示。不需要加热措施。
(2) K2Cr2O7与浓盐酸反应制氯气
离子方程式:__________________________________________________________________________。
(3) KClO3与浓盐酸反应制氯气
化学方程式:_________________________________________________________________________。
2. Cl2的工业制法
电解饱和食盐水:__________________________________________________________________(写化学方程式)。
3. 粗盐的精制
海水―→粗盐(含Fe3+、Mg2+、Ca2+、SO)溶解、过滤过滤蒸发结晶
其中,①依次加NaOH、BaCl2、Na2CO3或依次加_______________________________________________或依次加___________________________________________________;②过滤后,在溶液中滴入盐酸,调节溶液的pH=7。
Cl2的用途
制漂白粉、消毒、制盐酸、农药、氯仿等。
情景创设
消毒剂有效氯含量的计算
“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义为每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。
例 求NaClO2的有效氯含量(O—16,Cl—35.5)。
[分析] 1 mol NaClO2还原为Cl-时转移4 mol e-,1 mol Cl2还原为Cl-时转移2 mol e-,1 mol NaClO2相当于2 mol Cl2,即90.5 g NaClO2相当于142 g Cl2,NaClO2的有效氯含量为=1.57。
典 题 悟 法
物质的性质与用途
(2023·泰州中学)下列有关物质的性质与用途具有对应关系的是( )
A. Cl2能溶于水,可用于工业制盐酸
B. ClO2有强氧化性,可用于水体消毒
C. HClO溶液显酸性,可用作漂白剂
D. NH4Cl受热易分解,可用作氮肥
物质的转化
(2024·南通二模)在指定条件下,下列含氯物质间转化不能实现的是( )
A. NaCl(熔融)Cl2(g)
B. HCl(浓)Cl2(g)
C. MgCl2·6H2O(s)MgCl2(s)
D. ClO-(aq)ClO2(g)
氯水成分的探究
(2024·南通期末)为探究新制氯水的性质,某学生做了如下实验。
装置 实验 试剂X 现象
① 滴有酚酞的 NaOH 溶液 溶液红色褪色
② CaCO3粉末 产生气泡
③ Na2S 溶液 产生黄色沉淀
④ FeCl2溶液 溶液变为黄色
下列说法正确的是( )
A. 实验①中发生反应的离子方程式为
Cl2+2OH-===2ClO-+H2O
B. 实验②中存在反应: CaCO3+2HClO===Ca(ClO)2+CO2↑+ H2O
C. 实验③说明非金属性:Cl>S
D. 实验④反应后的溶液中存在大量的离子为Fe2+、Fe3+、Cl-、ClO-
氯气的实验室制法
(2023·江苏卷)实验室制取Cl2的实验原理及装置均正确的是( )
A. 制取Cl2 B. 除去Cl2中的HCl
C. 收集Cl2 D. 吸收尾气中的Cl2
次氯酸盐的性质
(2024·苏锡常镇一模)探究NaClO溶液的性质,下列实验方案能达到探究目的的是( )
选项 探究目的 实验方案
A 检验NaClO溶液中的Na+ 用洁净的铂丝蘸取少量NaClO溶液,在酒精灯上灼烧,透过蓝色钴玻璃观察火焰颜色
B 检验NaClO溶液的氧化性 将NaClO溶液滴加到淀粉碘化钾溶液中,观察溶液颜色变化
C 检验NaClO溶液的pH 用洁净的玻璃棒蘸取NaClO溶液滴在pH试纸上,待变色后与标准比色卡比对
D 检验NaClO溶液的还原产物 将少量NaClO溶液与FeCl2充分反应后,滴加硝酸酸化的硝酸银溶液,观察沉淀产生情况
ClO2的制备与性质
(2023·盐城期中)二氧化氯(ClO2)是一种高效消毒剂,易溶于水,沸点为11.0 ℃,浓度高时极易爆炸。
(1) 实验室在60 ℃的条件下用闪锌矿(主要成分为ZnS)与NaClO3溶液、H2SO4溶液制备二氧化氯,同时生成硫酸锌。
①写出该反应的离子方程式:______________________________________________________________ __________________________。
②用如图所示的装置制备二氧化氯。则闪锌矿、NaClO3溶液、H2SO4溶液三种反应物的加料方式是______________________________________________________________________________________________________________________________________________________。
③若闪锌矿加料过量太多,生成ClO2的量明显减少的原因是____________________________________ _______________________________________________________________________________________。
④反应过程中通入N2的作用是_____________________________________________________________ _________________________________________。
(2) 某同学测定自来水厂经ClO2处理后的水中ClO2的浓度。步骤如下:取水样1.0 L,用稀硫酸调节溶液pH≤2,加入足量KI晶体,摇匀,在暗处静置30 min。取20.00 mL加入锥形瓶中,以淀粉溶液作指示剂,用0.001 0 mol/L Na2S2O3溶液滴定至终点[反应原理:I2+2S2O===2I-+S4O,ClO2+I-+H+——I2+Cl-+H2O(未配平)],消耗Na2S2O3溶液10.00 mL。计算水样中ClO2的浓度(单位:mg/L,写出计算过程)。
卤素的歧化反应与归中反应及其应用
1. 碱性歧化
价态变化规律为“中间价―→高价+低价”。
(1) Cl2+2OH-===Cl-+ClO-+H2O
(2) 3Cl2+6OH-(浓)5Cl-+ClO+3H2O(在加热条件下,氯元素的化合价升高为+5)
2. 酸性归中
价态变化规律为“高价+低价―→中间价”。
(1) 2H++Cl-+ClO-===Cl2↑+H2O
(2) 5Cl-+ClO+6H+===3Cl2↑+3H2O
3. 应用
(1) 从海水中提取溴
提取溴涉及的步骤和相关反应:
①氧化:向母液中通入Cl2,将Br-氧化为Br2(Cl2+2Br-===Br2+2Cl-)。
②吹出:利用溴的______性,通入热空气或水蒸气,吹出溴蒸气。
③吸收:3Br2+3Na2CO3===5NaBr+NaBrO3+3CO2↑(也可用SO2吸收)。
④制粗溴:_______________________________________________________________(写离子方程式)。
⑤精制:粗溴精制后得到高纯度溴。
(2) 从海带中提取碘
提取碘涉及的离子方程式:
2I-+2H++H2O2===_____________________、
3I2+6OH-===_________________________________、
5I-+IO+6H+===________________________。
[易错提醒]
①从I2的CCl4溶液中分离出I2,采用蒸馏法分离不合理,因为I2易与CCl4形成共沸物,且I2易升华,会导致碘损失。②海带要放在坩埚中灼烧,不可用烧杯或蒸发皿灼烧。
考点2 卤族元素
知 识 梳 理
卤族元素性质比较
1. 卤素单质的物理性质
卤素 F2 Cl2 Br2 I2
状态 气体 气体 液体 固体
颜色 浅黄绿色 黄绿色 深红棕色 紫黑色
2. 卤素单质的化学性质
(1) 与H2反应:
H2+F2===2HF(暗处爆炸) 、
H2+Cl22HCl 、
H2+Br22HBr 、H2+I22HI
F2、Cl2、Br2、I2与氢气反应越来越困难,稳定性:HF___HCl___HBr___HI(填“>”或“<”,下同),说明非金属性:F___Cl___Br___I。
(2) 与水反应
X2+H2O??HX+HXO(X=Cl、Br、I)
特例: 2F2+2H2O===4HF+O2
(3) 与碱(如NaOH)反应(写离子方程式)
①Cl2与碱反应:
________________________________________________________________________。
Cl2与碱在加热的条件下的反应:
___________________________________________________________________________。
②Br2、I2与碱反应:
___________________________________________________________________________、
_____________________________________________________________________。
③Br2与碳酸钠溶液反应:
________________________________________________________________________。
(4) 与Fe反应
2Fe+3X22FeX3(X=F、Cl、Br)
特例: Fe+I2FeI2
(5) 与SO2、H2O反应
X2+SO2+2H2O===2HX+H2SO4
(X=Cl、Br、I)
(1) Cl2能置换出Br2(Cl2+2Br-===2Cl-+Br2),同理,Br2也能置换出I2(Br2+2I-===2Br-+I2),可证明氧化性:Cl2>Br2>I2,阴离子的还原性:Cl-(2) HF的特性
①HF是有剧毒的气体。
②HF的水溶液是氢氟酸,氢氟酸是弱酸(氢溴酸和氢碘酸是强酸)。
③氢氟酸能腐蚀玻璃,故应保存在______瓶中。
(3) 液溴有剧毒,易挥发,存放在带磨口的棕色细口瓶中,加___液封。液溴有强氧化性,不能使用______塞。
(4) 常温常压下,碘(I2)是紫黑色的固体,加热升华,遇淀粉溶液变蓝。食用盐中加入的是____________(填化学式),可防治甲状腺肿大。
(5) 卤化银:一般AgX难溶于水,但AgF可溶于水;AgBr和AgI可用作感光材料;AgI可用于人工降雨。
卤素离子的检验方法
1. AgNO3溶液——沉淀法
待测液生成
2. 置换——萃取法
待测液有机层呈
3. I-的其他检验方法:
待测液溶液变蓝,表明有I-
溴水和碘水的萃取
[易错提醒]
①酒精易溶于水,不能作萃取卤素单质的萃取剂;
②直馏汽油可作萃取卤素单质的萃取剂,裂化汽油分子中含有不饱和键,不能作萃取卤素单质的萃取剂。
HF、HCl的制备
1. CaF2+H2SO4(浓)CaSO4+2HF↑(反应在铅皿中进行)
2. H2SO4(浓)+NaClNaHSO4+HCl↑
①制备原理:难挥发性酸制挥发性酸或高沸点酸制低沸点酸。
②HBr、HI可被浓硫酸氧化成单质,不能用NaBr、NaI与浓硫酸共热制HBr、HI。可以利用无氧化性的浓磷酸代替浓硫酸,在加热条件下制备。
卤素互化物
1. 概念:由两种或三种卤素组成的共价型化合物。如:IBr、ICl、ICl3、BrF3、ClF3等。
2. 化学性质
(1) 强氧化性
2Mg+2IBr===MgI2+MgBr2
(2) 易水解
ICl+H2O===HCl+HIO
注意:该反应是非氧化还原反应。
典 题 悟 法
物质的性质与用途
(2024·镇江期初)下列物质的结构与性质或性质与用途具有对应关系的是( )
A. HF键能大于HCl,HF的沸点高于HCl
B. HClO具有强氧化性,自来水厂用氯气杀菌消毒
C. HF为一元弱酸,可用于雕刻玻璃
D. I2单质易升华,可用于检验淀粉的存在
卤素互化物的性质
氯化碘(ICl)的性质类似于卤素,ICl有很强的氧化性。现有下列两个反应:
①2ICl+2Zn===ZnCl2+ZnI2
②ICl+H2O===HCl+HIO
下列叙述正确的是( )
A. Cl2与I2生成ICl是非氧化还原反应
B. 反应①中,ZnI2只是氧化产物
C. 反应①中,当转移0.4 mol电子时生成13.6 g ZnCl2(Cl—35.5,Zn—65)
D. 反应②中,ICl既是氧化剂又是还原剂
工业制溴
(2023·扬州中学)一种海水提溴的部分工艺流程如图所示:
下列说法错误的是( )
A. “氧化”和“转化”工序中Cl2的主要作用相同
B. 水相Ⅰ和水相Ⅱ中均含有H+和Cl-
C. “洗脱”工序可完成R3NCl的再生
D. 保存液溴时加适量水的主要作用是防止溴单质被氧化
工业制碘
(2023·苏州期末)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
下列说法错误的是( )
A. “还原”时发生反应的离子方程式:
SO+I2+H2O===2I-+SO+2H+
B. “操作X”使用的仪器为分液漏斗且CCl4从漏斗上口倒出
C. “氧化”时控制较低温度反应的目的之一是为了增大Cl2的溶解量
D. 回收的粗碘可通过升华的方法进行纯化
1. (2024·南通)下列物质的结构与性质或物质的性质与用途不具有对应关系的是( )
A. HClO具有弱酸性,可用于杀菌消毒
B. ClF3具有强氧化性,可用作火箭助燃剂
C. Cl-有孤电子对,可与Cu2+形成[CuCl4]2-
D. HF分子间存在氢键,HF沸点较高
2. (2023·常熟期中)浓盐酸和高锰酸钾在室温下即可制备Cl2,用如图装置制备少量的Cl2并探究其性质。下列说法正确的是( )
A. 高锰酸钾和浓盐酸反应的离子方程式为2MnO+10Cl-+16H+===2Mn2++5Cl2↑+8H2O
B. 根据溴化钠和碘化钠中的现象可证明氧化性:Cl2>Br2>I2
C. 紫色石蕊试液先变红后褪色,说明氯气具有酸性和强氧化性
D. 可用饱和食盐水代替NaOH溶液吸收多余的氯气
3. (2024·如皋适应性二)下列化学反应表示正确的是( )
A. 电解饱和食盐水制备Cl2的离子方程式:2Cl-+2H+Cl2↑+H2↑
B. 将氯水在强光下照射的化学方程式:2HClOCl2↑+2H2O
C. 氨气检验Cl2泄露的化学方程式:3Cl2+8NH3===N2+6NH4Cl
D. Cl2处理含氰碱性废水的离子方程式:5Cl2+2CN-+4H2O===10Cl-+N2+2CO2+8H+
4. (2023·常州中学)探究卤族元素单质及其化合物的性质,下列实验方案能达到探究目的的是( )
选项 实验方案 探究目的
A 向NaBr溶液中滴加过量氯水,再加入淀粉碘化钾溶液,观察溶液颜色变化 氧化性:Cl2>Br2>I2
B 向碘的CCl4溶液中加入等体积的KI浓溶液,振荡分层,下层由紫红色变成浅粉红色,上层呈棕黄色 碘在KI浓溶液的溶解能力大于在CCl4中的溶解能力
C 常温下,向盛有NaCl、NaI的混合溶液中加入2滴0.1 mol/L AgNO3溶液,观察沉淀颜色 溶度积Ksp:AgCl>AgI
D 取两份新制氯水,分别滴加AgNO3溶液和淀粉碘化钾溶液,观察实验现象 氯气与水的反应是否存在限度
第10讲 氯及其化合物 卤素
[备考导航]
(1) × (2) × (3) √ (4) √ (5) × (6) × (7) √ (8) × (9) √ (10) √ (11) √ (12) ×
考点1
[知识梳理]
知识1
2. Cl—Cl 非极性 分子
知识3
1. (1) 2FeCl3 CuCl2
(4) 2 2NaCl+Br2 2 2KCl+I2 2 2Fe3++2Cl-
2H2O H2SO4+2HCl(或SO+2Cl-+4H+)
H2O 2H++2Cl-+SO
2HCl+S↓(或2H++2Cl-+S↓)
2HCl+O2(或2H++2Cl-+O2)
3 8 N2+6NH4Cl
2. (1) Cl2+ H2O??HCl+HClO
Cl2+ H2O??H++Cl-+HClO
(2) ①Cl2+2NaOH===NaCl+NaClO+H2O
②2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
[常考归纳]
(1) H—O—Cl ①2HCl+O2↑ ③弱
(2) ②ClO-+Cl-+2H+===Cl2↑+H2O
(3) ①石灰乳 ②Ca(ClO)2+CO2+H2O===2HClO+CaCO3↓ ③Ca(ClO)2+CO2+H2O===2HClO+CaCO3↓ 2HClO2HCl+O2↑
知识4
1. (2) MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(3) 饱和食盐水 浓硫酸 (4) 向上
(6) 氢氧化钠(答案合理即可)
[常考归纳]
(1) ①2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O
(2) Cr2O+14H++6Cl-===2Cr3++3Cl2↑+7H2O
(3) KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
2. 2NaCl+2H2O2NaOH+H2↑+Cl2↑
3. BaCl2、NaOH、Na2CO3 BaCl2、Na2CO3、NaOH
[典题悟法]
典例1 B 【解析】 Cl2用于工业制盐酸,是因为氯气与氢气反应生成氯化氢,与其溶解性无关,A错误;HClO具有强氧化性,可用作漂白剂,与溶液呈酸性无关,C错误;NH4Cl中含植物生长所需的营养元素N,NH4Cl可用作氮肥,与NH4Cl易分解的性质无关,D错误。
典例2 D 【解析】 ClO-具有氧化性,向含有ClO-的溶液中通入具有还原性的SO2,ClO-被还原为Cl-,D错误。
典例3 C 【解析】 实验①中发生反应为Cl2+2OH-===ClO-+Cl-+H2O,A错误;HClO酸性弱于H2CO3,该反应不能发生,B错误;Cl2+ Na2S===S↓+2NaCl,氧化性:Cl2>S,C正确;2FeCl2+ Cl2===2FeCl3,实验④反应后的溶液中存在大量的 Fe3+、Cl-,D错误。
典例4 C 【解析】 实验室制取Cl2,应选用浓盐酸,A错误;用洗气瓶洗气时,气体应“长进短出”,B错误;Cl2在水中溶解度不大,应用NaOH溶液吸收尾气中的Cl2,D错误。
典例5 B 【解析】 观察钠元素的焰色不用透过蓝色钴玻璃,A错误;NaClO具有漂白性,能使pH试纸褪色,C错误;NaClO溶液与FeCl2充分反应后的还原产物为Cl-,而FeCl2会引入Cl-,干扰还原产物的检验,D错误。
典例6 (1) ①ZnS+8ClO+8H+Zn2++8ClO2↑+SO+4H2O ②将粉碎后的闪锌矿和NaClO3溶液混合(制成浆料)加入三颈烧瓶中,从滴液漏斗中缓慢滴加H2SO4溶液 ③过量的ZnS将生成的ClO2还原(或者过量的ZnS直接将NaClO3中的Cl还原至更低价态) ④加速ClO2的排出;起搅拌作用;稀释ClO2,防止其浓度高时发生爆炸
(2) n(Na2S2O3)=10.00×10-3 L×0.001 0 mol/L =1×10-5 mol
配平反应:2ClO2+10I-+8H+===5I2+2Cl-+4H2O、I2+2S2O===2I-+S4O
可得关系式:2ClO2~5I2 ~10S2O
n(ClO2)=1×10-5 mol×=2×10-6 mol
1.0 L水样含m(ClO2)=2×10-6 mol×67.5 g/mol×
×1 000 mg/g=6.75 mg,则水样中ClO2的浓度为6.75 mg/L
[深度指津]
3. (1) ②挥发 ④5Br-+BrO+6H+===3Br2+3H2O
(2) I2+2H2O 5I-+IO+3H2O 3I2+3H2O
考点2
[知识梳理]
知识1
2. (1) > > > > > >
(3) ①Cl2+2OH-=== Cl-+ClO-+H2O
3Cl2+6OH-(浓)5Cl-+ClO+3H2O
②3Br2+6OH-===5Br-+BrO+3H2O
3I2+ 6OH-===5I-+IO+3H2O
③3Br2+3CO===5Br-+BrO+3CO2↑
[常考归纳] (2) ③塑料 (3) 水 橡胶 (4) KIO3
[典题悟法]
典例7 B 【解析】 HF分子间存在氢键、HCl分子间不存在氢键,HF沸点高于HCl,A错误;HF能与玻璃中的SiO2反应,HF可用于雕刻玻璃,C错误;淀粉遇I2变蓝,与碘单质易升华无关,D错误。
典例8 C 【解析】 ICl中,Cl为-1价、I为+1价,Cl2与I2生成ICl是氧化还原反应,A错误;反应①中,Zn化合价升高、I化合价降低,ZnI2既是氧化产物又是还原产物,B错误;反应①中,每生成1 mol ZnCl2转移4 mol电子,当转移0.4 mol电子时生成0.1 mol ZnCl2(即13.6 g ZnCl2),C正确;反应②中各元素的化合价均未发生变化,是非氧化还原反应,D错误。
典例9 D 【解析】 “氧化”和“转化”工序中Cl2的主要作用均为氧化Br-,A正确;“氧化”时Cl2与Br-生成Br2和Cl-,同时氯气与水反应生成的HCl进入水相Ⅰ;“还原”时SO2与R3N[ClBr2]生成H2SO4、HBr、R3NCl,R3NCl与HBr生成HCl和R3NBr,水相Ⅰ和水相Ⅱ中均含有H+和Cl-,B正确;用盐酸“洗脱”R3NBr生成HBr同时生成R3NCl,可完成R3NCl的再生,C正确;保存液溴时加适量水的主要作用是防止Br2挥发,D错误。
典例10 B 【解析】 “还原”时SO将I2还原为I-,A正确;CCl4的密度大于水,应从分液漏斗下口放出,B错误;气体的溶解度随温度升高而降低,故“氧化”时温度不宜过高,C正确;碘易升华,D正确。
[质量评价]
1. A 【解析】 HClO有强氧化性,可用于杀菌消毒,A错误。
2. A 【解析】 Cl2和NaI反应生成I2,Cl2和NaBr反应生成Br2,说明氧化性:Cl2>I2、Cl2> Br2,但不能说明Br2氧化性大于I2,B错误;Cl2与水反应生成HCl和HClO,酸使紫色石蕊试液变红,HClO使红色溶液褪色,说明氯水具有酸性和强氧化性,C错误;饱和食盐水不能吸收氯气,D错误。
3. C 【解析】 电解饱和食盐水生成NaOH、H2和Cl2,A错误;HClO分解生成HCl和O2,B错误;碱性条件下离子方程式中不出现H+,D错误。
4. B 【解析】 过量氯水既能氧化Br-又能氧化I-,无法比较Br2和I2的氧化性,A错误;I2与I-生成I,I2在KI浓溶液中的溶解能力大于在CCl4中的溶解能力,B正确;未指明NaCl、NaI溶液的浓度,无法判断Ksp(AgCl)、Ksp(AgI)的相对大小,C错误;新制氯水中的氯气和HClO都能与KI溶液反应生成使淀粉变蓝色的I2,溶液变蓝色不能说明溶液中存在Cl2分子,无法证明Cl2与水的反应存在限度,D错误。
第10讲 氯及其化合物 卤素
备考导航
复习目标 1. 了解氯气的制备方法与性质,了解氯的重要化合物的性质与应用。2. 知道氯水的性质及其成分探究的方法,知道常见含氯消毒剂的种类并能合理使用。3. 了解氯、溴、碘的单质及其化合物的递变规律与用途。4. 了解从海水中提取溴的工艺流程及原理。
熟记网络
课前自测 判断正误(正确的打“√”,错误的打“×”)。(1) (2023·浙江卷)标准状况下,11.2 L Cl2通入水中,溶液中氯离子数为0.5NA( )(2) (2023·重庆卷)Cl2通入石灰乳中,发生反应的离子方程式为Cl2+2OH-===ClO-+Cl-+H2O( )(3) 氯气、臭氧、二氧化氯都可用于饮用水的消毒( )(4) (2023·盐城五校)电解NaCl饱和溶液,可制得烧碱和氯气( )(5) (2023·如皋中学)HClO的电离方程式:HClO===H++ClO-( )(6) MnO2和稀盐酸反应制取Cl2( )(7) “洁厕灵”(主要成分为盐酸)和“84”消毒液(主要成分为次氯酸钠)不能混用( )(8) (2022·全国乙卷)向NaBr溶液中滴加过量氯水,再加入淀粉碘化钾溶液,溶液先变橙色,后变蓝色,说明氧化性:Cl2>Br2>I2( ) 图1 图2(9) (2024·苏州中学)Cl2NH4Cl( )(10) (2023·湖南卷)HClO的电子式:H( )(11) (2023·北京卷)图1:实验室制Cl2 ( )(12) 图2:氯气的净化( )
考点1 氯气及含氯化合物的结构与性质
知 识 梳 理
氯原子的结构和氯气分子的结构
1. 氯原子与氯离子的结构示意图
2. 氯气分子的电子式和结构式
电子式:___________,结构式:_______________,是_________(填“极性”或“非极性”)分子,属于______晶体。
氯气的物理性质
氯气是具有刺激性气味的黄绿色有毒气体,密度比空气大,常温常压下,1体积水能溶解约2体积Cl2。
氯气的化学性质
1. 氯气的氧化性
(1) 与金属反应
2Fe+3Cl2__________________;
Cu+Cl2_______________。
注意:Cl2的氧化性强,与变价金属反应生成高价态的金属氯化物。
(2) 与H2反应
①H2+Cl22HCl(用于工业制盐酸)
现象:苍白色火焰,瓶口有白雾。
②H2+Cl22HCl(易发生爆炸)
(3) 与P反应
2P+3Cl22PCl3、PCl3+Cl2PCl5
(4) 与还原性物质反应(完成化学或离子方程式)
Cl2+___NaBr===___________________________;
Cl2+___KI===_____________________;
(检验Cl2:Cl2能使使湿润的淀粉碘化钾试纸变蓝)
Cl2+___Fe2+===______________________________;
Cl2+SO2+____________===____________________________________________________________;
Cl2+SO+_________===________________________________;
Cl2+H2S===_______________________________________________________(氧化性:Cl2>S)
Cl2+H2O2===_______________________________________________________________;
___Cl2+___NH3===___________________________
(检验输氯管道是否发生泄漏)。
2. 氯气的歧化反应(Cl2既显氧化性又显还原性)
(1) 与水反应
化学方程式:______________________________________________________
(离子方程式:_______________________________________________________________)。
(2) 与碱反应
①与NaOH反应(写化学方程式,下同):
______________________________________________________________________________
(吸收尾气或制漂白液)。
②与Ca(OH)2反应:___________________________________________________________________(工业制漂白粉或漂粉精)。
(1) 次氯酸(HClO,结构式为__________________,电子式为___________)
①HClO具有不稳定性,见光易分解:2HClO_____________________,久置的氯水会变成稀盐酸。
②HClO具有较强氧化性:作杀菌消毒剂、漂白剂。干燥的氯气不具有漂白性。
③HClO是弱酸,酸性比碳酸___(填“强”或“弱”)。
(2) NaClO
①NaClO(ClO-)具有强氧化性,能杀菌消毒,可以漂白棉、麻、纸张等。
②“84”消毒液(有效成分是NaClO)与洁厕灵(有效成分是HCl)混合立即会产生氯气,其离子方程式:
_________________________________________________________________。
(3) 漂白粉
①工业上制取漂白粉的原料是氯气与_________。
②漂白粉的漂白原理(写化学方程式):
_____________________________________________________________________________________。
③漂白粉露置于空气中发生反应的化学方程式为_____________________________________________ _____________________________________________、____________________________________。漂白粉,需要密封保存。
氯水及其成分的检验
氯水中含氯微粒主要为Cl2,只有少量Cl2与水反应生成HCl和HClO。氯水中存在三种平衡:①Cl2+H2O??HCl+HClO,②HClO??H++ClO-,③H2O??H++OH-。氯水中存在三种分子(Cl2、H2O、HClO)和四种离子(Cl-、ClO-、H+、OH-)。
氯气的制法
1. 实验室制法
(1) 实验装置图
(2) 实验原理:_________________________________________________________________________
(写化学方程式)。
(3) 净化方法:先用_______________除去HCl,再用_________除去水蒸气。
(4) 收集方法:______排空气法或排饱和食盐水法。
(5) 验满方法
①将湿润的淀粉碘化钾试纸靠近盛Cl2的集气瓶口,若观察到试纸变蓝,证明已收集满。
②将湿润的蓝色石蕊试纸靠近盛Cl2的集气瓶口,若观察到试纸先变红后褪色,证明已集满。
(6) 尾气吸收:用____________________________________溶液吸收氯气。
(7) 注意事项
①反应物盐酸必须用浓盐酸;发生装置中须有加热措施。
②随着反应进行,浓盐酸将逐渐变稀,MnO2与稀盐酸不反应,HCl不可能完全反应。
实验室制取氯气的其他方法:
H (浓)2
(1) KMnO4与浓盐酸反应制氯气
①原理:________________________________________________________________________________ (写离子方程式)。
②发生装置如图所示。不需要加热措施。
(2) K2Cr2O7与浓盐酸反应制氯气
离子方程式:__________________________________________________________________________。
(3) KClO3与浓盐酸反应制氯气
化学方程式:_________________________________________________________________________。
2. Cl2的工业制法
电解饱和食盐水:__________________________________________________________________(写化学方程式)。
3. 粗盐的精制
海水―→粗盐(含Fe3+、Mg2+、Ca2+、SO)溶解、过滤过滤蒸发结晶
其中,①依次加NaOH、BaCl2、Na2CO3或依次加_______________________________________________或依次加___________________________________________________;②过滤后,在溶液中滴入盐酸,调节溶液的pH=7。
Cl2的用途
制漂白粉、消毒、制盐酸、农药、氯仿等。
情景创设
消毒剂有效氯含量的计算
“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义为每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。
例 求NaClO2的有效氯含量(O—16,Cl—35.5)。
[分析] 1 mol NaClO2还原为Cl-时转移4 mol e-,1 mol Cl2还原为Cl-时转移2 mol e-,1 mol NaClO2相当于2 mol Cl2,即90.5 g NaClO2相当于142 g Cl2,NaClO2的有效氯含量为=1.57。
典 题 悟 法
物质的性质与用途
(2023·泰州中学)下列有关物质的性质与用途具有对应关系的是( )
A. Cl2能溶于水,可用于工业制盐酸
B. ClO2有强氧化性,可用于水体消毒
C. HClO溶液显酸性,可用作漂白剂
D. NH4Cl受热易分解,可用作氮肥
物质的转化
(2024·南通二模)在指定条件下,下列含氯物质间转化不能实现的是( )
A. NaCl(熔融)Cl2(g)
B. HCl(浓)Cl2(g)
C. MgCl2·6H2O(s)MgCl2(s)
D. ClO-(aq)ClO2(g)
氯水成分的探究
(2024·南通期末)为探究新制氯水的性质,某学生做了如下实验。
装置 实验 试剂X 现象
① 滴有酚酞的 NaOH 溶液 溶液红色褪色
② CaCO3粉末 产生气泡
③ Na2S 溶液 产生黄色沉淀
④ FeCl2溶液 溶液变为黄色
下列说法正确的是( )
A. 实验①中发生反应的离子方程式为
Cl2+2OH-===2ClO-+H2O
B. 实验②中存在反应: CaCO3+2HClO===Ca(ClO)2+CO2↑+ H2O
C. 实验③说明非金属性:Cl>S
D. 实验④反应后的溶液中存在大量的离子为Fe2+、Fe3+、Cl-、ClO-
氯气的实验室制法
(2023·江苏卷)实验室制取Cl2的实验原理及装置均正确的是( )
A. 制取Cl2 B. 除去Cl2中的HCl
C. 收集Cl2 D. 吸收尾气中的Cl2
次氯酸盐的性质
(2024·苏锡常镇一模)探究NaClO溶液的性质,下列实验方案能达到探究目的的是( )
选项 探究目的 实验方案
A 检验NaClO溶液中的Na+ 用洁净的铂丝蘸取少量NaClO溶液,在酒精灯上灼烧,透过蓝色钴玻璃观察火焰颜色
B 检验NaClO溶液的氧化性 将NaClO溶液滴加到淀粉碘化钾溶液中,观察溶液颜色变化
C 检验NaClO溶液的pH 用洁净的玻璃棒蘸取NaClO溶液滴在pH试纸上,待变色后与标准比色卡比对
D 检验NaClO溶液的还原产物 将少量NaClO溶液与FeCl2充分反应后,滴加硝酸酸化的硝酸银溶液,观察沉淀产生情况
ClO2的制备与性质
(2023·盐城期中)二氧化氯(ClO2)是一种高效消毒剂,易溶于水,沸点为11.0 ℃,浓度高时极易爆炸。
(1) 实验室在60 ℃的条件下用闪锌矿(主要成分为ZnS)与NaClO3溶液、H2SO4溶液制备二氧化氯,同时生成硫酸锌。
①写出该反应的离子方程式:______________________________________________________________ __________________________。
②用如图所示的装置制备二氧化氯。则闪锌矿、NaClO3溶液、H2SO4溶液三种反应物的加料方式是______________________________________________________________________________________________________________________________________________________。
③若闪锌矿加料过量太多,生成ClO2的量明显减少的原因是____________________________________ _______________________________________________________________________________________。
④反应过程中通入N2的作用是_____________________________________________________________ _________________________________________。
(2) 某同学测定自来水厂经ClO2处理后的水中ClO2的浓度。步骤如下:取水样1.0 L,用稀硫酸调节溶液pH≤2,加入足量KI晶体,摇匀,在暗处静置30 min。取20.00 mL加入锥形瓶中,以淀粉溶液作指示剂,用0.001 0 mol/L Na2S2O3溶液滴定至终点[反应原理:I2+2S2O===2I-+S4O,ClO2+I-+H+——I2+Cl-+H2O(未配平)],消耗Na2S2O3溶液10.00 mL。计算水样中ClO2的浓度(单位:mg/L,写出计算过程)。
卤素的歧化反应与归中反应及其应用
1. 碱性歧化
价态变化规律为“中间价―→高价+低价”。
(1) Cl2+2OH-===Cl-+ClO-+H2O
(2) 3Cl2+6OH-(浓)5Cl-+ClO+3H2O(在加热条件下,氯元素的化合价升高为+5)
2. 酸性归中
价态变化规律为“高价+低价―→中间价”。
(1) 2H++Cl-+ClO-===Cl2↑+H2O
(2) 5Cl-+ClO+6H+===3Cl2↑+3H2O
3. 应用
(1) 从海水中提取溴
提取溴涉及的步骤和相关反应:
①氧化:向母液中通入Cl2,将Br-氧化为Br2(Cl2+2Br-===Br2+2Cl-)。
②吹出:利用溴的______性,通入热空气或水蒸气,吹出溴蒸气。
③吸收:3Br2+3Na2CO3===5NaBr+NaBrO3+3CO2↑(也可用SO2吸收)。
④制粗溴:_______________________________________________________________(写离子方程式)。
⑤精制:粗溴精制后得到高纯度溴。
(2) 从海带中提取碘
提取碘涉及的离子方程式:
2I-+2H++H2O2===_____________________、
3I2+6OH-===_________________________________、
5I-+IO+6H+===________________________。
[易错提醒]
①从I2的CCl4溶液中分离出I2,采用蒸馏法分离不合理,因为I2易与CCl4形成共沸物,且I2易升华,会导致碘损失。②海带要放在坩埚中灼烧,不可用烧杯或蒸发皿灼烧。
考点2 卤族元素
知 识 梳 理
卤族元素性质比较
1. 卤素单质的物理性质
卤素 F2 Cl2 Br2 I2
状态 气体 气体 液体 固体
颜色 浅黄绿色 黄绿色 深红棕色 紫黑色
2. 卤素单质的化学性质
(1) 与H2反应:
H2+F2===2HF(暗处爆炸) 、
H2+Cl22HCl 、
H2+Br22HBr 、H2+I22HI
F2、Cl2、Br2、I2与氢气反应越来越困难,稳定性:HF___HCl___HBr___HI(填“>”或“<”,下同),说明非金属性:F___Cl___Br___I。
(2) 与水反应
X2+H2O??HX+HXO(X=Cl、Br、I)
特例: 2F2+2H2O===4HF+O2
(3) 与碱(如NaOH)反应(写离子方程式)
①Cl2与碱反应:
________________________________________________________________________。
Cl2与碱在加热的条件下的反应:
___________________________________________________________________________。
②Br2、I2与碱反应:
___________________________________________________________________________、
_____________________________________________________________________。
③Br2与碳酸钠溶液反应:
________________________________________________________________________。
(4) 与Fe反应
2Fe+3X22FeX3(X=F、Cl、Br)
特例: Fe+I2FeI2
(5) 与SO2、H2O反应
X2+SO2+2H2O===2HX+H2SO4
(X=Cl、Br、I)
(1) Cl2能置换出Br2(Cl2+2Br-===2Cl-+Br2),同理,Br2也能置换出I2(Br2+2I-===2Br-+I2),可证明氧化性:Cl2>Br2>I2,阴离子的还原性:Cl-
①HF是有剧毒的气体。
②HF的水溶液是氢氟酸,氢氟酸是弱酸(氢溴酸和氢碘酸是强酸)。
③氢氟酸能腐蚀玻璃,故应保存在______瓶中。
(3) 液溴有剧毒,易挥发,存放在带磨口的棕色细口瓶中,加___液封。液溴有强氧化性,不能使用______塞。
(4) 常温常压下,碘(I2)是紫黑色的固体,加热升华,遇淀粉溶液变蓝。食用盐中加入的是____________(填化学式),可防治甲状腺肿大。
(5) 卤化银:一般AgX难溶于水,但AgF可溶于水;AgBr和AgI可用作感光材料;AgI可用于人工降雨。
卤素离子的检验方法
1. AgNO3溶液——沉淀法
待测液生成
2. 置换——萃取法
待测液有机层呈
3. I-的其他检验方法:
待测液溶液变蓝,表明有I-
溴水和碘水的萃取
[易错提醒]
①酒精易溶于水,不能作萃取卤素单质的萃取剂;
②直馏汽油可作萃取卤素单质的萃取剂,裂化汽油分子中含有不饱和键,不能作萃取卤素单质的萃取剂。
HF、HCl的制备
1. CaF2+H2SO4(浓)CaSO4+2HF↑(反应在铅皿中进行)
2. H2SO4(浓)+NaClNaHSO4+HCl↑
①制备原理:难挥发性酸制挥发性酸或高沸点酸制低沸点酸。
②HBr、HI可被浓硫酸氧化成单质,不能用NaBr、NaI与浓硫酸共热制HBr、HI。可以利用无氧化性的浓磷酸代替浓硫酸,在加热条件下制备。
卤素互化物
1. 概念:由两种或三种卤素组成的共价型化合物。如:IBr、ICl、ICl3、BrF3、ClF3等。
2. 化学性质
(1) 强氧化性
2Mg+2IBr===MgI2+MgBr2
(2) 易水解
ICl+H2O===HCl+HIO
注意:该反应是非氧化还原反应。
典 题 悟 法
物质的性质与用途
(2024·镇江期初)下列物质的结构与性质或性质与用途具有对应关系的是( )
A. HF键能大于HCl,HF的沸点高于HCl
B. HClO具有强氧化性,自来水厂用氯气杀菌消毒
C. HF为一元弱酸,可用于雕刻玻璃
D. I2单质易升华,可用于检验淀粉的存在
卤素互化物的性质
氯化碘(ICl)的性质类似于卤素,ICl有很强的氧化性。现有下列两个反应:
①2ICl+2Zn===ZnCl2+ZnI2
②ICl+H2O===HCl+HIO
下列叙述正确的是( )
A. Cl2与I2生成ICl是非氧化还原反应
B. 反应①中,ZnI2只是氧化产物
C. 反应①中,当转移0.4 mol电子时生成13.6 g ZnCl2(Cl—35.5,Zn—65)
D. 反应②中,ICl既是氧化剂又是还原剂
工业制溴
(2023·扬州中学)一种海水提溴的部分工艺流程如图所示:
下列说法错误的是( )
A. “氧化”和“转化”工序中Cl2的主要作用相同
B. 水相Ⅰ和水相Ⅱ中均含有H+和Cl-
C. “洗脱”工序可完成R3NCl的再生
D. 保存液溴时加适量水的主要作用是防止溴单质被氧化
工业制碘
(2023·苏州期末)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
下列说法错误的是( )
A. “还原”时发生反应的离子方程式:
SO+I2+H2O===2I-+SO+2H+
B. “操作X”使用的仪器为分液漏斗且CCl4从漏斗上口倒出
C. “氧化”时控制较低温度反应的目的之一是为了增大Cl2的溶解量
D. 回收的粗碘可通过升华的方法进行纯化
1. (2024·南通)下列物质的结构与性质或物质的性质与用途不具有对应关系的是( )
A. HClO具有弱酸性,可用于杀菌消毒
B. ClF3具有强氧化性,可用作火箭助燃剂
C. Cl-有孤电子对,可与Cu2+形成[CuCl4]2-
D. HF分子间存在氢键,HF沸点较高
2. (2023·常熟期中)浓盐酸和高锰酸钾在室温下即可制备Cl2,用如图装置制备少量的Cl2并探究其性质。下列说法正确的是( )
A. 高锰酸钾和浓盐酸反应的离子方程式为2MnO+10Cl-+16H+===2Mn2++5Cl2↑+8H2O
B. 根据溴化钠和碘化钠中的现象可证明氧化性:Cl2>Br2>I2
C. 紫色石蕊试液先变红后褪色,说明氯气具有酸性和强氧化性
D. 可用饱和食盐水代替NaOH溶液吸收多余的氯气
3. (2024·如皋适应性二)下列化学反应表示正确的是( )
A. 电解饱和食盐水制备Cl2的离子方程式:2Cl-+2H+Cl2↑+H2↑
B. 将氯水在强光下照射的化学方程式:2HClOCl2↑+2H2O
C. 氨气检验Cl2泄露的化学方程式:3Cl2+8NH3===N2+6NH4Cl
D. Cl2处理含氰碱性废水的离子方程式:5Cl2+2CN-+4H2O===10Cl-+N2+2CO2+8H+
4. (2023·常州中学)探究卤族元素单质及其化合物的性质,下列实验方案能达到探究目的的是( )
选项 实验方案 探究目的
A 向NaBr溶液中滴加过量氯水,再加入淀粉碘化钾溶液,观察溶液颜色变化 氧化性:Cl2>Br2>I2
B 向碘的CCl4溶液中加入等体积的KI浓溶液,振荡分层,下层由紫红色变成浅粉红色,上层呈棕黄色 碘在KI浓溶液的溶解能力大于在CCl4中的溶解能力
C 常温下,向盛有NaCl、NaI的混合溶液中加入2滴0.1 mol/L AgNO3溶液,观察沉淀颜色 溶度积Ksp:AgCl>AgI
D 取两份新制氯水,分别滴加AgNO3溶液和淀粉碘化钾溶液,观察实验现象 氯气与水的反应是否存在限度
第10讲 氯及其化合物 卤素
[备考导航]
(1) × (2) × (3) √ (4) √ (5) × (6) × (7) √ (8) × (9) √ (10) √ (11) √ (12) ×
考点1
[知识梳理]
知识1
2. Cl—Cl 非极性 分子
知识3
1. (1) 2FeCl3 CuCl2
(4) 2 2NaCl+Br2 2 2KCl+I2 2 2Fe3++2Cl-
2H2O H2SO4+2HCl(或SO+2Cl-+4H+)
H2O 2H++2Cl-+SO
2HCl+S↓(或2H++2Cl-+S↓)
2HCl+O2(或2H++2Cl-+O2)
3 8 N2+6NH4Cl
2. (1) Cl2+ H2O??HCl+HClO
Cl2+ H2O??H++Cl-+HClO
(2) ①Cl2+2NaOH===NaCl+NaClO+H2O
②2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
[常考归纳]
(1) H—O—Cl ①2HCl+O2↑ ③弱
(2) ②ClO-+Cl-+2H+===Cl2↑+H2O
(3) ①石灰乳 ②Ca(ClO)2+CO2+H2O===2HClO+CaCO3↓ ③Ca(ClO)2+CO2+H2O===2HClO+CaCO3↓ 2HClO2HCl+O2↑
知识4
1. (2) MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(3) 饱和食盐水 浓硫酸 (4) 向上
(6) 氢氧化钠(答案合理即可)
[常考归纳]
(1) ①2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O
(2) Cr2O+14H++6Cl-===2Cr3++3Cl2↑+7H2O
(3) KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
2. 2NaCl+2H2O2NaOH+H2↑+Cl2↑
3. BaCl2、NaOH、Na2CO3 BaCl2、Na2CO3、NaOH
[典题悟法]
典例1 B 【解析】 Cl2用于工业制盐酸,是因为氯气与氢气反应生成氯化氢,与其溶解性无关,A错误;HClO具有强氧化性,可用作漂白剂,与溶液呈酸性无关,C错误;NH4Cl中含植物生长所需的营养元素N,NH4Cl可用作氮肥,与NH4Cl易分解的性质无关,D错误。
典例2 D 【解析】 ClO-具有氧化性,向含有ClO-的溶液中通入具有还原性的SO2,ClO-被还原为Cl-,D错误。
典例3 C 【解析】 实验①中发生反应为Cl2+2OH-===ClO-+Cl-+H2O,A错误;HClO酸性弱于H2CO3,该反应不能发生,B错误;Cl2+ Na2S===S↓+2NaCl,氧化性:Cl2>S,C正确;2FeCl2+ Cl2===2FeCl3,实验④反应后的溶液中存在大量的 Fe3+、Cl-,D错误。
典例4 C 【解析】 实验室制取Cl2,应选用浓盐酸,A错误;用洗气瓶洗气时,气体应“长进短出”,B错误;Cl2在水中溶解度不大,应用NaOH溶液吸收尾气中的Cl2,D错误。
典例5 B 【解析】 观察钠元素的焰色不用透过蓝色钴玻璃,A错误;NaClO具有漂白性,能使pH试纸褪色,C错误;NaClO溶液与FeCl2充分反应后的还原产物为Cl-,而FeCl2会引入Cl-,干扰还原产物的检验,D错误。
典例6 (1) ①ZnS+8ClO+8H+Zn2++8ClO2↑+SO+4H2O ②将粉碎后的闪锌矿和NaClO3溶液混合(制成浆料)加入三颈烧瓶中,从滴液漏斗中缓慢滴加H2SO4溶液 ③过量的ZnS将生成的ClO2还原(或者过量的ZnS直接将NaClO3中的Cl还原至更低价态) ④加速ClO2的排出;起搅拌作用;稀释ClO2,防止其浓度高时发生爆炸
(2) n(Na2S2O3)=10.00×10-3 L×0.001 0 mol/L =1×10-5 mol
配平反应:2ClO2+10I-+8H+===5I2+2Cl-+4H2O、I2+2S2O===2I-+S4O
可得关系式:2ClO2~5I2 ~10S2O
n(ClO2)=1×10-5 mol×=2×10-6 mol
1.0 L水样含m(ClO2)=2×10-6 mol×67.5 g/mol×
×1 000 mg/g=6.75 mg,则水样中ClO2的浓度为6.75 mg/L
[深度指津]
3. (1) ②挥发 ④5Br-+BrO+6H+===3Br2+3H2O
(2) I2+2H2O 5I-+IO+3H2O 3I2+3H2O
考点2
[知识梳理]
知识1
2. (1) > > > > > >
(3) ①Cl2+2OH-=== Cl-+ClO-+H2O
3Cl2+6OH-(浓)5Cl-+ClO+3H2O
②3Br2+6OH-===5Br-+BrO+3H2O
3I2+ 6OH-===5I-+IO+3H2O
③3Br2+3CO===5Br-+BrO+3CO2↑
[常考归纳] (2) ③塑料 (3) 水 橡胶 (4) KIO3
[典题悟法]
典例7 B 【解析】 HF分子间存在氢键、HCl分子间不存在氢键,HF沸点高于HCl,A错误;HF能与玻璃中的SiO2反应,HF可用于雕刻玻璃,C错误;淀粉遇I2变蓝,与碘单质易升华无关,D错误。
典例8 C 【解析】 ICl中,Cl为-1价、I为+1价,Cl2与I2生成ICl是氧化还原反应,A错误;反应①中,Zn化合价升高、I化合价降低,ZnI2既是氧化产物又是还原产物,B错误;反应①中,每生成1 mol ZnCl2转移4 mol电子,当转移0.4 mol电子时生成0.1 mol ZnCl2(即13.6 g ZnCl2),C正确;反应②中各元素的化合价均未发生变化,是非氧化还原反应,D错误。
典例9 D 【解析】 “氧化”和“转化”工序中Cl2的主要作用均为氧化Br-,A正确;“氧化”时Cl2与Br-生成Br2和Cl-,同时氯气与水反应生成的HCl进入水相Ⅰ;“还原”时SO2与R3N[ClBr2]生成H2SO4、HBr、R3NCl,R3NCl与HBr生成HCl和R3NBr,水相Ⅰ和水相Ⅱ中均含有H+和Cl-,B正确;用盐酸“洗脱”R3NBr生成HBr同时生成R3NCl,可完成R3NCl的再生,C正确;保存液溴时加适量水的主要作用是防止Br2挥发,D错误。
典例10 B 【解析】 “还原”时SO将I2还原为I-,A正确;CCl4的密度大于水,应从分液漏斗下口放出,B错误;气体的溶解度随温度升高而降低,故“氧化”时温度不宜过高,C正确;碘易升华,D正确。
[质量评价]
1. A 【解析】 HClO有强氧化性,可用于杀菌消毒,A错误。
2. A 【解析】 Cl2和NaI反应生成I2,Cl2和NaBr反应生成Br2,说明氧化性:Cl2>I2、Cl2> Br2,但不能说明Br2氧化性大于I2,B错误;Cl2与水反应生成HCl和HClO,酸使紫色石蕊试液变红,HClO使红色溶液褪色,说明氯水具有酸性和强氧化性,C错误;饱和食盐水不能吸收氯气,D错误。
3. C 【解析】 电解饱和食盐水生成NaOH、H2和Cl2,A错误;HClO分解生成HCl和O2,B错误;碱性条件下离子方程式中不出现H+,D错误。
4. B 【解析】 过量氯水既能氧化Br-又能氧化I-,无法比较Br2和I2的氧化性,A错误;I2与I-生成I,I2在KI浓溶液中的溶解能力大于在CCl4中的溶解能力,B正确;未指明NaCl、NaI溶液的浓度,无法判断Ksp(AgCl)、Ksp(AgI)的相对大小,C错误;新制氯水中的氯气和HClO都能与KI溶液反应生成使淀粉变蓝色的I2,溶液变蓝色不能说明溶液中存在Cl2分子,无法证明Cl2与水的反应存在限度,D错误。
同课章节目录
