1.3氧化还原反应(第4课时)--人教A版(2019)高中化学必修1
文档属性
| 名称 | 1.3氧化还原反应(第4课时)--人教A版(2019)高中化学必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 851.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-15 09:13:47 | ||
图片预览






文档简介
(共22张PPT)
氧化还原反应
第4课时
掌握氧化还原反应方程式的配平与计算。
氧化还原反应方程式的配平
配平原则:
阴阳离子所带的电荷相等
电子守恒
还原剂失电子的总数=氧化剂得电子的总数
化合价升高的总数=化合价降低的总数
质量守恒
反应前后原子种类和个数不变
电荷守恒
×1
×1
2
2
+2 +2 +4 0
1
1
1
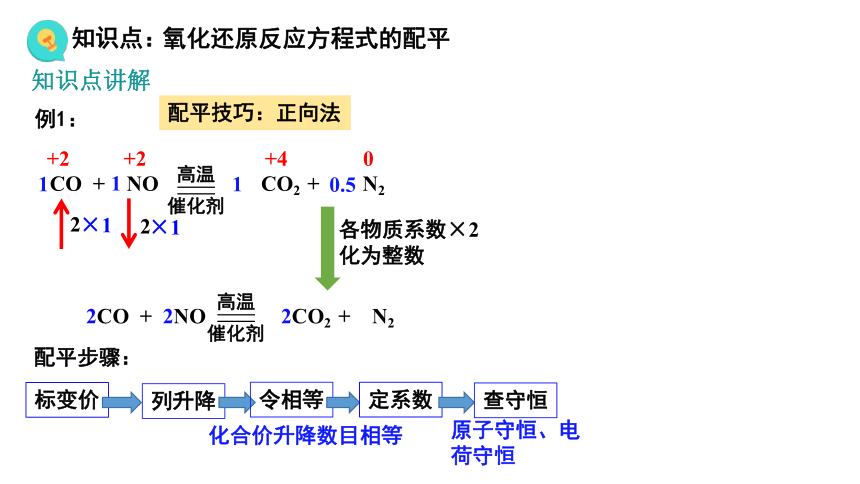
例1:
标变价
列升降
令相等
化合价升降数目相等
定系数
查守恒
原子守恒、电荷守恒
配平步骤:
0.5
各物质系数×2化为整数
2CO + 2NO 2CO2 + N2
CO + NO CO2 + N2
高温
催化剂
高温
催化剂
配平技巧:正向法
氧化还原反应方程式的配平
NO + NH3 N2 + H2O
+2
-3
0
×3
3
2
×2
2.5
3
2
3
各物质系数×2化为整数
例2:
NO + NH3 N2 + H2O
5
6
4
6
归中反应
易错警醒:
化学方程式的系数应为整数。
配平技巧:正向法
氧化还原反应方程式的配平
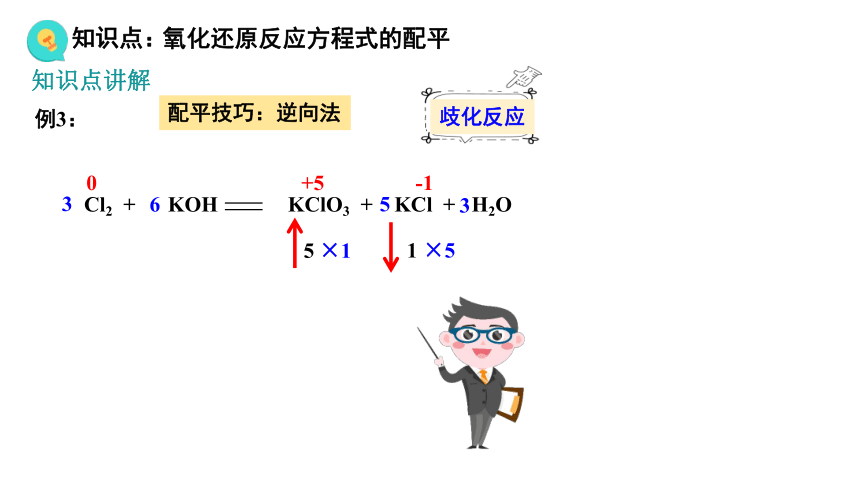
例3:
Cl2 + KOH KClO3 + KCl + H2O
0 +5 -1
×1
1
5
×5
5
3
6
3
歧化反应
配平技巧:逆向法
氧化还原反应方程式的配平
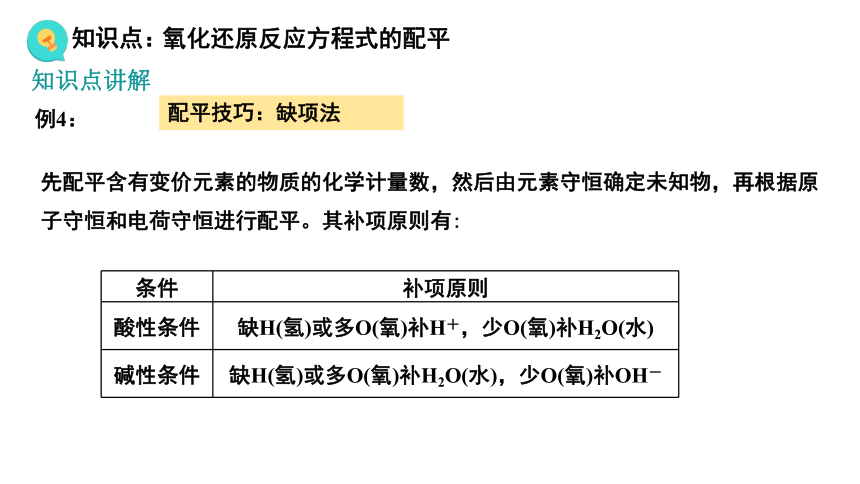
配平技巧:缺项法
例4:
①将Mn在酸性条件下氧化Fe2+的离子方程式补充完整:
___Mn +___Fe2+ +____===__Mn2++__Fe3++_____
1
5
8H+
1
5
4H2O
②___MnO2 +__Cl+_____===__Mn+__ Cl-+__H2O
3
1
6OH
3
1
3
氧化还原反应方程式的配平
配平技巧:缺项法
例4:
先配平含有变价元素的物质的化学计量数,然后由元素守恒确定未知物,再根据原子守恒和电荷守恒进行配平。其补项原则有:
条件 补项原则
酸性条件 缺H(氢)或多O(氧)补H+,少O(氧)补H2O(水)
碱性条件 缺H(氢)或多O(氧)补H2O(水),少O(氧)补OH-
氧化还原反应方程式的配平
①划好价——划出有变的元素化合价;
②列变化——列出元素化合价升降变化;
③求总数——求出化合价升降的最小公倍数,使化合价升高和降低的数目相等;
④配系数——配出氧化剂、还原剂、氧化产物、还原产物的系数,观察法配平其它物质的系数;
⑤作检查——查原子是否守恒、电荷是否守恒(通常通过检查氧元素的原子数),画上等号。
氧化还原方程式的配平步骤:
氧化还原反应方程式的配平
1. 一般从左配:对于一般氧化还原反应,一般从左边氧化剂、还原剂着手配平。
2. 自变从右配:对于自身氧化还原反应,一般从右边氧化产物、还原产物配平。
3. 归中从左配:对于一般氧化还原反应,一般从左边氧化剂、还原剂着手配平。
4. 部分别忘加:对于部分氧化还原反应,一般先配平得失电子,再加上没有变价的部分。
氧化还原方程式的配平技巧:
氧化还原反应方程式的配平
1. 按要求书写方程式:
(1)已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体(Cl2),而溶液的紫红色褪去。在一氧化还原反应的体系中,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。
①写出一个包含上述七种物质的氧化还原反应方程式,并配平_______________________________________________________
②在反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,BiO3-反应后变为无色的Bi3+。写出该实验中涉及反应的离子方程式_______________________________________________________
2KMnO4+10KCl+8H2SO4== 6K2SO4+2MnSO4+5Cl2↑+8H2O
2Mn2++5NaBiO3+14H+===2MnO4-+5Na++5Bi3++7H2O
氧化还原反应方程式的配平
(2)+6价铬的毒性很强,制取红矾钠后的废水中含有的Cr2O72-,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式_________________________________________________。
1. 按要求书写方程式:
Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O
氧化还原反应方程式的配平
氧化剂 对应还原产物
Cl2、ClO-、KClO3 Cl-
O2 O2-
Fe3+ Fe2+
KMnO4(H+)、MnO2 Mn2+(紫色褪去)
H2O2(绿色氧化剂) H2O
K2Cr2O7(H+) Cr3+
浓H2SO4 SO2 + H2O
浓HNO3 NO2 + H2O
稀HNO3 NO + H2O
常见氧化剂所对应的还原产物
氧化还原反应方程式的配平
氧化还原反应方程式的配平
常见还原剂所对应的氧化产物
还原剂 对应氧化产物
Fe2+ Fe3+
SO2、SO32-、S2O32- SO42-
H2O2 O2
S2-、HS-、H2S S
I- I2
H2C2O4 CO2
CO、C CO2
NH3 N2、NO
氧化还原反应的相关计算
计算依据——得失电子守恒
还原剂失电子总数=氧化剂得电子总数=氧化剂化合价降低总数=还原剂化合价升高总数=转移电子总数
氧化还原反应的相关计算
常见题型总结:
①判断特殊反应的转移电子数目。
②判断特殊反应的两剂两产物的比值关系。
③判断简单反应的产物价态或可能产物物质。
④建立物质数量与转移电子数目之间的联系。
氧化还原反应的相关计算
解题的一般步骤为:
(1)“找物质”
找出氧化剂、还原性及相应的还原产物和氧化产物。
(2)“定得失”
确定一个原子或离子得失电子数 (注意化学式中粒子的个数)。
(3)“列关系式”
根据方程式关系建立物质数量与转移电子数目之间的联系:还原剂失电子总数=氧化剂得电子总数=氧化剂化合价降低总数=还原剂化合价升高总数=转移电子总数。
氧化还原反应的相关计算
1. 2020年8月初,黎巴嫩首都贝鲁特港口发生大规模爆炸,该爆炸是由于储存在仓库的2750吨硝酸铵引起的。已知爆炸时硝酸钠按下式分解:5NH4NO3 = 4N2↑ + 2HNO3 + 9H2O,则该反应中被氧化和被还原的N原子数之比为( )
A.1:1
B.3:5
C.5:3
D.3:2
氧化还原反应的相关计算
【答案】C
【解析】 5NH4NO3 = 4N2↑ + 2HNO3 + 9H2O中N元素的化合价由-3价升高为0,N元素的化合价由+5价降低为0,5个N原子失去电子与3个N原子得到电子相等,则反应中被氧化和被还原的N原子数之比为5:3。
氧化还原反应的相关计算
2. M2O7x-与S2-在酸性溶液中发生如下反应:M2O7x- + 3S2- + 14H+ = 2M3+ + 3S↓ + 7H2O,则M2O7x-中M的化合价为( )
A.+7
B.+2
C.+6
D.+4
氧化还原反应的相关计算
【答案】C
【解析】先利用离子反应中的电荷守恒来确定 x ,再利用M2O7x-中元素的化合价的代数和为-x来计算M的化合价。
M2O7x- + 3S2- + 14H+ = 2M3+ + 3S↓ + 7H2O中,由电荷守恒可知,
(-x)+ 3×(-2)+ 14×(+1)= 2×(+3),解得x=2。
设M2O72- 中的M的化合价为y,M2O7x- 中元素的化合价的代数和为-x,则y×2 + (-2)×7 = -2,解得y= +6。
谢谢!
氧化还原反应
第4课时
掌握氧化还原反应方程式的配平与计算。
氧化还原反应方程式的配平
配平原则:
阴阳离子所带的电荷相等
电子守恒
还原剂失电子的总数=氧化剂得电子的总数
化合价升高的总数=化合价降低的总数
质量守恒
反应前后原子种类和个数不变
电荷守恒
×1
×1
2
2
+2 +2 +4 0
1
1
1
例1:
标变价
列升降
令相等
化合价升降数目相等
定系数
查守恒
原子守恒、电荷守恒
配平步骤:
0.5
各物质系数×2化为整数
2CO + 2NO 2CO2 + N2
CO + NO CO2 + N2
高温
催化剂
高温
催化剂
配平技巧:正向法
氧化还原反应方程式的配平
NO + NH3 N2 + H2O
+2
-3
0
×3
3
2
×2
2.5
3
2
3
各物质系数×2化为整数
例2:
NO + NH3 N2 + H2O
5
6
4
6
归中反应
易错警醒:
化学方程式的系数应为整数。
配平技巧:正向法
氧化还原反应方程式的配平
例3:
Cl2 + KOH KClO3 + KCl + H2O
0 +5 -1
×1
1
5
×5
5
3
6
3
歧化反应
配平技巧:逆向法
氧化还原反应方程式的配平
配平技巧:缺项法
例4:
①将Mn在酸性条件下氧化Fe2+的离子方程式补充完整:
___Mn +___Fe2+ +____===__Mn2++__Fe3++_____
1
5
8H+
1
5
4H2O
②___MnO2 +__Cl+_____===__Mn+__ Cl-+__H2O
3
1
6OH
3
1
3
氧化还原反应方程式的配平
配平技巧:缺项法
例4:
先配平含有变价元素的物质的化学计量数,然后由元素守恒确定未知物,再根据原子守恒和电荷守恒进行配平。其补项原则有:
条件 补项原则
酸性条件 缺H(氢)或多O(氧)补H+,少O(氧)补H2O(水)
碱性条件 缺H(氢)或多O(氧)补H2O(水),少O(氧)补OH-
氧化还原反应方程式的配平
①划好价——划出有变的元素化合价;
②列变化——列出元素化合价升降变化;
③求总数——求出化合价升降的最小公倍数,使化合价升高和降低的数目相等;
④配系数——配出氧化剂、还原剂、氧化产物、还原产物的系数,观察法配平其它物质的系数;
⑤作检查——查原子是否守恒、电荷是否守恒(通常通过检查氧元素的原子数),画上等号。
氧化还原方程式的配平步骤:
氧化还原反应方程式的配平
1. 一般从左配:对于一般氧化还原反应,一般从左边氧化剂、还原剂着手配平。
2. 自变从右配:对于自身氧化还原反应,一般从右边氧化产物、还原产物配平。
3. 归中从左配:对于一般氧化还原反应,一般从左边氧化剂、还原剂着手配平。
4. 部分别忘加:对于部分氧化还原反应,一般先配平得失电子,再加上没有变价的部分。
氧化还原方程式的配平技巧:
氧化还原反应方程式的配平
1. 按要求书写方程式:
(1)已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体(Cl2),而溶液的紫红色褪去。在一氧化还原反应的体系中,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。
①写出一个包含上述七种物质的氧化还原反应方程式,并配平_______________________________________________________
②在反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,BiO3-反应后变为无色的Bi3+。写出该实验中涉及反应的离子方程式_______________________________________________________
2KMnO4+10KCl+8H2SO4== 6K2SO4+2MnSO4+5Cl2↑+8H2O
2Mn2++5NaBiO3+14H+===2MnO4-+5Na++5Bi3++7H2O
氧化还原反应方程式的配平
(2)+6价铬的毒性很强,制取红矾钠后的废水中含有的Cr2O72-,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式_________________________________________________。
1. 按要求书写方程式:
Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O
氧化还原反应方程式的配平
氧化剂 对应还原产物
Cl2、ClO-、KClO3 Cl-
O2 O2-
Fe3+ Fe2+
KMnO4(H+)、MnO2 Mn2+(紫色褪去)
H2O2(绿色氧化剂) H2O
K2Cr2O7(H+) Cr3+
浓H2SO4 SO2 + H2O
浓HNO3 NO2 + H2O
稀HNO3 NO + H2O
常见氧化剂所对应的还原产物
氧化还原反应方程式的配平
氧化还原反应方程式的配平
常见还原剂所对应的氧化产物
还原剂 对应氧化产物
Fe2+ Fe3+
SO2、SO32-、S2O32- SO42-
H2O2 O2
S2-、HS-、H2S S
I- I2
H2C2O4 CO2
CO、C CO2
NH3 N2、NO
氧化还原反应的相关计算
计算依据——得失电子守恒
还原剂失电子总数=氧化剂得电子总数=氧化剂化合价降低总数=还原剂化合价升高总数=转移电子总数
氧化还原反应的相关计算
常见题型总结:
①判断特殊反应的转移电子数目。
②判断特殊反应的两剂两产物的比值关系。
③判断简单反应的产物价态或可能产物物质。
④建立物质数量与转移电子数目之间的联系。
氧化还原反应的相关计算
解题的一般步骤为:
(1)“找物质”
找出氧化剂、还原性及相应的还原产物和氧化产物。
(2)“定得失”
确定一个原子或离子得失电子数 (注意化学式中粒子的个数)。
(3)“列关系式”
根据方程式关系建立物质数量与转移电子数目之间的联系:还原剂失电子总数=氧化剂得电子总数=氧化剂化合价降低总数=还原剂化合价升高总数=转移电子总数。
氧化还原反应的相关计算
1. 2020年8月初,黎巴嫩首都贝鲁特港口发生大规模爆炸,该爆炸是由于储存在仓库的2750吨硝酸铵引起的。已知爆炸时硝酸钠按下式分解:5NH4NO3 = 4N2↑ + 2HNO3 + 9H2O,则该反应中被氧化和被还原的N原子数之比为( )
A.1:1
B.3:5
C.5:3
D.3:2
氧化还原反应的相关计算
【答案】C
【解析】 5NH4NO3 = 4N2↑ + 2HNO3 + 9H2O中N元素的化合价由-3价升高为0,N元素的化合价由+5价降低为0,5个N原子失去电子与3个N原子得到电子相等,则反应中被氧化和被还原的N原子数之比为5:3。
氧化还原反应的相关计算
2. M2O7x-与S2-在酸性溶液中发生如下反应:M2O7x- + 3S2- + 14H+ = 2M3+ + 3S↓ + 7H2O,则M2O7x-中M的化合价为( )
A.+7
B.+2
C.+6
D.+4
氧化还原反应的相关计算
【答案】C
【解析】先利用离子反应中的电荷守恒来确定 x ,再利用M2O7x-中元素的化合价的代数和为-x来计算M的化合价。
M2O7x- + 3S2- + 14H+ = 2M3+ + 3S↓ + 7H2O中,由电荷守恒可知,
(-x)+ 3×(-2)+ 14×(+1)= 2×(+3),解得x=2。
设M2O72- 中的M的化合价为y,M2O7x- 中元素的化合价的代数和为-x,则y×2 + (-2)×7 = -2,解得y= +6。
谢谢!
