大单元五 化学反应与能量变化 大单元整合 提能力验考情五 学案 (含答案)2026届高三化学一轮大单元复习
文档属性
| 名称 | 大单元五 化学反应与能量变化 大单元整合 提能力验考情五 学案 (含答案)2026届高三化学一轮大单元复习 |
|
|
| 格式 | DOC | ||
| 文件大小 | 941.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-15 00:00:00 | ||
图片预览




文档简介
大单元五 化学反应与能量变化
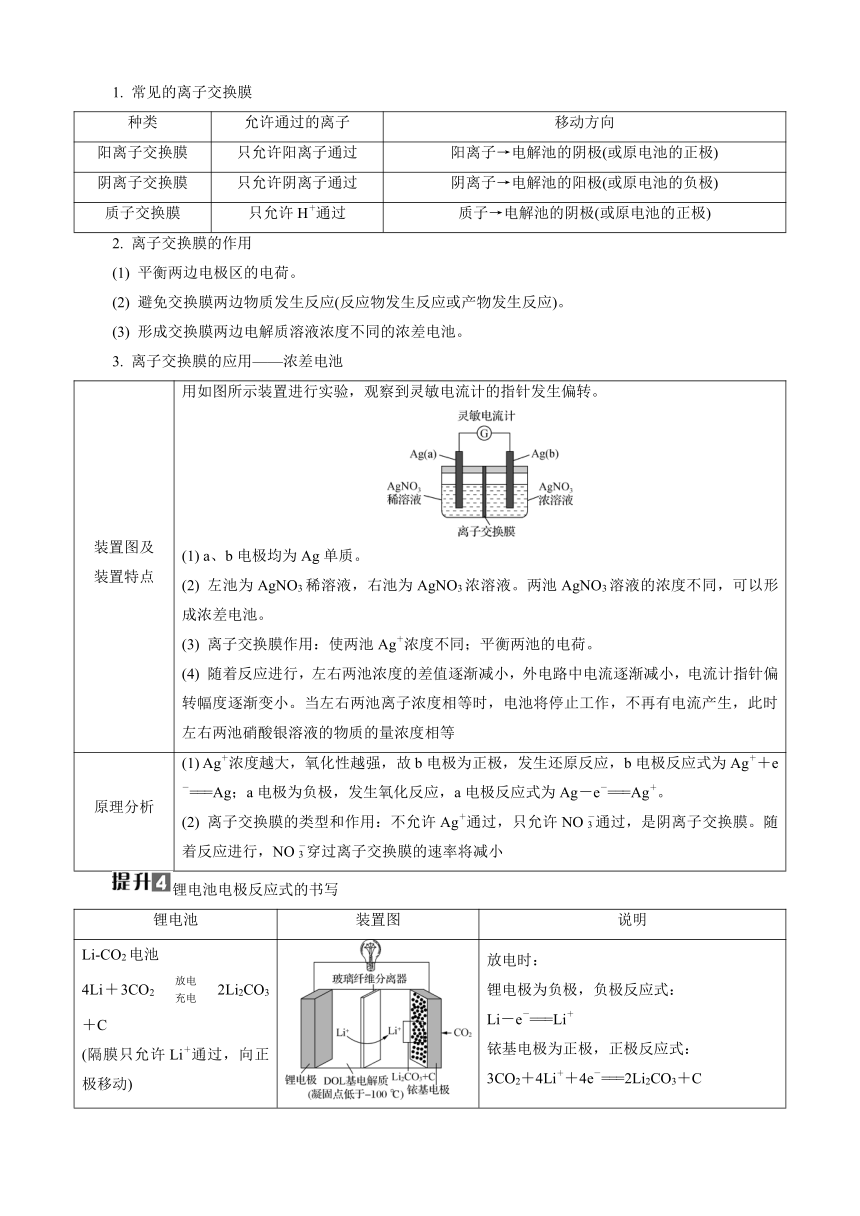
化学反应进行的方向
1. 熵和熵变
(1) 熵的含义:衡量一个体系混乱度的物理量,用符号S表示。一般规律是S(g)>S(l)>S(s)。
(2) 熵变的含义:反应前后熵的变化量,用ΔS表示,ΔS越大,越有利于反应自发进行。
2. 化学反应进行的方向及解题方法要点
(1) 反应趋势:化学反应大都趋向于放热反应和混乱度增加的方向进行。
(2) 解题方法要点:一个化学反应能够自发进行,ΔH和ΔS至少有一个是有利于反应自发的。若ΔH不利于反应自发,即ΔH>0,则ΔS必须有利于反应自发,即ΔS>0;若ΔS不利于反应自发,即ΔS<0,则ΔH必须有利于反应自发,即ΔH<0。
3. 综合判断
在等温、等压条件下的封闭体系中(不考虑体积变化做功以外的其他功),自由能的变化(符号为ΔG)综合了反应体系的焓变和熵变对自发过程的影响,即ΔG=ΔH-TΔS。ΔG<0反应能自发进行;ΔG=0反应处于平衡状态;ΔG>0反应不能自发进行。
有关电化学装置的分析
离子交换膜类型、作用及应用
1. 常见的离子交换膜
种类 允许通过的离子 移动方向
阳离子交换膜 只允许阳离子通过 阳离子→电解池的阴极(或原电池的正极)
阴离子交换膜 只允许阴离子通过 阴离子→电解池的阳极(或原电池的负极)
质子交换膜 只允许H+通过 质子→电解池的阴极(或原电池的正极)
2. 离子交换膜的作用
(1) 平衡两边电极区的电荷。
(2) 避免交换膜两边物质发生反应(反应物发生反应或产物发生反应)。
(3) 形成交换膜两边电解质溶液浓度不同的浓差电池。
3. 离子交换膜的应用——浓差电池
装置图及装置特点 用如图所示装置进行实验,观察到灵敏电流计的指针发生偏转。(1) a、b电极均为Ag单质。(2) 左池为AgNO3稀溶液,右池为AgNO3浓溶液。两池AgNO3溶液的浓度不同,可以形成浓差电池。(3) 离子交换膜作用:使两池Ag+浓度不同;平衡两池的电荷。(4) 随着反应进行,左右两池浓度的差值逐渐减小,外电路中电流逐渐减小,电流计指针偏转幅度逐渐变小。当左右两池离子浓度相等时,电池将停止工作,不再有电流产生,此时左右两池硝酸银溶液的物质的量浓度相等
原理分析 (1) Ag+浓度越大,氧化性越强,故b电极为正极,发生还原反应,b电极反应式为Ag++e-===Ag;a电极为负极,发生氧化反应,a电极反应式为Ag-e-===Ag+。(2) 离子交换膜的类型和作用:不允许Ag+通过,只允许NO通过,是阴离子交换膜。随着反应进行,NO穿过离子交换膜的速率将减小
锂电池电极反应式的书写
锂电池 装置图 说明
Li-CO2电池4Li+3CO22Li2CO3+C(隔膜只允许Li+通过,向正极移动) 放电时:锂电极为负极,负极反应式:Li-e-===Li+铱基电极为正极,正极反应式:3CO2+4Li++4e-===2Li2CO3+C
LiFePO4-C电池Li1-xFePO4+LixC6LiFePO4+6C(隔膜只允许Li+通过,向正极移动,LixC6中C元素为0价) 放电时:M为负极,负极反应式:LixC6-xe-===6C+xLi+N为正极,正极反应式:Li1-xFePO4+xLi++xe-===LiFePO4
全固态锂-硫电池16Li+xS88Li2Sx(2≤x≤8)(Li+移向电极a),电极a掺有石墨烯,可增强电极导电性 放电时:电极b是负极,负极反应式:Li-e-===Li+,电极a是正极,正极反应式(第一步):S8+2e-+2Li+===Li2S8
LiCoO2-C电池Li1-xCoO2+LixC6LiCoO2+6C (放电过程中,Li+从负极脱出,嵌入正极) 放电时:N为负极,负极反应式:LixC6-xe-===6C+xLi+M为正极,正极反应式:Li1-xCoO2+xLi++xe-===LiCoO2
锂-空气电池4Li+O2+2H2O4LiOH(Li+移向B极) 放电时:A为负极,负极反应式:Li-e-===Li+B为正极,正极反应式:O2+4e-+2H2O===4OH-(电解液不能是水溶液,因为金属锂可与水反应)
盖斯定律与反应的自发性
1. (2024·浙江6月卷)氢是清洁能源,硼氢化钠(NaBH4)是一种环境友好的固体储氢材料,其水解生氢反应方程式如下(除非特别说明,本题中反应条件均为25 ℃,101 kPa):NaBH4(s)+2H2O(l)===NaBO2(aq)+4H2(g) ΔH<0。该反应能自发进行的条件是( )
A. 高温 B. 低温
C. 任意温度 D. 无法判断
2. (1) (2024·浙江1月卷)某研究小组用热化学方法将CO2转化为HCOOH,相关热化学方程式如下:
Ⅰ. C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol
Ⅱ. C(s)+H2(g)+O2(g)===HCOOH(g) ΔH2=-378.7 kJ/mol
Ⅲ. CO2(g)+H2(g)??HCOOH(g)ΔH3
则ΔH3=_______________ kJ/mol。
(2) (2024·全国甲卷)已知如下热化学方程式:
①CH4(g)+Br2(g)===CH3Br(g)+HBr(g) ΔH1=-29 kJ/mol
②3CH3Br(g)===C3H6(g)+3HBr(g) ΔH2=+20 kJ/mol
计算反应③ 3CH4(g)+3Br2(g)===C3H6(g)+6HBr(g)的ΔH=_________ kJ/mol
(3) (2024·安徽卷)C2H6氧化脱氢反应:
①2C2H6(g)+O2(g)===2C2H4(g)+2H2O(g) ΔH1=-209.8 kJ/mol
②C2H6(g)+CO2(g)===C2H4(g)+H2O(g)+CO(g) ΔH2=+178.1 kJ/mol
计算反应2CO(g)+O2(g)===2CO2(g)的ΔH3=__________________ kJ/mol。
(4) (2024·广东卷)反应a:NO(aq)+NH(aq)===N2(g)+2H2O(l) ΔH
已知:
则反应a的ΔH=_____________________________________________。
(5) (2024·山东卷)已知:
Ⅰ. C(s)+H2O(g)===CO(g)+H2(g) ΔH1>0
Ⅱ. CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2<0
Ⅲ. CaO(s)+CO2(g)===CaCO3(s) ΔH3<0
则反应C(s)+CaO(s)+2H2O(g)??CaCO3(s)+2H2(g)的ΔH=_________________________________(用代数式表示)。
(6) (2024·湖南卷)已知:
ⅰ. HOCH2CH2COOC2H5(g)―→CH2===CHCOOC2H5(g)+H2O(g) ΔH1
ⅱ. CH2===CHCOOC2H5(g)+NH3(g)―→CH2===CHCONH2(g)+C2H5OH(g) ΔH2
ⅲ. CH2===CHCONH2(g)―→CH2===CHCN(g)+H2O(g) ΔH3
则反应HOCH2CH2COOC2H5(g)+NH3(g)―→CH2===CHCN(g)+C2H5OH(g)+2H2O(g)的ΔH=_________________________(用含ΔH1、ΔH2、和ΔH3的代数式表示)。
(7) (2024·浙江6月卷)某流程将偏硼酸钠(NaBO2)再生为NaBH4(已知:ΔG是反应的自由能变化量,其计算方法也遵循盖斯定律,可类比ΔH计算方法;当ΔG<0时,反应能自发进行)。
Ⅰ. NaBH4(s)+2H2O(l)===NaBO2(s)+4H2(g)ΔG1=-320 kJ/mol
Ⅱ. H2(g)+O2(g)===H2O(l)ΔG2=-240 kJ/mol
Ⅲ. Mg(s)+O2(g)===MgO(s)ΔG3=-570 kJ/mol
写出表示NaBO2再生为NaBH4的一种制备方法(注明ΔG,要求反应物不超过三种物质;氢原子利用率为100%):__________________________________________________________________________________ ______________________________________________________________________________________。
原电池
3. (2024·湖南卷)近年来,我国新能源产业得到了蓬勃发展。下列说法错误的是( )
A. 理想的新能源应具有资源丰富、可再生、对环境无污染等特点
B. 氢氧燃料电池具有能量转化率高、清洁等优点
C. 锂离子电池放电时锂离子从负极脱嵌,充电时锂离子从正极脱嵌
D. 太阳能电池是一种将化学能转化为电能的装置
4. (2024·北京卷)酸性锌锰干电池的构造如图所示。下列关于该电池及其工作原理的说法正确的是( )
A. 石墨作电池的负极材料
B. 电池工作时,NH向负极方向移动
C. MnO2发生氧化反应
D. 锌筒发生的电极反应为Zn-2e-===Zn2+
5. (2024·广东卷)我国自主设计建造的浮式生产储卸油装置“海葵一号”将在珠江口盆地海域使用,其钢铁外壳镶嵌了锌块,以利用电化学原理延缓外壳的腐蚀。下列有关说法正确的是( )
A. 钢铁外壳为负极
B. 镶嵌的锌块可永久使用
C. 该法为外加电流法
D. 锌发生反应:Zn-2e-===Zn2+
6. (2024·浙江1月卷)破损的镀锌铁皮在氨水中发生电化学腐蚀,生成[Zn(NH3)4]2+和H2。下列说法不正确的是( )
A. 氨水浓度越大,腐蚀趋势越大
B. 随着腐蚀的进行,溶液pH变大
C. 铁电极上的电极反应式为2NH3+2e-===2NH+H2↑
D. 每生成标准状况下224 mL H2,消耗0.010 mol Zn
7. (2024·浙江6月卷)金属腐蚀会对设备产生严重危害,腐蚀快慢与材料种类、所处环境有关。两种对海水中钢闸门的防腐措施如图所示。下列说法正确的是( )
A. 图1、图2中,阳极材料本身均失去电子
B. 图2中,外加电压偏高时,钢闸门表面可发生反应:O2+4e-+2H2O===4OH-
C. 图2中,外加电压保持恒定不变,有利于提高对钢闸门的防护效果
D. 图1、图2中,当钢闸门表面的腐蚀电流为零时,钢闸门、阳极均不发生化学反应
8. (2024·浙江6月卷)氢能的高效利用途径之一是在燃料电池中产生电能。某研究小组的自制熔融碳酸盐燃料电池工作原理如图所示,正极上的电极反应式为___________________________________________。
电解池
9. (2024·广东卷)一种基于氯碱工艺的新型电解池如图所示,可用于湿法冶铁的研究。电解过程中,下列说法不正确的是( )
A. 阳极反应:2Cl--2e-===Cl2↑
B. 阴极区溶液中OH-浓度逐渐升高
C. 理论上每消耗1 mol Fe2O3,阳极室溶液减少213 g
D. 理论上每消耗1 mol Fe2O3,阴极室物质最多增加138 g
10. (2024·湖南卷)在KOH水溶液中,电化学方法合成高能物质K4C6N16时,伴随少量O2生成,电解原理如图所示。下列说法正确的是( )
A. 电解时,OH-向Ni电极移动
B. 生成C6N的电极反应:2C3N8H4+8OH--4e-===C6N+8H2O
C. 电解一段时间后,溶液pH升高
D. 每生成1 mol H2的同时,生成0.5 mol K4C6N16
11. (2024·山东卷)以不同材料修饰的Pt为电极,一定浓度的NaBr溶液为电解液,采用电解和催化相结合的循环方式,可实现高效制H2和O2,装置如图所示。下列说法错误的是( )
A. 电极a连接电源负极
B. 加入Y的目的是补充NaBr
C. 电解总反应为Br-+3H2OBrO+3H2↑
D. 催化阶段反应产物物质的量之比n(Z)∶n(Br-)=3∶2
12. (2024·湖北卷)我国科学家设计了一种双位点PbCu电催化剂,用H2C2O4和NH2OH电化学催化合成甘氨酸,原理如图所示。双极膜中H2O解离的H+和OH-在电场作用下向两极迁移。已知在KOH溶液中,甲醛转化为HOCH2O-,存在平衡HOCH2O-+OH-??[OCH2O]2-+H2O。Cu电极上发生的电子转移反应为[OCH2O]2--e-===HCOO-+H·。下列说法错误的是( )
A. 电解一段时间后阳极区c(OH-)减小
B. 理论上生成1 mol H3N+CH2COOH双极膜中有4 mol H2O解离
C. 阳极总反应式为2HCHO+4OH--2e-―→2HCOO-+H2↑+2H2O
D. 阴极区存在反应:H2C2O4+2H++2e-―→CHOCOOH+H2O
13. (1) (2024·广东卷) 加入冰晶石“电解熔融Al2O3”中,反应的化学方程式为____________________ _______________________________。
(2) (2024·湖北卷)电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用是_________________________________。
(3) (2024·浙江1月卷)某研究小组采用电化学方法将CO2转化为HCOOH,装置如图。则电极B上发生的电极反应式是_________________________________________________________。
(4) (2024·北京卷)研究表明可以用电解法以N2为氨源直接制备HNO3,其原理如图所示。电极a表面生成NO的电极反应式:__________________________________________________________________。
(5) (2024·湖南卷)以CH2===CHCN为原料,稀硫酸为电解液,Sn作阴极,用电解的方法可制得Sn(CH2CH2CN)4,其阴极反应式:________________________________________________________________ __________________________________________________。
(6) (2024·安徽卷) 某“电沉积”步骤中[Ag(S2O3)2]3-得电子被还原为Ag,则阴极的电极反应式为_____________________________________________________________________________。
可充电电池
14. (2024·全国甲卷)科学家使用δ-MnO2研制了一种MnO2-Zn可充电电池(如图所示)。电池工作一段时间后,MnO2电极上检测到MnOOH和少量ZnMn2O4。下列叙述正确的是( )
A. 充电时,Zn2+向阳极方向迁移
B. 充电时,会发生反应:Zn+2MnO2===ZnMn2O4
C. 放电时,正极反应有MnO2+H2O+e-===MnOOH+OH-
D. 放电时,Zn电极质量减少0.65 g,MnO2电极生成了0.020 mol MnOOH
15. (2024·河北卷)我国科技工作者设计了如图所示的可充电Mg-CO2电池,以Mg(TFSI)2为电解质,电解液中加入1,3-丙二胺(PDA)以捕获CO2,使放电时CO2还原产物为MgC2O4。该设计克服了MgCO3导电性差和释放CO2能力差的障碍,同时改善了Mg2+的溶剂化环境,提高了电池充放电循环性能。下列说法错误的是( )
A. 放电时,电池总反应为2CO2+Mg===MgC2O4
B. 充电时,多孔碳纳米管电极与电源正极连接
C. 充电时,电子由Mg电极流向阳极,Mg2+向阴极迁移
D. 放电时,每转移1 mol电子,理论上可转化1 mol CO2
16. (2024·安徽卷)我国学者研发出一种新型水系锌电池,其示意图如下。该电池分别以Zn-TCPP(局部结构如标注框内所示)形成的稳定超分子材料和Zn为电极,以ZnSO4和KI混合液为电解质溶液。下列说法错误的是( )
A. 标注框内所示结构中存在共价键和配位键
B. 电池总反应为I+ZnZn2++3I-
C. 充电时,阴极被还原的Zn2+主要来自Zn-TCPP
D. 放电时,消耗0.65 g Zn,理论上转移0.02 mol 电子
大单元整合 提能力验考情五
[高考新视野]
1. C 【解析】 反应NaBH4(s)+2H2O(l)===NaBO2(aq)+4H2(g) ΔH<0,ΔS>0,由ΔG=ΔH-TΔS可知,任意温度下,该反应均能自发进行,故选C。
2. (1) +14.8 (2) -67 (3) -566.0
(4) ΔH1-ΔH2-ΔH3+ΔH4
(5) ΔH1+ΔH2+ΔH3
(6) ΔH1+ΔH2+ΔH3 (7) NaBO2(s)+2H2(g)+2Mg(s)===NaBH4(s)+2MgO(s) ΔG=-340 kJ/mol
【解析】 (1) ΔH3=ΔH2-ΔH1=(-378.7+393.5)kJ/mol=+14.8 kJ/ mol。(2) 根据盖斯定律,将反应①×3+②可得反应③,故ΔH=(-29×3+20)kJ/mol=-67 kJ/mol。(3) 根据盖斯定律,反应①-反应②×2可得目标反应,则ΔH3=ΔH1-2ΔH2=(-209.8-178.1×2) kJ/mol=-566.0 kJ/mol。(4) 由已知可得:Ⅰ. NaNO2(s)+NH4Cl(s)===N2(g)+NaCl(s)+2H2O(l) ΔH1;Ⅱ. NaNO2(s)===Na+(aq)+NO(aq) ΔH2;Ⅲ. NH4Cl(s)===Cl-(aq)+NH(aq) ΔH3;Ⅳ. NaCl(s)===Na+(aq)+Cl-(aq) ΔH4;由盖斯定律可知,由反应Ⅰ-Ⅱ-Ⅲ+Ⅳ可得目标反应,故ΔH=ΔH1-ΔH2-ΔH3+ΔH4。(7) 结合题干信息,要使得氢原子利用率为100%,可由(2×反应Ⅲ)-(2×反应Ⅱ+反应Ⅰ)得NaBO2(s)+2H2(g)+2Mg(s)===NaBH4(s)+2MgO(s),ΔG=2ΔG3-(2ΔG2+ΔG1)=2×(-570 kJ/mol)-[2×(-240)+(-320)]kJ/mol=-340 kJ/mol。
3. D 【解析】 太阳能电池是一种将太阳能转化为电能的装置,D错误。
4. D 【解析】 酸性锌锰干电池,锌筒为负极,石墨电极为正极,A错误;原电池工作时,阳离子向正极(石墨电极)方向移动,B错误;MnO2发生得电子的还原反应,C错误;锌筒为负极,负极发生失电子的氧化反应:Zn-2e-===Zn2+,D正确。
5. D 【解析】 钢铁外壳镶嵌了锌块,由于金属活动性:Zn>Fe,即锌块为负极,钢铁为正极,形成原电池,Zn失去电子,发生氧化反应,Zn-2e-===Zn2+,从而保护钢铁,延缓其腐蚀,故选D。
6. C 【解析】 氨水浓度越大,越容易生成[Zn(NH3)4]2+,腐蚀趋势越大,A正确;腐蚀的总反应为Zn+4NH3·H2O===[Zn(NH3)4]2++H2↑+2H2O+2OH-,有OH-生成,溶液pH变大,B正确;该电化学腐蚀中Zn作负极,Fe作正极,正极上水得电子生成氢气,铁电极上的电极反应式为2H2O+2e-===H2↑+2OH-,C错误;根据得失电子守恒,每生成标准状况下224 mL H2,转移电子数为=0.02 mol,消耗0.010 mol Zn,D正确。
7. B 【解析】 图1为牺牲阳极法保护钢闸门,牺牲阳极一般为较活泼金属,作为原电池的负极,失去电子被氧化;图2为外加电流法,阳极材料为辅助阳极,通常是惰性电极,本身不失去电子,电解质溶液中的阴离子在其表面失去电子,如海水中的Cl-,A错误;图2中,外加电压偏高时,钢闸门表面积累的电子很多,除了海水中的H+放电外,海水中溶解的O2也会竞争放电,故可发生:O2+4e-+2H2O===4OH-,B正确;图2中理论上只要能对抗钢闸门表面的腐蚀电流即可,当钢闸门表面的腐蚀电流为零时保护效果最好;腐蚀电流会随着环境的变化而变化,若外加电压保持恒定不变,则不能保证抵消腐蚀电流,不利于提高对钢闸门的防护效果,C错误;图1、图2中,当钢闸门表面的腐蚀电流为零时,说明从牺牲阳极或外加电流传递过来的电子阻止了Fe-2e-===Fe2+的发生,钢闸门不发生化学反应,但是牺牲阳极和辅助阳极上均发生了氧化反应,D错误。
8. O2+4e-+2CO2===2CO
【解析】 根据题干信息,该燃料电池中H2为负极,O2为正极,熔融碳酸盐为电解质溶液,故正极的电极反应式为O2+4e-+2CO2===2CO。
9. C 【解析】 该电解装置可用于湿法冶铁,则左侧发生反应为Fe2O3+6e-+3H2O===2Fe+6OH-,左侧电极为阴极,右侧电极为阳极,Cl-放电产生氯气,电极反应式为2Cl--2e-===Cl2↑,A正确;左侧电极为阴极,发生还原反应,Fe2O3在碱性条件下转化为Fe,电极反应式为Fe2O3+6e-+3H2O===2Fe+6OH-,消耗水产生OH-,阴极区溶液中OH-浓度逐渐升高,B正确;理论上每消耗1 mol Fe2O3,转移6 mol电子,产生3 mol Cl2,同时有6 mol Na+由阳极转移至阴极,则阳极室溶液减少3×71 g+6×23 g=351 g,C错误;阴极室物质最多增加6×23 g=138 g,D正确。
10. B 【解析】 由电解原理图可知,Ni电极产生氢气,阴极反应式为2H2O+2e-===H2↑+2OH-,Ni电极为阴极,Pt电极为阳极,电解过程中,阴离子向阳极移动,即OH-向Pt电极移动,A错误;Pt电极为阳极,Pt电极C3N8H4失去电子生成C6N,电解质溶液为KOH溶液,电极反应式为2C3N8H4+8OH--4e-===C6N+8H2O,B正确;则电解过程中发生的总反应主要为2C3N8H4+4OH-C6N+4H2O+2H2↑,反应消耗OH-,生成H2O,电解一段时间后,溶液pH降低,C错误;由电解总反应可知,每生成1 mol H2,生成0.5 mol K4C6N16,但Pt电极还会伴随少量O2生成,发生电极反应:4OH--4e-===O2↑+2H2O,则生成1 mol H2时得到的部分电子由OH-放电产生O2提供,所以生成K4C6N16小于0.5 mol,D错误。
11. B 【解析】 根据图知,电极b上Br-转化BrO,Br元素化合价升高,发生失电子的氧化反应,作阳极,接电源正极,则电极a连接电源负极,电极a发生反应:2H2O+2e-===H2↑+2OH-,X为H2,A正确;电极b发生的反应为Br-+3H2O-6e-===BrO+6H+,可得电解总反应为Br-+3H2OBrO+3H2↑,产生的BrO在催化剂存在下发生反应:2BrO2Br-+3O2↑,Z为O2,即Br-在循环过程中不需要补充,在此过程中消耗了H2O,加入Y的目的是补充H2O,B错误、C正确;由催化时发生的反应可知:n(O2)∶n(Br-)=3∶2,D正确。
12. B 【解析】 由已知信息知,Cu电极为阳极,PbCu电极为阴极,电解过程中,阳极区消耗OH-、同时生成H2O,故电解一段时间后阳极区c(OH-)减小,A正确;阴极区的总反应式为H2C2O4+HO—N+H3+6e-+6H+===H3N+CH2COOH+3H2O,1 mol H2O解离成1 mol H+和1 mol OH-,故理论上生成1 mol H3N+CH2COOH,双极膜中有6 mol H2O解离,B错误;阳极总反应式为2HCHO-2e-+4OH-===2HCOO-+H2↑+2H2O,C正确;阴极区的Pb上存在反应:H2C2O4+2e-+2H+===OHC—COOH+H2O,D正确。
13. (1) 2Al2O3(熔融)4Al+3O2↑
(2) 增强熔融氯化铍的导电性
(3) CO2+2e-+2H+===HCOOH
(4) N2-10e-+6H2O===2NO+12H+
(5) Sn+4CH2===CHCN+4e-+4H+===Sn(CH2CH2CN)4 (6) [Ag(S2O3)2]3-+e-===Ag↓+2S2O
【解析】 (2) 氯化铍的共价性较强,电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用为增强熔融氯化铍的导电性。(4) 由电极a上的物质转化可知,氮元素化合价升高,发生氧化反应,电极a为阳极。
14. C 【解析】 充电时该装置为电解池,电解池中阳离子向阴极迁移,即Zn2+向阴极方向迁移,A错误;放电时,负极的电极反应为Zn-2e-===Zn2+,则充电时阴极反应为Zn2++2e-===Zn,即充电时,应发生生成Zn的反应,B错误;放电时,MnO2电极为正极,正极上检测到MnOOH和少量ZnMn2O4,则正极上主要发生的电极反应是MnO2+H2O+e-===MnOOH+OH-,C正确;放电时,Zn电极质量减少0.65 g(物质的量为0.010 mol),电路中转移0.020 mol电子,由正极的主要反应MnO2+H2O+e-===MnOOH+OH-可知,若正极上只有MnOOH生成,则生成MnOOH的物质的量为0.020 mol,但是正极上还有ZnMn2O4生成,因此,MnOOH的物质的量小于0.020 mol,D错误。
15. C 【解析】 放电时CO2转化为MgC2O4,碳元素化合价由+4降低为+3,发生还原反应,所以放电时,多孔碳纳米管电极为正极、Mg电极为负极,则充电时多孔碳纳米管电极为阳极、Mg电极为阴极。放电时正极反应式为Mg2++2CO2+2e-===MgC2O4、负极反应式为Mg-2e-===Mg2+,则放电时电池总反应:Mg+2CO2===MgC2O4,A正确;充电时,多孔碳纳米管为阳极,与电源正极连接,B正确;充电时,Mg电极为阴极,电子从电源负极经外电路流向Mg电极,同时Mg2+向阴极迁移,C错误;根据放电时的正极反应式Mg2++2CO2+2e-===MgC2O4可知,每转移2 mol电子,有2 mol CO2参与反应,因此每转移1 mol电子,理论上可转化1 mol CO2,D正确。
16. C 【解析】 该新型水系锌电池的负极是锌、正极是超分子材料;负极反应式为Zn-2e-===Zn2+,则充电时,该电极为阴极,电极反应式为Zn2++2e-===Zn;正极上发生反应:I+2e-===3I-,则充电时,该电极为阳极,电极反应式为3I--2e-===I。标注框内所示结构属于配合物,配位体中存在碳碳单键、碳碳双键、碳氮单键、碳氮双键和碳氢键等多种共价键,还有由N提供孤电子对、Zn2+提供空轨道形成的配位键,A正确;该电池总反应为I+ZnZn2++3I-,B正确;充电时,被还原的Zn2+主要来自电解质溶液,C错误;放电时,负极反应式为Zn-2e-===Zn2+,因此消耗0.65 g Zn(物质的量为0.01 mol ),理论上转移0.02 mol电子,D正确。
化学反应进行的方向
1. 熵和熵变
(1) 熵的含义:衡量一个体系混乱度的物理量,用符号S表示。一般规律是S(g)>S(l)>S(s)。
(2) 熵变的含义:反应前后熵的变化量,用ΔS表示,ΔS越大,越有利于反应自发进行。
2. 化学反应进行的方向及解题方法要点
(1) 反应趋势:化学反应大都趋向于放热反应和混乱度增加的方向进行。
(2) 解题方法要点:一个化学反应能够自发进行,ΔH和ΔS至少有一个是有利于反应自发的。若ΔH不利于反应自发,即ΔH>0,则ΔS必须有利于反应自发,即ΔS>0;若ΔS不利于反应自发,即ΔS<0,则ΔH必须有利于反应自发,即ΔH<0。
3. 综合判断
在等温、等压条件下的封闭体系中(不考虑体积变化做功以外的其他功),自由能的变化(符号为ΔG)综合了反应体系的焓变和熵变对自发过程的影响,即ΔG=ΔH-TΔS。ΔG<0反应能自发进行;ΔG=0反应处于平衡状态;ΔG>0反应不能自发进行。
有关电化学装置的分析
离子交换膜类型、作用及应用
1. 常见的离子交换膜
种类 允许通过的离子 移动方向
阳离子交换膜 只允许阳离子通过 阳离子→电解池的阴极(或原电池的正极)
阴离子交换膜 只允许阴离子通过 阴离子→电解池的阳极(或原电池的负极)
质子交换膜 只允许H+通过 质子→电解池的阴极(或原电池的正极)
2. 离子交换膜的作用
(1) 平衡两边电极区的电荷。
(2) 避免交换膜两边物质发生反应(反应物发生反应或产物发生反应)。
(3) 形成交换膜两边电解质溶液浓度不同的浓差电池。
3. 离子交换膜的应用——浓差电池
装置图及装置特点 用如图所示装置进行实验,观察到灵敏电流计的指针发生偏转。(1) a、b电极均为Ag单质。(2) 左池为AgNO3稀溶液,右池为AgNO3浓溶液。两池AgNO3溶液的浓度不同,可以形成浓差电池。(3) 离子交换膜作用:使两池Ag+浓度不同;平衡两池的电荷。(4) 随着反应进行,左右两池浓度的差值逐渐减小,外电路中电流逐渐减小,电流计指针偏转幅度逐渐变小。当左右两池离子浓度相等时,电池将停止工作,不再有电流产生,此时左右两池硝酸银溶液的物质的量浓度相等
原理分析 (1) Ag+浓度越大,氧化性越强,故b电极为正极,发生还原反应,b电极反应式为Ag++e-===Ag;a电极为负极,发生氧化反应,a电极反应式为Ag-e-===Ag+。(2) 离子交换膜的类型和作用:不允许Ag+通过,只允许NO通过,是阴离子交换膜。随着反应进行,NO穿过离子交换膜的速率将减小
锂电池电极反应式的书写
锂电池 装置图 说明
Li-CO2电池4Li+3CO22Li2CO3+C(隔膜只允许Li+通过,向正极移动) 放电时:锂电极为负极,负极反应式:Li-e-===Li+铱基电极为正极,正极反应式:3CO2+4Li++4e-===2Li2CO3+C
LiFePO4-C电池Li1-xFePO4+LixC6LiFePO4+6C(隔膜只允许Li+通过,向正极移动,LixC6中C元素为0价) 放电时:M为负极,负极反应式:LixC6-xe-===6C+xLi+N为正极,正极反应式:Li1-xFePO4+xLi++xe-===LiFePO4
全固态锂-硫电池16Li+xS88Li2Sx(2≤x≤8)(Li+移向电极a),电极a掺有石墨烯,可增强电极导电性 放电时:电极b是负极,负极反应式:Li-e-===Li+,电极a是正极,正极反应式(第一步):S8+2e-+2Li+===Li2S8
LiCoO2-C电池Li1-xCoO2+LixC6LiCoO2+6C (放电过程中,Li+从负极脱出,嵌入正极) 放电时:N为负极,负极反应式:LixC6-xe-===6C+xLi+M为正极,正极反应式:Li1-xCoO2+xLi++xe-===LiCoO2
锂-空气电池4Li+O2+2H2O4LiOH(Li+移向B极) 放电时:A为负极,负极反应式:Li-e-===Li+B为正极,正极反应式:O2+4e-+2H2O===4OH-(电解液不能是水溶液,因为金属锂可与水反应)
盖斯定律与反应的自发性
1. (2024·浙江6月卷)氢是清洁能源,硼氢化钠(NaBH4)是一种环境友好的固体储氢材料,其水解生氢反应方程式如下(除非特别说明,本题中反应条件均为25 ℃,101 kPa):NaBH4(s)+2H2O(l)===NaBO2(aq)+4H2(g) ΔH<0。该反应能自发进行的条件是( )
A. 高温 B. 低温
C. 任意温度 D. 无法判断
2. (1) (2024·浙江1月卷)某研究小组用热化学方法将CO2转化为HCOOH,相关热化学方程式如下:
Ⅰ. C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol
Ⅱ. C(s)+H2(g)+O2(g)===HCOOH(g) ΔH2=-378.7 kJ/mol
Ⅲ. CO2(g)+H2(g)??HCOOH(g)ΔH3
则ΔH3=_______________ kJ/mol。
(2) (2024·全国甲卷)已知如下热化学方程式:
①CH4(g)+Br2(g)===CH3Br(g)+HBr(g) ΔH1=-29 kJ/mol
②3CH3Br(g)===C3H6(g)+3HBr(g) ΔH2=+20 kJ/mol
计算反应③ 3CH4(g)+3Br2(g)===C3H6(g)+6HBr(g)的ΔH=_________ kJ/mol
(3) (2024·安徽卷)C2H6氧化脱氢反应:
①2C2H6(g)+O2(g)===2C2H4(g)+2H2O(g) ΔH1=-209.8 kJ/mol
②C2H6(g)+CO2(g)===C2H4(g)+H2O(g)+CO(g) ΔH2=+178.1 kJ/mol
计算反应2CO(g)+O2(g)===2CO2(g)的ΔH3=__________________ kJ/mol。
(4) (2024·广东卷)反应a:NO(aq)+NH(aq)===N2(g)+2H2O(l) ΔH
已知:
则反应a的ΔH=_____________________________________________。
(5) (2024·山东卷)已知:
Ⅰ. C(s)+H2O(g)===CO(g)+H2(g) ΔH1>0
Ⅱ. CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2<0
Ⅲ. CaO(s)+CO2(g)===CaCO3(s) ΔH3<0
则反应C(s)+CaO(s)+2H2O(g)??CaCO3(s)+2H2(g)的ΔH=_________________________________(用代数式表示)。
(6) (2024·湖南卷)已知:
ⅰ. HOCH2CH2COOC2H5(g)―→CH2===CHCOOC2H5(g)+H2O(g) ΔH1
ⅱ. CH2===CHCOOC2H5(g)+NH3(g)―→CH2===CHCONH2(g)+C2H5OH(g) ΔH2
ⅲ. CH2===CHCONH2(g)―→CH2===CHCN(g)+H2O(g) ΔH3
则反应HOCH2CH2COOC2H5(g)+NH3(g)―→CH2===CHCN(g)+C2H5OH(g)+2H2O(g)的ΔH=_________________________(用含ΔH1、ΔH2、和ΔH3的代数式表示)。
(7) (2024·浙江6月卷)某流程将偏硼酸钠(NaBO2)再生为NaBH4(已知:ΔG是反应的自由能变化量,其计算方法也遵循盖斯定律,可类比ΔH计算方法;当ΔG<0时,反应能自发进行)。
Ⅰ. NaBH4(s)+2H2O(l)===NaBO2(s)+4H2(g)ΔG1=-320 kJ/mol
Ⅱ. H2(g)+O2(g)===H2O(l)ΔG2=-240 kJ/mol
Ⅲ. Mg(s)+O2(g)===MgO(s)ΔG3=-570 kJ/mol
写出表示NaBO2再生为NaBH4的一种制备方法(注明ΔG,要求反应物不超过三种物质;氢原子利用率为100%):__________________________________________________________________________________ ______________________________________________________________________________________。
原电池
3. (2024·湖南卷)近年来,我国新能源产业得到了蓬勃发展。下列说法错误的是( )
A. 理想的新能源应具有资源丰富、可再生、对环境无污染等特点
B. 氢氧燃料电池具有能量转化率高、清洁等优点
C. 锂离子电池放电时锂离子从负极脱嵌,充电时锂离子从正极脱嵌
D. 太阳能电池是一种将化学能转化为电能的装置
4. (2024·北京卷)酸性锌锰干电池的构造如图所示。下列关于该电池及其工作原理的说法正确的是( )
A. 石墨作电池的负极材料
B. 电池工作时,NH向负极方向移动
C. MnO2发生氧化反应
D. 锌筒发生的电极反应为Zn-2e-===Zn2+
5. (2024·广东卷)我国自主设计建造的浮式生产储卸油装置“海葵一号”将在珠江口盆地海域使用,其钢铁外壳镶嵌了锌块,以利用电化学原理延缓外壳的腐蚀。下列有关说法正确的是( )
A. 钢铁外壳为负极
B. 镶嵌的锌块可永久使用
C. 该法为外加电流法
D. 锌发生反应:Zn-2e-===Zn2+
6. (2024·浙江1月卷)破损的镀锌铁皮在氨水中发生电化学腐蚀,生成[Zn(NH3)4]2+和H2。下列说法不正确的是( )
A. 氨水浓度越大,腐蚀趋势越大
B. 随着腐蚀的进行,溶液pH变大
C. 铁电极上的电极反应式为2NH3+2e-===2NH+H2↑
D. 每生成标准状况下224 mL H2,消耗0.010 mol Zn
7. (2024·浙江6月卷)金属腐蚀会对设备产生严重危害,腐蚀快慢与材料种类、所处环境有关。两种对海水中钢闸门的防腐措施如图所示。下列说法正确的是( )
A. 图1、图2中,阳极材料本身均失去电子
B. 图2中,外加电压偏高时,钢闸门表面可发生反应:O2+4e-+2H2O===4OH-
C. 图2中,外加电压保持恒定不变,有利于提高对钢闸门的防护效果
D. 图1、图2中,当钢闸门表面的腐蚀电流为零时,钢闸门、阳极均不发生化学反应
8. (2024·浙江6月卷)氢能的高效利用途径之一是在燃料电池中产生电能。某研究小组的自制熔融碳酸盐燃料电池工作原理如图所示,正极上的电极反应式为___________________________________________。
电解池
9. (2024·广东卷)一种基于氯碱工艺的新型电解池如图所示,可用于湿法冶铁的研究。电解过程中,下列说法不正确的是( )
A. 阳极反应:2Cl--2e-===Cl2↑
B. 阴极区溶液中OH-浓度逐渐升高
C. 理论上每消耗1 mol Fe2O3,阳极室溶液减少213 g
D. 理论上每消耗1 mol Fe2O3,阴极室物质最多增加138 g
10. (2024·湖南卷)在KOH水溶液中,电化学方法合成高能物质K4C6N16时,伴随少量O2生成,电解原理如图所示。下列说法正确的是( )
A. 电解时,OH-向Ni电极移动
B. 生成C6N的电极反应:2C3N8H4+8OH--4e-===C6N+8H2O
C. 电解一段时间后,溶液pH升高
D. 每生成1 mol H2的同时,生成0.5 mol K4C6N16
11. (2024·山东卷)以不同材料修饰的Pt为电极,一定浓度的NaBr溶液为电解液,采用电解和催化相结合的循环方式,可实现高效制H2和O2,装置如图所示。下列说法错误的是( )
A. 电极a连接电源负极
B. 加入Y的目的是补充NaBr
C. 电解总反应为Br-+3H2OBrO+3H2↑
D. 催化阶段反应产物物质的量之比n(Z)∶n(Br-)=3∶2
12. (2024·湖北卷)我国科学家设计了一种双位点PbCu电催化剂,用H2C2O4和NH2OH电化学催化合成甘氨酸,原理如图所示。双极膜中H2O解离的H+和OH-在电场作用下向两极迁移。已知在KOH溶液中,甲醛转化为HOCH2O-,存在平衡HOCH2O-+OH-??[OCH2O]2-+H2O。Cu电极上发生的电子转移反应为[OCH2O]2--e-===HCOO-+H·。下列说法错误的是( )
A. 电解一段时间后阳极区c(OH-)减小
B. 理论上生成1 mol H3N+CH2COOH双极膜中有4 mol H2O解离
C. 阳极总反应式为2HCHO+4OH--2e-―→2HCOO-+H2↑+2H2O
D. 阴极区存在反应:H2C2O4+2H++2e-―→CHOCOOH+H2O
13. (1) (2024·广东卷) 加入冰晶石“电解熔融Al2O3”中,反应的化学方程式为____________________ _______________________________。
(2) (2024·湖北卷)电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用是_________________________________。
(3) (2024·浙江1月卷)某研究小组采用电化学方法将CO2转化为HCOOH,装置如图。则电极B上发生的电极反应式是_________________________________________________________。
(4) (2024·北京卷)研究表明可以用电解法以N2为氨源直接制备HNO3,其原理如图所示。电极a表面生成NO的电极反应式:__________________________________________________________________。
(5) (2024·湖南卷)以CH2===CHCN为原料,稀硫酸为电解液,Sn作阴极,用电解的方法可制得Sn(CH2CH2CN)4,其阴极反应式:________________________________________________________________ __________________________________________________。
(6) (2024·安徽卷) 某“电沉积”步骤中[Ag(S2O3)2]3-得电子被还原为Ag,则阴极的电极反应式为_____________________________________________________________________________。
可充电电池
14. (2024·全国甲卷)科学家使用δ-MnO2研制了一种MnO2-Zn可充电电池(如图所示)。电池工作一段时间后,MnO2电极上检测到MnOOH和少量ZnMn2O4。下列叙述正确的是( )
A. 充电时,Zn2+向阳极方向迁移
B. 充电时,会发生反应:Zn+2MnO2===ZnMn2O4
C. 放电时,正极反应有MnO2+H2O+e-===MnOOH+OH-
D. 放电时,Zn电极质量减少0.65 g,MnO2电极生成了0.020 mol MnOOH
15. (2024·河北卷)我国科技工作者设计了如图所示的可充电Mg-CO2电池,以Mg(TFSI)2为电解质,电解液中加入1,3-丙二胺(PDA)以捕获CO2,使放电时CO2还原产物为MgC2O4。该设计克服了MgCO3导电性差和释放CO2能力差的障碍,同时改善了Mg2+的溶剂化环境,提高了电池充放电循环性能。下列说法错误的是( )
A. 放电时,电池总反应为2CO2+Mg===MgC2O4
B. 充电时,多孔碳纳米管电极与电源正极连接
C. 充电时,电子由Mg电极流向阳极,Mg2+向阴极迁移
D. 放电时,每转移1 mol电子,理论上可转化1 mol CO2
16. (2024·安徽卷)我国学者研发出一种新型水系锌电池,其示意图如下。该电池分别以Zn-TCPP(局部结构如标注框内所示)形成的稳定超分子材料和Zn为电极,以ZnSO4和KI混合液为电解质溶液。下列说法错误的是( )
A. 标注框内所示结构中存在共价键和配位键
B. 电池总反应为I+ZnZn2++3I-
C. 充电时,阴极被还原的Zn2+主要来自Zn-TCPP
D. 放电时,消耗0.65 g Zn,理论上转移0.02 mol 电子
大单元整合 提能力验考情五
[高考新视野]
1. C 【解析】 反应NaBH4(s)+2H2O(l)===NaBO2(aq)+4H2(g) ΔH<0,ΔS>0,由ΔG=ΔH-TΔS可知,任意温度下,该反应均能自发进行,故选C。
2. (1) +14.8 (2) -67 (3) -566.0
(4) ΔH1-ΔH2-ΔH3+ΔH4
(5) ΔH1+ΔH2+ΔH3
(6) ΔH1+ΔH2+ΔH3 (7) NaBO2(s)+2H2(g)+2Mg(s)===NaBH4(s)+2MgO(s) ΔG=-340 kJ/mol
【解析】 (1) ΔH3=ΔH2-ΔH1=(-378.7+393.5)kJ/mol=+14.8 kJ/ mol。(2) 根据盖斯定律,将反应①×3+②可得反应③,故ΔH=(-29×3+20)kJ/mol=-67 kJ/mol。(3) 根据盖斯定律,反应①-反应②×2可得目标反应,则ΔH3=ΔH1-2ΔH2=(-209.8-178.1×2) kJ/mol=-566.0 kJ/mol。(4) 由已知可得:Ⅰ. NaNO2(s)+NH4Cl(s)===N2(g)+NaCl(s)+2H2O(l) ΔH1;Ⅱ. NaNO2(s)===Na+(aq)+NO(aq) ΔH2;Ⅲ. NH4Cl(s)===Cl-(aq)+NH(aq) ΔH3;Ⅳ. NaCl(s)===Na+(aq)+Cl-(aq) ΔH4;由盖斯定律可知,由反应Ⅰ-Ⅱ-Ⅲ+Ⅳ可得目标反应,故ΔH=ΔH1-ΔH2-ΔH3+ΔH4。(7) 结合题干信息,要使得氢原子利用率为100%,可由(2×反应Ⅲ)-(2×反应Ⅱ+反应Ⅰ)得NaBO2(s)+2H2(g)+2Mg(s)===NaBH4(s)+2MgO(s),ΔG=2ΔG3-(2ΔG2+ΔG1)=2×(-570 kJ/mol)-[2×(-240)+(-320)]kJ/mol=-340 kJ/mol。
3. D 【解析】 太阳能电池是一种将太阳能转化为电能的装置,D错误。
4. D 【解析】 酸性锌锰干电池,锌筒为负极,石墨电极为正极,A错误;原电池工作时,阳离子向正极(石墨电极)方向移动,B错误;MnO2发生得电子的还原反应,C错误;锌筒为负极,负极发生失电子的氧化反应:Zn-2e-===Zn2+,D正确。
5. D 【解析】 钢铁外壳镶嵌了锌块,由于金属活动性:Zn>Fe,即锌块为负极,钢铁为正极,形成原电池,Zn失去电子,发生氧化反应,Zn-2e-===Zn2+,从而保护钢铁,延缓其腐蚀,故选D。
6. C 【解析】 氨水浓度越大,越容易生成[Zn(NH3)4]2+,腐蚀趋势越大,A正确;腐蚀的总反应为Zn+4NH3·H2O===[Zn(NH3)4]2++H2↑+2H2O+2OH-,有OH-生成,溶液pH变大,B正确;该电化学腐蚀中Zn作负极,Fe作正极,正极上水得电子生成氢气,铁电极上的电极反应式为2H2O+2e-===H2↑+2OH-,C错误;根据得失电子守恒,每生成标准状况下224 mL H2,转移电子数为=0.02 mol,消耗0.010 mol Zn,D正确。
7. B 【解析】 图1为牺牲阳极法保护钢闸门,牺牲阳极一般为较活泼金属,作为原电池的负极,失去电子被氧化;图2为外加电流法,阳极材料为辅助阳极,通常是惰性电极,本身不失去电子,电解质溶液中的阴离子在其表面失去电子,如海水中的Cl-,A错误;图2中,外加电压偏高时,钢闸门表面积累的电子很多,除了海水中的H+放电外,海水中溶解的O2也会竞争放电,故可发生:O2+4e-+2H2O===4OH-,B正确;图2中理论上只要能对抗钢闸门表面的腐蚀电流即可,当钢闸门表面的腐蚀电流为零时保护效果最好;腐蚀电流会随着环境的变化而变化,若外加电压保持恒定不变,则不能保证抵消腐蚀电流,不利于提高对钢闸门的防护效果,C错误;图1、图2中,当钢闸门表面的腐蚀电流为零时,说明从牺牲阳极或外加电流传递过来的电子阻止了Fe-2e-===Fe2+的发生,钢闸门不发生化学反应,但是牺牲阳极和辅助阳极上均发生了氧化反应,D错误。
8. O2+4e-+2CO2===2CO
【解析】 根据题干信息,该燃料电池中H2为负极,O2为正极,熔融碳酸盐为电解质溶液,故正极的电极反应式为O2+4e-+2CO2===2CO。
9. C 【解析】 该电解装置可用于湿法冶铁,则左侧发生反应为Fe2O3+6e-+3H2O===2Fe+6OH-,左侧电极为阴极,右侧电极为阳极,Cl-放电产生氯气,电极反应式为2Cl--2e-===Cl2↑,A正确;左侧电极为阴极,发生还原反应,Fe2O3在碱性条件下转化为Fe,电极反应式为Fe2O3+6e-+3H2O===2Fe+6OH-,消耗水产生OH-,阴极区溶液中OH-浓度逐渐升高,B正确;理论上每消耗1 mol Fe2O3,转移6 mol电子,产生3 mol Cl2,同时有6 mol Na+由阳极转移至阴极,则阳极室溶液减少3×71 g+6×23 g=351 g,C错误;阴极室物质最多增加6×23 g=138 g,D正确。
10. B 【解析】 由电解原理图可知,Ni电极产生氢气,阴极反应式为2H2O+2e-===H2↑+2OH-,Ni电极为阴极,Pt电极为阳极,电解过程中,阴离子向阳极移动,即OH-向Pt电极移动,A错误;Pt电极为阳极,Pt电极C3N8H4失去电子生成C6N,电解质溶液为KOH溶液,电极反应式为2C3N8H4+8OH--4e-===C6N+8H2O,B正确;则电解过程中发生的总反应主要为2C3N8H4+4OH-C6N+4H2O+2H2↑,反应消耗OH-,生成H2O,电解一段时间后,溶液pH降低,C错误;由电解总反应可知,每生成1 mol H2,生成0.5 mol K4C6N16,但Pt电极还会伴随少量O2生成,发生电极反应:4OH--4e-===O2↑+2H2O,则生成1 mol H2时得到的部分电子由OH-放电产生O2提供,所以生成K4C6N16小于0.5 mol,D错误。
11. B 【解析】 根据图知,电极b上Br-转化BrO,Br元素化合价升高,发生失电子的氧化反应,作阳极,接电源正极,则电极a连接电源负极,电极a发生反应:2H2O+2e-===H2↑+2OH-,X为H2,A正确;电极b发生的反应为Br-+3H2O-6e-===BrO+6H+,可得电解总反应为Br-+3H2OBrO+3H2↑,产生的BrO在催化剂存在下发生反应:2BrO2Br-+3O2↑,Z为O2,即Br-在循环过程中不需要补充,在此过程中消耗了H2O,加入Y的目的是补充H2O,B错误、C正确;由催化时发生的反应可知:n(O2)∶n(Br-)=3∶2,D正确。
12. B 【解析】 由已知信息知,Cu电极为阳极,PbCu电极为阴极,电解过程中,阳极区消耗OH-、同时生成H2O,故电解一段时间后阳极区c(OH-)减小,A正确;阴极区的总反应式为H2C2O4+HO—N+H3+6e-+6H+===H3N+CH2COOH+3H2O,1 mol H2O解离成1 mol H+和1 mol OH-,故理论上生成1 mol H3N+CH2COOH,双极膜中有6 mol H2O解离,B错误;阳极总反应式为2HCHO-2e-+4OH-===2HCOO-+H2↑+2H2O,C正确;阴极区的Pb上存在反应:H2C2O4+2e-+2H+===OHC—COOH+H2O,D正确。
13. (1) 2Al2O3(熔融)4Al+3O2↑
(2) 增强熔融氯化铍的导电性
(3) CO2+2e-+2H+===HCOOH
(4) N2-10e-+6H2O===2NO+12H+
(5) Sn+4CH2===CHCN+4e-+4H+===Sn(CH2CH2CN)4 (6) [Ag(S2O3)2]3-+e-===Ag↓+2S2O
【解析】 (2) 氯化铍的共价性较强,电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用为增强熔融氯化铍的导电性。(4) 由电极a上的物质转化可知,氮元素化合价升高,发生氧化反应,电极a为阳极。
14. C 【解析】 充电时该装置为电解池,电解池中阳离子向阴极迁移,即Zn2+向阴极方向迁移,A错误;放电时,负极的电极反应为Zn-2e-===Zn2+,则充电时阴极反应为Zn2++2e-===Zn,即充电时,应发生生成Zn的反应,B错误;放电时,MnO2电极为正极,正极上检测到MnOOH和少量ZnMn2O4,则正极上主要发生的电极反应是MnO2+H2O+e-===MnOOH+OH-,C正确;放电时,Zn电极质量减少0.65 g(物质的量为0.010 mol),电路中转移0.020 mol电子,由正极的主要反应MnO2+H2O+e-===MnOOH+OH-可知,若正极上只有MnOOH生成,则生成MnOOH的物质的量为0.020 mol,但是正极上还有ZnMn2O4生成,因此,MnOOH的物质的量小于0.020 mol,D错误。
15. C 【解析】 放电时CO2转化为MgC2O4,碳元素化合价由+4降低为+3,发生还原反应,所以放电时,多孔碳纳米管电极为正极、Mg电极为负极,则充电时多孔碳纳米管电极为阳极、Mg电极为阴极。放电时正极反应式为Mg2++2CO2+2e-===MgC2O4、负极反应式为Mg-2e-===Mg2+,则放电时电池总反应:Mg+2CO2===MgC2O4,A正确;充电时,多孔碳纳米管为阳极,与电源正极连接,B正确;充电时,Mg电极为阴极,电子从电源负极经外电路流向Mg电极,同时Mg2+向阴极迁移,C错误;根据放电时的正极反应式Mg2++2CO2+2e-===MgC2O4可知,每转移2 mol电子,有2 mol CO2参与反应,因此每转移1 mol电子,理论上可转化1 mol CO2,D正确。
16. C 【解析】 该新型水系锌电池的负极是锌、正极是超分子材料;负极反应式为Zn-2e-===Zn2+,则充电时,该电极为阴极,电极反应式为Zn2++2e-===Zn;正极上发生反应:I+2e-===3I-,则充电时,该电极为阳极,电极反应式为3I--2e-===I。标注框内所示结构属于配合物,配位体中存在碳碳单键、碳碳双键、碳氮单键、碳氮双键和碳氢键等多种共价键,还有由N提供孤电子对、Zn2+提供空轨道形成的配位键,A正确;该电池总反应为I+ZnZn2++3I-,B正确;充电时,被还原的Zn2+主要来自电解质溶液,C错误;放电时,负极反应式为Zn-2e-===Zn2+,因此消耗0.65 g Zn(物质的量为0.01 mol ),理论上转移0.02 mol电子,D正确。
同课章节目录
