大单元六 化学反应速率 化学平衡 第22讲 化学平衡的移动 学案 (含答案)2026届高三化学一轮大单元复习
文档属性
| 名称 | 大单元六 化学反应速率 化学平衡 第22讲 化学平衡的移动 学案 (含答案)2026届高三化学一轮大单元复习 |  | |
| 格式 | DOC | ||
| 文件大小 | 684.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-15 11:14:34 | ||
图片预览




文档简介
第22讲 化学平衡的移动
备考导航
复习目标 1. 通过实验探究,了解浓度、压强、温度对化学平衡状态的影响。
2. 认识化学反应速率和化学平衡调控在生产、生活和科研中的重要作用。
熟记网络
课前自测 判断正误(正确的打“√”,错误的打“×”)。
(1) (2023·句容中学)在合成氨工业中,移走NH3可增大正反应速率,提高原料转化率( )
(2) N2(g)+3H2(g)2NH3(g) ΔH<0,其他条件不变时,升高温度,反应速率和H2的平衡转化率均增大( )
(3) 工业上合成氨反应[N2(g)+3H2(g)2NH3(g) ΔH<0]采用500 ℃的高温,是为了提高反应物的平衡转化率( )
(4) 反应2SO2(g)+O2(g)2SO3(g) ΔH<0达到平衡后,升高温度,正反应速率减小,逆反应速率增大,平衡逆向移动( )
(5) (2024·南通三模)反应2SO2(g)+O2(g)2SO3(g)使用V2O5的目的是增大SO2的平衡转化率( )
(6) (2023·常熟中学)将少量氯化钴晶体溶于浓盐酸配成蓝色溶液([CoCl4]2-),加水稀释至溶液呈紫色([Co(H2O)6]2+)后,再加热,溶液又恢复蓝色,反应[Co(H2O)6]2++4Cl-[CoCl4]2-+6H2O的ΔH>0( )
(7) (2023·南通通州)某温度下,反应BaCO3(s)BaO(s)+CO2(g)达到平衡,压缩容器容积后达到新平衡时,容器中的CO2浓度将增大( )
(8) (2023·南京、盐城二模)向盛有5 mL 0.005 mol/L FeCl3溶液的试管中加入5 mL 0.015 mol/L KSCN溶液,再加入少量铁粉,振荡,观察溶液颜色变化,探究反应物浓度影响化学平衡( )
(9) (2024·如东中学)向盛有2 mL 0.1 mol/L K2Cr2O7溶液的试管中滴加5~10滴NaOH溶液,再继续滴加5~10滴6 mol/L H2SO4溶液,观察现象,探究浓度对化学平衡的影响( )
(10) (2024·北京卷)依据相同温度下可逆反应的Q与K大小的比较,可推断反应进行的方向( )
考点1 化学平衡的移动
知 识 梳 理
勒夏特列原理
1. 内容:如果改变影响平衡的一个因素(如参加反应的物质的浓度、压强或温度等),平衡就向能够______这种改变的方向移动。
2. 若其他条件不变,改变下列条件对化学平衡的影响
改变的条件(其他条件不变) 化学平衡移动的方向
浓度 增大反应物浓度或减小生成物浓度(Q___K) 平衡______移动
减小反应物浓度或增大生成物浓度(Q___K) 平衡______移动
压强(对有气 体参加的反应) 反应前后气体分子数改变 增大压强 向气体分子数______的方向移动
减小压强 向气体分子数______的方向移动
反应前后气体分子数不变 改变压强 平衡___移动
温度 升高温度 向______反应方向移动
降低温度 向______反应方向移动
催化剂 — 同等程度地改变v正、v逆,平衡不移动
平衡移动方向的判断
1. 根据勒夏特列原理判断
几种不能用勒夏特列原理解释的问题:
(1) 反应前后气体分子数不变的反应,如H2(g)+I2(g)2HI(g),增大体系压强,气体颜色加深,但平衡不移动。
(2) 催化剂能同等程度地改变正、逆反应速率,催化剂不会影响化学平衡。
2. 根据平衡常数K与Q判断
Q<K,平衡______移动;
Q=K,平衡___移动;
Q>K,平衡______移动。
3. 根据反应速率判断
v正>v逆,平衡______移动;
v正=v逆,平衡___移动;
v正4. 恒温条件下,密闭反应体系中通入“惰性气体”
(1) 恒容容器
原平衡体系体系总压强增大→体系中各组分的浓度不变→平衡不移动。
(2) 恒压容器
原平衡体系容器容积增大,体系中各组分气体的分压减小→体系中各组分的浓度同倍数减小(等效于减压) →平衡向气体分子数增大的方向移动。
典 题 悟 法
化学平衡移动基础判断
(2024·浙江6月卷)为探究化学平衡移动的影响因素,设计方案并进行实验,观察到相关现象。其中方案设计和结论都正确的是( )
选项 影响因素 方案设计 现象 结论
A 浓度 向1 mL 0.1 mol/L K2CrO4溶液中加入1 mL 1.0 mol/L HBr溶液 黄色溶液变橙色 增大反应物浓度,平衡向正反应方向移动
B 压强 向恒温恒容密闭玻璃容器中充入100 mL HI气体,分解达到平衡后再充入100 mL Ar 气体颜色不变 对于反应前后气体总体积不变的可逆反应,改变压强平衡不移动
C 温度 将封装有NO2和N2O4混合气体的烧瓶浸泡在热水中 气体颜色变深 升高温度,平衡向吸热反应方向移动
D 催化剂 向1mL乙酸乙酯中加入1 mL 0.3 mol/L H2SO4溶液,水浴加热 上层液体逐渐减少 使用合适的催化剂可使平衡向正反应方向移动
平衡转化率
(2021·江苏适应性)反应:2SO2(g)+O2(g)2SO3(g) ΔH=-198 kJ/mol。下列有关说法不正确的是( )
A. 使用催化剂能缩短该反应达到平衡所需的时间
B. 温度升高有利于提高SO2的平衡转化率
C. 提高的值可增大SO2的转化率
D. 增大体系压强能增大SO2的反应速率和转化率
考点2 平衡图像分析
知 识 梳 理
催化剂的选择性
1. 定义:很多情况下,在给定条件下反应物之间能够同时发生多个反应,催化剂对不同反应的催化效率不同,各种产物所占的比例便会不同。理想的催化剂可以大幅度提高目标产物在最终产物中的比率,催化剂的这种特性称为它的选择性。
2. 选择性的表示方法:某产物的选择性可用消耗的原料转变为指定产物的百分率表示。如:CO2催化加氢主要反应如下:
反应Ⅰ. CO2(g)+3H2(g)CH3OH(g)+H2O(g)
反应Ⅱ. CO2(g)+H2(g)CO(g)+H2O(g)
CH3OH(或CO)的选择性=。
根据反应可知反应Ⅰ生成的n(CH3OH)=反应Ⅰ消耗的n(CO2)、反应Ⅱ生成的n(CO)=反应Ⅱ消耗的n(CO2),故CH3OH的选择性+CO的选择性=___。
单一反应转化率-温度图像、产率-温度图像
1. 转化率-温度图像
(1) 若不使用催化剂
①拐点前,温度升高,反应速率加快,反应物转化率增大。此阶段是____________影响转化率。拐点前未平衡,拐点为平衡点。
②拐点后,温度升高,反应物转化率降低,平衡逆向移动,此阶段是______影响转化率。
(2) 若使用催化剂
最高点不一定代表平衡点,但最高点时催化剂活性最好。后半部分转化率减小的原因可能有:①升高温度,平衡左移;②催化剂活性降低。
2. 产率-温度图像
(1) 拐点前,产率增大的主要原因:温度升高,反应速率加快,产率增大。
(2) 拐点后,产率减小的原因可能有:①升高温度,平衡左移;②催化剂活性降低;③催化剂的选择性降低,生成了更多的副产物。
多重平衡图像分析
1. 竞争反应体系中,不同温度、不同催化剂发生的主要反应不同,即温度、催化剂对反应选择性有影响。
2. 分析图像,判断反应是否已经达到平衡,是速率问题还是平衡问题,影响的因素有哪些,多个因素是协同的还是以某个因素为主,若改变出现相反的结论,要结合问题中的图像(或结论)抓住矛盾的主要方面解题。
3. 提高平衡转化率的方法:
(1) 调节p、T使平衡正移,则转化率增大;
(2) 增大反应物浓度,提高另一物质转化率,本身转化率降低。
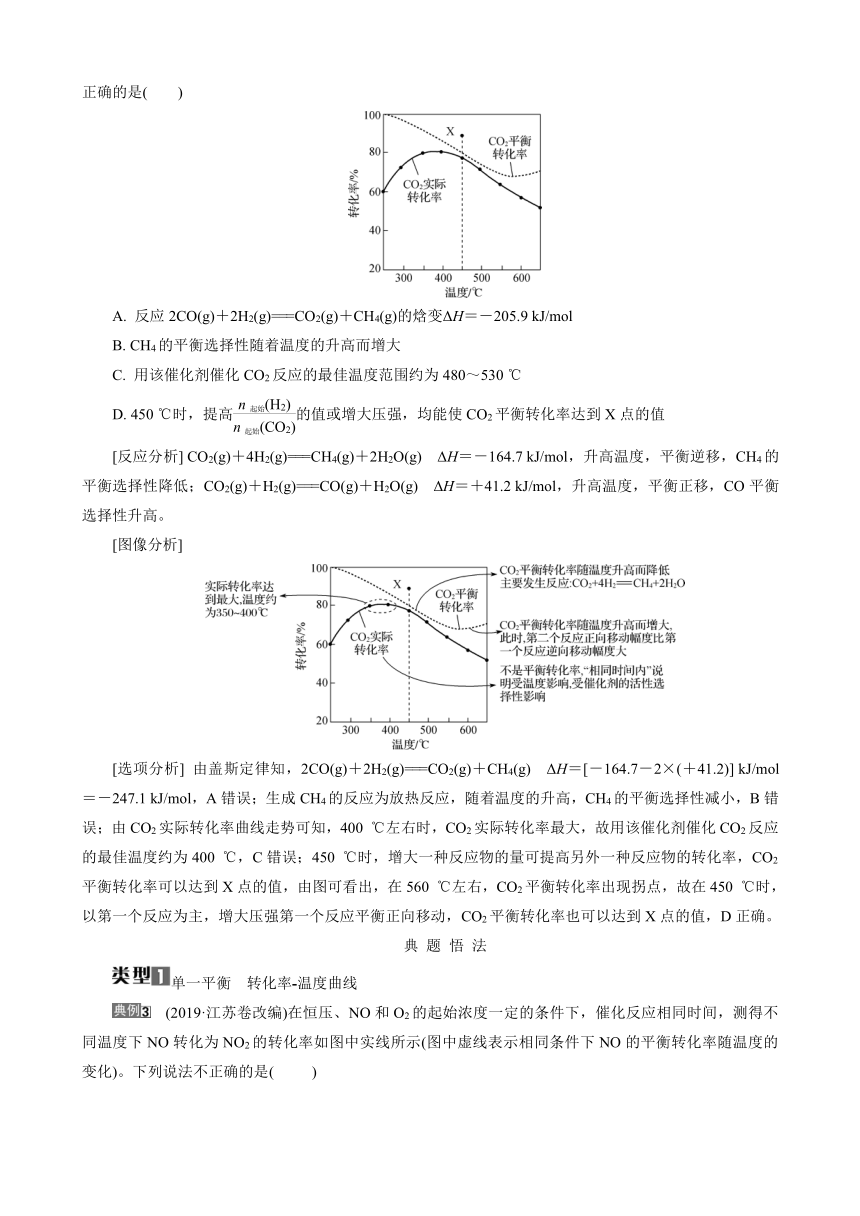
例 (2023·江苏卷)二氧化碳加氢制甲烷过程中的主要反应如下:
CO2(g)+4H2(g)===CH4(g)+2H2O(g) ΔH=-164.7 kJ/mol
CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41.2 kJ/mol
在密闭容器中,1.01×105 Pa、n起始(CO2)∶n起始(H2)=1∶4时,CO2平衡转化率、在催化剂作用下反应相同时间所测得的CO2实际转化率随温度的变化如图所示。CH4的选择性=×100%。下列说法正确的是( )
A. 反应2CO(g)+2H2(g)===CO2(g)+CH4(g)的焓变ΔH=-205.9 kJ/mol
B. CH4的平衡选择性随着温度的升高而增大
C. 用该催化剂催化CO2反应的最佳温度范围约为480~530 ℃
D. 450 ℃时,提高的值或增大压强,均能使CO2平衡转化率达到X点的值
[反应分析] CO2(g)+4H2(g)===CH4(g)+2H2O(g) ΔH=-164.7 kJ/mol,升高温度,平衡逆移,CH4的平衡选择性降低;CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41.2 kJ/mol,升高温度,平衡正移,CO平衡选择性升高。
[图像分析]
[选项分析] 由盖斯定律知,2CO(g)+2H2(g)===CO2(g)+CH4(g) ΔH=[-164.7-2×(+41.2)] kJ/mol=-247.1 kJ/mol,A错误;生成CH4的反应为放热反应,随着温度的升高,CH4的平衡选择性减小,B错误;由CO2实际转化率曲线走势可知,400 ℃左右时,CO2实际转化率最大,故用该催化剂催化CO2反应的最佳温度约为400 ℃,C错误;450 ℃时,增大一种反应物的量可提高另外一种反应物的转化率,CO2平衡转化率可以达到X点的值,由图可看出,在560 ℃左右,CO2平衡转化率出现拐点,故在450 ℃时,以第一个反应为主,增大压强第一个反应平衡正向移动,CO2平衡转化率也可以达到X点的值,D正确。
典 题 悟 法
单一平衡 转化率-温度曲线
(2019·江苏卷改编)在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法不正确的是( )
A. 反应2NO(g)+O2(g)2NO2(g)的ΔH<0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D. 380 ℃下,c起始(O2)=5.0×10-4 mol/L,NO平衡转化率为50%,则平衡常数K>2 000
多重平衡 转化率-温度曲线
(2020·江苏卷改编)CH4与CO2重整生成H2和CO的过程中主要发生下列反应:
CH4(g)+CO2(g)2H2(g)+2CO(g)ΔH=+247.1 kJ/mol
H2(g)+CO2(g)H2O(g)+CO(g)ΔH=+41.2 kJ/mol
在恒压、反应物起始物质的量比n(CH4)∶n(CO2)=1∶1 条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是( )
A. 升高温度、增大压强均有利于提高CH4的平衡转化率
B. 曲线A表示CH4的平衡转化率随温度的变化
C. 相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D. 恒压、800 K、n(CH4)∶n(CO2)=1∶1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
多重平衡 选择性-温度曲线
(2022·江苏卷)乙醇-水催化重整可获得H2。其主要反应为
C2H5OH(g)+3H2O(g)===2CO2(g)+6H2(g)ΔH=+173.3 kJ/mol
CO2(g)+H2(g)===CO(g)+H2O(g)ΔH=+41.2 kJ/mol
在1.0×105 Pa、n始(C2H5OH)∶n始(H2O)=1∶3时,若仅考虑上述反应,平衡时CO2和CO的选择性及H2的产率随温度的变化如图所示。CO的选择性=×100%,下列说法正确的是( )
A. 图中曲线①表示平衡时H2的产率随温度的变化
B. 升高温度,平衡时CO的选择性增大
C. 一定温度下,增大可提高乙醇的平衡转化率
D. 一定温度下,加入CaO(s)或选用高效催化剂,均能提高平衡时H2的产率
转化率、选择性-温度曲线
(2021·江苏卷) NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应。工业尾气中的NH3可通过催化氧化为N2除去。将一定比例的NH3、O2和N2的混合气体以一定流速通过装有催化剂的反应管,NH3的转化率、生成N2的选择性与温度的关系如图所示。下列说法正确的是( )
A. 其他条件不变,升高温度,NH3的平衡转化率增大
B. 其他条件不变,在175~300 ℃范围,随着温度的升高,出口处N2、氮氧化物的量均不断增大
C. 催化氧化除去尾气中的NH3应选择反应温度高于250 ℃
D. 高效除去尾气中的NH3,需研发低温下NH3转化率高和N2选择性高的催化剂
陌生图像变化趋势的原因分析
(2019·江苏卷)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ. CO2(g)+H2(g)===CO(g)+H2O(g)ΔH=+41.2 kJ/mol
反应Ⅱ. 2CO2(g)+6H2(g)===CH3OCH3(g)+3H2O(g)ΔH=-122.5 kJ/mol
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。CH3OCH3的选择性=×100%。
(1) 温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是________________________________ ___________________________________________________________________________________________________________________________________________________________________________________。
(2) 220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有________________________________ ____________________________。
(2021·江苏卷)甲烷是重要的资源,通过如下过程可实现由甲烷到氢气的转化:
甲烷―→―→―→―→氢气
(1) 500 ℃时,CH4与H2O重整主要发生下列反应:
CH4(g)+H2O(g) CO(g)+3H2(g)、CO(g)+H2O(g) CO2(g)+H2(g)
已知:CaO(s)+CO2(g)===CaCO3(s) ΔH=-178.8 kJ/mol。向重整反应体系中加入适量多孔CaO,其优点是____________________________________。
(2) CH4与CO2重整的主要反应的热化学方程式如下:
反应Ⅰ. CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH1=+246.5 kJ/mol
反应Ⅱ. H2(g)+CO2(g) CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
反应Ⅲ. 2CO(g) CO2(g)+C(s) ΔH3=-172.5 kJ/mol
①在CH4与CO2重整体系中通入适量H2O(g),可减少C(s)的生成,反应3CH4(g)+CO2(g)+2H2O(g) ?4CO(g)+8H2(g)的ΔH=_______________________________________。
②1.01×105 Pa下,将n起始(CO2)∶n起始(CH4)=1∶1的混合气体置于密闭容器中,不同温度下重整体系中CH4和CO2的平衡转化率如图所示。800 ℃下CO2平衡转化率远大于600 ℃下CO2平衡转化率,其原因是_______________________________________________________________________________________ ________________________________________________________________________________________。
1. (2023·北京卷)下列事实能用平衡移动原理解释的是( )
A. H2O2溶液中加入少量MnO2固体,促进H2O2分解
B. 密闭烧瓶内的NO2和N2O4的混合气体,受热后颜色加深
C. 钢铁放入浓硝酸中,待不再变化后,加热能产生大量红棕色气体
D. 锌片与稀硫酸反应过程中,加入少量CuSO4固体,促进H2的产生
2. (2021·江苏适应性)在二氧化碳加氢制甲烷的反应体系中,主要发生反应的热化学方程式如下:
反应Ⅰ:CO2(g)+4H2(g)CH4(g)+2H2O(g)ΔH=-164.7 kJ/mol
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g)ΔH=+41.2 kJ/mol
反应Ⅲ:2CO(g)+2H2(g)CO2(g)+CH4(g)ΔH=-247.1 kJ/mol
向恒压、密闭容器中通入1 mol CO2和4 mol H2,平衡时CH4、CO、CO2的物质的量随温度的变化如图所示。下列说法正确的是( )
A. 反应Ⅰ的平衡常数可表示为K=
B. 图中曲线B表示CO的物质的量随温度的变化
C. 提高CO2转化为CH4的转化率,需要研发在低温区高效的催化剂
D. CH4(g)+H2O(g)CO(g)+3H2(g)的ΔH=-205.9 kJ/mol
3. (2021·江苏适应性)通过反应Ⅰ:4HCl(g)+O2(g)2Cl2(g)+2H2O(g)可将有机氯化工业的副产品HCl转化为Cl2。在0.2 MPa、反应物起始物质的量比=2的条件下,不同温度时HCl 平衡转化率如图所示。向反应体系中加入CuCl2,能加快反应速率。
反应Ⅱ:2CuCl2(s)+O2(g)2CuO(s)+2Cl2(g)ΔH=+125.6 kJ/mol
反应Ⅲ:CuO(s)+2HCl(g)CuCl2(s)+H2O(g)ΔH=-120.0 kJ/mol
下列说法正确的是( )
A. 反应Ⅰ的ΔH=+5.6 kJ/mol
B. 升高温度和增大压强均能提高反应Ⅰ中HCl的平衡转化率
C. 保持其他条件不变,500 ℃时,使用CuCl2,能使HCl转化率从X点的值升至Y点的值
D. 在0.2 MPa、500 ℃条件下,若起始<2,HCl的转化率可能达到Y点的值
4. (2024·广西高三七省联考)工业尾气脱硝是减少空气污染的重要举措。回答下列问题:
(1) 已知相关反应的热力学数据如下。
反应 ΔH( kJ/mol) Kp(800K)
CH4(g)+2O2(g) CO2(g)+2H2O(g) -802.6
N2(g)+O2(g) 2NO(g) +182.6
CH4(g)+2NO(g)+O2(g)CO2(g)+ N2(g)+ 2H2O(g)
5.0×1062
2NO(g)+ O2(g)2NO2(g)
8.5×10-3(kPa)-1
①CH4脱硝反应CH4(g)+2NO(g)+ O2(g)CO2(g)+ N2(g)+ 2H2O(g)的ΔH=__________________ kJ/mol。800 K时,为了提高该反应中NO的平衡转化率,理论上可采取的措施是______(填字母)。
A. 恒容时增大O2的压强 B. 减小反应容器的容积
C. 移去部分H2O(g) D. 选择合适的催化剂
②CH4另一脱硝反应CH4(g)+2NO2(g)CO2(g)+ N2(g)+2H2O(g)的Kp(800 K)=____________ kPa。
(2) 模拟工业尾气脱硝:一定条件下,将p(CH4)∶p(NO)∶p(O2)=1∶1∶50的气体与Ar混合,匀速通过催化脱硝反应器,测得NO去除率和CH4转化率随反应温度的变化如图。
当温度低于780 K时,NO的去除率随温度升高而升高,可能原因是_______________________________ ______________________________________________________________________________________;高于780 K时,NO的去除率随温度升高而降低,结合(1)的信息分析其可能原因是_______________________________________________________________________________________________________________________________________。
第22讲 化学平衡的移动
[备考导航]
(1) × (2) × (3) × (4) × (5) × (6) √ (7) × (8) √ (9) √ (10) √
考点1
[知识梳理]
知识1 1. 减弱
2. < 正向 > 逆向 减小 增大 不 吸热 放热
知识2 2. 正向 不 逆向 3.正向 不 逆向
[典题悟法]
典例1 C 【解析】 Br-能被氧化为Br2,溴水也为橙色,A错误;恒温恒容密闭容器中发生反应:2HI(g)H2(g)+I2(g),该反应前后气体分子数不变,充入Ar,相当于没有改变压强,故不能得出相应结论,B错误;2NO2(g)N2O4为放热反应,升高温度,气体颜色变深,说明平衡逆向移动,C正确;催化剂不影响平衡移动,D错误。
典例2 B 【解析】 催化剂能加快反应速率,缩短达到平衡所需的时间,A正确;正反应放热,升高温度,平衡左移,SO2的平衡转化率减小,B错误;增大O2浓度,SO2的转化率增大,C正确;该反应为气体分子数减小的反应,增大压强,反应速率加快,平衡右移,SO2转化率增大,D正确。
考点2
[知识梳理]
知识1 2. 1
知识2 1. (1) ①反应速率 ②平衡
[典题悟法]
典例3 C 【解析】 随着温度升高,NO平衡转化率降低,说明升高温度平衡逆向移动,该反应为放热反应,A正确;X点反应未达到平衡状态,此时反应正向进行程度大,故延长反应时间,可使NO转化率增大,B正确;增大一种反应物的浓度,能提高另一种反应物的转化率,Y点为400 ℃时的平衡状态,增大O2浓度平衡正向移动,NO转化率增大,C错误;设NO起始物质的量浓度为a mol/L,则
2NO(g)+ O2(g) 2NO2(g)
c(始)/(mol/L) a 5.0×10-4 0
c(转)/(mol/L) 0.5a 0.25a 0.5a
c(平)/(mol/L) 0.5a 5.0×10-4-0.25a 0.5a
平衡常数K==>=2 000,D正确。
典例4 D 【解析】 标记CH4(g)+CO2(g) ??2H2(g)+2CO(g)为反应Ⅰ,H2(g)+CO2(g) H2O(g)+CO(g)为反应Ⅱ。上述两个反应均为吸热反应,升高温度,平衡右移,CH4的平衡转化率升高,增大压强,反应Ⅰ平衡左移,故CH4平衡转化率降低,A错误;CH4、CO2等物质的量投入,在反应Ⅰ中,二者的转化率相同,由于反应Ⅱ也消耗CO2,故相同条件下反应达到平衡时,CO2的平衡转化率大于CH4的平衡转化率,即曲线A表示CO2的平衡转化率随温度的变化,B错误;催化剂只能改变反应速率,不能改变平衡转化率,故改用高效催化剂后,曲线A、B也不可能重叠,C错误;如果不断分离出H2或CO,最终会导致反应Ⅰ正向进行的程度变大,从而提高CH4的转化率,CH4的转化率能从X点的值增大到Y点的值,D正确。
典例5 B 【解析】 由n始(C2H5OH)∶n始(H2O)=1∶3可知,初始投料只有C2H5OH和H2O,故开始反应时,只能发生第一个反应,产物中没有CO,则CO2的选择性为100%,图中曲线①表示平衡时CO2的选择性随温度的变化,由CO的选择性=×100%可知,CO2、CO的选择性之和为1,则曲线③表示平衡时CO的选择性随温度的变化,曲线②表示平衡时H2的产率随温度的变化,A错误;由图可知,升高温度时,曲线③上升,则平衡时CO的选择性随温度的升高而增大,B正确;一定温度下,增大,相当于增大n(C2H5OH),H2O的平衡转化率增大,C2H5OH的平衡转化率减小,C错误;选用高效催化剂只能改变反应速率,不能改变平衡时H2的产率,D错误。
典例6 D 【解析】 由于NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应,升高温度,三个反应的平衡均逆向移动,NH3的平衡转化率一定减小,A错误;由图像知,其他条件不变,在175~300 ℃范围内,随着温度升高,NH3的转化率逐渐增大至几乎不变,N2的选择性逐渐减小,曲线交点前NH3的转化率增大幅度大于N2的选择性减小幅度,则低温时,NH3的转化率为影响N2产量的主要因素,高温时,N2的选择性为影响N2产量的主要因素,故出口处N2的量先增大后减小,B错误;温度高于250 ℃时,NH3的转化率虽然接近100%,但是N2的选择性较小,NH3较多地转化为NO、N2O,NO、N2O属于污染性气体,C错误;由图可知,低温时,N2的选择性较高,温度高于250 ℃时,NH3的平衡转化率接近100%,由于NH3转化的反应为放热反应,随着温度的降低,NH3的平衡转化率应升高,故低温时,NH3的平衡转化率更接近100%,但实际上低温时,NH3的转化率远远低于平衡时NH3的转化率,说明在低温条件下NH3的转化反应速率较小,故要高效除去尾气中的NH3,需研发低温下NH3转化率高和N2选择性高的催化剂,D正确。
典例7 (1) 反应Ⅰ的ΔH>0,反应Ⅱ的ΔH<0,温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅度 (2) 增大压强、使用对反应Ⅱ催化活性更高的催化剂
【解析】 反应Ⅰ为吸热反应,反应Ⅱ为放热反应,当升高温度时,反应Ⅰ平衡正向移动,CO2转化为CO的平衡转化率上升,反应Ⅱ平衡逆向移动,CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅度。(2) 反应Ⅰ是气体分子数不变的反应,反应Ⅱ是气体分子数减小的反应,通过加压可使反应Ⅱ平衡正向移动,或者加入有利于反应Ⅱ进行的催化剂。
典例8 (1) 提高H2的产率;提供热量
(2) ①+657.1 kJ/mol ②反应Ⅰ、反应Ⅱ的ΔH>0,高温下正反应进行程度大,CO2反应的量多,反应Ⅲ的ΔH<0,高温下正反应进行程度小,CO2生成的量少
【解析】 (1) CaO可以吸收一部分CO2,使体系中CO2的浓度降低,可促进反应CO(g)+H2O(g) H2(g)+CO2(g)平衡右移,则体系中CO的浓度降低,又可促进反应CH4(g)+H2O(g) CO(g)+3H2(g)平衡右移,则体系中H2的产率升高;由CaO吸收CO2的反应是放热反应,且CH4与H2O重整反应需要在500 ℃条件下发生知,CaO吸收CO2的反应可以为CH4与H2O重整反应的发生提供热量;多孔CaO与CO2的接触面积较大,吸收CO2效率更高。(2) ①根据盖斯定律,反应Ⅰ×3-反应Ⅱ×2,可得3CH4(g)+CO2(g)+2H2O(g) ??4CO(g)+8H2(g)的ΔH=3×246.5 kJ/mol-2×41.2 kJ/mol=+657.1 kJ/mol。②高温时(如800 ℃),吸热反应(反应Ⅰ和反应Ⅱ)进行的程度更大,放热反应(反应Ⅲ)进行的程度更小,由图可知,在较低温度下(如低于600 ℃),CH4的平衡转化率高于CO2的平衡转化率,体系中主要发生反应Ⅰ和反应Ⅲ;在较高温度下(如800 ℃),CO2的平衡转化率逼近CH4的平衡转化率,体系中主要发生反应Ⅰ和反应Ⅱ,此时,反应Ⅲ受到抑制,反应Ⅱ受到促进,体系中主要反应发生转变。
[质量评价]
1. B 【解析】 MnO2催化 H2O2分解,与平衡移动无关,A错误;NO2转化为N2O4是放热反应,升温平衡逆向移动,NO2浓度增大,混合气体颜色加深,B正确;常温下,铁在浓硝酸中钝化,加热会使表面的致密氧化膜溶解,铁与浓硝酸反应生成大量红棕色气体NO2,与平衡移动无关,C错误;加入硫酸铜以后,锌置换出铜,锌、铜和稀硫酸构成原电池,反应速率加快,与平衡移动无关,D错误。
2. C 【解析】 H2O为气态,应列入K,A错误;反应Ⅱ是吸热反应,反应Ⅲ是放热反应,CO的物质的量随温度升高而增大,故曲线C表示CO的物质的量随温度的变化,B错误;曲线A表示CH4的物质的量随温度的变化,低温时以反应Ⅰ为主,高温时以反应Ⅲ为主,所以欲提高CO2转化为CH4的转化率,需要研发在低温区高效的催化剂,C正确;根据盖斯定律,反应Ⅱ-反应Ⅰ或-(反应Ⅱ+反应Ⅲ)可得CH4(g)+H2O(g) CO(g)+3H2(g)的ΔH=+205.9 kJ/mol,D错误。
3. D 【解析】 根据盖斯定律,反应Ⅱ+反应Ⅲ×2=反应Ⅰ,反应Ⅰ的ΔH=+125.6 kJ/mol+(-120.0 kJ/mol)×2=-114.4 kJ/mol,A错误;由图可知,升高温度,HCl的平衡转化率减小,反应Ⅰ为气体分子数减小的反应,增大压强平衡右移,HCl的平衡转化率提高,B错误;CuCl2作反应Ⅰ的催化剂,催化剂不能改变平衡转化率,故加催化剂可以使X点移至曲线上,但不能升至Y点,C错误;增大O2的浓度,HCl的转化率提高,D正确。
4. (1) ① -985.2 AC ②5.9×1064 (2) 温度低于780 K,反应未达平衡,升高温度,向正反应方向移动,NO的去除率升高 高于780 K时,该反应是放热反应,随温度升高,平衡逆向移动,NO的去除率随温度升高而降低
【解析】 (1) ①根据盖斯定律,由表格中第一反应减第二个反应可得目标反应,故ΔH=-802.6 kJ/mol-182.6 kJ/mol=-985.2 kJ/mol。恒容时增大O2压强,平衡右移,NO转化率提高,A正确;减小容器的容积,平衡不移动,B错误;移去部分H2O (g),平衡右移,NO转化率提高,C正确;催化剂对平衡移动无影响,D错误。②根据盖斯定律,由第三个反应减第四个反应可得目标反应,故该反应的Kp(800 K)= kPa=5.9×1064 kPa。
备考导航
复习目标 1. 通过实验探究,了解浓度、压强、温度对化学平衡状态的影响。
2. 认识化学反应速率和化学平衡调控在生产、生活和科研中的重要作用。
熟记网络
课前自测 判断正误(正确的打“√”,错误的打“×”)。
(1) (2023·句容中学)在合成氨工业中,移走NH3可增大正反应速率,提高原料转化率( )
(2) N2(g)+3H2(g)2NH3(g) ΔH<0,其他条件不变时,升高温度,反应速率和H2的平衡转化率均增大( )
(3) 工业上合成氨反应[N2(g)+3H2(g)2NH3(g) ΔH<0]采用500 ℃的高温,是为了提高反应物的平衡转化率( )
(4) 反应2SO2(g)+O2(g)2SO3(g) ΔH<0达到平衡后,升高温度,正反应速率减小,逆反应速率增大,平衡逆向移动( )
(5) (2024·南通三模)反应2SO2(g)+O2(g)2SO3(g)使用V2O5的目的是增大SO2的平衡转化率( )
(6) (2023·常熟中学)将少量氯化钴晶体溶于浓盐酸配成蓝色溶液([CoCl4]2-),加水稀释至溶液呈紫色([Co(H2O)6]2+)后,再加热,溶液又恢复蓝色,反应[Co(H2O)6]2++4Cl-[CoCl4]2-+6H2O的ΔH>0( )
(7) (2023·南通通州)某温度下,反应BaCO3(s)BaO(s)+CO2(g)达到平衡,压缩容器容积后达到新平衡时,容器中的CO2浓度将增大( )
(8) (2023·南京、盐城二模)向盛有5 mL 0.005 mol/L FeCl3溶液的试管中加入5 mL 0.015 mol/L KSCN溶液,再加入少量铁粉,振荡,观察溶液颜色变化,探究反应物浓度影响化学平衡( )
(9) (2024·如东中学)向盛有2 mL 0.1 mol/L K2Cr2O7溶液的试管中滴加5~10滴NaOH溶液,再继续滴加5~10滴6 mol/L H2SO4溶液,观察现象,探究浓度对化学平衡的影响( )
(10) (2024·北京卷)依据相同温度下可逆反应的Q与K大小的比较,可推断反应进行的方向( )
考点1 化学平衡的移动
知 识 梳 理
勒夏特列原理
1. 内容:如果改变影响平衡的一个因素(如参加反应的物质的浓度、压强或温度等),平衡就向能够______这种改变的方向移动。
2. 若其他条件不变,改变下列条件对化学平衡的影响
改变的条件(其他条件不变) 化学平衡移动的方向
浓度 增大反应物浓度或减小生成物浓度(Q___K) 平衡______移动
减小反应物浓度或增大生成物浓度(Q___K) 平衡______移动
压强(对有气 体参加的反应) 反应前后气体分子数改变 增大压强 向气体分子数______的方向移动
减小压强 向气体分子数______的方向移动
反应前后气体分子数不变 改变压强 平衡___移动
温度 升高温度 向______反应方向移动
降低温度 向______反应方向移动
催化剂 — 同等程度地改变v正、v逆,平衡不移动
平衡移动方向的判断
1. 根据勒夏特列原理判断
几种不能用勒夏特列原理解释的问题:
(1) 反应前后气体分子数不变的反应,如H2(g)+I2(g)2HI(g),增大体系压强,气体颜色加深,但平衡不移动。
(2) 催化剂能同等程度地改变正、逆反应速率,催化剂不会影响化学平衡。
2. 根据平衡常数K与Q判断
Q<K,平衡______移动;
Q=K,平衡___移动;
Q>K,平衡______移动。
3. 根据反应速率判断
v正>v逆,平衡______移动;
v正=v逆,平衡___移动;
v正
(1) 恒容容器
原平衡体系体系总压强增大→体系中各组分的浓度不变→平衡不移动。
(2) 恒压容器
原平衡体系容器容积增大,体系中各组分气体的分压减小→体系中各组分的浓度同倍数减小(等效于减压) →平衡向气体分子数增大的方向移动。
典 题 悟 法
化学平衡移动基础判断
(2024·浙江6月卷)为探究化学平衡移动的影响因素,设计方案并进行实验,观察到相关现象。其中方案设计和结论都正确的是( )
选项 影响因素 方案设计 现象 结论
A 浓度 向1 mL 0.1 mol/L K2CrO4溶液中加入1 mL 1.0 mol/L HBr溶液 黄色溶液变橙色 增大反应物浓度,平衡向正反应方向移动
B 压强 向恒温恒容密闭玻璃容器中充入100 mL HI气体,分解达到平衡后再充入100 mL Ar 气体颜色不变 对于反应前后气体总体积不变的可逆反应,改变压强平衡不移动
C 温度 将封装有NO2和N2O4混合气体的烧瓶浸泡在热水中 气体颜色变深 升高温度,平衡向吸热反应方向移动
D 催化剂 向1mL乙酸乙酯中加入1 mL 0.3 mol/L H2SO4溶液,水浴加热 上层液体逐渐减少 使用合适的催化剂可使平衡向正反应方向移动
平衡转化率
(2021·江苏适应性)反应:2SO2(g)+O2(g)2SO3(g) ΔH=-198 kJ/mol。下列有关说法不正确的是( )
A. 使用催化剂能缩短该反应达到平衡所需的时间
B. 温度升高有利于提高SO2的平衡转化率
C. 提高的值可增大SO2的转化率
D. 增大体系压强能增大SO2的反应速率和转化率
考点2 平衡图像分析
知 识 梳 理
催化剂的选择性
1. 定义:很多情况下,在给定条件下反应物之间能够同时发生多个反应,催化剂对不同反应的催化效率不同,各种产物所占的比例便会不同。理想的催化剂可以大幅度提高目标产物在最终产物中的比率,催化剂的这种特性称为它的选择性。
2. 选择性的表示方法:某产物的选择性可用消耗的原料转变为指定产物的百分率表示。如:CO2催化加氢主要反应如下:
反应Ⅰ. CO2(g)+3H2(g)CH3OH(g)+H2O(g)
反应Ⅱ. CO2(g)+H2(g)CO(g)+H2O(g)
CH3OH(或CO)的选择性=。
根据反应可知反应Ⅰ生成的n(CH3OH)=反应Ⅰ消耗的n(CO2)、反应Ⅱ生成的n(CO)=反应Ⅱ消耗的n(CO2),故CH3OH的选择性+CO的选择性=___。
单一反应转化率-温度图像、产率-温度图像
1. 转化率-温度图像
(1) 若不使用催化剂
①拐点前,温度升高,反应速率加快,反应物转化率增大。此阶段是____________影响转化率。拐点前未平衡,拐点为平衡点。
②拐点后,温度升高,反应物转化率降低,平衡逆向移动,此阶段是______影响转化率。
(2) 若使用催化剂
最高点不一定代表平衡点,但最高点时催化剂活性最好。后半部分转化率减小的原因可能有:①升高温度,平衡左移;②催化剂活性降低。
2. 产率-温度图像
(1) 拐点前,产率增大的主要原因:温度升高,反应速率加快,产率增大。
(2) 拐点后,产率减小的原因可能有:①升高温度,平衡左移;②催化剂活性降低;③催化剂的选择性降低,生成了更多的副产物。
多重平衡图像分析
1. 竞争反应体系中,不同温度、不同催化剂发生的主要反应不同,即温度、催化剂对反应选择性有影响。
2. 分析图像,判断反应是否已经达到平衡,是速率问题还是平衡问题,影响的因素有哪些,多个因素是协同的还是以某个因素为主,若改变出现相反的结论,要结合问题中的图像(或结论)抓住矛盾的主要方面解题。
3. 提高平衡转化率的方法:
(1) 调节p、T使平衡正移,则转化率增大;
(2) 增大反应物浓度,提高另一物质转化率,本身转化率降低。
例 (2023·江苏卷)二氧化碳加氢制甲烷过程中的主要反应如下:
CO2(g)+4H2(g)===CH4(g)+2H2O(g) ΔH=-164.7 kJ/mol
CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41.2 kJ/mol
在密闭容器中,1.01×105 Pa、n起始(CO2)∶n起始(H2)=1∶4时,CO2平衡转化率、在催化剂作用下反应相同时间所测得的CO2实际转化率随温度的变化如图所示。CH4的选择性=×100%。下列说法正确的是( )
A. 反应2CO(g)+2H2(g)===CO2(g)+CH4(g)的焓变ΔH=-205.9 kJ/mol
B. CH4的平衡选择性随着温度的升高而增大
C. 用该催化剂催化CO2反应的最佳温度范围约为480~530 ℃
D. 450 ℃时,提高的值或增大压强,均能使CO2平衡转化率达到X点的值
[反应分析] CO2(g)+4H2(g)===CH4(g)+2H2O(g) ΔH=-164.7 kJ/mol,升高温度,平衡逆移,CH4的平衡选择性降低;CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41.2 kJ/mol,升高温度,平衡正移,CO平衡选择性升高。
[图像分析]
[选项分析] 由盖斯定律知,2CO(g)+2H2(g)===CO2(g)+CH4(g) ΔH=[-164.7-2×(+41.2)] kJ/mol=-247.1 kJ/mol,A错误;生成CH4的反应为放热反应,随着温度的升高,CH4的平衡选择性减小,B错误;由CO2实际转化率曲线走势可知,400 ℃左右时,CO2实际转化率最大,故用该催化剂催化CO2反应的最佳温度约为400 ℃,C错误;450 ℃时,增大一种反应物的量可提高另外一种反应物的转化率,CO2平衡转化率可以达到X点的值,由图可看出,在560 ℃左右,CO2平衡转化率出现拐点,故在450 ℃时,以第一个反应为主,增大压强第一个反应平衡正向移动,CO2平衡转化率也可以达到X点的值,D正确。
典 题 悟 法
单一平衡 转化率-温度曲线
(2019·江苏卷改编)在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法不正确的是( )
A. 反应2NO(g)+O2(g)2NO2(g)的ΔH<0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D. 380 ℃下,c起始(O2)=5.0×10-4 mol/L,NO平衡转化率为50%,则平衡常数K>2 000
多重平衡 转化率-温度曲线
(2020·江苏卷改编)CH4与CO2重整生成H2和CO的过程中主要发生下列反应:
CH4(g)+CO2(g)2H2(g)+2CO(g)ΔH=+247.1 kJ/mol
H2(g)+CO2(g)H2O(g)+CO(g)ΔH=+41.2 kJ/mol
在恒压、反应物起始物质的量比n(CH4)∶n(CO2)=1∶1 条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是( )
A. 升高温度、增大压强均有利于提高CH4的平衡转化率
B. 曲线A表示CH4的平衡转化率随温度的变化
C. 相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D. 恒压、800 K、n(CH4)∶n(CO2)=1∶1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
多重平衡 选择性-温度曲线
(2022·江苏卷)乙醇-水催化重整可获得H2。其主要反应为
C2H5OH(g)+3H2O(g)===2CO2(g)+6H2(g)ΔH=+173.3 kJ/mol
CO2(g)+H2(g)===CO(g)+H2O(g)ΔH=+41.2 kJ/mol
在1.0×105 Pa、n始(C2H5OH)∶n始(H2O)=1∶3时,若仅考虑上述反应,平衡时CO2和CO的选择性及H2的产率随温度的变化如图所示。CO的选择性=×100%,下列说法正确的是( )
A. 图中曲线①表示平衡时H2的产率随温度的变化
B. 升高温度,平衡时CO的选择性增大
C. 一定温度下,增大可提高乙醇的平衡转化率
D. 一定温度下,加入CaO(s)或选用高效催化剂,均能提高平衡时H2的产率
转化率、选择性-温度曲线
(2021·江苏卷) NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应。工业尾气中的NH3可通过催化氧化为N2除去。将一定比例的NH3、O2和N2的混合气体以一定流速通过装有催化剂的反应管,NH3的转化率、生成N2的选择性与温度的关系如图所示。下列说法正确的是( )
A. 其他条件不变,升高温度,NH3的平衡转化率增大
B. 其他条件不变,在175~300 ℃范围,随着温度的升高,出口处N2、氮氧化物的量均不断增大
C. 催化氧化除去尾气中的NH3应选择反应温度高于250 ℃
D. 高效除去尾气中的NH3,需研发低温下NH3转化率高和N2选择性高的催化剂
陌生图像变化趋势的原因分析
(2019·江苏卷)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ. CO2(g)+H2(g)===CO(g)+H2O(g)ΔH=+41.2 kJ/mol
反应Ⅱ. 2CO2(g)+6H2(g)===CH3OCH3(g)+3H2O(g)ΔH=-122.5 kJ/mol
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。CH3OCH3的选择性=×100%。
(1) 温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是________________________________ ___________________________________________________________________________________________________________________________________________________________________________________。
(2) 220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有________________________________ ____________________________。
(2021·江苏卷)甲烷是重要的资源,通过如下过程可实现由甲烷到氢气的转化:
甲烷―→―→―→―→氢气
(1) 500 ℃时,CH4与H2O重整主要发生下列反应:
CH4(g)+H2O(g) CO(g)+3H2(g)、CO(g)+H2O(g) CO2(g)+H2(g)
已知:CaO(s)+CO2(g)===CaCO3(s) ΔH=-178.8 kJ/mol。向重整反应体系中加入适量多孔CaO,其优点是____________________________________。
(2) CH4与CO2重整的主要反应的热化学方程式如下:
反应Ⅰ. CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH1=+246.5 kJ/mol
反应Ⅱ. H2(g)+CO2(g) CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
反应Ⅲ. 2CO(g) CO2(g)+C(s) ΔH3=-172.5 kJ/mol
①在CH4与CO2重整体系中通入适量H2O(g),可减少C(s)的生成,反应3CH4(g)+CO2(g)+2H2O(g) ?4CO(g)+8H2(g)的ΔH=_______________________________________。
②1.01×105 Pa下,将n起始(CO2)∶n起始(CH4)=1∶1的混合气体置于密闭容器中,不同温度下重整体系中CH4和CO2的平衡转化率如图所示。800 ℃下CO2平衡转化率远大于600 ℃下CO2平衡转化率,其原因是_______________________________________________________________________________________ ________________________________________________________________________________________。
1. (2023·北京卷)下列事实能用平衡移动原理解释的是( )
A. H2O2溶液中加入少量MnO2固体,促进H2O2分解
B. 密闭烧瓶内的NO2和N2O4的混合气体,受热后颜色加深
C. 钢铁放入浓硝酸中,待不再变化后,加热能产生大量红棕色气体
D. 锌片与稀硫酸反应过程中,加入少量CuSO4固体,促进H2的产生
2. (2021·江苏适应性)在二氧化碳加氢制甲烷的反应体系中,主要发生反应的热化学方程式如下:
反应Ⅰ:CO2(g)+4H2(g)CH4(g)+2H2O(g)ΔH=-164.7 kJ/mol
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g)ΔH=+41.2 kJ/mol
反应Ⅲ:2CO(g)+2H2(g)CO2(g)+CH4(g)ΔH=-247.1 kJ/mol
向恒压、密闭容器中通入1 mol CO2和4 mol H2,平衡时CH4、CO、CO2的物质的量随温度的变化如图所示。下列说法正确的是( )
A. 反应Ⅰ的平衡常数可表示为K=
B. 图中曲线B表示CO的物质的量随温度的变化
C. 提高CO2转化为CH4的转化率,需要研发在低温区高效的催化剂
D. CH4(g)+H2O(g)CO(g)+3H2(g)的ΔH=-205.9 kJ/mol
3. (2021·江苏适应性)通过反应Ⅰ:4HCl(g)+O2(g)2Cl2(g)+2H2O(g)可将有机氯化工业的副产品HCl转化为Cl2。在0.2 MPa、反应物起始物质的量比=2的条件下,不同温度时HCl 平衡转化率如图所示。向反应体系中加入CuCl2,能加快反应速率。
反应Ⅱ:2CuCl2(s)+O2(g)2CuO(s)+2Cl2(g)ΔH=+125.6 kJ/mol
反应Ⅲ:CuO(s)+2HCl(g)CuCl2(s)+H2O(g)ΔH=-120.0 kJ/mol
下列说法正确的是( )
A. 反应Ⅰ的ΔH=+5.6 kJ/mol
B. 升高温度和增大压强均能提高反应Ⅰ中HCl的平衡转化率
C. 保持其他条件不变,500 ℃时,使用CuCl2,能使HCl转化率从X点的值升至Y点的值
D. 在0.2 MPa、500 ℃条件下,若起始<2,HCl的转化率可能达到Y点的值
4. (2024·广西高三七省联考)工业尾气脱硝是减少空气污染的重要举措。回答下列问题:
(1) 已知相关反应的热力学数据如下。
反应 ΔH( kJ/mol) Kp(800K)
CH4(g)+2O2(g) CO2(g)+2H2O(g) -802.6
N2(g)+O2(g) 2NO(g) +182.6
CH4(g)+2NO(g)+O2(g)CO2(g)+ N2(g)+ 2H2O(g)
5.0×1062
2NO(g)+ O2(g)2NO2(g)
8.5×10-3(kPa)-1
①CH4脱硝反应CH4(g)+2NO(g)+ O2(g)CO2(g)+ N2(g)+ 2H2O(g)的ΔH=__________________ kJ/mol。800 K时,为了提高该反应中NO的平衡转化率,理论上可采取的措施是______(填字母)。
A. 恒容时增大O2的压强 B. 减小反应容器的容积
C. 移去部分H2O(g) D. 选择合适的催化剂
②CH4另一脱硝反应CH4(g)+2NO2(g)CO2(g)+ N2(g)+2H2O(g)的Kp(800 K)=____________ kPa。
(2) 模拟工业尾气脱硝:一定条件下,将p(CH4)∶p(NO)∶p(O2)=1∶1∶50的气体与Ar混合,匀速通过催化脱硝反应器,测得NO去除率和CH4转化率随反应温度的变化如图。
当温度低于780 K时,NO的去除率随温度升高而升高,可能原因是_______________________________ ______________________________________________________________________________________;高于780 K时,NO的去除率随温度升高而降低,结合(1)的信息分析其可能原因是_______________________________________________________________________________________________________________________________________。
第22讲 化学平衡的移动
[备考导航]
(1) × (2) × (3) × (4) × (5) × (6) √ (7) × (8) √ (9) √ (10) √
考点1
[知识梳理]
知识1 1. 减弱
2. < 正向 > 逆向 减小 增大 不 吸热 放热
知识2 2. 正向 不 逆向 3.正向 不 逆向
[典题悟法]
典例1 C 【解析】 Br-能被氧化为Br2,溴水也为橙色,A错误;恒温恒容密闭容器中发生反应:2HI(g)H2(g)+I2(g),该反应前后气体分子数不变,充入Ar,相当于没有改变压强,故不能得出相应结论,B错误;2NO2(g)N2O4为放热反应,升高温度,气体颜色变深,说明平衡逆向移动,C正确;催化剂不影响平衡移动,D错误。
典例2 B 【解析】 催化剂能加快反应速率,缩短达到平衡所需的时间,A正确;正反应放热,升高温度,平衡左移,SO2的平衡转化率减小,B错误;增大O2浓度,SO2的转化率增大,C正确;该反应为气体分子数减小的反应,增大压强,反应速率加快,平衡右移,SO2转化率增大,D正确。
考点2
[知识梳理]
知识1 2. 1
知识2 1. (1) ①反应速率 ②平衡
[典题悟法]
典例3 C 【解析】 随着温度升高,NO平衡转化率降低,说明升高温度平衡逆向移动,该反应为放热反应,A正确;X点反应未达到平衡状态,此时反应正向进行程度大,故延长反应时间,可使NO转化率增大,B正确;增大一种反应物的浓度,能提高另一种反应物的转化率,Y点为400 ℃时的平衡状态,增大O2浓度平衡正向移动,NO转化率增大,C错误;设NO起始物质的量浓度为a mol/L,则
2NO(g)+ O2(g) 2NO2(g)
c(始)/(mol/L) a 5.0×10-4 0
c(转)/(mol/L) 0.5a 0.25a 0.5a
c(平)/(mol/L) 0.5a 5.0×10-4-0.25a 0.5a
平衡常数K==>=2 000,D正确。
典例4 D 【解析】 标记CH4(g)+CO2(g) ??2H2(g)+2CO(g)为反应Ⅰ,H2(g)+CO2(g) H2O(g)+CO(g)为反应Ⅱ。上述两个反应均为吸热反应,升高温度,平衡右移,CH4的平衡转化率升高,增大压强,反应Ⅰ平衡左移,故CH4平衡转化率降低,A错误;CH4、CO2等物质的量投入,在反应Ⅰ中,二者的转化率相同,由于反应Ⅱ也消耗CO2,故相同条件下反应达到平衡时,CO2的平衡转化率大于CH4的平衡转化率,即曲线A表示CO2的平衡转化率随温度的变化,B错误;催化剂只能改变反应速率,不能改变平衡转化率,故改用高效催化剂后,曲线A、B也不可能重叠,C错误;如果不断分离出H2或CO,最终会导致反应Ⅰ正向进行的程度变大,从而提高CH4的转化率,CH4的转化率能从X点的值增大到Y点的值,D正确。
典例5 B 【解析】 由n始(C2H5OH)∶n始(H2O)=1∶3可知,初始投料只有C2H5OH和H2O,故开始反应时,只能发生第一个反应,产物中没有CO,则CO2的选择性为100%,图中曲线①表示平衡时CO2的选择性随温度的变化,由CO的选择性=×100%可知,CO2、CO的选择性之和为1,则曲线③表示平衡时CO的选择性随温度的变化,曲线②表示平衡时H2的产率随温度的变化,A错误;由图可知,升高温度时,曲线③上升,则平衡时CO的选择性随温度的升高而增大,B正确;一定温度下,增大,相当于增大n(C2H5OH),H2O的平衡转化率增大,C2H5OH的平衡转化率减小,C错误;选用高效催化剂只能改变反应速率,不能改变平衡时H2的产率,D错误。
典例6 D 【解析】 由于NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应,升高温度,三个反应的平衡均逆向移动,NH3的平衡转化率一定减小,A错误;由图像知,其他条件不变,在175~300 ℃范围内,随着温度升高,NH3的转化率逐渐增大至几乎不变,N2的选择性逐渐减小,曲线交点前NH3的转化率增大幅度大于N2的选择性减小幅度,则低温时,NH3的转化率为影响N2产量的主要因素,高温时,N2的选择性为影响N2产量的主要因素,故出口处N2的量先增大后减小,B错误;温度高于250 ℃时,NH3的转化率虽然接近100%,但是N2的选择性较小,NH3较多地转化为NO、N2O,NO、N2O属于污染性气体,C错误;由图可知,低温时,N2的选择性较高,温度高于250 ℃时,NH3的平衡转化率接近100%,由于NH3转化的反应为放热反应,随着温度的降低,NH3的平衡转化率应升高,故低温时,NH3的平衡转化率更接近100%,但实际上低温时,NH3的转化率远远低于平衡时NH3的转化率,说明在低温条件下NH3的转化反应速率较小,故要高效除去尾气中的NH3,需研发低温下NH3转化率高和N2选择性高的催化剂,D正确。
典例7 (1) 反应Ⅰ的ΔH>0,反应Ⅱ的ΔH<0,温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅度 (2) 增大压强、使用对反应Ⅱ催化活性更高的催化剂
【解析】 反应Ⅰ为吸热反应,反应Ⅱ为放热反应,当升高温度时,反应Ⅰ平衡正向移动,CO2转化为CO的平衡转化率上升,反应Ⅱ平衡逆向移动,CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅度。(2) 反应Ⅰ是气体分子数不变的反应,反应Ⅱ是气体分子数减小的反应,通过加压可使反应Ⅱ平衡正向移动,或者加入有利于反应Ⅱ进行的催化剂。
典例8 (1) 提高H2的产率;提供热量
(2) ①+657.1 kJ/mol ②反应Ⅰ、反应Ⅱ的ΔH>0,高温下正反应进行程度大,CO2反应的量多,反应Ⅲ的ΔH<0,高温下正反应进行程度小,CO2生成的量少
【解析】 (1) CaO可以吸收一部分CO2,使体系中CO2的浓度降低,可促进反应CO(g)+H2O(g) H2(g)+CO2(g)平衡右移,则体系中CO的浓度降低,又可促进反应CH4(g)+H2O(g) CO(g)+3H2(g)平衡右移,则体系中H2的产率升高;由CaO吸收CO2的反应是放热反应,且CH4与H2O重整反应需要在500 ℃条件下发生知,CaO吸收CO2的反应可以为CH4与H2O重整反应的发生提供热量;多孔CaO与CO2的接触面积较大,吸收CO2效率更高。(2) ①根据盖斯定律,反应Ⅰ×3-反应Ⅱ×2,可得3CH4(g)+CO2(g)+2H2O(g) ??4CO(g)+8H2(g)的ΔH=3×246.5 kJ/mol-2×41.2 kJ/mol=+657.1 kJ/mol。②高温时(如800 ℃),吸热反应(反应Ⅰ和反应Ⅱ)进行的程度更大,放热反应(反应Ⅲ)进行的程度更小,由图可知,在较低温度下(如低于600 ℃),CH4的平衡转化率高于CO2的平衡转化率,体系中主要发生反应Ⅰ和反应Ⅲ;在较高温度下(如800 ℃),CO2的平衡转化率逼近CH4的平衡转化率,体系中主要发生反应Ⅰ和反应Ⅱ,此时,反应Ⅲ受到抑制,反应Ⅱ受到促进,体系中主要反应发生转变。
[质量评价]
1. B 【解析】 MnO2催化 H2O2分解,与平衡移动无关,A错误;NO2转化为N2O4是放热反应,升温平衡逆向移动,NO2浓度增大,混合气体颜色加深,B正确;常温下,铁在浓硝酸中钝化,加热会使表面的致密氧化膜溶解,铁与浓硝酸反应生成大量红棕色气体NO2,与平衡移动无关,C错误;加入硫酸铜以后,锌置换出铜,锌、铜和稀硫酸构成原电池,反应速率加快,与平衡移动无关,D错误。
2. C 【解析】 H2O为气态,应列入K,A错误;反应Ⅱ是吸热反应,反应Ⅲ是放热反应,CO的物质的量随温度升高而增大,故曲线C表示CO的物质的量随温度的变化,B错误;曲线A表示CH4的物质的量随温度的变化,低温时以反应Ⅰ为主,高温时以反应Ⅲ为主,所以欲提高CO2转化为CH4的转化率,需要研发在低温区高效的催化剂,C正确;根据盖斯定律,反应Ⅱ-反应Ⅰ或-(反应Ⅱ+反应Ⅲ)可得CH4(g)+H2O(g) CO(g)+3H2(g)的ΔH=+205.9 kJ/mol,D错误。
3. D 【解析】 根据盖斯定律,反应Ⅱ+反应Ⅲ×2=反应Ⅰ,反应Ⅰ的ΔH=+125.6 kJ/mol+(-120.0 kJ/mol)×2=-114.4 kJ/mol,A错误;由图可知,升高温度,HCl的平衡转化率减小,反应Ⅰ为气体分子数减小的反应,增大压强平衡右移,HCl的平衡转化率提高,B错误;CuCl2作反应Ⅰ的催化剂,催化剂不能改变平衡转化率,故加催化剂可以使X点移至曲线上,但不能升至Y点,C错误;增大O2的浓度,HCl的转化率提高,D正确。
4. (1) ① -985.2 AC ②5.9×1064 (2) 温度低于780 K,反应未达平衡,升高温度,向正反应方向移动,NO的去除率升高 高于780 K时,该反应是放热反应,随温度升高,平衡逆向移动,NO的去除率随温度升高而降低
【解析】 (1) ①根据盖斯定律,由表格中第一反应减第二个反应可得目标反应,故ΔH=-802.6 kJ/mol-182.6 kJ/mol=-985.2 kJ/mol。恒容时增大O2压强,平衡右移,NO转化率提高,A正确;减小容器的容积,平衡不移动,B错误;移去部分H2O (g),平衡右移,NO转化率提高,C正确;催化剂对平衡移动无影响,D错误。②根据盖斯定律,由第三个反应减第四个反应可得目标反应,故该反应的Kp(800 K)= kPa=5.9×1064 kPa。
同课章节目录
