大单元八 化学工艺流程 大单元整合 提能力验考情八 学案 (含答案)2026届高三化学一轮大单元复习
文档属性
| 名称 | 大单元八 化学工艺流程 大单元整合 提能力验考情八 学案 (含答案)2026届高三化学一轮大单元复习 |  | |
| 格式 | DOC | ||
| 文件大小 | 848.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-15 10:57:52 | ||
图片预览



文档简介
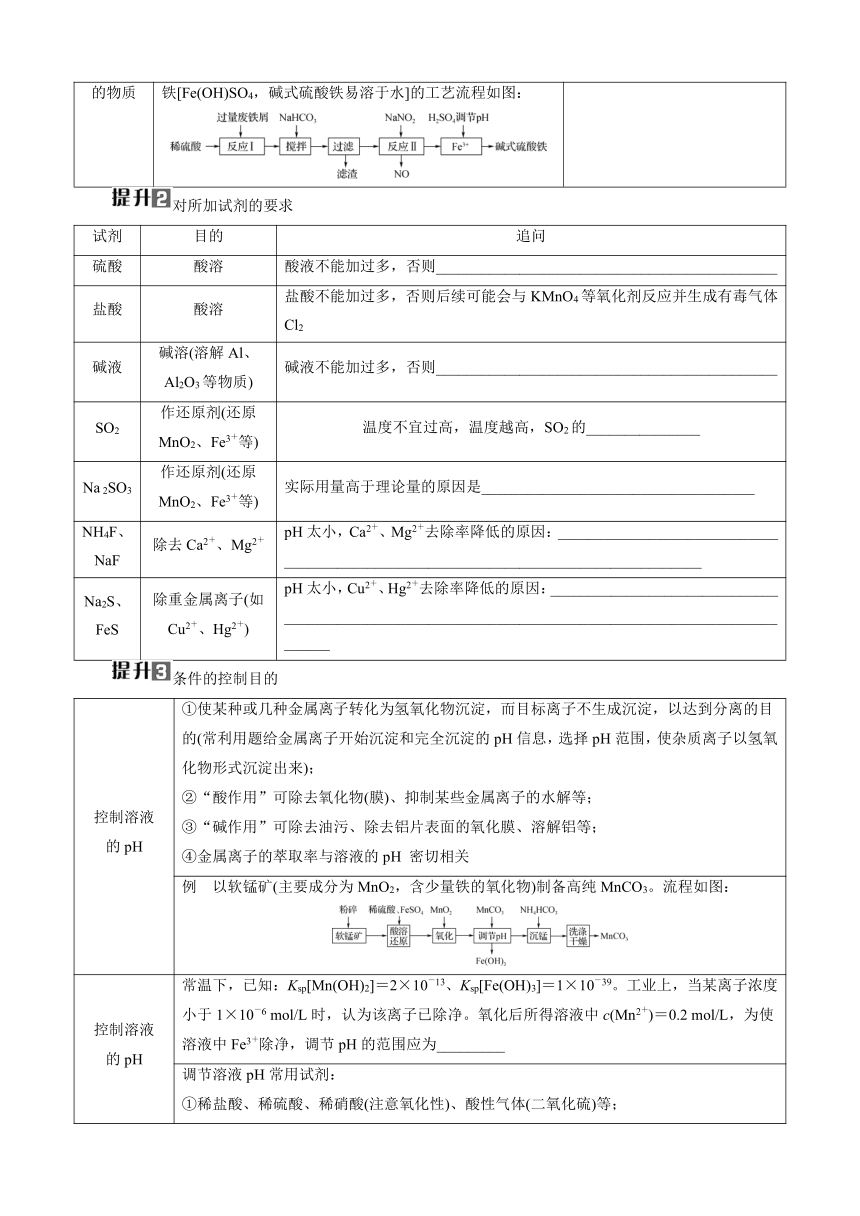
大单元八 化学工艺流程
物质的跟踪
1. 原料到产品的转化:比对原料与产品,确定要除去什么元素,要引进什么元素。
2. 沉淀成分的判断
考查角度 举例 滤渣的成分(填化学式)
原料中不参与反应的物质 蛇纹石是一种富镁硅酸盐矿物的总称,工业上由蛇纹石(主要成分MgO、FeO和Fe2O3、Al2O3、SiO2)制取碱式碳酸镁产品的流程如下: 滤渣a为_________
原料中不参与反应的物质及过量的反应物 以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如图: 滤渣为___________________________
原料中不参与反应的物质及生成物 某粉煤灰经预处理后含Cu2O、SiO2、Al2O3、FeO,一种综合利用工艺设计的流程如下:已知:Cu2O+2H+===Cu+Cu2++H2O 滤渣Ⅰ为__________________
杂质转化的物质 工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4,碱式硫酸铁易溶于水]的工艺流程如图: 滤渣为_____________________
对所加试剂的要求
试剂 目的 追问
硫酸 酸溶 酸液不能加过多,否则_____________________________________________
盐酸 酸溶 盐酸不能加过多,否则后续可能会与KMnO4等氧化剂反应并生成有毒气体Cl2
碱液 碱溶(溶解Al、Al2O3等物质) 碱液不能加过多,否则_____________________________________________
SO2 作还原剂(还原MnO2、Fe3+等) 温度不宜过高,温度越高,SO2的_______________
Na 2SO3 作还原剂(还原MnO2、Fe3+等) 实际用量高于理论量的原因是____________________________________
NH4F、NaF 除去Ca2+、Mg2+ pH太小,Ca2+、Mg2+去除率降低的原因:____________________________________________________________________________________
Na2S、FeS 除重金属离子(如Cu2+、Hg2+) pH太小,Cu2+、Hg2+去除率降低的原因:_____________________________________________________________________________________________________
条件的控制目的
控制溶液的pH ①使某种或几种金属离子转化为氢氧化物沉淀,而目标离子不生成沉淀,以达到分离的目的(常利用题给金属离子开始沉淀和完全沉淀的pH信息,选择pH范围,使杂质离子以氢氧化物形式沉淀出来);②“酸作用”可除去氧化物(膜)、抑制某些金属离子的水解等;③“碱作用”可除去油污、除去铝片表面的氧化膜、溶解铝等;④金属离子的萃取率与溶液的pH 密切相关
例 以软锰矿(主要成分为MnO2,含少量铁的氧化物)制备高纯MnCO3。流程如图:
控制溶液的pH 常温下,已知:Ksp[Mn(OH)2]=2×10-13、Ksp[Fe(OH)3]=1×10-39。工业上,当某离子浓度小于1×10-6 mol/L时,认为该离子已除净。氧化后所得溶液中c(Mn2+)=0.2 mol/L,为使溶液中Fe3+除净,调节pH的范围应为_________
调节溶液pH常用试剂:①稀盐酸、稀硫酸、稀硝酸(注意氧化性)、酸性气体(二氧化硫)等;②氢氧化钠、氨水、碳酸钠、碳酸氢铵、金属氧化物等
控制温度(常用水浴、冰水浴或油浴) ①控制反应速率(升温加快反应速率)、适宜的温度使催化剂的活性最大、防止副反应的发生;②控制化学反应进行的方向,使化学平衡发生移动;③升温:使溶液中的气体逸出,使易挥发的物质挥发,使易分解的物质分解;煮沸:使气体逸出;促进水解,聚沉后便于过滤分离;④控制温度,结晶与过滤
循环物质的确定
考查角度 举例 可循环物质
可逆反应的反应物 _________
前面步骤的反应物,后面步骤的生成物 以菱锰矿(主要成分为MnCO3,还含有FeCO3、CaCO3、SiO2、Al2O3、Fe2O3、MgCO3等杂质)为原料制备二氧化锰的工艺流程如图:已知:草酸钙、草酸镁不溶于水 ______
箭头回头 联碱法(侯氏制碱法)和氨碱法的生产流程简要表示如图: _______________
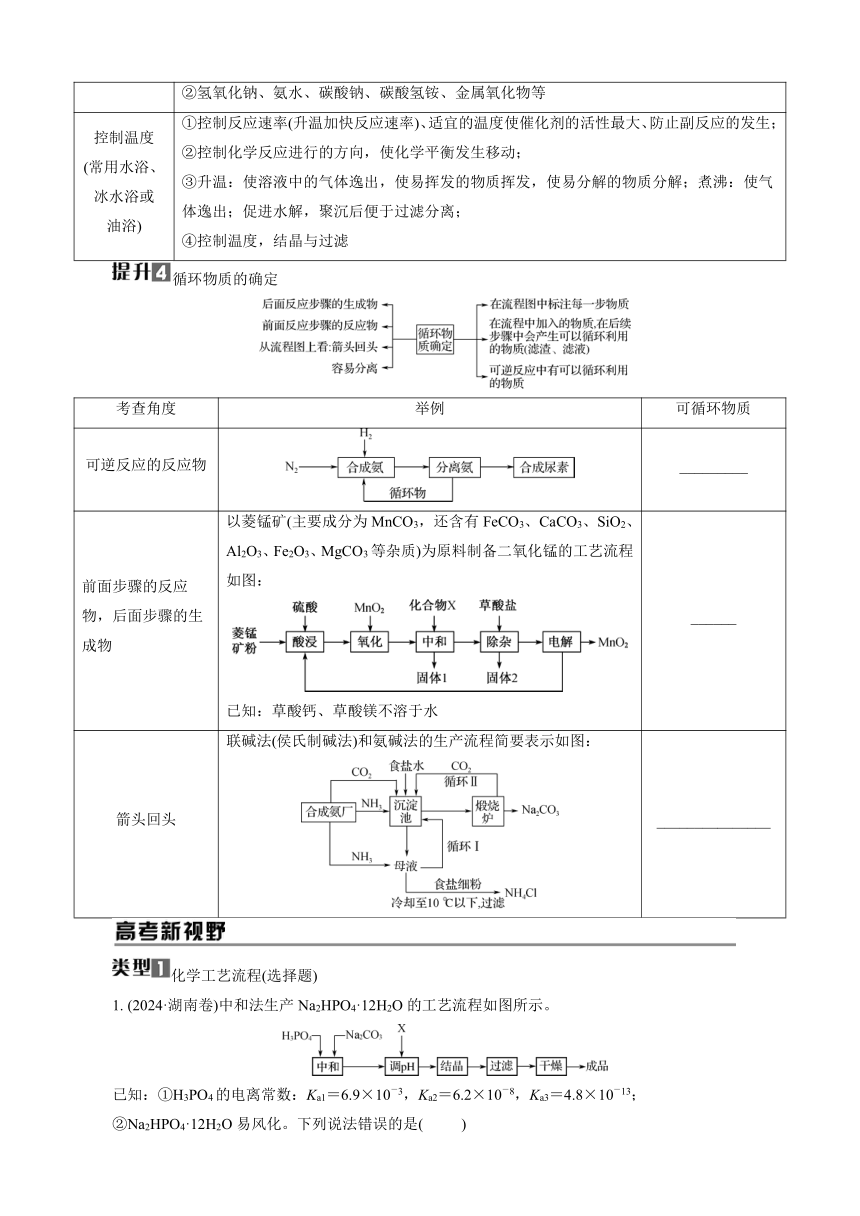
化学工艺流程(选择题)
1. (2024·湖南卷)中和法生产Na2HPO4·12H2O的工艺流程如图所示。
已知:①H3PO4的电离常数:Ka1=6.9×10-3,Ka2=6.2×10-8,Ka3=4.8×10-13;
②Na2HPO4·12H2O易风化。下列说法错误的是( )
A. “中和”工序若在铁质容器中进行,应先加入Na2CO3溶液
B. “调pH”工序中X为NaOH或H3PO4
C. “结晶”工序中溶液显酸性
D. “干燥”工序需在低温下进行
工艺流程综合题型
2. (2024·广东卷)镓(Ga)在半导体、记忆合金等高精尖材料领域有重要应用。一种从电解铝的副产品炭渣(含C、Na、Al、F和少量的Ga、Fe、K、Ca等元素)中提取镓及循环利用铝的工艺如下。
工艺中,LAEM是一种新型阴离子交换膜,允许带负电荷的配离子从高浓度区扩散至低浓度区。用LAEM提取金属离子Mn+的原理如图所示。已知:①pKa(HF)=3.2。②Na3AlF6(冰晶石)的Ksp为4.0×10-10。③浸取液中,Ga(Ⅲ)和Fe(Ⅲ)以(m-3)-(m=0~4)粒子形式存在,Fe2+最多可与2个Cl-配位,其他金属离子与Cl-的配位可忽略。
(1) “电解”中,反应的化学方程式为___________________________________________。
(2) “浸取”中,由Ga3+形成-的离子方程式为_______________________________________。
(3) “还原”的目的:避免___元素以_____________________(填化学式)粒子的形式通过LAEM,从而有利于Ga的分离。
(4) “LAEM提取”中,原料液的Cl-浓度越___,越有利于Ga的提取;研究表明,原料液酸度过高,会降低Ga的提取率。因此,在不提高原料液酸度的前提下,可向Ⅰ室中加入____________(填化学式),以进一步提高Ga的提取率。
(5) “调pH”中,pH至少应大于_________,使溶液中c>c(HF),有利于3-配离子及Na3晶体的生成。若“结晶”后溶液中c=0.10 mol/L,则3-浓度为______________mol/L。
3. (2024·安徽卷)精炼铜产生的铜阳极泥富含Cu、Ag、Au等多种元素。研究人员设计了一种从铜阳极泥中分离提收金和银的流程,如图所示。
(1) Cu位于元素周期表第___周期______族。
(2) “浸出液1”中含有的金属离子主要是____________。
(3) “浸取2”步骤中,单质金转化为HAuCl4的化学方程式为__________________________________ _______________________________________。
(4) “浸取3”步骤中,“浸渣2”中的____________(填化学式)转化为[Ag(S2O3)2]3-。
(5) “电沉积”步骤中阴极的电极反应式为_______________________________________________ ___________________。
“电沉积”步骤完成后,阴极区溶液中可循环利用的物质为____________(填化学式)。
(6) “还原”步骤中,被氧化的N2H4与产物Au的物质的量之比为__________。
(7) Na2S2O3可被I2氧化为Na2S4O6。从物质结构的角度分析S4O的结构为(a)而不是(b)的原因:___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
(a) (b)
4. (2024·湖北卷)铍用于宇航器件的构筑。一种从其铝硅酸盐中提取铍的路径如图所示。已知:Be2++4HA??BeA2(HA)2+2H+。
(1) 基态Be2+的轨道表示式为___。
(2) 为了从“热熔、冷却”步骤得到玻璃态,冷却过程的特点是____________。
(3) “萃取、分液”的目的是分离Be2+和Al3+,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是____________________________________。
(4) 写出反萃取生成Na2的化学方程式:_________________________________ _______________________________________________________________________。“滤液2”可以进入__________________步骤再利用。
(5) 电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用是_________________________________。
(6) Be(OH)2与醋酸反应得到某含4个Be的配合物,4个Be位于以1个O原子为中心的四面体的4个顶点,且每个Be的配位环境相同,Be与Be间通过CH3COO-相连,其化学式为____________________________________。
5. (2024·湖南卷)铜阳极泥(含有Au、Ag2Se、Cu2Se、PbSO4等)是一种含贵金属的可再生资源,回收贵金属的化工流程如图所示。
已知:①当某离子的浓度低于1.0×10-5 mol/L时,可忽略该离子的存在;
②AgCl+Cl-??,\s\up6())- K=2.0×10-5;
③Na2SO3易从溶液中结晶析出;
④不同温度下Na2SO3的溶解度如下:
温度/℃ 0 20 40 60 80
溶解度/g 14.4 26.1 37.4 33.2 29.0
(1) Cu属于______区元素,其基态原子的价层电子排布式为_____________________。
(2) “滤液1”中含有Cu2+和H2SeO3,“氧化酸浸”时Cu2Se反应的离子方程式为_________________________________________________________________________________________。
(3) “氧化酸浸”和“除金”工序均需加入一定量的NaCl:
①在“氧化酸浸”工序中,加入适量NaCl的原因是_______________________________________。
②在“除金”工序溶液中,Cl-浓度不能超过_________ mol/L。
(4) 在“银转化”体系中,[Ag(SO3)2]3-和[Ag(SO3)3]5-浓度之和为0.075 mol/L,两种离子分布分数δ随SO浓度的变化关系如图所示。若SO浓度为1.0 mol/L,则5-的浓度为____________ mol/L。
(5) 滤液4中溶质主要成分为__________________(填化学式);在连续生产的模式下,“银转化”和“银还原”工序需在40 ℃左右进行,若反应温度过高,将难以实现连续生产,原因是_________________________________________________________________________________________________________________________。
6. (2024·山东卷)以铅精矿(含PbS,Ag2S等)为主要原料提取金属Pb和Ag的工艺流程如下:
(1) “热浸”时,难溶的PbS和Ag2S转化为2-和-及单质硫。溶解等物质的量的PbS和Ag2S时,消耗Fe3+物质的量之比为_________;溶液中盐酸浓度不宜过大,除防止“热浸”时HCl挥发外,另一目的是防止产生_________(填化学式)。
(2) 将“过滤Ⅱ”得到的PbCl2沉淀反复用饱和食盐水热溶,电解所得溶液可制备金属Pb。“电解Ⅰ”阳极产物用尾液吸收后在工艺中循环使用,利用该吸收液的操作单元为______。
(3) “还原”中加入铅精矿的目的是_____________________________________________。
(4) “置换”中可选用的试剂X为___(填字母)。
A. Al B. Zn
C. Pb D. Ag
“置换”反应的离子方程式为____________________________________________________。
(5) “电解Ⅱ”中将富银铅泥制成电极板,用作______(填“阴极”或“阳极”)。
7. (2024·新课标卷)钴及其化合物在制造合金、磁性材料、催化剂及陶瓷釉等方面有着广泛应用。一种从湿法炼锌产生的废渣(主要含Co、Zn、Pb、Fe的单质或氧化物)中富集回收得到含锰高钴成品的工艺如下:
已知溶液中相关离子开始沉淀和沉淀完全(c≤1.0×10-5 mol/L)时的pH:
相关离子 Fe3+ Fe2+ Co3+ Co2+ Zn2+
开始沉淀的pH 1.5 6.9 — 7.4 6.2
沉淀完全的pH 2.8 8.4 1.1 9.4 8.2
(1) “酸浸”前废渣需粉碎处理,目的是__________________________________________________;
“滤渣1”中金属元素主要为______。
(2) “过滤1”后的溶液中加入MnO2的作用是_______________________________________ _________________________________________________________。
取少量反应后的溶液,加入化学试剂________________________________检验____________,若出现蓝色沉淀,需补加MnO2。
(3) “氧化沉钴”中氧化还原反应的离子方程式为______________________________________ ___________________________________________________________________________________________、_______________________________________________________________________________________。
(4) “除钴液”中主要的盐有__________________________(写化学式),残留的Co3+浓度为_____________________mol/L。
大单元整合 提能力验考情八
[能力提升]
提升1 1. SiO2 CaCO3、Ca(OH)2 SiO2、Cu Al(OH)3
提升2 会造成后续调pH时消耗过多试剂
会造成后续调pH时消耗过多试剂
溶解度越小 Na 2SO3被空气中的O2氧化
pH太小,溶液中的F-与H+结合生成HF,使溶液中的F-浓度减小
pH太小,溶液中的S2-与H+结合生成HS-、H2S,使溶液中的S2-浓度减小
提升3 例 3~8
【解析】 Fe3+除净时,c(OH-)==mol/L=1×10-11 mol/L,pH=3;锰离子开始沉淀时,c(OH-)== mol/L=1×10-6 mol/L,pH=8,故应调节pH的范围是3~8
提升4 N2、H2 硫酸 母液、CO2
[高考新视野]
1. C 【解析】 H3PO4和Na2CO3先发生反应,通过加入X调节pH,使产物完全转化为Na2HPO4,通过结晶、过滤、干燥,最终得到Na2HPO4·12H2O成品。铁是较活泼金属,可与H3PO4反应生成氢气,故“中和”工序若在铁质容器中进行,应先加入Na2CO3溶液,A正确;若“中和”工序加入Na2CO3过量,则需要加入酸性物质来调节pH,为了不引入新杂质,可加入H3PO4;若“中和”工序加入H3PO4过量,则需要加入碱性物质来调节pH,为了不引入新杂质,可加入NaOH,所以“调pH”工序中X为NaOH或H3PO4,B正确;“结晶”工序中的溶液为饱和Na2HPO4溶液,HPO的水解常数Kh==≈1.6×10-7,由于Kh>Ka3,则Na2HPO4的水解程度大于电离程度,溶液显碱性,C错误;由于Na2HPO4·12H2O易风化失去结晶水,故“干燥”工序需要在低温下进行,D正确。
2. (1) 2Al2O3(熔融)4Al+3O2↑
(2) Ga3++4Cl-===[GaCl4]- (3) 铁 [FeCl4]- (4) 高 NaCl (5) 3.2 4.0×10-7
【解析】 电解铝的副产品炭渣(含C、Na、Al、F和少量的Ga、Fe、K、Ca等元素)进行“焙烧”,金属转化为氧化物,焙烧后的固体加入盐酸“浸取”,浸取液加入铝片是将Fe3+进行“还原”,得到原料液,原料液用“LAEM提取”,[GaCl4]-通过交换膜进入Ⅱ室并转化为Ga3+,Ⅱ室溶液进一步处理得到镓,Ⅰ室溶液加入含F-的废液“调pH”并结晶得到NaAlF6晶体用于电解铝。(3) 由信息知浸取液中,Ga(Ⅲ)和Fe(Ⅲ)以[MClm](m-3)-(m=0~4)粒子形式存在,LAEM是一种新型阴离子交换膜,允许带负电荷的配离子从高浓度区扩散至低浓度区,为了避免铁元素的配离子通过LAEM,故要先加入铝片还原Fe3+,从而有利于Ga的分离。(4) “LAEM提取”中,原料液的Cl-浓度越高,更有利于生成[GaCl4]-的反应正向移动,更有利于Ga的提取,在不提高原料液酸度的前提下,同时又不引入新杂质,可向Ⅰ室中加入NaCl,以提高Cl-浓度,进一步提高Ga的提取率。(5) 由pKa(HF)=3.2,Ka(HF)==10-3.2,为了使溶液中c(F-)>c(HF),故c(H+)<10-3.2 mol/L,故pH至少应大于3.2,有利于[AlF6]3-配离子及Na3AlF6晶体的生成。若“结晶”后溶液中c(Na+)=0.10 mol/L,根据Na3 AlF6(冰晶石)的Ksp=4.0×10-10,[AlF6]3-== mol/L=4.0×10-7 mol/L。
3. (1) 四 ⅠB (2) Cu2+
(3) 2Au+8HCl+3H2O2===2HAuCl4+6H2O (4) AgCl
(5) [Ag(S2O3)2]3-+e-===Ag↓+2S2O Na2S2O3
(6) 3∶4 (7) (a)结构中电子云分布较均衡,结构较为稳定,(b)结构中正、负电荷中心不重合,极性较大,较不稳定,且存在过氧键,过氧键的氧化性大于I2,故Na2S2O3不能被I2氧化成(b)结构
【解析】 (3) “浸取2”步骤中,Au与盐酸、H2O2发生氧化还原反应,生成HAuCl4和H2O,根据得失电子守恒及原子守恒,可得反应的化学方程式。(4) 浸渣2中含有AgCl,与Na2S2O3反应转化为[Ag(S2O3)2]3-。(5) “电沉积”步骤中,阴极发生还原反应,[Ag(S2O3)2]3-得电子被还原为Ag,电极反应式为[Ag(S2O3)2]3-+e-===Ag↓+2S2O;阴极反应生成S2O,同时阴极区溶液中含有Na+,故“电沉积”步骤完成后,阴极区溶液中可循环利用的物质为Na2S2O3。(6)“还原”步骤中, HAuCl4被还原为Au,Au元素的化合价由+3变为0,一个HAuCl4转移3个电子,N2H4被氧化为N2,N元素的化合价由-2变为0,一个N2H4转移4个电子,根据得失电子守恒,被氧化的N2H4与产物Au的物质的量之比为3∶4。
4. (1) (2) 快速冷却 (3) 出现白色浑浊,后迅速消失 (4) BeA2(HA)2+6NaOH===Na2[Be(OH)4]+4NaA+2H2O 反萃取、分液 (5) 增强熔融氯化铍的导电性
(6)C12H18Be4O13
【解析】 铝硅酸盐先加热熔融,然后快速冷却到其玻璃态,再加入稀硫酸酸浸过滤,滤渣的成分为H2SiO3,“滤液1”中有Be2+和Al3+,加入含HA的煤油将Be2+萃取到有机相中,水相1中含有Al3+,有机相为BeA2(HA)2,加入过量氢氧化钠反萃取Be2+使其转化为Na2[Be(OH)4]进入水相2中,分离出含NaA的煤油,最后对水相2加热过滤,分离出Be(OH)2,通过系列操作得到金属铍。(2) 熔融态物质冷却凝固时,缓慢冷却会形成晶体,快速冷却会形成非晶态,即玻璃态。(3) “滤液1”中有Be2+和Al3+,加入含HA的煤油将Be2+萃取到有机相中,则水相1中含有Al3+,则向过量烧碱的溶液中逐滴加入少量水相1的溶液,出现白色浑浊,后迅速消失。(4) 滤液2的主要成分为NaOH,可进入反萃取步骤再利用。(6)由题意可知,该配合物中有4个铍位于四面体的四个顶点上,四面体中心只有一个O,Be与Be之间总共有6个CH3COO-,则其结构简式为Be4O(CH3COO)6,化学式为C12H18Be4O13。
5. (1) ①ds 3d104s1
(2) Cu2Se+4H2O2+4H+===2Cu2++H2SeO3+5H2O (3) ①使银元素转化为AgCl沉淀 ② 0.5 (4) 0.05
(5) Na2SO3 高于40 ℃后,Na2SO3的溶解度下降,“银转化”和“银还原”的效率降低,难以实现连续生产
【解析】 (3) ②在“除金”工序溶液中,根据反应AgCl+Cl--,若Cl-加入过多,AgCl则会转化为-,当某离子的浓度低于1.0×10-5 mol/L时,可忽略该离子的存在,为了不让AgCl发生转化,则令c{[AgCl2]-}=1.0×10-5 mol/L,由K==2.0×10-5,可得c=0.5 mol/L,即Cl-浓度不能超过0.5 mol/L。(4) 在“银转化”体系中,3-和5-浓度之和为0.075 mol/L,溶液中存在平衡关系:3-+SO??5-,当c(SO)=0.5 mol/L时,此时c=c=0.037 5 mol/L,则该平衡关系的平衡常数K===2,当c(SO)=1 mol/L时,K===2,解得此时c=0.05 mol/L。(5) 滤液4中溶质主要成分为Na2SO3;由不同温度下Na2SO3的溶解度可知,高于40 ℃后,Na2SO3的溶解度下降,“银转化”和“银还原”的效率降低,难以实现连续生产。
6. (1) 1∶1 H2S (2) 热浸 (3) 将过量的Fe3+还原为Fe2+ (4) C Pb+2[AgCl2]-===2Ag+[PbCl4]2-
(5) 阳极
【解析】 (1) “热浸”时,Fe3+将PbS和Ag2S中-2价的硫氧化为单质硫,Fe3+被还原为Fe2+,在这个过程中Pb和Ag的化合价保持不变,所以等物质的量的PbS和Ag2S时,S2-物质的量相等,所以消耗Fe3+的物质的量相等,比值为1∶1;溶液中盐酸浓度过大,这里主要考虑氢离子浓度会过大,会生成H2S 气体。(2) “过滤Ⅱ”得到的PbCl2沉淀反复用饱和食盐水热溶,会溶解为2-,电解2-溶液制备金属Pb,Pb在阴极产生,阳极Cl-放电产生Cl2, 尾液成分为FeCl2,FeCl2吸收Cl2后转化为FeCl3,可以在热浸中循环使用。(3) 过滤Ⅱ所得的滤液中有过量的未反应的Fe3+,根据还原之后可以得到含硫滤渣,“还原”中加入铅精矿的目的是将过量的Fe3+还原为Fe2+。(4) “置换”中加入试剂X可以得到富银铅泥,为了防止引入其他杂质,则试剂X应为Pb,发生的反应为Pb+2[AgCl2]-===2Ag+[PbCl4]2-。(5) “电解Ⅱ”中将富银铅泥制成电极板,“电解Ⅱ”得到金属银和金属铅,将银和铅分离出来,阳极放电,银变成阳极泥而沉降下来,铅失电子为Pb2+,阴极得电子得到Pb,所以电极板应作阳极。
7. (1) 增大固液接触面积,加快酸浸速率,提高浸取效率 Pb (2) 将溶液中的Fe2+氧化为Fe3+,以便在后续调pH时除去Fe元素 K3[Fe(CN)6]溶液 Fe2+ (3) 3Co2++MnO+7H2O===3Co(OH)3↓+MnO2↓+5H+ 3Mn2++2MnO+2H2O===5MnO2↓+4H+
(4) ZnSO4 、K2SO4 10-16.7
【解析】 (3) “氧化沉钴”,加入强氧化剂KMnO4,将溶液中Co2+氧化为Co3+,在pH=5时Co3+形成Co(OH)3沉淀,而KMnO4则被还原为MnO2,KMnO4还会与溶液中的Mn2+发生归中反应生成MnO2,得到Co(OH)3和MnO2的混合物。(4) 最终得到的“除钴液”中含有的金属离子主要是加入ZnO调pH时引入的Zn2+、加入KMnO4“氧化沉钴”时引入的K+,而阴离子是在“酸浸”时引入的SO,因此其中主要的盐有ZnSO4和K2SO4;由表可知,当溶液pH=1.1时,Co3+恰好完全沉淀,此时溶液中c(Co3+)=1.0×10-5 mol/L,c(OH-)=10-12.9 mol/L,则Ksp[Co(OH)3]=1.0×10-5×(10-12.9)3=10-43.7,“除钴液”的pH=5,即c(H+)=10-5 mol/L,则c(OH-)=10-9 mol/L,此时溶液中c(Co3+)== mol/L=10-16.7 mol/L。
物质的跟踪
1. 原料到产品的转化:比对原料与产品,确定要除去什么元素,要引进什么元素。
2. 沉淀成分的判断
考查角度 举例 滤渣的成分(填化学式)
原料中不参与反应的物质 蛇纹石是一种富镁硅酸盐矿物的总称,工业上由蛇纹石(主要成分MgO、FeO和Fe2O3、Al2O3、SiO2)制取碱式碳酸镁产品的流程如下: 滤渣a为_________
原料中不参与反应的物质及过量的反应物 以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如图: 滤渣为___________________________
原料中不参与反应的物质及生成物 某粉煤灰经预处理后含Cu2O、SiO2、Al2O3、FeO,一种综合利用工艺设计的流程如下:已知:Cu2O+2H+===Cu+Cu2++H2O 滤渣Ⅰ为__________________
杂质转化的物质 工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4,碱式硫酸铁易溶于水]的工艺流程如图: 滤渣为_____________________
对所加试剂的要求
试剂 目的 追问
硫酸 酸溶 酸液不能加过多,否则_____________________________________________
盐酸 酸溶 盐酸不能加过多,否则后续可能会与KMnO4等氧化剂反应并生成有毒气体Cl2
碱液 碱溶(溶解Al、Al2O3等物质) 碱液不能加过多,否则_____________________________________________
SO2 作还原剂(还原MnO2、Fe3+等) 温度不宜过高,温度越高,SO2的_______________
Na 2SO3 作还原剂(还原MnO2、Fe3+等) 实际用量高于理论量的原因是____________________________________
NH4F、NaF 除去Ca2+、Mg2+ pH太小,Ca2+、Mg2+去除率降低的原因:____________________________________________________________________________________
Na2S、FeS 除重金属离子(如Cu2+、Hg2+) pH太小,Cu2+、Hg2+去除率降低的原因:_____________________________________________________________________________________________________
条件的控制目的
控制溶液的pH ①使某种或几种金属离子转化为氢氧化物沉淀,而目标离子不生成沉淀,以达到分离的目的(常利用题给金属离子开始沉淀和完全沉淀的pH信息,选择pH范围,使杂质离子以氢氧化物形式沉淀出来);②“酸作用”可除去氧化物(膜)、抑制某些金属离子的水解等;③“碱作用”可除去油污、除去铝片表面的氧化膜、溶解铝等;④金属离子的萃取率与溶液的pH 密切相关
例 以软锰矿(主要成分为MnO2,含少量铁的氧化物)制备高纯MnCO3。流程如图:
控制溶液的pH 常温下,已知:Ksp[Mn(OH)2]=2×10-13、Ksp[Fe(OH)3]=1×10-39。工业上,当某离子浓度小于1×10-6 mol/L时,认为该离子已除净。氧化后所得溶液中c(Mn2+)=0.2 mol/L,为使溶液中Fe3+除净,调节pH的范围应为_________
调节溶液pH常用试剂:①稀盐酸、稀硫酸、稀硝酸(注意氧化性)、酸性气体(二氧化硫)等;②氢氧化钠、氨水、碳酸钠、碳酸氢铵、金属氧化物等
控制温度(常用水浴、冰水浴或油浴) ①控制反应速率(升温加快反应速率)、适宜的温度使催化剂的活性最大、防止副反应的发生;②控制化学反应进行的方向,使化学平衡发生移动;③升温:使溶液中的气体逸出,使易挥发的物质挥发,使易分解的物质分解;煮沸:使气体逸出;促进水解,聚沉后便于过滤分离;④控制温度,结晶与过滤
循环物质的确定
考查角度 举例 可循环物质
可逆反应的反应物 _________
前面步骤的反应物,后面步骤的生成物 以菱锰矿(主要成分为MnCO3,还含有FeCO3、CaCO3、SiO2、Al2O3、Fe2O3、MgCO3等杂质)为原料制备二氧化锰的工艺流程如图:已知:草酸钙、草酸镁不溶于水 ______
箭头回头 联碱法(侯氏制碱法)和氨碱法的生产流程简要表示如图: _______________
化学工艺流程(选择题)
1. (2024·湖南卷)中和法生产Na2HPO4·12H2O的工艺流程如图所示。
已知:①H3PO4的电离常数:Ka1=6.9×10-3,Ka2=6.2×10-8,Ka3=4.8×10-13;
②Na2HPO4·12H2O易风化。下列说法错误的是( )
A. “中和”工序若在铁质容器中进行,应先加入Na2CO3溶液
B. “调pH”工序中X为NaOH或H3PO4
C. “结晶”工序中溶液显酸性
D. “干燥”工序需在低温下进行
工艺流程综合题型
2. (2024·广东卷)镓(Ga)在半导体、记忆合金等高精尖材料领域有重要应用。一种从电解铝的副产品炭渣(含C、Na、Al、F和少量的Ga、Fe、K、Ca等元素)中提取镓及循环利用铝的工艺如下。
工艺中,LAEM是一种新型阴离子交换膜,允许带负电荷的配离子从高浓度区扩散至低浓度区。用LAEM提取金属离子Mn+的原理如图所示。已知:①pKa(HF)=3.2。②Na3AlF6(冰晶石)的Ksp为4.0×10-10。③浸取液中,Ga(Ⅲ)和Fe(Ⅲ)以(m-3)-(m=0~4)粒子形式存在,Fe2+最多可与2个Cl-配位,其他金属离子与Cl-的配位可忽略。
(1) “电解”中,反应的化学方程式为___________________________________________。
(2) “浸取”中,由Ga3+形成-的离子方程式为_______________________________________。
(3) “还原”的目的:避免___元素以_____________________(填化学式)粒子的形式通过LAEM,从而有利于Ga的分离。
(4) “LAEM提取”中,原料液的Cl-浓度越___,越有利于Ga的提取;研究表明,原料液酸度过高,会降低Ga的提取率。因此,在不提高原料液酸度的前提下,可向Ⅰ室中加入____________(填化学式),以进一步提高Ga的提取率。
(5) “调pH”中,pH至少应大于_________,使溶液中c>c(HF),有利于3-配离子及Na3晶体的生成。若“结晶”后溶液中c=0.10 mol/L,则3-浓度为______________mol/L。
3. (2024·安徽卷)精炼铜产生的铜阳极泥富含Cu、Ag、Au等多种元素。研究人员设计了一种从铜阳极泥中分离提收金和银的流程,如图所示。
(1) Cu位于元素周期表第___周期______族。
(2) “浸出液1”中含有的金属离子主要是____________。
(3) “浸取2”步骤中,单质金转化为HAuCl4的化学方程式为__________________________________ _______________________________________。
(4) “浸取3”步骤中,“浸渣2”中的____________(填化学式)转化为[Ag(S2O3)2]3-。
(5) “电沉积”步骤中阴极的电极反应式为_______________________________________________ ___________________。
“电沉积”步骤完成后,阴极区溶液中可循环利用的物质为____________(填化学式)。
(6) “还原”步骤中,被氧化的N2H4与产物Au的物质的量之比为__________。
(7) Na2S2O3可被I2氧化为Na2S4O6。从物质结构的角度分析S4O的结构为(a)而不是(b)的原因:___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
(a) (b)
4. (2024·湖北卷)铍用于宇航器件的构筑。一种从其铝硅酸盐中提取铍的路径如图所示。已知:Be2++4HA??BeA2(HA)2+2H+。
(1) 基态Be2+的轨道表示式为___。
(2) 为了从“热熔、冷却”步骤得到玻璃态,冷却过程的特点是____________。
(3) “萃取、分液”的目的是分离Be2+和Al3+,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是____________________________________。
(4) 写出反萃取生成Na2的化学方程式:_________________________________ _______________________________________________________________________。“滤液2”可以进入__________________步骤再利用。
(5) 电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用是_________________________________。
(6) Be(OH)2与醋酸反应得到某含4个Be的配合物,4个Be位于以1个O原子为中心的四面体的4个顶点,且每个Be的配位环境相同,Be与Be间通过CH3COO-相连,其化学式为____________________________________。
5. (2024·湖南卷)铜阳极泥(含有Au、Ag2Se、Cu2Se、PbSO4等)是一种含贵金属的可再生资源,回收贵金属的化工流程如图所示。
已知:①当某离子的浓度低于1.0×10-5 mol/L时,可忽略该离子的存在;
②AgCl+Cl-??,\s\up6())- K=2.0×10-5;
③Na2SO3易从溶液中结晶析出;
④不同温度下Na2SO3的溶解度如下:
温度/℃ 0 20 40 60 80
溶解度/g 14.4 26.1 37.4 33.2 29.0
(1) Cu属于______区元素,其基态原子的价层电子排布式为_____________________。
(2) “滤液1”中含有Cu2+和H2SeO3,“氧化酸浸”时Cu2Se反应的离子方程式为_________________________________________________________________________________________。
(3) “氧化酸浸”和“除金”工序均需加入一定量的NaCl:
①在“氧化酸浸”工序中,加入适量NaCl的原因是_______________________________________。
②在“除金”工序溶液中,Cl-浓度不能超过_________ mol/L。
(4) 在“银转化”体系中,[Ag(SO3)2]3-和[Ag(SO3)3]5-浓度之和为0.075 mol/L,两种离子分布分数δ随SO浓度的变化关系如图所示。若SO浓度为1.0 mol/L,则5-的浓度为____________ mol/L。
(5) 滤液4中溶质主要成分为__________________(填化学式);在连续生产的模式下,“银转化”和“银还原”工序需在40 ℃左右进行,若反应温度过高,将难以实现连续生产,原因是_________________________________________________________________________________________________________________________。
6. (2024·山东卷)以铅精矿(含PbS,Ag2S等)为主要原料提取金属Pb和Ag的工艺流程如下:
(1) “热浸”时,难溶的PbS和Ag2S转化为2-和-及单质硫。溶解等物质的量的PbS和Ag2S时,消耗Fe3+物质的量之比为_________;溶液中盐酸浓度不宜过大,除防止“热浸”时HCl挥发外,另一目的是防止产生_________(填化学式)。
(2) 将“过滤Ⅱ”得到的PbCl2沉淀反复用饱和食盐水热溶,电解所得溶液可制备金属Pb。“电解Ⅰ”阳极产物用尾液吸收后在工艺中循环使用,利用该吸收液的操作单元为______。
(3) “还原”中加入铅精矿的目的是_____________________________________________。
(4) “置换”中可选用的试剂X为___(填字母)。
A. Al B. Zn
C. Pb D. Ag
“置换”反应的离子方程式为____________________________________________________。
(5) “电解Ⅱ”中将富银铅泥制成电极板,用作______(填“阴极”或“阳极”)。
7. (2024·新课标卷)钴及其化合物在制造合金、磁性材料、催化剂及陶瓷釉等方面有着广泛应用。一种从湿法炼锌产生的废渣(主要含Co、Zn、Pb、Fe的单质或氧化物)中富集回收得到含锰高钴成品的工艺如下:
已知溶液中相关离子开始沉淀和沉淀完全(c≤1.0×10-5 mol/L)时的pH:
相关离子 Fe3+ Fe2+ Co3+ Co2+ Zn2+
开始沉淀的pH 1.5 6.9 — 7.4 6.2
沉淀完全的pH 2.8 8.4 1.1 9.4 8.2
(1) “酸浸”前废渣需粉碎处理,目的是__________________________________________________;
“滤渣1”中金属元素主要为______。
(2) “过滤1”后的溶液中加入MnO2的作用是_______________________________________ _________________________________________________________。
取少量反应后的溶液,加入化学试剂________________________________检验____________,若出现蓝色沉淀,需补加MnO2。
(3) “氧化沉钴”中氧化还原反应的离子方程式为______________________________________ ___________________________________________________________________________________________、_______________________________________________________________________________________。
(4) “除钴液”中主要的盐有__________________________(写化学式),残留的Co3+浓度为_____________________mol/L。
大单元整合 提能力验考情八
[能力提升]
提升1 1. SiO2 CaCO3、Ca(OH)2 SiO2、Cu Al(OH)3
提升2 会造成后续调pH时消耗过多试剂
会造成后续调pH时消耗过多试剂
溶解度越小 Na 2SO3被空气中的O2氧化
pH太小,溶液中的F-与H+结合生成HF,使溶液中的F-浓度减小
pH太小,溶液中的S2-与H+结合生成HS-、H2S,使溶液中的S2-浓度减小
提升3 例 3~8
【解析】 Fe3+除净时,c(OH-)==mol/L=1×10-11 mol/L,pH=3;锰离子开始沉淀时,c(OH-)== mol/L=1×10-6 mol/L,pH=8,故应调节pH的范围是3~8
提升4 N2、H2 硫酸 母液、CO2
[高考新视野]
1. C 【解析】 H3PO4和Na2CO3先发生反应,通过加入X调节pH,使产物完全转化为Na2HPO4,通过结晶、过滤、干燥,最终得到Na2HPO4·12H2O成品。铁是较活泼金属,可与H3PO4反应生成氢气,故“中和”工序若在铁质容器中进行,应先加入Na2CO3溶液,A正确;若“中和”工序加入Na2CO3过量,则需要加入酸性物质来调节pH,为了不引入新杂质,可加入H3PO4;若“中和”工序加入H3PO4过量,则需要加入碱性物质来调节pH,为了不引入新杂质,可加入NaOH,所以“调pH”工序中X为NaOH或H3PO4,B正确;“结晶”工序中的溶液为饱和Na2HPO4溶液,HPO的水解常数Kh==≈1.6×10-7,由于Kh>Ka3,则Na2HPO4的水解程度大于电离程度,溶液显碱性,C错误;由于Na2HPO4·12H2O易风化失去结晶水,故“干燥”工序需要在低温下进行,D正确。
2. (1) 2Al2O3(熔融)4Al+3O2↑
(2) Ga3++4Cl-===[GaCl4]- (3) 铁 [FeCl4]- (4) 高 NaCl (5) 3.2 4.0×10-7
【解析】 电解铝的副产品炭渣(含C、Na、Al、F和少量的Ga、Fe、K、Ca等元素)进行“焙烧”,金属转化为氧化物,焙烧后的固体加入盐酸“浸取”,浸取液加入铝片是将Fe3+进行“还原”,得到原料液,原料液用“LAEM提取”,[GaCl4]-通过交换膜进入Ⅱ室并转化为Ga3+,Ⅱ室溶液进一步处理得到镓,Ⅰ室溶液加入含F-的废液“调pH”并结晶得到NaAlF6晶体用于电解铝。(3) 由信息知浸取液中,Ga(Ⅲ)和Fe(Ⅲ)以[MClm](m-3)-(m=0~4)粒子形式存在,LAEM是一种新型阴离子交换膜,允许带负电荷的配离子从高浓度区扩散至低浓度区,为了避免铁元素的配离子通过LAEM,故要先加入铝片还原Fe3+,从而有利于Ga的分离。(4) “LAEM提取”中,原料液的Cl-浓度越高,更有利于生成[GaCl4]-的反应正向移动,更有利于Ga的提取,在不提高原料液酸度的前提下,同时又不引入新杂质,可向Ⅰ室中加入NaCl,以提高Cl-浓度,进一步提高Ga的提取率。(5) 由pKa(HF)=3.2,Ka(HF)==10-3.2,为了使溶液中c(F-)>c(HF),故c(H+)<10-3.2 mol/L,故pH至少应大于3.2,有利于[AlF6]3-配离子及Na3AlF6晶体的生成。若“结晶”后溶液中c(Na+)=0.10 mol/L,根据Na3 AlF6(冰晶石)的Ksp=4.0×10-10,[AlF6]3-== mol/L=4.0×10-7 mol/L。
3. (1) 四 ⅠB (2) Cu2+
(3) 2Au+8HCl+3H2O2===2HAuCl4+6H2O (4) AgCl
(5) [Ag(S2O3)2]3-+e-===Ag↓+2S2O Na2S2O3
(6) 3∶4 (7) (a)结构中电子云分布较均衡,结构较为稳定,(b)结构中正、负电荷中心不重合,极性较大,较不稳定,且存在过氧键,过氧键的氧化性大于I2,故Na2S2O3不能被I2氧化成(b)结构
【解析】 (3) “浸取2”步骤中,Au与盐酸、H2O2发生氧化还原反应,生成HAuCl4和H2O,根据得失电子守恒及原子守恒,可得反应的化学方程式。(4) 浸渣2中含有AgCl,与Na2S2O3反应转化为[Ag(S2O3)2]3-。(5) “电沉积”步骤中,阴极发生还原反应,[Ag(S2O3)2]3-得电子被还原为Ag,电极反应式为[Ag(S2O3)2]3-+e-===Ag↓+2S2O;阴极反应生成S2O,同时阴极区溶液中含有Na+,故“电沉积”步骤完成后,阴极区溶液中可循环利用的物质为Na2S2O3。(6)“还原”步骤中, HAuCl4被还原为Au,Au元素的化合价由+3变为0,一个HAuCl4转移3个电子,N2H4被氧化为N2,N元素的化合价由-2变为0,一个N2H4转移4个电子,根据得失电子守恒,被氧化的N2H4与产物Au的物质的量之比为3∶4。
4. (1) (2) 快速冷却 (3) 出现白色浑浊,后迅速消失 (4) BeA2(HA)2+6NaOH===Na2[Be(OH)4]+4NaA+2H2O 反萃取、分液 (5) 增强熔融氯化铍的导电性
(6)C12H18Be4O13
【解析】 铝硅酸盐先加热熔融,然后快速冷却到其玻璃态,再加入稀硫酸酸浸过滤,滤渣的成分为H2SiO3,“滤液1”中有Be2+和Al3+,加入含HA的煤油将Be2+萃取到有机相中,水相1中含有Al3+,有机相为BeA2(HA)2,加入过量氢氧化钠反萃取Be2+使其转化为Na2[Be(OH)4]进入水相2中,分离出含NaA的煤油,最后对水相2加热过滤,分离出Be(OH)2,通过系列操作得到金属铍。(2) 熔融态物质冷却凝固时,缓慢冷却会形成晶体,快速冷却会形成非晶态,即玻璃态。(3) “滤液1”中有Be2+和Al3+,加入含HA的煤油将Be2+萃取到有机相中,则水相1中含有Al3+,则向过量烧碱的溶液中逐滴加入少量水相1的溶液,出现白色浑浊,后迅速消失。(4) 滤液2的主要成分为NaOH,可进入反萃取步骤再利用。(6)由题意可知,该配合物中有4个铍位于四面体的四个顶点上,四面体中心只有一个O,Be与Be之间总共有6个CH3COO-,则其结构简式为Be4O(CH3COO)6,化学式为C12H18Be4O13。
5. (1) ①ds 3d104s1
(2) Cu2Se+4H2O2+4H+===2Cu2++H2SeO3+5H2O (3) ①使银元素转化为AgCl沉淀 ② 0.5 (4) 0.05
(5) Na2SO3 高于40 ℃后,Na2SO3的溶解度下降,“银转化”和“银还原”的效率降低,难以实现连续生产
【解析】 (3) ②在“除金”工序溶液中,根据反应AgCl+Cl--,若Cl-加入过多,AgCl则会转化为-,当某离子的浓度低于1.0×10-5 mol/L时,可忽略该离子的存在,为了不让AgCl发生转化,则令c{[AgCl2]-}=1.0×10-5 mol/L,由K==2.0×10-5,可得c=0.5 mol/L,即Cl-浓度不能超过0.5 mol/L。(4) 在“银转化”体系中,3-和5-浓度之和为0.075 mol/L,溶液中存在平衡关系:3-+SO??5-,当c(SO)=0.5 mol/L时,此时c=c=0.037 5 mol/L,则该平衡关系的平衡常数K===2,当c(SO)=1 mol/L时,K===2,解得此时c=0.05 mol/L。(5) 滤液4中溶质主要成分为Na2SO3;由不同温度下Na2SO3的溶解度可知,高于40 ℃后,Na2SO3的溶解度下降,“银转化”和“银还原”的效率降低,难以实现连续生产。
6. (1) 1∶1 H2S (2) 热浸 (3) 将过量的Fe3+还原为Fe2+ (4) C Pb+2[AgCl2]-===2Ag+[PbCl4]2-
(5) 阳极
【解析】 (1) “热浸”时,Fe3+将PbS和Ag2S中-2价的硫氧化为单质硫,Fe3+被还原为Fe2+,在这个过程中Pb和Ag的化合价保持不变,所以等物质的量的PbS和Ag2S时,S2-物质的量相等,所以消耗Fe3+的物质的量相等,比值为1∶1;溶液中盐酸浓度过大,这里主要考虑氢离子浓度会过大,会生成H2S 气体。(2) “过滤Ⅱ”得到的PbCl2沉淀反复用饱和食盐水热溶,会溶解为2-,电解2-溶液制备金属Pb,Pb在阴极产生,阳极Cl-放电产生Cl2, 尾液成分为FeCl2,FeCl2吸收Cl2后转化为FeCl3,可以在热浸中循环使用。(3) 过滤Ⅱ所得的滤液中有过量的未反应的Fe3+,根据还原之后可以得到含硫滤渣,“还原”中加入铅精矿的目的是将过量的Fe3+还原为Fe2+。(4) “置换”中加入试剂X可以得到富银铅泥,为了防止引入其他杂质,则试剂X应为Pb,发生的反应为Pb+2[AgCl2]-===2Ag+[PbCl4]2-。(5) “电解Ⅱ”中将富银铅泥制成电极板,“电解Ⅱ”得到金属银和金属铅,将银和铅分离出来,阳极放电,银变成阳极泥而沉降下来,铅失电子为Pb2+,阴极得电子得到Pb,所以电极板应作阳极。
7. (1) 增大固液接触面积,加快酸浸速率,提高浸取效率 Pb (2) 将溶液中的Fe2+氧化为Fe3+,以便在后续调pH时除去Fe元素 K3[Fe(CN)6]溶液 Fe2+ (3) 3Co2++MnO+7H2O===3Co(OH)3↓+MnO2↓+5H+ 3Mn2++2MnO+2H2O===5MnO2↓+4H+
(4) ZnSO4 、K2SO4 10-16.7
【解析】 (3) “氧化沉钴”,加入强氧化剂KMnO4,将溶液中Co2+氧化为Co3+,在pH=5时Co3+形成Co(OH)3沉淀,而KMnO4则被还原为MnO2,KMnO4还会与溶液中的Mn2+发生归中反应生成MnO2,得到Co(OH)3和MnO2的混合物。(4) 最终得到的“除钴液”中含有的金属离子主要是加入ZnO调pH时引入的Zn2+、加入KMnO4“氧化沉钴”时引入的K+,而阴离子是在“酸浸”时引入的SO,因此其中主要的盐有ZnSO4和K2SO4;由表可知,当溶液pH=1.1时,Co3+恰好完全沉淀,此时溶液中c(Co3+)=1.0×10-5 mol/L,c(OH-)=10-12.9 mol/L,则Ksp[Co(OH)3]=1.0×10-5×(10-12.9)3=10-43.7,“除钴液”的pH=5,即c(H+)=10-5 mol/L,则c(OH-)=10-9 mol/L,此时溶液中c(Co3+)== mol/L=10-16.7 mol/L。
同课章节目录
