大单元八 化学工艺流程 第26讲 化学工艺流程 学案 (含答案)2026届高三化学一轮大单元复习
文档属性
| 名称 | 大单元八 化学工艺流程 第26讲 化学工艺流程 学案 (含答案)2026届高三化学一轮大单元复习 |  | |
| 格式 | DOC | ||
| 文件大小 | 916.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-15 10:58:52 | ||
图片预览




文档简介
大单元八 化学工艺流程
第26讲 化学工艺流程
备考导航
复习目标 1. 认识化学在海水、金属矿物等自然资源综合利用和实现物质间转化等方面的实际应用。2. 认识常见无机物在生产中的应用和对生态环境的影响。
熟记网络
课前自测 判断正误(正确的打“√”,错误的打“×”)。(1) “水浸”时适当升高温度和搅拌有利于加快浸取的速率( )(2) “调pH”沉铁时,加入Na2CO3溶液,目的是使Fe3+转化为Fe2(CO3)3沉淀( )(3) 菱锌矿的主要成分为ZnCO3,菱锌矿焙烧生成ZnO的化学方程式为 ZnCO3ZnO+CO2↑ ( )(4) 已知:水合肼(N2H4·H2O)不稳定,具有强还原性。制备水合肼时应将氨水逐滴滴入NaClO溶液中 ( )(5) 钪的萃取率(E%)与O/A值[萃取剂体积(O)和废酸液体积(A)之比]的关系如图,应选择最合适的O/A值为 1∶2 ( )
考点1 原料的预处理
知 识 梳 理
流程基本结构
原料的预处理
1. 粉碎
(1) 目的:将块状或颗粒状的物质磨成粉末,增大反应物接触面积,加快反应速率。
(2) 过筛的目的:控制颗粒大小。
2. 灼烧、焙烧
(1) 除去挥发性物质;除去C、S等单质。
(2) 除去有机物、铵盐等。
(3) 高温下,原料与空气中的氧气反应,使一些物质在高温下氧化。如4FeS2+11O22Fe2O3+8SO2、2MS+3O22MO+2SO2(M代表某些金属元素)。
(4) 除去某些受热不稳定的杂质。如MCO3MO+CO2↑、M(OH)2MO+H2O(M代表某些金属元素)。
3. 浸取
(1) 水浸:与水接触反应或溶解,使原料变成离子进入溶液中。
(2) 酸浸:加入酸使可溶性金属离子进入溶液,不溶物通过过滤除去。
①酸还能溶解金属及其氧化物(膜)。
②用盐酸、硝酸酸溶时,要注意控温。
③用硫酸酸溶时,要注意Pb2+、Ca2+、Ag+会生成PbSO4、 CaSO4、Ag2SO4进入滤渣。
④酸溶时,酸不能加入过多,否则会造成后续调pH时多加入碱。
⑤酸溶时,盐酸不能加过多,否则可能会与后续加入的KMnO4等氧化剂反应,生成有毒气体Cl2。
(3) 碱浸:常用NaOH溶液、氨水、Na2CO3溶液等,使其中可溶性的物质溶解。
①NaOH、Na2CO3溶液还能除去油污。
② NaOH溶液能溶解两性化合物(如Al2O3、ZnO)。
③NaOH溶液能溶解SiO2、Al、Zn等。
④氨水还能与金属离子形成配离子进入溶液。
⑤碱溶时,碱不能加入过多,否则会造成后续调pH时多加入酸。
(4) 盐浸:用铵盐溶液、FeCl3溶液溶解。
(5) 提高浸出率的措施:
①将矿石粉碎;
②适当加热;
③充分搅拌;
④适当提高浸取液的浓度;
⑤适当延长浸取时间等。
典 题 悟 法
(2023·海安期初)某研究小组欲从废旧电路板(主要含有Fe、Cu、SnO2、PbO2、塑料等)中回收金属锡,流程如图。已知:SnO2、PbO2可与NaOH共热反应生成易溶于水的Na2SnO3和Na2PbO3。下列说法错误的是( )
A. 废旧电路板“粉碎”目的是为了焙烧时与O2充分反应
B. 滤渣的主要成分是Fe(OH)3和Cu(OH)2
C. 水热法过程中发生反应:SnO+H2OSnO2↓+2OH-
D. 若得到干燥的PbS和S的固体混合物27.1 g,则反应①有0.2 mol电子转移(Pb—207、S—32)
考点2 控制条件除杂
知 识 梳 理
沉淀法
1. 调pH法
(1) 调高pH:加入消耗H+的物质(碱、氧化物、碳酸盐、碱式碳酸盐等)。
①如除去Al3+、Fe3+,可以调高pH,使其分别转化成Al(OH)3沉淀、Fe(OH)3沉淀。
②如除去CuSO4溶液中混有的Fe3+,可加入_________________________________________________ ____________________________等调节溶液的pH至3~4,使 Fe3+转化为 Fe(OH)3沉淀除去。离子方程式为________________________________________________________________________________________ _____________________________,不可加入NaOH溶液、氨水等。
(2) 调低pH:加入消耗OH-的物质(盐酸、硫酸、CO2、NH等)。
如除去SiO、[Al(OH)4]-,可以调低pH,使其分别转化成H2SiO3沉淀、Al(OH)3沉淀。
(3) pH范围的选择:杂质离子完全沉淀时pH~主要离子开始沉淀时pH。如Fe(OH)3、Zn(OH)2开始沉淀至沉淀完全时的pH范围分别为1.5~3.3、5.4~8.2,则要除去Zn2+溶液中的Fe3+,应控制溶液的pH范围为_____________________。
(4) pH不能过高或过低:过低会导致某些离子沉淀不完全;过高可能会导致主体离子损失。生成两性物质时,pH也不宜过高或过低。
2. 形成氟化物沉淀
(1) 如除去Mg2+、Ca2+,可以加入NaF,使其分别转化成MgF2沉淀、CaF2沉淀。注意溶液pH不宜过低,原因是________________________________________________________________________________ __________________________________________________________________________________________________________________________________________________________________________________。
(2) 如除去Mn2+中的Mg2+,因MgF2比MnF2更难溶,故可加入MnF2形成MgF2沉淀,利用沉淀转化除去Mg2+。
3. 形成硫化物沉淀
(1) 如除去Cu2+、Zn2+、Fe2+、Hg2+,可以加入Na2S,使其分别转化成CuS沉淀、ZnS沉淀、FeS沉淀、HgS沉淀。用Na2S 除Cu2+,pH过低时,Cu2+去除率低,原因是_____________________________ _________________________________________________________。
(2) 用一些溶解度较大的硫化物(如FeS、MnS)通过沉淀转化使某些金属离子转化为更难溶的硫化物。
4. 氧化还原沉淀法
(1) 用单质进行置换,如可用Zn置换Cu2+。
(2) 加入氧化剂(或还原剂)使某些粒子转化为沉淀,如:
KMnO4除铁:MnO+3Fe2++7H2O===3Fe(OH)3↓+MnO2↓+5H+。
Na2SO3沉铜:2Cu2++SO+2Cl-+H2O===2CuCl↓+SO+2H+。
双氧水氧化沉淀转化:CuS+H2O2+H2SO4===CuSO4+S+2H2O。
MnO2氧化沉淀转化:MnO2+MnS+2H2SO4===2MnSO4+S+2H2O。
Fe3+氧化沉淀转化:2Fe3++Pb+SO===PbSO4+2Fe2+。
5. 碳酸盐沉淀法
(1) 用Na2CO3沉淀Zn2+,离子反应为
Zn2++CO===ZnCO3↓。
(2) 用NH4HCO3沉淀Co2+,离子反应为
_________________________________________________________________________。
(3) 用NH4HCO3-氨水沉淀Mn2+,离子反应为________________________________________________ _____________________________________________________________________________________________________________________。
(4) 用NH3(先)+CO2(后)沉淀Ca2+,离子反应为Ca2++CO2+2NH3+H2O===CaCO3↓+2NH。
[注意]
①M2++2HCO===MCO3↓+H2O+CO2↑(M2+为Ca2+、Mn2+、Co2+、Ni2+、Fe2+)。
②Cu2+、Zn2+与HCO反应生成碱式碳酸盐沉淀,如:
6HCO+3Zn2+===ZnCO3·2Zn(OH)2·H2O↓+5CO2↑
6. 草酸盐沉淀法
如Ca2++C2O===CaC2O4↓
7. 硫酸盐沉淀法
(1) Ca2++SO===CaSO4
(2) BaCO3沉淀转化硫酸盐沉淀:BaCO3+SO+2H3PO4===BaSO4+CO2↑+H2O+2H2PO
萃取与反萃取法
1. 萃取:利用溶质在互不相溶的溶剂里的溶解度不同提取分离物质。萃取常见考查角度:
(1) 萃取操作
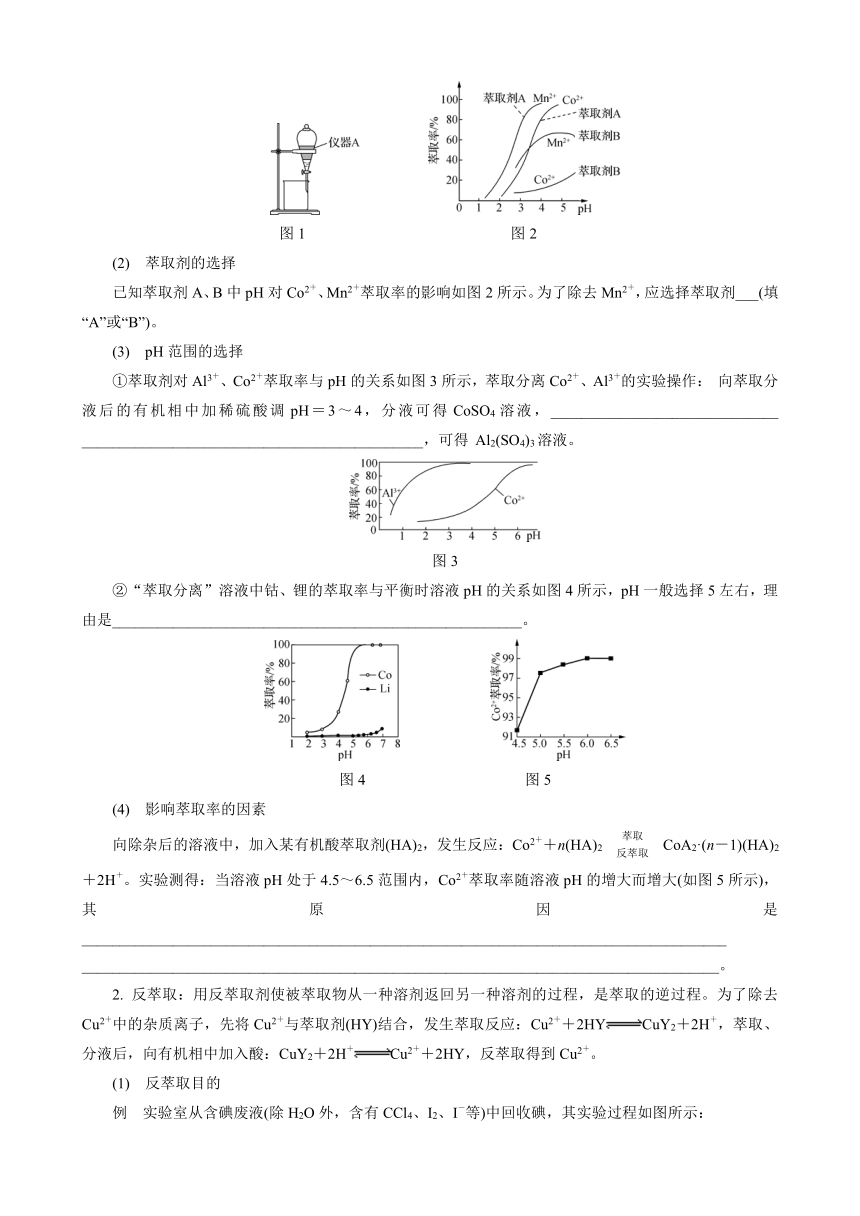
如用CCl4或苯萃取溴水中的溴,用如图1所示的实验装置进行萃取分液,以除去溶液中的Fe3+。为使Fe3+尽可能多地从水相转移至有机相,采取的实验操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,____________、静置、分液,并重复多次。
图1 图2
(2) 萃取剂的选择
已知萃取剂A、B中pH对Co2+、Mn2+萃取率的影响如图2所示。为了除去Mn2+,应选择萃取剂___(填“A”或“B”)。
(3) pH范围的选择
①萃取剂对Al3+、Co2+萃取率与pH的关系如图3所示,萃取分离Co2+、Al3+的实验操作: 向萃取分液后的有机相中加稀硫酸调pH=3~4,分液可得CoSO4溶液,______________________________ _____________________________________________,可得 Al2(SO4)3溶液。
图3
②“萃取分离”溶液中钴、锂的萃取率与平衡时溶液pH的关系如图4所示,pH一般选择5左右,理由是______________________________________________________。
图4 图5
(4) 影响萃取率的因素
向除杂后的溶液中,加入某有机酸萃取剂(HA)2,发生反应:Co2++n(HA)2CoA2·(n-1)(HA)2+2H+。实验测得:当溶液pH处于4.5~6.5范围内,Co2+萃取率随溶液pH的增大而增大(如图5所示),其原因是_____________________________________________________________________________________ ____________________________________________________________________________________。
2. 反萃取:用反萃取剂使被萃取物从一种溶剂返回另一种溶剂的过程,是萃取的逆过程。为了除去Cu2+中的杂质离子,先将Cu2+与萃取剂(HY)结合,发生萃取反应:Cu2++2HYCuY2+2H+,萃取、分液后,向有机相中加入酸:CuY2+2H+Cu2++2HY,反萃取得到Cu2+。
(1) 反萃取目的
例 实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如图所示:
向含碘废液中加入稍过量的 Na2SO3 溶液,将废液中的I2还原为I-,该操作的目的是_________________________________。
(2) 反萃取剂的选择
例 钒及其化合物在工业上有许多用途。从废钒(主要成分为V2O3、V2O5、Fe2O3、FeO、SiO2)中提取V2O5的一种工艺流程如图:
已知:①VOSO4能溶于水,VO2+与Fe不能反应;②有机溶剂H2R对VO2+及Fe3+萃取率高,但不能萃取Fe2+。
“溶剂萃取与反萃取”可表示为VO2++H2RVOR+2H+。为了提高VO2+的产率,反萃取剂可选用___(填字母)。
A. NaCl B. NaOH C. H2SO4
(3) “萃取”和“反萃取”目的
例 由钼精矿(主要成分是MoS2)湿法回收钼酸铵[(NH4)2MoO4]部分工艺流程如图:
“滤液2”先加入有机溶剂“萃取”,再加氨水“反萃取”,进行“萃取”和“反萃取”操作的目的是_____________________________________________________________________。
(4) 反萃取操作
向溶解、过滤后所得滤液中加入萃取剂,萃取后分液获得有机层和水层。
例 萃取时发生反应:M2++2RHMR2+2H+(M表示Ni2+或Fe2+,RH表示萃取剂)。萃取剂体积V0与溶液体积VA的比值(V0/VA)对溶液中Ni2+和Fe2+萃取率的影响如图所示。通过反萃取可获得NiSO4溶液并回收萃取剂。
萃取时应控制V0/VA的比值为____________;反萃取获得NiSO4溶液的实验操作是__________________ _____________________________________________。
典 题 悟 法
(2023·常州中学)陶瓷工业中钴系色釉具有呈色稳定、呈色强度高等优点,利用含钴废料(主要成分为Co3O4,还含有少量的铝箔,LiCoO2等杂质)制备碳酸钴的工艺流程如图:
下列有关描述错误的是( )
A. “滤液①”主要成分是Na[Al(OH)4]
B. “操作①”“操作②”的分离方法不同
C. “酸溶”反应中H2O2可以换成O2
D. “沉钴”时,Na2CO3的滴速过快或浓度太大将导致产品不纯,其原因是溶液碱性增强会产生Co(OH)2杂质
(2023·华罗庚中学)工业上以铬铁矿(FeCr2O4,含Al、Si氧化物等杂质)为主要原料制备红矾钠(Na2Cr2O7·2H2O)的工艺流程如图。回答下列问题:
(1) “焙烧”的目的是将FeCr2O4转化为Na2CrO4并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是______________________________________________________。
(2) 矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图1所示。当溶液中可溶性组分浓度c≤1.0×10-5 mol/L时,可认为已除尽。
图1
“中和”时pH的理论范围为_______________________;“酸化”的目的是______________________ _______________________________________________________________________________;Fe元素在______(填操作单元的名称)过程中除去。
(3) “蒸发结晶”时,过度蒸发将导致________________________;冷却结晶所得母液中,除Na2Cr2O7外,可在上述流程中循环利用的物质还有_________。
(4) 利用膜电解技术(装置如图2所示),以Na2CrO4为主要原料制备Na2Cr2O7的总反应化学方程式为4Na2CrO4+4H2O2Na2Cr2O7+4NaOH+2H2↑+O2↑。则Na2Cr2O7在___(填“阴”或“阳”)极室制得,电解时通过离子交换膜的离子主要为_________。
图2
考点3 工艺流程中加入试剂的作用
知 识 梳 理
加氧化剂或还原剂
1. 转变某种金属离子的价态,再通过调节溶液pH,使金属离子以氢氧化物形式沉淀出来,以达到除去杂质的目的[如Fe2+―→Fe3+―→Fe(OH)3]。
2. 为生成目标产物的价态而加入氧化剂(如在碱性条件下,加入H2O2将Cr3+氧化成CrO)。
3. 常见氧化剂:KMnO4、H2O2、空气(O2)、Cl2、次氯酸盐、ClO2、ClO、MnO2、HNO3、Fe3+等。
4. 常见还原剂:金属单质、SO2(SO)、I-、Fe2+、H2O2、HCl、H2C2O4等。
通入空气
1. 氧化某些离子(如SO、Fe2+)。
2. 起搅拌作用。
加有机溶剂
萃取某些物质或降低某些物质的溶解度。
蒸发结晶时加对应酸抑制水解
如从溶液中析出FeCl3、CuCl2、AlCl3、MgCl2、ZnCl2等晶体时,应在HCl气流中加热,以抑制其水解。
①H2O2是绿色氧化剂,无污染,但需注意H2O2受热易分解;Fe3+、Cu2+能催化H2O2分解。
②用SO2还原MnO、Fe3+等离子时,温度不宜过高,温度越高,SO2溶解度越小。
③用Na2SO3还原MnO2、Fe3+等时,Na2SO3实际用量高于理论量,原因是Na2SO3被空气部分氧化。
④判断能否加其他物质,要考虑是否引入杂质(或影响产物的纯度)等。
典 题 悟 法
(2023·高邮调研)室温时,实验室以含铬废液(主要离子含K+、Fe3+、Cr3+、SO)制取含K2Cr2O7溶液的流程如下:
已知:①室温时,Ksp=6×10-31,Ksp=4×10-38;②假设溶液中某离子浓度≤1×10-6mol/L时,该离子沉淀完全;③“氧化”时Cr3转化为CrO。下列说法正确的是( )
A. “过滤Ⅰ”所得滤液中c=6×10-7mol/L
B. “氧化”时的离子方程式为2Cr3+3H2O2===2CrO+4H2O+4H+
C. “酸化”时溶液pH越低,CrO转化为Cr2O的转化率越低
D. 将“含K2Cr2O7的溶液”蒸干不能得到纯净的K2Cr2O7固体
考点4 工艺流程中反应条件的控制
知 识 梳 理
加过量试剂
反应物过量,能保证反应的完全发生或提高其他物质的转化率,但可能引入杂质,增加后续处理成本(关注后续化学反应)。
气体氛围
1. 隔绝空气:防止空气中的组分(如氧气)参与反应。
2. HCl氛围:抑制弱离子的水解。
3. 惰性气体氛围:通入Ar、N2、H2等,防止某些物质被氧化。
热空气(或水蒸气)吹出气体
如海水提溴、凯氏定氮。
控制溶液的pH
1. 增强物质(MnO、NO等)的氧化性或还原性。
2. 调节离子的水解程度。
3. 萃取、离子交换可能有pH要求。
4. 沉淀某些金属阳离子。
控制温度
1. 温度对物质性质的影响
(1) 关注易分解物质:双氧水、氨水、铵盐、硝酸、次氯酸、硝酸盐、草酸、草酸盐以及信息中给出的易分解物质。
(2) 关注易挥发物质:氨水、硝酸、盐酸等易挥发物质以及沸点较低物质。
(3) 关注易被氧化物质:Na2S、Na2SO3、KI、含Fe(Ⅱ)的化合物、酚类、醛类以及信息中给出的易被氧化物质。
(4) 关注物质的溶解度:若固体物质的溶解度随温度升高而增大,则降温能促使产品析出;若固体物质的溶解度随温度升高而减小,则升温能促使产品析出;气体的溶解度随温度升高而减小。
2. 温度在反应原理中的影响
(1) 温度对反应速率或固体溶解速率的影响
①制备物质时,常使用加热的方法加快反应速率。
②原料的预处理阶段,升温可以提高浸取速率。
(2) 温度对平衡移动、反应物转化率或生成物产率的影响
①正反应吸热的可逆反应,升温使平衡正向移动,有利于提高反应物的平衡转化率,从而提高产物的产率。
②正反应放热的可逆反应,升高温度不利于反应物平衡转化率的提高,不利于提高产物的产率。
③升温促进盐类水解,有利于生成沉淀(胶体聚沉后利于过滤分离)。
(3) 温度对催化剂活性的影响
如合成氨或SO2催化氧化生成SO3时,选择的温度是500 ℃左右,原因之一就是该温度范围内催化剂的活性最强。
(4) 温度对副反应发生的影响
很多有机反应过程一般较为复杂,对温度的控制尤为关键,如实验室制取乙烯、硝基苯等,控制温度都是为了防止副反应的发生。
3. 控制温度在一定范围内的答题角度
(1) 控制反应速率、适宜的温度使催化剂的活性最大、防止副反应的发生。
(2) 控制化学反应进行的方向,使化学平衡移动。
(3) 升温:使溶液中的气体逸出,使易挥发物质挥发,使易分解的物质分解。
(4) 控制温度结晶与过滤。
(5) 能源的利用(耗能);生产安全(温度过高,反应过于剧烈,可能有安全问题)等。
4. 控温方法
(1) 缓慢加入××溶液或缓慢通入××气体。
(2) 水浴(热水浴、冰水浴等)、油浴、沙浴等。
典 题 悟 法
(2023·徐州铜山期中)由碳酸锰矿(主要成分MnCO3,还含有FeCO3、MnO2、Al2O3、SiO2等)提取金属锰的一种流程如图。下列有关说法正确的是( )
A. “酸浸”中,FeCO3溶于稀硫酸的离子方程式:CO+2H+===H2O+CO2↑
B. “除铁、铝”中,温度越高,越有利于除铁、铝
C. 滤渣Ⅱ的主要成分为Fe(OH)2和Al(OH)3
D. “电解浸出”过程中,溶液的pH变小
1. (2024·南京江宁期初)某工厂采用如下工艺制备Cr(OH)3,已知焙烧后Cr元素以+6价形式存在。下列说法错误的是( )
A. “焙烧”中产生CO2
B. 滤渣的主要成分为Fe(OH)2
C. 滤液①中Cr元素的主要存在形式为CrO
D. 淀粉水解液中的葡萄糖起还原作用
2. (2024·如皋期初)硫酸钾是一种重要的无氯优质钾肥,利用某高钾明矾石制备硫酸钾的工艺流程如下:
已知:高钾明矾石的主要成分为K2SO4·Al23·2Al2O3·H2O和少量Fe2O3。下列说法正确的是( )
A. “焙烧”时Al23反应的化学方程式为2Al23+3S===2Al2O3+9SO3
B. “调节pH”的目的是使Fe3+和Al3+完全沉淀
C. 化合物Y可制成铝热剂用于焊接铁轨
D. SO3可回收利用后应用于本流程
3. (2023·海安期中)从砷化镓废料(主要成分为GaAs、Fe2O3、SiO2和CaCO3)中回收镓和砷的工艺流程如图所示。
下列说法错误的是( )
A. “碱浸”前,废料先浆化为悬浊液的目的是提高Ga、As元素浸出率
B. “碱浸”后,溶液中主要离子有Ga3+、Na+、SiO、AsO
C. 滤渣Ⅱ的成分为Ga3和H2SiO3
D. 电解后的尾液中溶质主要成分为H2SO4,可以循环利用
4. (2023·苏锡常镇一模)钴的氧化物常用于制取催化剂和颜料等。以含钴废料(含Co2O3和少量Fe、Al、Mn、Ca、Mg等的氧化物及活性炭)为原料制取钴的氧化物的流程如下。
已知:萃取时发生的反应为Co2++n(HA)2CoA2·(n-1)(HA)2+2H+。
(1) 除Fe、Al:先加入NaClO3溶液,再加入Na2CO3溶液调节pH。写出NaClO3氧化Fe2+的离子方程式:______________________________________________________________________________________。
(2) 除Ca、Mg:当某离子浓度c≤1×10-6 mol/L时,认为该离子已除尽。
①为使Ca2+、Mg2+除尽,必须保持溶液中c(F-)≥____________mol/L。
②若调节溶液的pH偏低,将会导致Ca2+、Mg2+沉淀不完全,其原因是_________________________ ________________________________________________________________________________________________________________________________[Ksp(CaF2)=1.0×10-10,Ksp(MgF2)=7.4×10-11,Ka(HF)=3.5×10-4]。
(3) 萃取、反萃取:加入某有机酸萃取剂(HA)2,实验测得Co2+萃取率随pH的变化如图所示。向萃取所得有机相中加入H2SO4,反萃取得到水相。
①该工艺中设计萃取、反萃取的目的是__________________________________________。
②Co2+萃取率随pH升高先增大后减小的可能原因是_________________________________________ _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
第26讲 化学工艺流程
[备考导航]
(1) √ (2) × (3) √ (4) × (5) ×
考点1
[典题悟法]
典例1 B 【解析】 废旧电路板“粉碎”目的是焙烧时与O2充分反应,使反应更充分,A正确;铁、铜的氧化物不溶于碱,结合后续流程,滤渣的主要成分应为铁、铜的氧化物,B错误;“碱浸”过程中,SnO2与NaOH反应转化为SnO,水热法过程中发生反应:SnO+H2OSnO2↓+2OH-,C正确;若得到干燥的PbS和S的固体混合物27.1 g,反应①为PbO+2S2-+3H2O===PbS↓+S↓+6OH-,该反应中生成等物质的量的PbS和S,则生成0.1 mol硫单质,因此反应①有0.2 mol电子转移,D正确。
考点2
[知识梳理]
知识1
1. (1) ②CuO[或CuCO3或Cu(OH)2或Cu2(OH)2CO3] Fe3++3H2OFe(OH)3+3H+、CuO+2H+===Cu 2++H2O (3) 3.3~5.4
2. (1) F-与H+结合生成弱电解质HF,MgF2(s)Mg2+(aq)+2F-(aq)、CaF2(s)Ca2+(aq)+2F-(aq)平衡向右移动,Mg2+、Ca2+沉淀不完全
3. (1) S2-与H+结合生成HS-、H2S,使溶液中的S2-浓度降低 5. (2) Co2++2HCO===CoCO3↓+H2O+CO2↑
(3) Mn2++HCO+NH3·H2O===MnCO3↓+NH+H2O或Mn2++HCO+NH3===MnCO3↓+NH
知识2
1. (1) 充分振荡 (2) B (3) ①继续向萃取分液后的有机相加稀硫酸调pH≤1,然后分液 ②pH在5左右时,钴、锂的分离效率最高 (4) pH越大,溶液中c(H+)越小,有利于Co2++n(HA)2CoA2·(n-1)(HA)2+2H+反应正向进行,Co2+萃取率越高
2. (1) 例 使CCl4中的碘进入水层 (2) 例 C
(3) 例 富集钼酸根离子(或将钼酸根离子和其他杂质分离)
(4) 例 0.25 向有机层中加入硫酸,充分振荡后分液,取水层
[典题悟法]
典例2 C 【解析】 Al与NaOH溶液反应生成Na[Al(OH)4]和H2,“滤液①”主要成分是Na[Al(OH)4],A正确;“操作①”为过滤,“操作②”为萃取、分液,B正确;“酸溶”反应中H2O2作还原剂,H2O2不可以换成O2,C错误;“沉钴”时Na2CO3的滴速过快或浓度太大,溶液碱性增强,会产生Co(OH)2杂质,D正确。
典例3 (1) 增大反应物接触面积,提高化学反应速率 (2) 4.5≤pH≤9.3 使2CrO+2H+Cr2O+H2O平衡正向移动,提高Na2Cr2O7的产率 浸取 (3) 重铬酸钠提前析出 H2SO4 (4) 阳 Na+
【解析】 (2) “中和”时调节溶液pH的目的是将[Al(OH)4]-、SiO转化为沉淀过滤除去,由图可知,当溶液pH≥4.5时,Al3+除尽,当溶液pH>9.3时,H2SiO3会再溶解生成SiO,因此“中和”时pH的理论范围为4.5≤pH≤9.3。将Al元素和Si元素除去后,溶液中Cr元素主要以Cr2O和CrO存在,溶液中存在平衡:2CrO+2H+??Cr2O+H2O,降低溶液pH,平衡正向移动,可提高Na2Cr2O7产率;Fe元素在“浸取”操作中除去。(4) 阳极上水失电子生成H+和O2,2CrO+2H+Cr2O+H2O平衡右移,Cr2O在阳极室产生;阴极上H2O得电子生成OH-和H2,Na+通过离子交换膜。
考点3
[典题悟法]
典例4 D 【解析】 根据Ksp[Cr(OH)3]=c(Cr3+)·c3(OH-)=6×10-31,pH=8,c(OH-)=10-6 mol/L,c(Cr3+)==mol/L=6×10-13 mol/L,A错误;“氧化”过程Cr(OH)3转化为CrO,H2O2作氧化剂,溶液呈碱性,离子方程式为4OH-+2Cr(OH)3+3H2O2===2CrO+8H2O,B错误;2CrO+2H+Cr2O+H2O,“酸化”时溶液pH越低,CrO转化为Cr2O的转化率越大,C错误;“含K2Cr2O7的溶液”中有KCl,将“含K2Cr2O7的溶液”蒸干得不到纯净的K2Cr2O7固体,D正确。
考点4
[典题悟法]
典例5 D 【解析】 FeCO3不溶于水,不拆分为离子形式,A错误;H2O2受热易分解,温度过高时,不利于除铁铝,B错误;滤渣Ⅱ的主要成分为Fe(OH)3和Al(OH)3,C错误;由2MnSO4+2H2O2Mn+O2↑+2H2SO4知,D正确。
[质量评价]
1. B 【解析】 “焙烧”生成Fe2O3、CO2、Na2CrO4,滤渣的主要成分为Fe2O3,A正确、B错误、C正确;淀粉水解液中的葡萄糖将Cr(Ⅵ)还原为Cr(Ⅲ),D正确。
2. D 【解析】 “焙烧”时Al23反应的化学方程式为2Al23+4S+6O22Al2O3+10SO3,A错误;“调节pH”的目的是使[Al(OH)4]-转化为Al(OH)3沉淀,B错误;Al(OH)3灼烧生成Al2O3,Al2O3不可制铝热剂,C错误;SO3溶于水制得硫酸,溶液X为H2SO4,D正确。
3. B 【解析】 将废料先浆化为悬浊液,可以增大接触面积,提高Ga、As元素浸出率,A正确;“碱浸”后,Na[Ga(OH)4]、Na3AsO4、Na2SiO3进入浸出液中,溶液中主要离子有Na+、SiO、AsO、[Ga(OH)4]-,B错误;滤渣Ⅱ的成分为Ga3和H2SiO3,C正确;电解Ga2(SO4)3溶液生成Ga、氧气、硫酸,尾液中含有H2SO4,可以循环利用,D正确。
4. (1) 6Fe2++ClO+6H+===6Fe3++Cl-+3H2O (2) ①0.01 ②pH偏低,较多的F-与H+形成弱酸HF,导致溶液中F-浓度减小,使Ca2+、Mg2+不能完全转化为沉淀 (3) ①分离提纯并富集Co2+的浓度 ②当pH<6.5时,随着pH升高,溶液中c(H+)减小,平衡向正反应方向移动,更多的Co2+与萃取剂反应;当pH>6.5时,随着pH升高,溶液中c(OH-)增大,Co2+与OH-形成Co(OH)2沉淀
【解析】 (2) ①Ksp(CaF2)=1.0×10-10,Ksp(MgF2)=7.4×10-11,则CaF2的溶解度更大,使Ca2+除尽,则需要保证c(F-)≥= mol/L=0.01 mol/L。②若调节溶液的pH偏低,则c(H+)过大,F-与H+形成弱酸HF,而导致溶液中F-浓度减小,使Ca2+、Mg2+不能完全转化为沉淀。(3) ①该工艺中设计萃取、反萃取的目的是将Co2+从滤液中提取到有机层中,然后分液后再反萃取到水层中,实现Co2+的提纯和富集。②随着pH升高,c(H+)减小,Co2++n(HA)2CoA2·(n-1)(HA)2+2H+平衡正向移动,导致Co2+萃取率升高;若pH过高,则Co2+转化为Co(OH)2沉淀,导致Co2+萃取率下降。
第26讲 化学工艺流程
备考导航
复习目标 1. 认识化学在海水、金属矿物等自然资源综合利用和实现物质间转化等方面的实际应用。2. 认识常见无机物在生产中的应用和对生态环境的影响。
熟记网络
课前自测 判断正误(正确的打“√”,错误的打“×”)。(1) “水浸”时适当升高温度和搅拌有利于加快浸取的速率( )(2) “调pH”沉铁时,加入Na2CO3溶液,目的是使Fe3+转化为Fe2(CO3)3沉淀( )(3) 菱锌矿的主要成分为ZnCO3,菱锌矿焙烧生成ZnO的化学方程式为 ZnCO3ZnO+CO2↑ ( )(4) 已知:水合肼(N2H4·H2O)不稳定,具有强还原性。制备水合肼时应将氨水逐滴滴入NaClO溶液中 ( )(5) 钪的萃取率(E%)与O/A值[萃取剂体积(O)和废酸液体积(A)之比]的关系如图,应选择最合适的O/A值为 1∶2 ( )
考点1 原料的预处理
知 识 梳 理
流程基本结构
原料的预处理
1. 粉碎
(1) 目的:将块状或颗粒状的物质磨成粉末,增大反应物接触面积,加快反应速率。
(2) 过筛的目的:控制颗粒大小。
2. 灼烧、焙烧
(1) 除去挥发性物质;除去C、S等单质。
(2) 除去有机物、铵盐等。
(3) 高温下,原料与空气中的氧气反应,使一些物质在高温下氧化。如4FeS2+11O22Fe2O3+8SO2、2MS+3O22MO+2SO2(M代表某些金属元素)。
(4) 除去某些受热不稳定的杂质。如MCO3MO+CO2↑、M(OH)2MO+H2O(M代表某些金属元素)。
3. 浸取
(1) 水浸:与水接触反应或溶解,使原料变成离子进入溶液中。
(2) 酸浸:加入酸使可溶性金属离子进入溶液,不溶物通过过滤除去。
①酸还能溶解金属及其氧化物(膜)。
②用盐酸、硝酸酸溶时,要注意控温。
③用硫酸酸溶时,要注意Pb2+、Ca2+、Ag+会生成PbSO4、 CaSO4、Ag2SO4进入滤渣。
④酸溶时,酸不能加入过多,否则会造成后续调pH时多加入碱。
⑤酸溶时,盐酸不能加过多,否则可能会与后续加入的KMnO4等氧化剂反应,生成有毒气体Cl2。
(3) 碱浸:常用NaOH溶液、氨水、Na2CO3溶液等,使其中可溶性的物质溶解。
①NaOH、Na2CO3溶液还能除去油污。
② NaOH溶液能溶解两性化合物(如Al2O3、ZnO)。
③NaOH溶液能溶解SiO2、Al、Zn等。
④氨水还能与金属离子形成配离子进入溶液。
⑤碱溶时,碱不能加入过多,否则会造成后续调pH时多加入酸。
(4) 盐浸:用铵盐溶液、FeCl3溶液溶解。
(5) 提高浸出率的措施:
①将矿石粉碎;
②适当加热;
③充分搅拌;
④适当提高浸取液的浓度;
⑤适当延长浸取时间等。
典 题 悟 法
(2023·海安期初)某研究小组欲从废旧电路板(主要含有Fe、Cu、SnO2、PbO2、塑料等)中回收金属锡,流程如图。已知:SnO2、PbO2可与NaOH共热反应生成易溶于水的Na2SnO3和Na2PbO3。下列说法错误的是( )
A. 废旧电路板“粉碎”目的是为了焙烧时与O2充分反应
B. 滤渣的主要成分是Fe(OH)3和Cu(OH)2
C. 水热法过程中发生反应:SnO+H2OSnO2↓+2OH-
D. 若得到干燥的PbS和S的固体混合物27.1 g,则反应①有0.2 mol电子转移(Pb—207、S—32)
考点2 控制条件除杂
知 识 梳 理
沉淀法
1. 调pH法
(1) 调高pH:加入消耗H+的物质(碱、氧化物、碳酸盐、碱式碳酸盐等)。
①如除去Al3+、Fe3+,可以调高pH,使其分别转化成Al(OH)3沉淀、Fe(OH)3沉淀。
②如除去CuSO4溶液中混有的Fe3+,可加入_________________________________________________ ____________________________等调节溶液的pH至3~4,使 Fe3+转化为 Fe(OH)3沉淀除去。离子方程式为________________________________________________________________________________________ _____________________________,不可加入NaOH溶液、氨水等。
(2) 调低pH:加入消耗OH-的物质(盐酸、硫酸、CO2、NH等)。
如除去SiO、[Al(OH)4]-,可以调低pH,使其分别转化成H2SiO3沉淀、Al(OH)3沉淀。
(3) pH范围的选择:杂质离子完全沉淀时pH~主要离子开始沉淀时pH。如Fe(OH)3、Zn(OH)2开始沉淀至沉淀完全时的pH范围分别为1.5~3.3、5.4~8.2,则要除去Zn2+溶液中的Fe3+,应控制溶液的pH范围为_____________________。
(4) pH不能过高或过低:过低会导致某些离子沉淀不完全;过高可能会导致主体离子损失。生成两性物质时,pH也不宜过高或过低。
2. 形成氟化物沉淀
(1) 如除去Mg2+、Ca2+,可以加入NaF,使其分别转化成MgF2沉淀、CaF2沉淀。注意溶液pH不宜过低,原因是________________________________________________________________________________ __________________________________________________________________________________________________________________________________________________________________________________。
(2) 如除去Mn2+中的Mg2+,因MgF2比MnF2更难溶,故可加入MnF2形成MgF2沉淀,利用沉淀转化除去Mg2+。
3. 形成硫化物沉淀
(1) 如除去Cu2+、Zn2+、Fe2+、Hg2+,可以加入Na2S,使其分别转化成CuS沉淀、ZnS沉淀、FeS沉淀、HgS沉淀。用Na2S 除Cu2+,pH过低时,Cu2+去除率低,原因是_____________________________ _________________________________________________________。
(2) 用一些溶解度较大的硫化物(如FeS、MnS)通过沉淀转化使某些金属离子转化为更难溶的硫化物。
4. 氧化还原沉淀法
(1) 用单质进行置换,如可用Zn置换Cu2+。
(2) 加入氧化剂(或还原剂)使某些粒子转化为沉淀,如:
KMnO4除铁:MnO+3Fe2++7H2O===3Fe(OH)3↓+MnO2↓+5H+。
Na2SO3沉铜:2Cu2++SO+2Cl-+H2O===2CuCl↓+SO+2H+。
双氧水氧化沉淀转化:CuS+H2O2+H2SO4===CuSO4+S+2H2O。
MnO2氧化沉淀转化:MnO2+MnS+2H2SO4===2MnSO4+S+2H2O。
Fe3+氧化沉淀转化:2Fe3++Pb+SO===PbSO4+2Fe2+。
5. 碳酸盐沉淀法
(1) 用Na2CO3沉淀Zn2+,离子反应为
Zn2++CO===ZnCO3↓。
(2) 用NH4HCO3沉淀Co2+,离子反应为
_________________________________________________________________________。
(3) 用NH4HCO3-氨水沉淀Mn2+,离子反应为________________________________________________ _____________________________________________________________________________________________________________________。
(4) 用NH3(先)+CO2(后)沉淀Ca2+,离子反应为Ca2++CO2+2NH3+H2O===CaCO3↓+2NH。
[注意]
①M2++2HCO===MCO3↓+H2O+CO2↑(M2+为Ca2+、Mn2+、Co2+、Ni2+、Fe2+)。
②Cu2+、Zn2+与HCO反应生成碱式碳酸盐沉淀,如:
6HCO+3Zn2+===ZnCO3·2Zn(OH)2·H2O↓+5CO2↑
6. 草酸盐沉淀法
如Ca2++C2O===CaC2O4↓
7. 硫酸盐沉淀法
(1) Ca2++SO===CaSO4
(2) BaCO3沉淀转化硫酸盐沉淀:BaCO3+SO+2H3PO4===BaSO4+CO2↑+H2O+2H2PO
萃取与反萃取法
1. 萃取:利用溶质在互不相溶的溶剂里的溶解度不同提取分离物质。萃取常见考查角度:
(1) 萃取操作
如用CCl4或苯萃取溴水中的溴,用如图1所示的实验装置进行萃取分液,以除去溶液中的Fe3+。为使Fe3+尽可能多地从水相转移至有机相,采取的实验操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,____________、静置、分液,并重复多次。
图1 图2
(2) 萃取剂的选择
已知萃取剂A、B中pH对Co2+、Mn2+萃取率的影响如图2所示。为了除去Mn2+,应选择萃取剂___(填“A”或“B”)。
(3) pH范围的选择
①萃取剂对Al3+、Co2+萃取率与pH的关系如图3所示,萃取分离Co2+、Al3+的实验操作: 向萃取分液后的有机相中加稀硫酸调pH=3~4,分液可得CoSO4溶液,______________________________ _____________________________________________,可得 Al2(SO4)3溶液。
图3
②“萃取分离”溶液中钴、锂的萃取率与平衡时溶液pH的关系如图4所示,pH一般选择5左右,理由是______________________________________________________。
图4 图5
(4) 影响萃取率的因素
向除杂后的溶液中,加入某有机酸萃取剂(HA)2,发生反应:Co2++n(HA)2CoA2·(n-1)(HA)2+2H+。实验测得:当溶液pH处于4.5~6.5范围内,Co2+萃取率随溶液pH的增大而增大(如图5所示),其原因是_____________________________________________________________________________________ ____________________________________________________________________________________。
2. 反萃取:用反萃取剂使被萃取物从一种溶剂返回另一种溶剂的过程,是萃取的逆过程。为了除去Cu2+中的杂质离子,先将Cu2+与萃取剂(HY)结合,发生萃取反应:Cu2++2HYCuY2+2H+,萃取、分液后,向有机相中加入酸:CuY2+2H+Cu2++2HY,反萃取得到Cu2+。
(1) 反萃取目的
例 实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如图所示:
向含碘废液中加入稍过量的 Na2SO3 溶液,将废液中的I2还原为I-,该操作的目的是_________________________________。
(2) 反萃取剂的选择
例 钒及其化合物在工业上有许多用途。从废钒(主要成分为V2O3、V2O5、Fe2O3、FeO、SiO2)中提取V2O5的一种工艺流程如图:
已知:①VOSO4能溶于水,VO2+与Fe不能反应;②有机溶剂H2R对VO2+及Fe3+萃取率高,但不能萃取Fe2+。
“溶剂萃取与反萃取”可表示为VO2++H2RVOR+2H+。为了提高VO2+的产率,反萃取剂可选用___(填字母)。
A. NaCl B. NaOH C. H2SO4
(3) “萃取”和“反萃取”目的
例 由钼精矿(主要成分是MoS2)湿法回收钼酸铵[(NH4)2MoO4]部分工艺流程如图:
“滤液2”先加入有机溶剂“萃取”,再加氨水“反萃取”,进行“萃取”和“反萃取”操作的目的是_____________________________________________________________________。
(4) 反萃取操作
向溶解、过滤后所得滤液中加入萃取剂,萃取后分液获得有机层和水层。
例 萃取时发生反应:M2++2RHMR2+2H+(M表示Ni2+或Fe2+,RH表示萃取剂)。萃取剂体积V0与溶液体积VA的比值(V0/VA)对溶液中Ni2+和Fe2+萃取率的影响如图所示。通过反萃取可获得NiSO4溶液并回收萃取剂。
萃取时应控制V0/VA的比值为____________;反萃取获得NiSO4溶液的实验操作是__________________ _____________________________________________。
典 题 悟 法
(2023·常州中学)陶瓷工业中钴系色釉具有呈色稳定、呈色强度高等优点,利用含钴废料(主要成分为Co3O4,还含有少量的铝箔,LiCoO2等杂质)制备碳酸钴的工艺流程如图:
下列有关描述错误的是( )
A. “滤液①”主要成分是Na[Al(OH)4]
B. “操作①”“操作②”的分离方法不同
C. “酸溶”反应中H2O2可以换成O2
D. “沉钴”时,Na2CO3的滴速过快或浓度太大将导致产品不纯,其原因是溶液碱性增强会产生Co(OH)2杂质
(2023·华罗庚中学)工业上以铬铁矿(FeCr2O4,含Al、Si氧化物等杂质)为主要原料制备红矾钠(Na2Cr2O7·2H2O)的工艺流程如图。回答下列问题:
(1) “焙烧”的目的是将FeCr2O4转化为Na2CrO4并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是______________________________________________________。
(2) 矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图1所示。当溶液中可溶性组分浓度c≤1.0×10-5 mol/L时,可认为已除尽。
图1
“中和”时pH的理论范围为_______________________;“酸化”的目的是______________________ _______________________________________________________________________________;Fe元素在______(填操作单元的名称)过程中除去。
(3) “蒸发结晶”时,过度蒸发将导致________________________;冷却结晶所得母液中,除Na2Cr2O7外,可在上述流程中循环利用的物质还有_________。
(4) 利用膜电解技术(装置如图2所示),以Na2CrO4为主要原料制备Na2Cr2O7的总反应化学方程式为4Na2CrO4+4H2O2Na2Cr2O7+4NaOH+2H2↑+O2↑。则Na2Cr2O7在___(填“阴”或“阳”)极室制得,电解时通过离子交换膜的离子主要为_________。
图2
考点3 工艺流程中加入试剂的作用
知 识 梳 理
加氧化剂或还原剂
1. 转变某种金属离子的价态,再通过调节溶液pH,使金属离子以氢氧化物形式沉淀出来,以达到除去杂质的目的[如Fe2+―→Fe3+―→Fe(OH)3]。
2. 为生成目标产物的价态而加入氧化剂(如在碱性条件下,加入H2O2将Cr3+氧化成CrO)。
3. 常见氧化剂:KMnO4、H2O2、空气(O2)、Cl2、次氯酸盐、ClO2、ClO、MnO2、HNO3、Fe3+等。
4. 常见还原剂:金属单质、SO2(SO)、I-、Fe2+、H2O2、HCl、H2C2O4等。
通入空气
1. 氧化某些离子(如SO、Fe2+)。
2. 起搅拌作用。
加有机溶剂
萃取某些物质或降低某些物质的溶解度。
蒸发结晶时加对应酸抑制水解
如从溶液中析出FeCl3、CuCl2、AlCl3、MgCl2、ZnCl2等晶体时,应在HCl气流中加热,以抑制其水解。
①H2O2是绿色氧化剂,无污染,但需注意H2O2受热易分解;Fe3+、Cu2+能催化H2O2分解。
②用SO2还原MnO、Fe3+等离子时,温度不宜过高,温度越高,SO2溶解度越小。
③用Na2SO3还原MnO2、Fe3+等时,Na2SO3实际用量高于理论量,原因是Na2SO3被空气部分氧化。
④判断能否加其他物质,要考虑是否引入杂质(或影响产物的纯度)等。
典 题 悟 法
(2023·高邮调研)室温时,实验室以含铬废液(主要离子含K+、Fe3+、Cr3+、SO)制取含K2Cr2O7溶液的流程如下:
已知:①室温时,Ksp=6×10-31,Ksp=4×10-38;②假设溶液中某离子浓度≤1×10-6mol/L时,该离子沉淀完全;③“氧化”时Cr3转化为CrO。下列说法正确的是( )
A. “过滤Ⅰ”所得滤液中c=6×10-7mol/L
B. “氧化”时的离子方程式为2Cr3+3H2O2===2CrO+4H2O+4H+
C. “酸化”时溶液pH越低,CrO转化为Cr2O的转化率越低
D. 将“含K2Cr2O7的溶液”蒸干不能得到纯净的K2Cr2O7固体
考点4 工艺流程中反应条件的控制
知 识 梳 理
加过量试剂
反应物过量,能保证反应的完全发生或提高其他物质的转化率,但可能引入杂质,增加后续处理成本(关注后续化学反应)。
气体氛围
1. 隔绝空气:防止空气中的组分(如氧气)参与反应。
2. HCl氛围:抑制弱离子的水解。
3. 惰性气体氛围:通入Ar、N2、H2等,防止某些物质被氧化。
热空气(或水蒸气)吹出气体
如海水提溴、凯氏定氮。
控制溶液的pH
1. 增强物质(MnO、NO等)的氧化性或还原性。
2. 调节离子的水解程度。
3. 萃取、离子交换可能有pH要求。
4. 沉淀某些金属阳离子。
控制温度
1. 温度对物质性质的影响
(1) 关注易分解物质:双氧水、氨水、铵盐、硝酸、次氯酸、硝酸盐、草酸、草酸盐以及信息中给出的易分解物质。
(2) 关注易挥发物质:氨水、硝酸、盐酸等易挥发物质以及沸点较低物质。
(3) 关注易被氧化物质:Na2S、Na2SO3、KI、含Fe(Ⅱ)的化合物、酚类、醛类以及信息中给出的易被氧化物质。
(4) 关注物质的溶解度:若固体物质的溶解度随温度升高而增大,则降温能促使产品析出;若固体物质的溶解度随温度升高而减小,则升温能促使产品析出;气体的溶解度随温度升高而减小。
2. 温度在反应原理中的影响
(1) 温度对反应速率或固体溶解速率的影响
①制备物质时,常使用加热的方法加快反应速率。
②原料的预处理阶段,升温可以提高浸取速率。
(2) 温度对平衡移动、反应物转化率或生成物产率的影响
①正反应吸热的可逆反应,升温使平衡正向移动,有利于提高反应物的平衡转化率,从而提高产物的产率。
②正反应放热的可逆反应,升高温度不利于反应物平衡转化率的提高,不利于提高产物的产率。
③升温促进盐类水解,有利于生成沉淀(胶体聚沉后利于过滤分离)。
(3) 温度对催化剂活性的影响
如合成氨或SO2催化氧化生成SO3时,选择的温度是500 ℃左右,原因之一就是该温度范围内催化剂的活性最强。
(4) 温度对副反应发生的影响
很多有机反应过程一般较为复杂,对温度的控制尤为关键,如实验室制取乙烯、硝基苯等,控制温度都是为了防止副反应的发生。
3. 控制温度在一定范围内的答题角度
(1) 控制反应速率、适宜的温度使催化剂的活性最大、防止副反应的发生。
(2) 控制化学反应进行的方向,使化学平衡移动。
(3) 升温:使溶液中的气体逸出,使易挥发物质挥发,使易分解的物质分解。
(4) 控制温度结晶与过滤。
(5) 能源的利用(耗能);生产安全(温度过高,反应过于剧烈,可能有安全问题)等。
4. 控温方法
(1) 缓慢加入××溶液或缓慢通入××气体。
(2) 水浴(热水浴、冰水浴等)、油浴、沙浴等。
典 题 悟 法
(2023·徐州铜山期中)由碳酸锰矿(主要成分MnCO3,还含有FeCO3、MnO2、Al2O3、SiO2等)提取金属锰的一种流程如图。下列有关说法正确的是( )
A. “酸浸”中,FeCO3溶于稀硫酸的离子方程式:CO+2H+===H2O+CO2↑
B. “除铁、铝”中,温度越高,越有利于除铁、铝
C. 滤渣Ⅱ的主要成分为Fe(OH)2和Al(OH)3
D. “电解浸出”过程中,溶液的pH变小
1. (2024·南京江宁期初)某工厂采用如下工艺制备Cr(OH)3,已知焙烧后Cr元素以+6价形式存在。下列说法错误的是( )
A. “焙烧”中产生CO2
B. 滤渣的主要成分为Fe(OH)2
C. 滤液①中Cr元素的主要存在形式为CrO
D. 淀粉水解液中的葡萄糖起还原作用
2. (2024·如皋期初)硫酸钾是一种重要的无氯优质钾肥,利用某高钾明矾石制备硫酸钾的工艺流程如下:
已知:高钾明矾石的主要成分为K2SO4·Al23·2Al2O3·H2O和少量Fe2O3。下列说法正确的是( )
A. “焙烧”时Al23反应的化学方程式为2Al23+3S===2Al2O3+9SO3
B. “调节pH”的目的是使Fe3+和Al3+完全沉淀
C. 化合物Y可制成铝热剂用于焊接铁轨
D. SO3可回收利用后应用于本流程
3. (2023·海安期中)从砷化镓废料(主要成分为GaAs、Fe2O3、SiO2和CaCO3)中回收镓和砷的工艺流程如图所示。
下列说法错误的是( )
A. “碱浸”前,废料先浆化为悬浊液的目的是提高Ga、As元素浸出率
B. “碱浸”后,溶液中主要离子有Ga3+、Na+、SiO、AsO
C. 滤渣Ⅱ的成分为Ga3和H2SiO3
D. 电解后的尾液中溶质主要成分为H2SO4,可以循环利用
4. (2023·苏锡常镇一模)钴的氧化物常用于制取催化剂和颜料等。以含钴废料(含Co2O3和少量Fe、Al、Mn、Ca、Mg等的氧化物及活性炭)为原料制取钴的氧化物的流程如下。
已知:萃取时发生的反应为Co2++n(HA)2CoA2·(n-1)(HA)2+2H+。
(1) 除Fe、Al:先加入NaClO3溶液,再加入Na2CO3溶液调节pH。写出NaClO3氧化Fe2+的离子方程式:______________________________________________________________________________________。
(2) 除Ca、Mg:当某离子浓度c≤1×10-6 mol/L时,认为该离子已除尽。
①为使Ca2+、Mg2+除尽,必须保持溶液中c(F-)≥____________mol/L。
②若调节溶液的pH偏低,将会导致Ca2+、Mg2+沉淀不完全,其原因是_________________________ ________________________________________________________________________________________________________________________________[Ksp(CaF2)=1.0×10-10,Ksp(MgF2)=7.4×10-11,Ka(HF)=3.5×10-4]。
(3) 萃取、反萃取:加入某有机酸萃取剂(HA)2,实验测得Co2+萃取率随pH的变化如图所示。向萃取所得有机相中加入H2SO4,反萃取得到水相。
①该工艺中设计萃取、反萃取的目的是__________________________________________。
②Co2+萃取率随pH升高先增大后减小的可能原因是_________________________________________ _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
第26讲 化学工艺流程
[备考导航]
(1) √ (2) × (3) √ (4) × (5) ×
考点1
[典题悟法]
典例1 B 【解析】 废旧电路板“粉碎”目的是焙烧时与O2充分反应,使反应更充分,A正确;铁、铜的氧化物不溶于碱,结合后续流程,滤渣的主要成分应为铁、铜的氧化物,B错误;“碱浸”过程中,SnO2与NaOH反应转化为SnO,水热法过程中发生反应:SnO+H2OSnO2↓+2OH-,C正确;若得到干燥的PbS和S的固体混合物27.1 g,反应①为PbO+2S2-+3H2O===PbS↓+S↓+6OH-,该反应中生成等物质的量的PbS和S,则生成0.1 mol硫单质,因此反应①有0.2 mol电子转移,D正确。
考点2
[知识梳理]
知识1
1. (1) ②CuO[或CuCO3或Cu(OH)2或Cu2(OH)2CO3] Fe3++3H2OFe(OH)3+3H+、CuO+2H+===Cu 2++H2O (3) 3.3~5.4
2. (1) F-与H+结合生成弱电解质HF,MgF2(s)Mg2+(aq)+2F-(aq)、CaF2(s)Ca2+(aq)+2F-(aq)平衡向右移动,Mg2+、Ca2+沉淀不完全
3. (1) S2-与H+结合生成HS-、H2S,使溶液中的S2-浓度降低 5. (2) Co2++2HCO===CoCO3↓+H2O+CO2↑
(3) Mn2++HCO+NH3·H2O===MnCO3↓+NH+H2O或Mn2++HCO+NH3===MnCO3↓+NH
知识2
1. (1) 充分振荡 (2) B (3) ①继续向萃取分液后的有机相加稀硫酸调pH≤1,然后分液 ②pH在5左右时,钴、锂的分离效率最高 (4) pH越大,溶液中c(H+)越小,有利于Co2++n(HA)2CoA2·(n-1)(HA)2+2H+反应正向进行,Co2+萃取率越高
2. (1) 例 使CCl4中的碘进入水层 (2) 例 C
(3) 例 富集钼酸根离子(或将钼酸根离子和其他杂质分离)
(4) 例 0.25 向有机层中加入硫酸,充分振荡后分液,取水层
[典题悟法]
典例2 C 【解析】 Al与NaOH溶液反应生成Na[Al(OH)4]和H2,“滤液①”主要成分是Na[Al(OH)4],A正确;“操作①”为过滤,“操作②”为萃取、分液,B正确;“酸溶”反应中H2O2作还原剂,H2O2不可以换成O2,C错误;“沉钴”时Na2CO3的滴速过快或浓度太大,溶液碱性增强,会产生Co(OH)2杂质,D正确。
典例3 (1) 增大反应物接触面积,提高化学反应速率 (2) 4.5≤pH≤9.3 使2CrO+2H+Cr2O+H2O平衡正向移动,提高Na2Cr2O7的产率 浸取 (3) 重铬酸钠提前析出 H2SO4 (4) 阳 Na+
【解析】 (2) “中和”时调节溶液pH的目的是将[Al(OH)4]-、SiO转化为沉淀过滤除去,由图可知,当溶液pH≥4.5时,Al3+除尽,当溶液pH>9.3时,H2SiO3会再溶解生成SiO,因此“中和”时pH的理论范围为4.5≤pH≤9.3。将Al元素和Si元素除去后,溶液中Cr元素主要以Cr2O和CrO存在,溶液中存在平衡:2CrO+2H+??Cr2O+H2O,降低溶液pH,平衡正向移动,可提高Na2Cr2O7产率;Fe元素在“浸取”操作中除去。(4) 阳极上水失电子生成H+和O2,2CrO+2H+Cr2O+H2O平衡右移,Cr2O在阳极室产生;阴极上H2O得电子生成OH-和H2,Na+通过离子交换膜。
考点3
[典题悟法]
典例4 D 【解析】 根据Ksp[Cr(OH)3]=c(Cr3+)·c3(OH-)=6×10-31,pH=8,c(OH-)=10-6 mol/L,c(Cr3+)==mol/L=6×10-13 mol/L,A错误;“氧化”过程Cr(OH)3转化为CrO,H2O2作氧化剂,溶液呈碱性,离子方程式为4OH-+2Cr(OH)3+3H2O2===2CrO+8H2O,B错误;2CrO+2H+Cr2O+H2O,“酸化”时溶液pH越低,CrO转化为Cr2O的转化率越大,C错误;“含K2Cr2O7的溶液”中有KCl,将“含K2Cr2O7的溶液”蒸干得不到纯净的K2Cr2O7固体,D正确。
考点4
[典题悟法]
典例5 D 【解析】 FeCO3不溶于水,不拆分为离子形式,A错误;H2O2受热易分解,温度过高时,不利于除铁铝,B错误;滤渣Ⅱ的主要成分为Fe(OH)3和Al(OH)3,C错误;由2MnSO4+2H2O2Mn+O2↑+2H2SO4知,D正确。
[质量评价]
1. B 【解析】 “焙烧”生成Fe2O3、CO2、Na2CrO4,滤渣的主要成分为Fe2O3,A正确、B错误、C正确;淀粉水解液中的葡萄糖将Cr(Ⅵ)还原为Cr(Ⅲ),D正确。
2. D 【解析】 “焙烧”时Al23反应的化学方程式为2Al23+4S+6O22Al2O3+10SO3,A错误;“调节pH”的目的是使[Al(OH)4]-转化为Al(OH)3沉淀,B错误;Al(OH)3灼烧生成Al2O3,Al2O3不可制铝热剂,C错误;SO3溶于水制得硫酸,溶液X为H2SO4,D正确。
3. B 【解析】 将废料先浆化为悬浊液,可以增大接触面积,提高Ga、As元素浸出率,A正确;“碱浸”后,Na[Ga(OH)4]、Na3AsO4、Na2SiO3进入浸出液中,溶液中主要离子有Na+、SiO、AsO、[Ga(OH)4]-,B错误;滤渣Ⅱ的成分为Ga3和H2SiO3,C正确;电解Ga2(SO4)3溶液生成Ga、氧气、硫酸,尾液中含有H2SO4,可以循环利用,D正确。
4. (1) 6Fe2++ClO+6H+===6Fe3++Cl-+3H2O (2) ①0.01 ②pH偏低,较多的F-与H+形成弱酸HF,导致溶液中F-浓度减小,使Ca2+、Mg2+不能完全转化为沉淀 (3) ①分离提纯并富集Co2+的浓度 ②当pH<6.5时,随着pH升高,溶液中c(H+)减小,平衡向正反应方向移动,更多的Co2+与萃取剂反应;当pH>6.5时,随着pH升高,溶液中c(OH-)增大,Co2+与OH-形成Co(OH)2沉淀
【解析】 (2) ①Ksp(CaF2)=1.0×10-10,Ksp(MgF2)=7.4×10-11,则CaF2的溶解度更大,使Ca2+除尽,则需要保证c(F-)≥= mol/L=0.01 mol/L。②若调节溶液的pH偏低,则c(H+)过大,F-与H+形成弱酸HF,而导致溶液中F-浓度减小,使Ca2+、Mg2+不能完全转化为沉淀。(3) ①该工艺中设计萃取、反萃取的目的是将Co2+从滤液中提取到有机层中,然后分液后再反萃取到水层中,实现Co2+的提纯和富集。②随着pH升高,c(H+)减小,Co2++n(HA)2CoA2·(n-1)(HA)2+2H+平衡正向移动,导致Co2+萃取率升高;若pH过高,则Co2+转化为Co(OH)2沉淀,导致Co2+萃取率下降。
同课章节目录
