第二章 分子结构与性质复习 课件 (共20张PPT) 人教版(2019) 选择性必修2
文档属性
| 名称 | 第二章 分子结构与性质复习 课件 (共20张PPT) 人教版(2019) 选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-15 21:45:26 | ||
图片预览





文档简介
(共20张PPT)
人教版 选择性必修2 第二章
《分子结构与性质》复习课
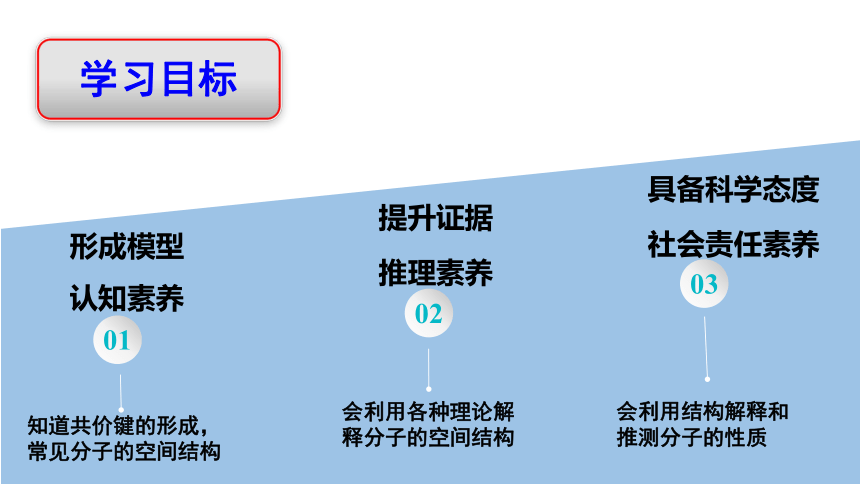
形成模型
认知素养
提升证据
推理素养
具备科学态度
社会责任素养
知道共价键的形成,常见分子的空间结构
会利用各种理论解释分子的空间结构
会利用结构解释和推测分子的性质
01
02
03
学习目标
一定条件下,CH4和CO2都能与H2O形成笼状结构(如图) 的水合物晶体。CH4与H2O形成的水合物俗称“可燃冰”。请回答下列问题:
前置作业
①写出基态C原子价电子排布图并思考原子核外电子排布遵循的规律。
②为什么甲烷分子式是CH4而不是CH2 ?甲烷的空间构型?
③“可燃冰“中存在的作用力有哪些?
④为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想是否可行?
构造原理、泡利原理、洪特规则
使成对电子变单电子,有利于多成键,
杂化轨道电子云变形,有利于最大重叠
能量最低原理
共价键、范德华力、氢键
结构决定性质
CO2与H2O的结合能大于CH4,CO2分子直径小于笼状结构的空腔直径
化学思维模型:能量—结构—性质
【典例1】写出下图所示的共价键名称,并选出含有该共价键的一种物质(H2、Cl2、HCl、N2)。示例:①s-s σ键,H2
② 键, ; ③ 键, ;
④ 键, ; ⑤ 键, 。
【典例2】
分子CH2=CH-CH2OH中含有 个σ键、 个π键,____个极性键。
1、共价键的分类
按共用电子对数
单键
双键
三键
按共用电子对是否偏移
极性键
非极性键
按原子轨道的重叠方式
σ键
π键
单键:σ键
双键:1个σ键、1个π键
三键:1个σ键、2个π键
知识点一:探“共价键”之究竟
能量最低
σ键:头碰头、轴对称
π键:肩并肩、镜面对称
电子配对-饱和性
原子轨道最大重叠-方向性
s-p σ
p-p σ
p-p π
p-p π
HCl
Cl2
N2
N2
9
1
7
下列说法正确的是( )
A. 一般来说,分子中键能越大,键长越长,则分子越稳定
B. 水分子可表示为H-O-H,分子中键角为180°
C. H-O键键能为463KJ/mol,即18gH2O分解成H2和O2时
消耗能量为926KJ
D. 元素周期表中的第ⅠA族和第ⅦA族元素的原子间可
以形成共价键
【典例3】
键 能
键 长
键 角
决定分子稳定性
决定分子空间结构
2、键参数的应用
一般地,键长越短,键能越大,共价键越稳定,含有该键的分子越稳定!
D
键能:气态分子中1mol化学键解离成气态原子所吸收的能量
V形
1.[2016新课标Ⅰ卷]
Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是:
体验高考
Ge原子半径大,原子间形成的σ键较长,p轨道之间重叠程度很小或几乎不能重叠,难以形成π键
2.[2018新课标Ⅰ卷] Li2O是离子晶体,其晶格能可通过Born Haber循环计算得到。由图可知,O=O键键能为 kJ·mol 1
共价键的本质:原子轨道重叠
498
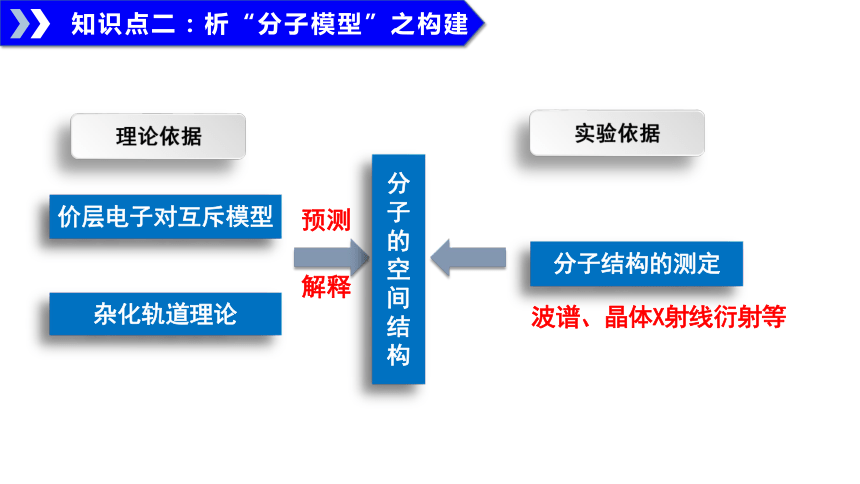
知识点二:析“分子模型”之构建
实验依据
杂化轨道理论
价层电子对互斥模型
理论依据
分子结构的测定
波谱、晶体X射线衍射等
分子的空间结构
预测
解释
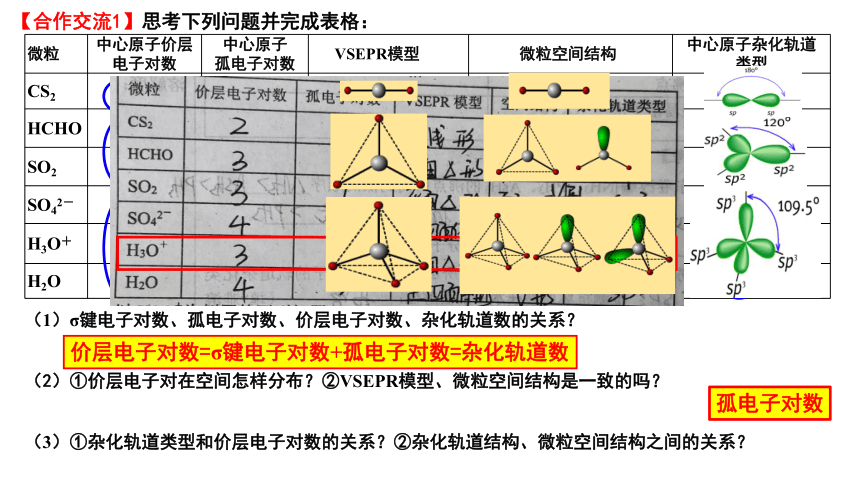
微粒 中心原子价层电子对数 中心原子 孤电子对数 VSEPR模型 微粒空间结构 中心原子杂化轨道
类型
CS2
HCHO
SO2
SO42-
H3O+
H2O
2 0 直线形 直线形 sp
3 0 平面三角形 平面三角形 sp2
3 1 平面三角形 V形 sp2
4 0 正四面体形 正四面体形 sp3
4 1 四面体形 三角锥形 sp3
4 2 四面体形 V形 sp3
【合作交流1】思考下列问题并完成表格:
(1)σ键电子对数、孤电子对数、价层电子对数、杂化轨道数的关系?
(2)①价层电子对在空间怎样分布?②VSEPR模型、微粒空间结构是一致的吗?
(3)①杂化轨道类型和价层电子对数的关系?②杂化轨道结构、微粒空间结构之间的关系?
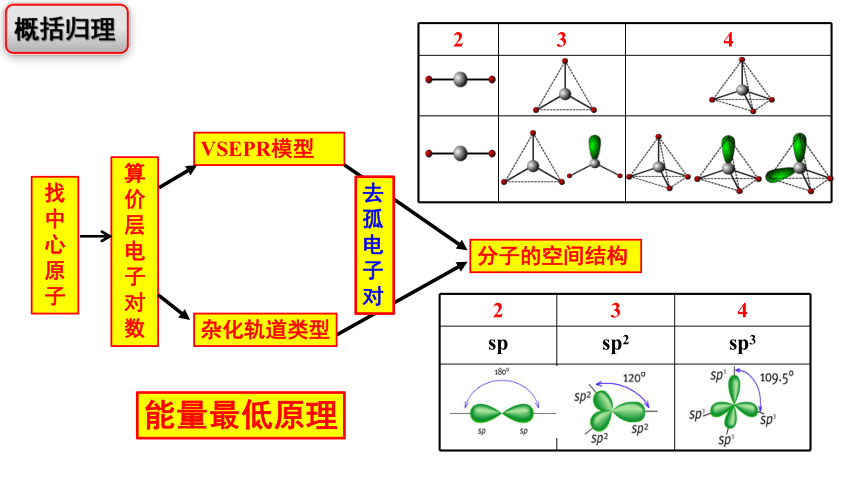
价层电子对数=σ键电子对数+孤电子对数=杂化轨道数
孤电子对数
算价层电子对数
VSEPR模型
分子的空间结构
2 3 4
杂化轨道类型
去孤电子对
2 3 4
sp sp2 sp3
能量最低原理
概括归理
找中心原子
2、[2018·全国卷Ⅱ,35(4)] 气态三氧化硫以单分子形式存在,其分子的立体构型为_________,固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为____。
平面三角形
sp3
体验高考
1、[2020·新课标Ⅰ]磷酸根离子(PO43-)的空间构型为_____________,其中P的价层电子对数为_______、杂化轨道类型为_______。
正四面体形
4
sp3
杂化类型的判断:①价层电子对数②结构式
【典例4】比较下列各组物质中微粒键角的大小
(1)CH4、CO2、BF3
(2)CH4、NH3、H2O
(3)NH3、PH3、AsH3
孤电子对与成键电子对间的斥力>成键电子对间的斥力
NH3>PH3>AsH3
键角的比较思路:
①杂化类型②孤电子对数③原子电负性
CO2>BF3>CH4
CO2>NH3>H2O
中心原子杂化类型相同,孤电子对数相等,中心原子的电负性越大,成键电子对之间的斥力越大,键角越大。
sp > sp2 > sp3
物质的宏观性质 微观解释
1、CO2是非极性分子;H2O是极性分子
2、CF3COOH的酸性大于CH3COOH的酸性
3、卤素单质从F2到I2的熔沸点越来越高
4、对羟基苯甲醛的沸点高于邻羟基苯甲醛的沸点
5、氨气极易溶于水
知识点三: 揭“分子性质”之由来
【合作交流2】完成下列表格:
都含有极性共价键,CO2为直线形,正电中心和负电中心重合
分子的极性
分子的空间结构
键的极性
判断分子极性的思维模型:
非极性键
极性键
非极性分子
极性分子
结构对称
结构不对称
直线形、平面三角形、正四面体形
物质的宏观性质 微观解释
1、CO2是非极性分子;H2O是极性分子
2、CF3COOH的酸性大于CCl3COOH 的酸性
3、卤素单质从F2到I2的熔沸点越来越高
4、对羟基苯甲醛的沸点高于邻羟基苯甲醛的沸点
5、氨气极易溶于水
知识点三: 揭“分子性质”之由来
【合作交流2】完成下列表格:
都含有极性共价键,CO2为直线形,正电中心和负电中心重合
F-C极性大于Cl-C极性,使F3C-极性大于Cl3C-极性,前者羧基中O-H极性更大,更易电离出H+
从F2到I2相对分子质量逐渐增大,范德华力逐渐增大
分子极性:①键的极性 ②空间结构
键的极性对物质化学性质的影响
对羟基苯甲醛能形成分子间氢键,邻羟基苯甲醛形成
分子内氢键
熔、沸点:①氢键 ②范德华力
分子间作用力:范德华力、氢键
【问题1】化学键、范德华力、氢键的强弱顺序?
化学键>氢键>范德华力
(1)相对分子质量越大,范德华力越大,熔沸点越高;
(2)分子的极性越大,范德华力越大,熔沸点越高。
【问题2】范德华力对物质熔沸点的影响?
【典例5】中科院国家纳米科学中心科研员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了 80 多年的问题提供了直观证据。下列有关氢键说法中不正确的是( )。
A: 由于氢键的存在,冰能浮在水面上
B: 由于氢键的存在,乙醇比乙烷更易溶于水
C: 由于氢键的存在,沸点:HF>HCl>HBr>HI
D: 由于氢键的存在,影响了蛋白质分子独特的结构
氢键影响物质的熔沸点、溶解性、密度等
C
物质的宏观性质 微观解释
1、CO2是非极性分子;H2O是极性分子
2、CF3COOH的酸性大于CH3COOH 的酸性
3、卤素单质从F2到I2的熔沸点越来越高
4、对羟基苯甲醛的沸点高于邻羟基苯甲醛的沸点
5、氨气极易溶于水
知识点三: 揭“分子性质”之由来
【合作交流2】完成下列表格:
都含有极性共价键,CO2为直线形,正电中心和负电中心重合
F-C极性大于H-C极性,使F3C-极性大于H3C-极性,前者羧基中O-H极性更大,更易电离出H+
从F2到I2相对分子质量逐渐增大,范德华力逐渐增大
分子极性:①键的极性 ②空间结构
键的极性对物质性质的影响
对羟基苯甲醛能形成分子间氢键,邻羟基苯甲醛形成
分子内氢键
熔、沸点:①氢键 ②范德华力
①NH3和H2O都是极性分子,根据相似相溶原理,NH3易溶于水。②NH3和H2O分子间形成氢键。③氨气与水反应
溶解性:
①相似相溶 ②氢键 ③能否与水反应
性质
决定
反映
结构
【典例6】青蒿素是从黄花蒿中提取得到的一种无色针状晶体,分子结构如图所示,则
青蒿素分子中含有______个手性碳原子。
7
1.[2020·山东卷改编]NH3、PH3、AsH3的沸点由高到低的顺序________________,
原因是___________________________________________________________;
PH3是________(填“极性”或“非极性”)分子。
体验高考
2.[2019·江苏卷]抗坏血酸的分子结构如图所示,推测抗坏血酸在水中的溶解性:____________(填“难溶于水”或“易溶于水”)。
极性
NH3>AsH3>PH3
NH3分子间能形成氢键,AsH3相对分子质量比PH3大,范德华力大
易溶于水
3.我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl
图中虚线代表氢键,其表示式为(NH4+)N—H…Cl、 、 。
(NH4+)N—H…N(N5-)
(H3O+)O—H…N(N5-)
氢键表示方法:X—H…Y(其中X、Y为F、O、N)
橘子遇气球
实验原理
橘子、橙子、柠檬这些柑橘类水果果皮上密密麻麻分布着一些小孔,这些就是它们的油脂腺,像人的毛孔一样。在这些孔里,会分泌出一种可以溶解橡胶的芳香油类物质。吹起来的气球“皮薄个大”,当被橘子皮汁溅到,沾到汁液的部分就会迅速溶解,气球压力遭到破坏,于是就爆了。
价层电子对互斥模型杂化轨道理论
理论依据
微观结构
宏观性质
实验依据
课堂总结
能量—结构—性质
波谱等实验技术
共价键
氢键
范德华力
…
极性
稳定性
熔沸点
溶解性
手性
…
课后作业
1、制作一张本章的知识思维导图
2、你已经学过很多物质的化学性质,请举例与同学讨论分子
结构对化学性质的影响
人教版 选择性必修2 第二章
《分子结构与性质》复习课
形成模型
认知素养
提升证据
推理素养
具备科学态度
社会责任素养
知道共价键的形成,常见分子的空间结构
会利用各种理论解释分子的空间结构
会利用结构解释和推测分子的性质
01
02
03
学习目标
一定条件下,CH4和CO2都能与H2O形成笼状结构(如图) 的水合物晶体。CH4与H2O形成的水合物俗称“可燃冰”。请回答下列问题:
前置作业
①写出基态C原子价电子排布图并思考原子核外电子排布遵循的规律。
②为什么甲烷分子式是CH4而不是CH2 ?甲烷的空间构型?
③“可燃冰“中存在的作用力有哪些?
④为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想是否可行?
构造原理、泡利原理、洪特规则
使成对电子变单电子,有利于多成键,
杂化轨道电子云变形,有利于最大重叠
能量最低原理
共价键、范德华力、氢键
结构决定性质
CO2与H2O的结合能大于CH4,CO2分子直径小于笼状结构的空腔直径
化学思维模型:能量—结构—性质
【典例1】写出下图所示的共价键名称,并选出含有该共价键的一种物质(H2、Cl2、HCl、N2)。示例:①s-s σ键,H2
② 键, ; ③ 键, ;
④ 键, ; ⑤ 键, 。
【典例2】
分子CH2=CH-CH2OH中含有 个σ键、 个π键,____个极性键。
1、共价键的分类
按共用电子对数
单键
双键
三键
按共用电子对是否偏移
极性键
非极性键
按原子轨道的重叠方式
σ键
π键
单键:σ键
双键:1个σ键、1个π键
三键:1个σ键、2个π键
知识点一:探“共价键”之究竟
能量最低
σ键:头碰头、轴对称
π键:肩并肩、镜面对称
电子配对-饱和性
原子轨道最大重叠-方向性
s-p σ
p-p σ
p-p π
p-p π
HCl
Cl2
N2
N2
9
1
7
下列说法正确的是( )
A. 一般来说,分子中键能越大,键长越长,则分子越稳定
B. 水分子可表示为H-O-H,分子中键角为180°
C. H-O键键能为463KJ/mol,即18gH2O分解成H2和O2时
消耗能量为926KJ
D. 元素周期表中的第ⅠA族和第ⅦA族元素的原子间可
以形成共价键
【典例3】
键 能
键 长
键 角
决定分子稳定性
决定分子空间结构
2、键参数的应用
一般地,键长越短,键能越大,共价键越稳定,含有该键的分子越稳定!
D
键能:气态分子中1mol化学键解离成气态原子所吸收的能量
V形
1.[2016新课标Ⅰ卷]
Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是:
体验高考
Ge原子半径大,原子间形成的σ键较长,p轨道之间重叠程度很小或几乎不能重叠,难以形成π键
2.[2018新课标Ⅰ卷] Li2O是离子晶体,其晶格能可通过Born Haber循环计算得到。由图可知,O=O键键能为 kJ·mol 1
共价键的本质:原子轨道重叠
498
知识点二:析“分子模型”之构建
实验依据
杂化轨道理论
价层电子对互斥模型
理论依据
分子结构的测定
波谱、晶体X射线衍射等
分子的空间结构
预测
解释
微粒 中心原子价层电子对数 中心原子 孤电子对数 VSEPR模型 微粒空间结构 中心原子杂化轨道
类型
CS2
HCHO
SO2
SO42-
H3O+
H2O
2 0 直线形 直线形 sp
3 0 平面三角形 平面三角形 sp2
3 1 平面三角形 V形 sp2
4 0 正四面体形 正四面体形 sp3
4 1 四面体形 三角锥形 sp3
4 2 四面体形 V形 sp3
【合作交流1】思考下列问题并完成表格:
(1)σ键电子对数、孤电子对数、价层电子对数、杂化轨道数的关系?
(2)①价层电子对在空间怎样分布?②VSEPR模型、微粒空间结构是一致的吗?
(3)①杂化轨道类型和价层电子对数的关系?②杂化轨道结构、微粒空间结构之间的关系?
价层电子对数=σ键电子对数+孤电子对数=杂化轨道数
孤电子对数
算价层电子对数
VSEPR模型
分子的空间结构
2 3 4
杂化轨道类型
去孤电子对
2 3 4
sp sp2 sp3
能量最低原理
概括归理
找中心原子
2、[2018·全国卷Ⅱ,35(4)] 气态三氧化硫以单分子形式存在,其分子的立体构型为_________,固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为____。
平面三角形
sp3
体验高考
1、[2020·新课标Ⅰ]磷酸根离子(PO43-)的空间构型为_____________,其中P的价层电子对数为_______、杂化轨道类型为_______。
正四面体形
4
sp3
杂化类型的判断:①价层电子对数②结构式
【典例4】比较下列各组物质中微粒键角的大小
(1)CH4、CO2、BF3
(2)CH4、NH3、H2O
(3)NH3、PH3、AsH3
孤电子对与成键电子对间的斥力>成键电子对间的斥力
NH3>PH3>AsH3
键角的比较思路:
①杂化类型②孤电子对数③原子电负性
CO2>BF3>CH4
CO2>NH3>H2O
中心原子杂化类型相同,孤电子对数相等,中心原子的电负性越大,成键电子对之间的斥力越大,键角越大。
sp > sp2 > sp3
物质的宏观性质 微观解释
1、CO2是非极性分子;H2O是极性分子
2、CF3COOH的酸性大于CH3COOH的酸性
3、卤素单质从F2到I2的熔沸点越来越高
4、对羟基苯甲醛的沸点高于邻羟基苯甲醛的沸点
5、氨气极易溶于水
知识点三: 揭“分子性质”之由来
【合作交流2】完成下列表格:
都含有极性共价键,CO2为直线形,正电中心和负电中心重合
分子的极性
分子的空间结构
键的极性
判断分子极性的思维模型:
非极性键
极性键
非极性分子
极性分子
结构对称
结构不对称
直线形、平面三角形、正四面体形
物质的宏观性质 微观解释
1、CO2是非极性分子;H2O是极性分子
2、CF3COOH的酸性大于CCl3COOH 的酸性
3、卤素单质从F2到I2的熔沸点越来越高
4、对羟基苯甲醛的沸点高于邻羟基苯甲醛的沸点
5、氨气极易溶于水
知识点三: 揭“分子性质”之由来
【合作交流2】完成下列表格:
都含有极性共价键,CO2为直线形,正电中心和负电中心重合
F-C极性大于Cl-C极性,使F3C-极性大于Cl3C-极性,前者羧基中O-H极性更大,更易电离出H+
从F2到I2相对分子质量逐渐增大,范德华力逐渐增大
分子极性:①键的极性 ②空间结构
键的极性对物质化学性质的影响
对羟基苯甲醛能形成分子间氢键,邻羟基苯甲醛形成
分子内氢键
熔、沸点:①氢键 ②范德华力
分子间作用力:范德华力、氢键
【问题1】化学键、范德华力、氢键的强弱顺序?
化学键>氢键>范德华力
(1)相对分子质量越大,范德华力越大,熔沸点越高;
(2)分子的极性越大,范德华力越大,熔沸点越高。
【问题2】范德华力对物质熔沸点的影响?
【典例5】中科院国家纳米科学中心科研员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了 80 多年的问题提供了直观证据。下列有关氢键说法中不正确的是( )。
A: 由于氢键的存在,冰能浮在水面上
B: 由于氢键的存在,乙醇比乙烷更易溶于水
C: 由于氢键的存在,沸点:HF>HCl>HBr>HI
D: 由于氢键的存在,影响了蛋白质分子独特的结构
氢键影响物质的熔沸点、溶解性、密度等
C
物质的宏观性质 微观解释
1、CO2是非极性分子;H2O是极性分子
2、CF3COOH的酸性大于CH3COOH 的酸性
3、卤素单质从F2到I2的熔沸点越来越高
4、对羟基苯甲醛的沸点高于邻羟基苯甲醛的沸点
5、氨气极易溶于水
知识点三: 揭“分子性质”之由来
【合作交流2】完成下列表格:
都含有极性共价键,CO2为直线形,正电中心和负电中心重合
F-C极性大于H-C极性,使F3C-极性大于H3C-极性,前者羧基中O-H极性更大,更易电离出H+
从F2到I2相对分子质量逐渐增大,范德华力逐渐增大
分子极性:①键的极性 ②空间结构
键的极性对物质性质的影响
对羟基苯甲醛能形成分子间氢键,邻羟基苯甲醛形成
分子内氢键
熔、沸点:①氢键 ②范德华力
①NH3和H2O都是极性分子,根据相似相溶原理,NH3易溶于水。②NH3和H2O分子间形成氢键。③氨气与水反应
溶解性:
①相似相溶 ②氢键 ③能否与水反应
性质
决定
反映
结构
【典例6】青蒿素是从黄花蒿中提取得到的一种无色针状晶体,分子结构如图所示,则
青蒿素分子中含有______个手性碳原子。
7
1.[2020·山东卷改编]NH3、PH3、AsH3的沸点由高到低的顺序________________,
原因是___________________________________________________________;
PH3是________(填“极性”或“非极性”)分子。
体验高考
2.[2019·江苏卷]抗坏血酸的分子结构如图所示,推测抗坏血酸在水中的溶解性:____________(填“难溶于水”或“易溶于水”)。
极性
NH3>AsH3>PH3
NH3分子间能形成氢键,AsH3相对分子质量比PH3大,范德华力大
易溶于水
3.我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl
图中虚线代表氢键,其表示式为(NH4+)N—H…Cl、 、 。
(NH4+)N—H…N(N5-)
(H3O+)O—H…N(N5-)
氢键表示方法:X—H…Y(其中X、Y为F、O、N)
橘子遇气球
实验原理
橘子、橙子、柠檬这些柑橘类水果果皮上密密麻麻分布着一些小孔,这些就是它们的油脂腺,像人的毛孔一样。在这些孔里,会分泌出一种可以溶解橡胶的芳香油类物质。吹起来的气球“皮薄个大”,当被橘子皮汁溅到,沾到汁液的部分就会迅速溶解,气球压力遭到破坏,于是就爆了。
价层电子对互斥模型杂化轨道理论
理论依据
微观结构
宏观性质
实验依据
课堂总结
能量—结构—性质
波谱等实验技术
共价键
氢键
范德华力
…
极性
稳定性
熔沸点
溶解性
手性
…
课后作业
1、制作一张本章的知识思维导图
2、你已经学过很多物质的化学性质,请举例与同学讨论分子
结构对化学性质的影响
