2.4 课时1 羧酸(23页)课件 2024-2025学年高二化学鲁科版(2019)选择性必修3
文档属性
| 名称 | 2.4 课时1 羧酸(23页)课件 2024-2025学年高二化学鲁科版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 45.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-16 18:34:17 | ||
图片预览







文档简介
(共23张PPT)
羧酸
第2章 官能团与有机化学反应 烃的衍生物
1.了解常见羧酸的结构特点及主要物理性质,会用系统命名法命名简单的羧酸。
2.掌握羧酸的主要化学性质,理解化学性质及官能团与反应类型之间的关系。
羧酸的组成是怎样的?决定羧酸性质的官能团是什么?
醋是人类最早认识和使用的具有酸味的有机化合物,其主要成分是乙酸
白醋、黑醋、苹果醋、麦芽醋
羧酸:乙酸
一、羧酸
1.羧酸的结构
由烃基(或氢原子)与羧基相连而构成的有机化合物称为羧酸。
②饱和一元羧酸通式:
CnH2n+1COOH(或CnH2nO2)
①官能团:
—C—OH
O
羧基:—COOH,
蚁酸(甲酸)
HCOOH
COOH
(苯甲酸)
一、羧酸
2.羧酸的分类
①按分子中烃基的结构分类
②按分子中羧基的个数分类
蚁酸(甲酸)
HCOOH
COOH
(苯甲酸)
脂肪酸
芳香酸
蚁酸(甲酸)
HCOOH
COOH
COOH
草酸 (乙二酸)
柠檬酸
一元羧酸
二元羧酸
多元羧酸
CH2-COOH
HO-C-COOH
CH2-COOH
-
-
一、羧酸
2.羧酸的分类
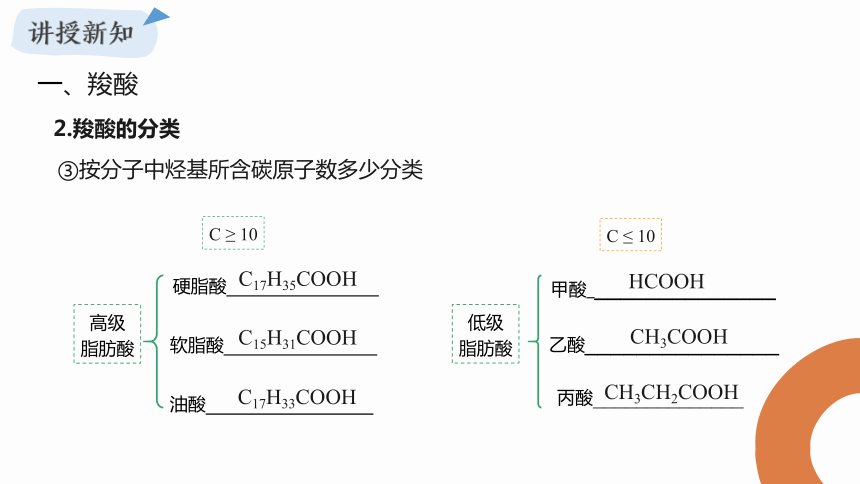
③按分子中烃基所含碳原子数多少分类
低级
脂肪酸
甲酸_______________
C ≤ 10
乙酸_______________
丙酸______________
硬脂酸
软脂酸
油酸
高级
脂肪酸
C ≥ 10
C17H35COOH
C17H33COOH
C15H31COOH
HCOOH
CH3COOH
CH3CH2COOH
一、羧酸
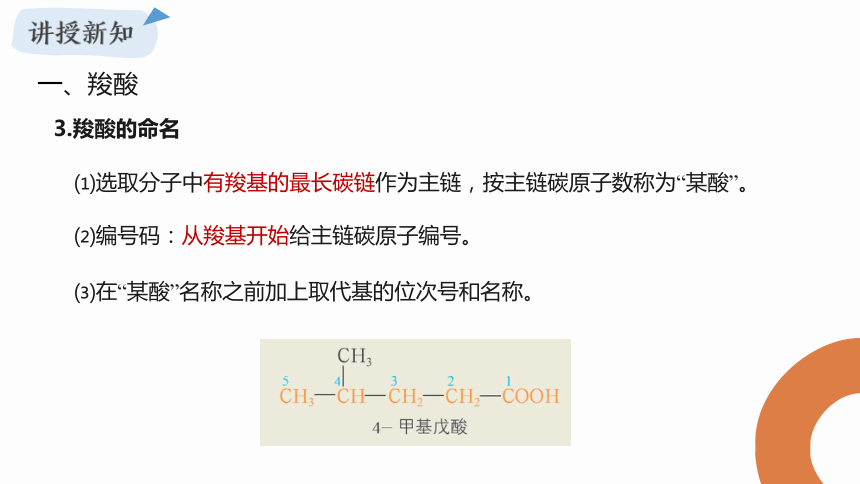
3.羧酸的命名
⑴选取分子中有羧基的最长碳链作为主链,按主链碳原子数称为“某酸”。
⑵编号码:从羧基开始给主链碳原子编号。
⑶在“某酸”名称之前加上取代基的位次号和名称。
一、羧酸
4.羧酸的物理性质
(1)水溶性:分子中碳原子数在4以下的羧酸能与水互溶。随着碳链的增长,羧酸在水中的溶解度迅速减小,直至与相对分子质量相近的烷烃的溶解度相近。
(2)熔、沸点:羧酸的沸点比相应的醇的沸点高,原因是羧酸分子形成氢键的机会比相对分子质量相近的醇多。
例如,乙酸和 1- 丙醇的相对分子质量都是 60,但乙酸的沸 点为 118℃,1- 丙醇的沸点为 97.4℃。
一、羧酸
5.常见的羧酸
甲酸(蚁酸)
HCOOH
甲酸是有刺激性气味的无色液体,有腐蚀性,能与水、 乙醇、乙醚、甘油等互溶。
甲酸在工业上可用作还原剂,在医疗上可用作消毒剂。
COOH
一、羧酸
5.常见的羧酸
苯甲酸(安息香酸)
苯甲酸是白色针状晶体,易升华,微溶于水,易溶于乙醇、乙醚。
苯甲酸及其钠盐或钾盐常用作食品防腐剂。
一、羧酸
5.常见的羧酸
乙二酸(草酸)
COOH
COOH
乙二酸是无色透明晶体,通常含有结晶水,能溶于水或乙醇,以钠盐或钙盐形式广泛存在于植物中。
一、羧酸
6.常见的取代羧酸
羧酸分子中烃基上的氢原子被其他官能团取代的羧酸称为取代羧酸。
①卤代酸,如氯乙酸:
ClCH2COOH
②氨基酸,如丙氨酸:
α-氨基丙酸
③羟基酸,如乳酸:
α-羟基丙酸
结构 性质
α-氢的反应
δ-
δ+
O—H 断裂时,表现出酸性
C—O 断裂时,—OH 可以被其他基团取代
二、羧酸的化学反应
1. 羧基中的羟基也可以发生取代反应
⑴与醇(R'OH)的酯化反应:
⑵与氨反应生成酰胺:
实验活动:乙酸乙酯的制备
实验用品
按一定体积比配好的无水乙醇、浓硫酸、冰醋酸的混合物,饱和 Na2CO3 溶液;
pH 试纸,试管,橡胶塞,玻璃导管,酒精灯,铁架台(带铁夹),沸石(碎瓷片)等。
实验方案设计及实施
实验目的
设计合理方案完成乙酸乙酯的制备。
1. 确定反应原理
2. 选择实验装置
实验操作 解释或结论
(1)按图连接实验装置,检查气密性 (2)在试管中加入无水乙醇、浓硫酸、冰醋酸的混合物,试剂总体积不超过试管容积的1/3,并加入沸石 (3)在另一支试管中加入饱和 Na2CO3 溶液, 准备承接导管中流出的产物,导管口不要 伸入 Na2CO3 溶液中 (4)点燃酒精灯,加热反应物至微微沸腾后,改用小火加热 (5)观察饱和 Na2CO3 溶液上方形成的酯层, 获得粗制乙酸乙酯 在试管中加入沸石的原因:
加入饱和 Na2CO3 溶液的目的:
既要对反应物加热,又不能使温度过高的原因:
___________________________________________。
防止暴沸
a.中和挥发出来的乙酸;
b.溶解挥发出来的乙醇;
c.减小乙酸乙酯在水中的溶解度,便于分层,得到乙酸乙酯。
小火:防止乙醇和乙酸挥发,使充分反应
大火:将生成的乙酸乙酯与反应物分离
二、羧酸的化学反应
2. 酸性
羧基中羟基受羰基的影响,其中的氢原子更容易以离子形式电离出来
RCOOH
RCOO-+H+
与醛、酮的羰基相比,羧基中的羰基较难发生加成反应,只有在特定条件或催化剂作用下,反应才能进行。
二、羧酸的化学反应
3. α-H被取代的反应(以RCH2COOH为例)
通过羧酸 α-H 的取代反应,可以合成卤代酸,进而制得氨基酸、羟基酸等。
4.还原反应:
一般情况下,羧基很难被还原,但强还原剂如氢化铝锂(LiAlH4)可将羧基还原,羧酸还原为相应的醇。
拓展:乙酸乙酯的制备与纯化
有机化学实验室大量制备乙酸乙酯通常经过反应回流和产物蒸馏提纯两个步骤。
步骤一:反应回流
在圆底烧瓶中加入体积比为 1∶1 的乙醇和冰醋酸,再加入乙醇和浓硫酸的混合物。将圆底 烧瓶与球形冷凝管连接,用电加热套或油浴加热圆底烧瓶,并保持温度为110~120 ℃(图2-4-5)。 反应物和产物以气体形式从圆底烧瓶逸出进入冷凝管内管,冷凝管的外管以低进高出方式持续通 入冷水,进入内管的气体遇冷又凝结为液体回流至圆底烧瓶中。
拓展:乙酸乙酯的制备与纯化
有机化学实验室大量制备乙酸乙酯通常经过反应回流和产物蒸馏提纯两个步骤。
步骤二:产物蒸馏提纯
反应后将回流装置改装成蒸馏装置(图 2-4-6),用电加热套或油浴加热圆底烧瓶,控制温度在 80 ℃以下,获得粗产品。
在获得的粗产品中缓慢加入饱和 Na2CO3 溶液至无二氧化碳逸出,分液保留酯层;在酯层中 加入等体积的饱和 NaCl 溶液,充分混匀,以洗出酯层中的少量碳酸钠,酯层用 pH 试纸检验呈 中性,分液保留酯层;向产品中继续加入饱和 CaCl2 溶液,充分混匀,以去除酯层中的乙醇, 分液保留酯层;向产品中加入无水硫酸镁,干燥;对产品再次蒸馏,收集 77 ℃左右的馏分。
1.正误判断
(1)乙酸分子中含有羧基,可与NaHCO3溶液或者Na2CO3溶液反应生成CO2
( )
(2)分别向苯酚和醋酸中滴加少量紫色石蕊溶液,溶液都变为红色( )
(3)1 molC2H5OH和1 molCH3COOH在浓硫酸作用下加热可以完全反应生成1 mol
CH3COOC2H5( )
(4)乙酸分子中含有碳氧双键,一定条件下乙酸能与氢气发生加成反应( )
(5)乙酸显酸性,能电离出H+,因此发生酯化反应时断裂H—O( )
×
×
√
×
×
(1)苹果酸分子中所含官能团的名称是 、 。
(2)苹果酸不可能发生的反应有 (填序号)。
①加成反应②酯化反应③加聚反应④氧化反应⑤消去反应⑥取代反应
(3)1 mol苹果酸与足量金属钠反应,可产生 mol H2。
(4)1 mol苹果酸与足量NaHCO3溶液反应,可产生 mol CO2。
(5)一定条件下,2 mol苹果酸发生反应,生成1 mol含有八元环的化合物和2 mol H2O,写出反应的化学方程式:
羟基 羧基
①③
1.5
2
2.苹果酸是一种常见的有机酸,其结构简式为
NaHCO3
NaOH
(或Na2CO3)
NaHCO3
COOH
OH
HOCH2
COONa
OH
HOCH2
COOH
OH
HOCH2
COONa
ONa
HOCH2
Na
COOH
OH
HOCH2
COONa
ONa
NaOCH2
COONa
ONa
HOCH2
足量CO2
+
HOCH2
COONa
OH
羧酸
第2章 官能团与有机化学反应 烃的衍生物
1.了解常见羧酸的结构特点及主要物理性质,会用系统命名法命名简单的羧酸。
2.掌握羧酸的主要化学性质,理解化学性质及官能团与反应类型之间的关系。
羧酸的组成是怎样的?决定羧酸性质的官能团是什么?
醋是人类最早认识和使用的具有酸味的有机化合物,其主要成分是乙酸
白醋、黑醋、苹果醋、麦芽醋
羧酸:乙酸
一、羧酸
1.羧酸的结构
由烃基(或氢原子)与羧基相连而构成的有机化合物称为羧酸。
②饱和一元羧酸通式:
CnH2n+1COOH(或CnH2nO2)
①官能团:
—C—OH
O
羧基:—COOH,
蚁酸(甲酸)
HCOOH
COOH
(苯甲酸)
一、羧酸
2.羧酸的分类
①按分子中烃基的结构分类
②按分子中羧基的个数分类
蚁酸(甲酸)
HCOOH
COOH
(苯甲酸)
脂肪酸
芳香酸
蚁酸(甲酸)
HCOOH
COOH
COOH
草酸 (乙二酸)
柠檬酸
一元羧酸
二元羧酸
多元羧酸
CH2-COOH
HO-C-COOH
CH2-COOH
-
-
一、羧酸
2.羧酸的分类
③按分子中烃基所含碳原子数多少分类
低级
脂肪酸
甲酸_______________
C ≤ 10
乙酸_______________
丙酸______________
硬脂酸
软脂酸
油酸
高级
脂肪酸
C ≥ 10
C17H35COOH
C17H33COOH
C15H31COOH
HCOOH
CH3COOH
CH3CH2COOH
一、羧酸
3.羧酸的命名
⑴选取分子中有羧基的最长碳链作为主链,按主链碳原子数称为“某酸”。
⑵编号码:从羧基开始给主链碳原子编号。
⑶在“某酸”名称之前加上取代基的位次号和名称。
一、羧酸
4.羧酸的物理性质
(1)水溶性:分子中碳原子数在4以下的羧酸能与水互溶。随着碳链的增长,羧酸在水中的溶解度迅速减小,直至与相对分子质量相近的烷烃的溶解度相近。
(2)熔、沸点:羧酸的沸点比相应的醇的沸点高,原因是羧酸分子形成氢键的机会比相对分子质量相近的醇多。
例如,乙酸和 1- 丙醇的相对分子质量都是 60,但乙酸的沸 点为 118℃,1- 丙醇的沸点为 97.4℃。
一、羧酸
5.常见的羧酸
甲酸(蚁酸)
HCOOH
甲酸是有刺激性气味的无色液体,有腐蚀性,能与水、 乙醇、乙醚、甘油等互溶。
甲酸在工业上可用作还原剂,在医疗上可用作消毒剂。
COOH
一、羧酸
5.常见的羧酸
苯甲酸(安息香酸)
苯甲酸是白色针状晶体,易升华,微溶于水,易溶于乙醇、乙醚。
苯甲酸及其钠盐或钾盐常用作食品防腐剂。
一、羧酸
5.常见的羧酸
乙二酸(草酸)
COOH
COOH
乙二酸是无色透明晶体,通常含有结晶水,能溶于水或乙醇,以钠盐或钙盐形式广泛存在于植物中。
一、羧酸
6.常见的取代羧酸
羧酸分子中烃基上的氢原子被其他官能团取代的羧酸称为取代羧酸。
①卤代酸,如氯乙酸:
ClCH2COOH
②氨基酸,如丙氨酸:
α-氨基丙酸
③羟基酸,如乳酸:
α-羟基丙酸
结构 性质
α-氢的反应
δ-
δ+
O—H 断裂时,表现出酸性
C—O 断裂时,—OH 可以被其他基团取代
二、羧酸的化学反应
1. 羧基中的羟基也可以发生取代反应
⑴与醇(R'OH)的酯化反应:
⑵与氨反应生成酰胺:
实验活动:乙酸乙酯的制备
实验用品
按一定体积比配好的无水乙醇、浓硫酸、冰醋酸的混合物,饱和 Na2CO3 溶液;
pH 试纸,试管,橡胶塞,玻璃导管,酒精灯,铁架台(带铁夹),沸石(碎瓷片)等。
实验方案设计及实施
实验目的
设计合理方案完成乙酸乙酯的制备。
1. 确定反应原理
2. 选择实验装置
实验操作 解释或结论
(1)按图连接实验装置,检查气密性 (2)在试管中加入无水乙醇、浓硫酸、冰醋酸的混合物,试剂总体积不超过试管容积的1/3,并加入沸石 (3)在另一支试管中加入饱和 Na2CO3 溶液, 准备承接导管中流出的产物,导管口不要 伸入 Na2CO3 溶液中 (4)点燃酒精灯,加热反应物至微微沸腾后,改用小火加热 (5)观察饱和 Na2CO3 溶液上方形成的酯层, 获得粗制乙酸乙酯 在试管中加入沸石的原因:
加入饱和 Na2CO3 溶液的目的:
既要对反应物加热,又不能使温度过高的原因:
___________________________________________。
防止暴沸
a.中和挥发出来的乙酸;
b.溶解挥发出来的乙醇;
c.减小乙酸乙酯在水中的溶解度,便于分层,得到乙酸乙酯。
小火:防止乙醇和乙酸挥发,使充分反应
大火:将生成的乙酸乙酯与反应物分离
二、羧酸的化学反应
2. 酸性
羧基中羟基受羰基的影响,其中的氢原子更容易以离子形式电离出来
RCOOH
RCOO-+H+
与醛、酮的羰基相比,羧基中的羰基较难发生加成反应,只有在特定条件或催化剂作用下,反应才能进行。
二、羧酸的化学反应
3. α-H被取代的反应(以RCH2COOH为例)
通过羧酸 α-H 的取代反应,可以合成卤代酸,进而制得氨基酸、羟基酸等。
4.还原反应:
一般情况下,羧基很难被还原,但强还原剂如氢化铝锂(LiAlH4)可将羧基还原,羧酸还原为相应的醇。
拓展:乙酸乙酯的制备与纯化
有机化学实验室大量制备乙酸乙酯通常经过反应回流和产物蒸馏提纯两个步骤。
步骤一:反应回流
在圆底烧瓶中加入体积比为 1∶1 的乙醇和冰醋酸,再加入乙醇和浓硫酸的混合物。将圆底 烧瓶与球形冷凝管连接,用电加热套或油浴加热圆底烧瓶,并保持温度为110~120 ℃(图2-4-5)。 反应物和产物以气体形式从圆底烧瓶逸出进入冷凝管内管,冷凝管的外管以低进高出方式持续通 入冷水,进入内管的气体遇冷又凝结为液体回流至圆底烧瓶中。
拓展:乙酸乙酯的制备与纯化
有机化学实验室大量制备乙酸乙酯通常经过反应回流和产物蒸馏提纯两个步骤。
步骤二:产物蒸馏提纯
反应后将回流装置改装成蒸馏装置(图 2-4-6),用电加热套或油浴加热圆底烧瓶,控制温度在 80 ℃以下,获得粗产品。
在获得的粗产品中缓慢加入饱和 Na2CO3 溶液至无二氧化碳逸出,分液保留酯层;在酯层中 加入等体积的饱和 NaCl 溶液,充分混匀,以洗出酯层中的少量碳酸钠,酯层用 pH 试纸检验呈 中性,分液保留酯层;向产品中继续加入饱和 CaCl2 溶液,充分混匀,以去除酯层中的乙醇, 分液保留酯层;向产品中加入无水硫酸镁,干燥;对产品再次蒸馏,收集 77 ℃左右的馏分。
1.正误判断
(1)乙酸分子中含有羧基,可与NaHCO3溶液或者Na2CO3溶液反应生成CO2
( )
(2)分别向苯酚和醋酸中滴加少量紫色石蕊溶液,溶液都变为红色( )
(3)1 molC2H5OH和1 molCH3COOH在浓硫酸作用下加热可以完全反应生成1 mol
CH3COOC2H5( )
(4)乙酸分子中含有碳氧双键,一定条件下乙酸能与氢气发生加成反应( )
(5)乙酸显酸性,能电离出H+,因此发生酯化反应时断裂H—O( )
×
×
√
×
×
(1)苹果酸分子中所含官能团的名称是 、 。
(2)苹果酸不可能发生的反应有 (填序号)。
①加成反应②酯化反应③加聚反应④氧化反应⑤消去反应⑥取代反应
(3)1 mol苹果酸与足量金属钠反应,可产生 mol H2。
(4)1 mol苹果酸与足量NaHCO3溶液反应,可产生 mol CO2。
(5)一定条件下,2 mol苹果酸发生反应,生成1 mol含有八元环的化合物和2 mol H2O,写出反应的化学方程式:
羟基 羧基
①③
1.5
2
2.苹果酸是一种常见的有机酸,其结构简式为
NaHCO3
NaOH
(或Na2CO3)
NaHCO3
COOH
OH
HOCH2
COONa
OH
HOCH2
COOH
OH
HOCH2
COONa
ONa
HOCH2
Na
COOH
OH
HOCH2
COONa
ONa
NaOCH2
COONa
ONa
HOCH2
足量CO2
+
HOCH2
COONa
OH
