5.1 原子的结构 课件(共24张PPT)2024-2025学年高二物理粤教版(2019)选择性必修3
文档属性
| 名称 | 5.1 原子的结构 课件(共24张PPT)2024-2025学年高二物理粤教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版(2019) | ||
| 科目 | 物理 | ||
| 更新时间 | 2025-04-16 20:08:02 | ||
图片预览








文档简介
(共24张PPT)
第五章 原子与原子核
第一节 原子的结构
科学家在研究稀薄气体放电时发现, 当玻璃管内的气体足够稀薄时,阴极就发出一种射线。它能使对着阴极的玻璃管壁发出荧光,这种射线的本质是什么呢?
两种观点:
1.一种电磁波
2.带电微粒
学习目标
1.了解α粒子散射实验原理和实验现象;
2.了解卢瑟福的原子核式结构模型,
3.了解玻尔原子理论的基本假设的主要内容。
4.能用玻尔原子理论解释氢原子能级图及光谱。
一、原子核式结构的提出
近代科学原子论(1803年)
2.原子模型:原子是坚实的,不可再分的实心球。
1.一切物质都是由最小的不能再分的粒子——原子构成
【特别提醒】
(1)注意阴极射线和X射线的区别.阴极射线是电子流,X射线是电磁辐射。
(2)由阴极射线在电场、磁场中的偏转可确定射线由带负电的粒子组成。
J.J汤姆孙在实验室
J. J.汤姆孙通过研究气体电离和光电效应实验现象中发现并完全确认了电子的存在。
阴极射线的本质——电子的发现
电子的基本规律如下:
1.组成阴极射线的成分是电子;
2.密立根通过著名的“油滴实验”精确测定了电子的电荷量:
3.电荷是量子化的;
4.电子的发现的意义:打破了传统的“原子不可分”的观念。
电子的发现打破了传统的“原子不可分”的观念,使人类对自然世界的认识又向前迈进了一步,也大大激发了人们研究原子内部结构的热情。
原子是一个球体,正电荷均匀地分布其中,质量很小的电子镶嵌其中,就像枣点缀在一块蛋糕里一样,所以又被人们称为“枣糕模型”或“葡萄干布丁模型”。
也可理解为“西瓜模型”,电子是西瓜的籽
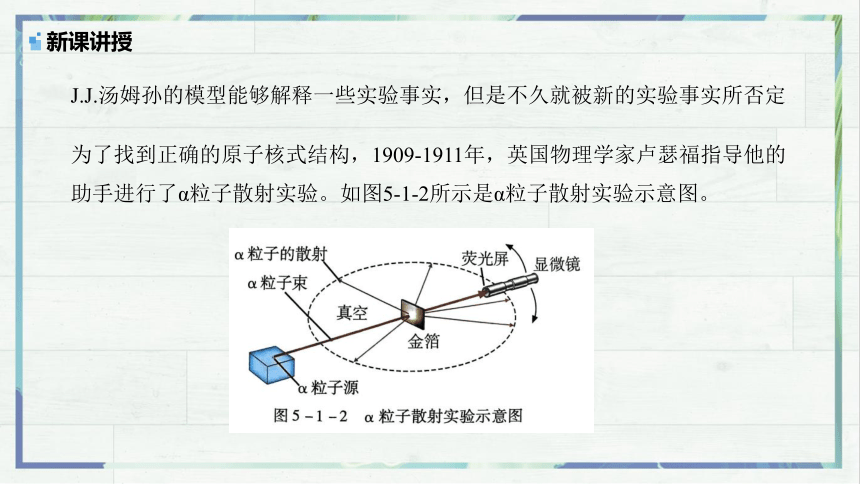
J.J.汤姆孙的模型能够解释一些实验事实,但是不久就被新的实验事实所否定
为了找到正确的原子核式结构,1909-1911年,英国物理学家卢瑟福指导他的助手进行了α粒子散射实验。如图5-1-2所示是α粒子散射实验示意图。
为什么要用α粒子来做散射实验?
原子的结构非常紧密,质量较大的α粒子具有足够的能量接近原子的中心,α粒子还可以使荧光物质发光,如果α粒子与其他粒子发生作用而改变运动方向,荧光屏能显示出它方向的变化。
粒子的散射实验实验结果如下:
绝大多数α粒子穿过金箔后仍沿原来的方向前进,但少数α粒子发生了较大的偏转,并且有极少数α粒子的偏转超过了90°,有的甚至达到180°。
卢瑟福根据他的导师汤姆生模型计算的结果:
电子质量很小,对α粒子的运动方向不会发生明显影响;由于正电荷均匀分布,α粒子所受库仑力也很小,散射角不超过零点几度,发生大角度偏转的几率几乎是零。
实验结果却是有八千分之一的粒子发生了大角度转 !!!
实验结果与之前预测完全不一致,所以原子结构模型必须重新构思!
1911年,卢瑟福提出了原子的核式结构模型。
1.原子核:原子中心有一个很小的核,集中了原子的全部正电荷和几乎全部质量。
2.带负电的电子在核外空间绕着核旋转。
二、氢原子光谱
1.原子光谱:某种原子的气体通电后可以发光并产生固定不变的光谱。
2.氢原子光谱:由实验得到的氢原子光谱是分立的。
每种原子都有自己的特征光谱
发射光谱
吸收光谱:
连续光谱
线状光谱
炽热的固体、液体或高压气体
游离原子、稀薄气体、金属蒸气
原子光谱
物质吸收光子,从低能级跃迁到高能级而产生的光谱
(光源发出)
三、原子的能级结构
氢原子光谱为什么是这样的?
按照经典物理学的观点去推断,在轨道上运动的电子带有电荷,运动中要辐射电磁波,电子损失了能量,其轨道半径不断缩小,最终落在原子核上,由于电子轨道的变化是连续的,辐射电磁波的频率也会连续变化。
事实上,原子是稳定的,辐射电磁波的频率也只是某些确定的值。
+
围绕原子核运动的电子轨道半径只能是某些分立的数值。
且电子在这些轨道上绕核的转动是稳定的,不产生电磁辐射
假说1:轨道量子化
+
m
r
v
原子在不同的轨道上运动时,原子处于不同的状态,波尔指出,原子的不同的状态中具有不同的能量,所以原子的能量也是量子化的。
量子数
——基态
1
2
3
4
5
E5
能级图
假说2:能量量子化
E4
E3
E2
E1
+
当电子从能量较高的定态轨道(其能量记为Em)跃迁到能量较低的定态轨道(能量记为En,m>n)时,会放出能量为hν的光子(h是普朗克常量),这个光子的能量由前后两个能级的能量差决定,
即hν=Em-En
称为频率条件,又称辐射条件
假说3:频率条件(跃迁假说)
1
2
3
4
5
-13.6
-3.4
-1.51
-0.85
-0.54
基态
激发态
氢原子能级的跃迁条件
光子的能量:E=hv
如果电子想从n=1跃迁到n=2的轨道
E2-E1=10.2eV
如果电子想从n=1跃迁到n=3的轨道
E3-E1=12.09eV
则原子需要刚好吸收12.09eV的能量
实物粒子
玻尔的原子理论成功地解释了氢原子光谱的实验规律,是原子结构理论发展中的一个重大进展,但对于稍微复杂一点的原子,例如氦原子,就无法解释它的光谱现象。玻尔理论的局限性主要在于其保留了经典粒子的观念,把电子的运动仍然看做为经典理论下的轨道运动。我们知道,波粒二象性是包括电子在内的一切微观粒子的共同特征。对于电子的运动,我们只能用概率波对其作统计性的描述。当原子处于不同的状态时,电子在原子核周围各处出现的概率不同。图5-1-10氢原子处于基态时的电子云若用疏密不同的点表示电子在各处出现的概率,这样画出的概率分布图称为电子云。
1.下列说法符合事实的是( )
A.原子是不可再分的最小粒子
B.汤姆孙研究阴极射线时发现了电子,并提出原子的“核式结构”模型
C.电子的电荷量最早由密立根通过油滴实验测得
D.汤姆生发现电子,并提出了原子的核式结构
C
2.在α粒子穿过金箔发生大角度散射的过程中,下列说法中正确的是( )
A.α粒子一直受到金原子核的斥力作用
B.α粒子的动能不断减小
C.α粒子和金原子的电势能不断增加
D.α粒子发生散射,是与电子碰撞的结果
A
3.(多选)氢原子各个能级的能量如图所示,大量氢原子由n=1能级跃迁到n=4能级,在它回到n=1能级过程中,下列说法中正确的是( )
A.可能激发出频率不同的光子只有6种
B.可能激发出频率不同的光子只有3种
C.可能激发出的光子的最大能量为12.75 eV
D.可能激发出的光子的最大能量为0.66 eV
AC
第五章 原子与原子核
第一节 原子的结构
科学家在研究稀薄气体放电时发现, 当玻璃管内的气体足够稀薄时,阴极就发出一种射线。它能使对着阴极的玻璃管壁发出荧光,这种射线的本质是什么呢?
两种观点:
1.一种电磁波
2.带电微粒
学习目标
1.了解α粒子散射实验原理和实验现象;
2.了解卢瑟福的原子核式结构模型,
3.了解玻尔原子理论的基本假设的主要内容。
4.能用玻尔原子理论解释氢原子能级图及光谱。
一、原子核式结构的提出
近代科学原子论(1803年)
2.原子模型:原子是坚实的,不可再分的实心球。
1.一切物质都是由最小的不能再分的粒子——原子构成
【特别提醒】
(1)注意阴极射线和X射线的区别.阴极射线是电子流,X射线是电磁辐射。
(2)由阴极射线在电场、磁场中的偏转可确定射线由带负电的粒子组成。
J.J汤姆孙在实验室
J. J.汤姆孙通过研究气体电离和光电效应实验现象中发现并完全确认了电子的存在。
阴极射线的本质——电子的发现
电子的基本规律如下:
1.组成阴极射线的成分是电子;
2.密立根通过著名的“油滴实验”精确测定了电子的电荷量:
3.电荷是量子化的;
4.电子的发现的意义:打破了传统的“原子不可分”的观念。
电子的发现打破了传统的“原子不可分”的观念,使人类对自然世界的认识又向前迈进了一步,也大大激发了人们研究原子内部结构的热情。
原子是一个球体,正电荷均匀地分布其中,质量很小的电子镶嵌其中,就像枣点缀在一块蛋糕里一样,所以又被人们称为“枣糕模型”或“葡萄干布丁模型”。
也可理解为“西瓜模型”,电子是西瓜的籽
J.J.汤姆孙的模型能够解释一些实验事实,但是不久就被新的实验事实所否定
为了找到正确的原子核式结构,1909-1911年,英国物理学家卢瑟福指导他的助手进行了α粒子散射实验。如图5-1-2所示是α粒子散射实验示意图。
为什么要用α粒子来做散射实验?
原子的结构非常紧密,质量较大的α粒子具有足够的能量接近原子的中心,α粒子还可以使荧光物质发光,如果α粒子与其他粒子发生作用而改变运动方向,荧光屏能显示出它方向的变化。
粒子的散射实验实验结果如下:
绝大多数α粒子穿过金箔后仍沿原来的方向前进,但少数α粒子发生了较大的偏转,并且有极少数α粒子的偏转超过了90°,有的甚至达到180°。
卢瑟福根据他的导师汤姆生模型计算的结果:
电子质量很小,对α粒子的运动方向不会发生明显影响;由于正电荷均匀分布,α粒子所受库仑力也很小,散射角不超过零点几度,发生大角度偏转的几率几乎是零。
实验结果却是有八千分之一的粒子发生了大角度转 !!!
实验结果与之前预测完全不一致,所以原子结构模型必须重新构思!
1911年,卢瑟福提出了原子的核式结构模型。
1.原子核:原子中心有一个很小的核,集中了原子的全部正电荷和几乎全部质量。
2.带负电的电子在核外空间绕着核旋转。
二、氢原子光谱
1.原子光谱:某种原子的气体通电后可以发光并产生固定不变的光谱。
2.氢原子光谱:由实验得到的氢原子光谱是分立的。
每种原子都有自己的特征光谱
发射光谱
吸收光谱:
连续光谱
线状光谱
炽热的固体、液体或高压气体
游离原子、稀薄气体、金属蒸气
原子光谱
物质吸收光子,从低能级跃迁到高能级而产生的光谱
(光源发出)
三、原子的能级结构
氢原子光谱为什么是这样的?
按照经典物理学的观点去推断,在轨道上运动的电子带有电荷,运动中要辐射电磁波,电子损失了能量,其轨道半径不断缩小,最终落在原子核上,由于电子轨道的变化是连续的,辐射电磁波的频率也会连续变化。
事实上,原子是稳定的,辐射电磁波的频率也只是某些确定的值。
+
围绕原子核运动的电子轨道半径只能是某些分立的数值。
且电子在这些轨道上绕核的转动是稳定的,不产生电磁辐射
假说1:轨道量子化
+
m
r
v
原子在不同的轨道上运动时,原子处于不同的状态,波尔指出,原子的不同的状态中具有不同的能量,所以原子的能量也是量子化的。
量子数
——基态
1
2
3
4
5
E5
能级图
假说2:能量量子化
E4
E3
E2
E1
+
当电子从能量较高的定态轨道(其能量记为Em)跃迁到能量较低的定态轨道(能量记为En,m>n)时,会放出能量为hν的光子(h是普朗克常量),这个光子的能量由前后两个能级的能量差决定,
即hν=Em-En
称为频率条件,又称辐射条件
假说3:频率条件(跃迁假说)
1
2
3
4
5
-13.6
-3.4
-1.51
-0.85
-0.54
基态
激发态
氢原子能级的跃迁条件
光子的能量:E=hv
如果电子想从n=1跃迁到n=2的轨道
E2-E1=10.2eV
如果电子想从n=1跃迁到n=3的轨道
E3-E1=12.09eV
则原子需要刚好吸收12.09eV的能量
实物粒子
玻尔的原子理论成功地解释了氢原子光谱的实验规律,是原子结构理论发展中的一个重大进展,但对于稍微复杂一点的原子,例如氦原子,就无法解释它的光谱现象。玻尔理论的局限性主要在于其保留了经典粒子的观念,把电子的运动仍然看做为经典理论下的轨道运动。我们知道,波粒二象性是包括电子在内的一切微观粒子的共同特征。对于电子的运动,我们只能用概率波对其作统计性的描述。当原子处于不同的状态时,电子在原子核周围各处出现的概率不同。图5-1-10氢原子处于基态时的电子云若用疏密不同的点表示电子在各处出现的概率,这样画出的概率分布图称为电子云。
1.下列说法符合事实的是( )
A.原子是不可再分的最小粒子
B.汤姆孙研究阴极射线时发现了电子,并提出原子的“核式结构”模型
C.电子的电荷量最早由密立根通过油滴实验测得
D.汤姆生发现电子,并提出了原子的核式结构
C
2.在α粒子穿过金箔发生大角度散射的过程中,下列说法中正确的是( )
A.α粒子一直受到金原子核的斥力作用
B.α粒子的动能不断减小
C.α粒子和金原子的电势能不断增加
D.α粒子发生散射,是与电子碰撞的结果
A
3.(多选)氢原子各个能级的能量如图所示,大量氢原子由n=1能级跃迁到n=4能级,在它回到n=1能级过程中,下列说法中正确的是( )
A.可能激发出频率不同的光子只有6种
B.可能激发出频率不同的光子只有3种
C.可能激发出的光子的最大能量为12.75 eV
D.可能激发出的光子的最大能量为0.66 eV
AC
同课章节目录
- 第一章 分子动理论
- 第一节 物质是由大量分子组成的
- 第二节 分子热运动与分子力
- 第三节 气体分子运动的统计规律
- 第二章 气体、液体和固态
- 第一节 气体实验定律(Ⅰ)
- 第二节 气体实验定律(Ⅱ)
- 第三节 气体实验定律的微观解释
- 第四节 液体的表面张力
- 第五节 晶体
- 第六节 新材料
- 第三章 热力学定律
- 第一节 热力学第一定律
- 第二节 能量守恒定律及其应用
- 第三节 热力学第二定律
- 第四章 波粒二象性
- 第一节 光电效应
- 第二节 光电效应方程及其意义
- 第三节 光的波粒二象性
- 第四节 德布罗意波
- 第五节 不确定性关系
- 第五章 原子与原子核
- 第一节 原子的结构
- 第二节 放射性元素的衰变
- 第三节 核力与核反应方程
- 第四节 放射性同位素
- 第五节 裂变和聚变
