人教版化学高二选修4第三章第一节弱电解质的电离同步练习
文档属性
| 名称 | 人教版化学高二选修4第三章第一节弱电解质的电离同步练习 | 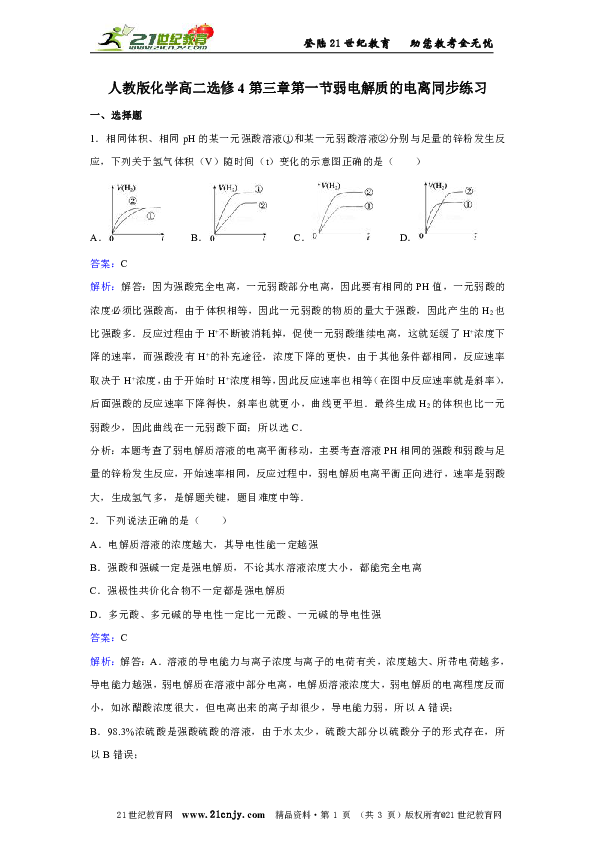 | |
| 格式 | doc | ||
| 文件大小 | 100.0KB | ||
| 资源类型 | 素材 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-05-30 08:24:40 | ||
图片预览



文档简介
登陆21世纪教育 助您教考全无忧
人教版化学高二选修4第三章第一节弱电解质的电离同步练习
一、选择题
1.相同体积、相同pH的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )
A. B. C. D.
答案:C
解析:解答:因为强酸完全电离,一元弱酸部分电离,因此要有相同的PH值,一元弱酸的浓度必须比强酸高,由于体积相等,因此一元弱酸的物质的量大于强酸,因此产生的H2也比强酸多.反应过程由于H+不断被消耗掉,促使一元弱酸继续电离,这就延缓了H+浓度下降的速率,而强酸没有H+的补充途径,浓度下降的更快,由于其他条件都相同,反应速率取决于H+浓度,由于开始时H+浓度相等,因此反应速率也相等(在图中反应速率就是斜率),后面强酸的反应速率下降得快,斜率也就更小,曲线更平坦.最终生成H2的体积也比一元弱酸少,因此曲线在一元弱酸下面;所以选C.
分析:本题考查了弱电解质溶液的电离平衡移动,主要考查溶液PH相同的强酸和弱酸与足量的锌粉发生反应,开始速率相同,反应过程中,弱电解质电离平衡正向进行,速率是弱酸大,生成氢气多,是解题关键,题目难度中等.
2.下列说法正确的是( )
A.电解质溶液的浓度越大,其导电性能一定越强
B.强酸和强碱一定是强电解质,不论其水溶液浓度大小,都能完全电离
C.强极性共价化合物不一定都是强电解质
D.多元酸、多元碱的导电性一定比一元酸、一元碱的导电性强
答案:C
解析:解答:A.溶液的导电能力与离子浓度与离子的电荷有关,浓度越大、所带电荷越多,导电能力越强,弱电解质在溶液中部分电离,电解质溶液浓度大,弱电解质的电离程度反而小,如冰醋酸浓度很大,但电离出来的离子却很少,导电能力弱,所以A错误;
B.98.3%浓硫酸是强酸硫酸的溶液,由于水太少,硫酸大部分以硫酸分子的形式存在,所以B错误;
C.氟的非金属性最强,HF强极性共价化合物,但HF在水溶液中部分电离,为弱电解质,所以C正确;
D.溶液的导电能力与离子浓度与离子的电荷有关,浓度越大、所带电荷越多,导电能力越强,与几元酸碱无关,如磷酸是三元酸,但其为弱酸,同浓度电离出的离子浓度不及二元酸硫酸,所以D错误;所以选C.
分析:本题综合性较大,涉及强电解质、导电能力、极性等,掌握物质的性质是解题的关键,平时注意基础知识的积累.
3.0.1mol L﹣1氨水10mL,加蒸馏水稀释到1L后,下列变化中正确的是( )
①电离程度增大 ②c(NH3 H2O)增大 ③NH4+数目增多
④c(OH﹣)增大 ⑤导电性增强 ⑥增大.
A.①②③ B.①③⑤ C.①③⑥ D.②④⑥
答案:C
解析:解答:①因加水促进弱电解质的电离,则氨水的电离程度增大,所以①正确;
②加水时电离平衡正向移动,n(NH3 H2O)减小,且溶液的体积变大,则c(NH3 H2O)减小,所以②错误;
③加水时电离平衡正向移动,n(NH4+)增大,由N=n×NA,则NH4+数目增多,所以③正确;
④加水时电离平衡正向移动,n(OH﹣)增大,但溶液的体积变大,则c(OH﹣)减小,所以④错误;
⑤加水稀释时,溶液中的离子的浓度减小,则导电性减弱,所以⑤错误;
⑥加水时电离平衡正向移动,n(NH4+)增大,n(NH3 H2O)减小,在同一溶液中体积相同,离子的浓度之比等于物质的量之比,则增大,所以⑥正确;所以选C.
分析:本题考查加水对氨水电离平衡的影响,明确离子的物质的量的变化与浓度的变化的区别是解答的关键,并注意稀释时溶液的体积增大来分析解答.
4.已知:HCl为强酸,下列对比实验不能用于证明CH3COOH为弱酸的是( )
A.对比等浓度的两种酸的pH
B.对比等浓度的两种酸,与相同大小镁条反应的初始速率
C.对比等浓度、等体积的两种酸,与等量NaOH溶液反应后放出的热量
D.对比等浓度、等体积的两种酸,与足量Zn反应,生成H2的体积
答案:D
解析:解答:A.对比等浓度的两种酸的pH,如醋酸pH比盐酸pH大,说明醋酸没有完全电离,可说明为弱酸,A不选;
B.氢离子浓度越大,反应速率越大,可对比等浓度的两种酸,与相同大小镁条反应的初始速率判断酸性的强弱,所以B不选;
C.电解质的电离为吸热过程,如醋酸为弱酸,也发生中和反应放出的热量少于盐酸,可证明酸性的强弱,所以C不选;
D.等浓度、等体积的两种酸,与足量Zn反应,生成H2的体积相等,不能证明酸性的强弱,所以D选.所以选D.
分析:本题考查弱电解质的实验方法设计,注意判断弱电解质的角度,把握正确的判断方法.
5.在0.1mol L﹣1CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO﹣+H+,对于该平衡,下列叙述不正确的是( )
A.加水稀释,电离平衡正向移动,溶液中n(H+)减小
B.加热,电离平衡正向移动,溶液中c(CH3COO﹣)增大
C.通入少量HCl气体,电离平衡逆向移动,溶液中c(H+)增大
D.加入少量CH3COONa固体,电离平衡逆向移动,溶液中c(H+)减小
答案:A
解析:解答:A.加水稀释,电离平衡正向移动,溶液中n(H+)增大,所以A错误;
B.弱电解质的电离为吸热过程,加热促进电离,溶液中c(CH3COO﹣)增大,所以B正确;
C.氯化氢是强电解质,在水溶液里完全电离,则向醋酸中加入等浓度的盐酸,溶液中氢离子浓度增大,抑制醋酸电离,所以C正确;
D.加入少量CH3COONa固体,由电离平衡可知,c(CH3COO﹣)增大,则电离平衡逆向移动,溶液中c(H+)减小,所以D正确.所以选A.
分析:本题考查了弱电解质的电离,明确加水稀释时促进弱电解质电离,但酸溶液中除了氢氧根离子外,其它离子浓度都减小,再结合平衡移动影响因素来分析解答.
6.下列说法正确的是( )
A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
B.因为CH3COOH是弱电解质,HCl是强电解质,所以中和等体积、等物质的量浓度的醋酸和盐酸时,中和醋酸消耗的NaOH比中和盐酸消耗的NaOH的量少
C.足量Zn分别与等体积、等物质的量浓度的盐酸和醋酸反应时,产生H2的量相同,放出H2的速率不同
D.在物质的量浓度相同的磷酸钠溶液和磷酸溶液中PO43-的物质的量浓度相同
答案:C
解析:解答:A、溶液导电能力取决于溶液中离子浓度大小,强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强,所以A错误;
B、中和等体积、等物质的量浓度的醋酸和盐酸时,醋酸和盐酸都是一元酸消耗氢氧化钠相同,所以B错误;
C、足量Zn分别与等体积、等物质的量浓度的盐酸和醋酸反应时,醋酸和氯化氢物质的量相同,产生H2的量相同,醋酸是弱酸存在电离平衡,氢离子浓度小于盐酸溶液中,放出H2的速率不同,所以C正确;
D、磷酸钠是强电解质溶于水是盐溶液,磷酸是弱酸存在电离平衡,在物质的量浓度相同的磷酸钠溶液和磷酸溶液中磷酸钠溶液中磷酸根离子浓度大,所以D错误;所以选C.
分析:本题考查电解质溶液导电能力,强弱电解质的分析判断,酸碱反应的电离分析应用,盐类水解和弱电解质电离平衡的理解.
7.可以证明乙酸是弱酸的事实是( )
A.乙酸和水能任意比例混溶
B.1mol L﹣1的醋酸水溶液能使紫色石蕊试液变红色
C.醋酸能与碳酸钠溶液反应生成CO2气体
D.醋酸溶液中存在醋酸分子
答案:D
解析:解答:完全电离的电解质为强电解质,只有部分电离的电解质为弱电解质,要证明乙酸是弱酸,只要证明乙酸部分电离即可,
A.乙酸和水以任意比例互溶,不能说明乙酸部分电离,所以不能证明乙酸是弱电解质,所以A错误;
B.1mol L﹣1的醋酸水溶液能使紫色石蕊试液变红色,说明醋酸水溶液呈酸性,则醋酸是酸,但不能说明醋酸部分电离,所以不能证明醋酸是弱电解质,所以B错误;
C.醋酸能与碳酸钠溶液反应生成CO2气体,说明醋酸酸性大于碳酸,但不能说明醋酸部分电离,所以不能证明醋酸是弱电解质,所以C错误;
D.醋酸溶液中存在醋酸分子,说明醋酸部分电离,所以证明醋酸是弱电解质,所以D正确;
所以选D.
分析:本题考查电解质强弱判断,强弱电解质的根本区别是电离程度,电解质强弱与溶解性无关.
8.已知:(1)Al(OH)3的电离方程式为:AlO2﹣+H++H2OAl(OH)3Al3++3OH﹣
(2)无水AlCl3晶体的沸点为182.9℃,溶于水的电离方程式为:AlCl3=Al3++3Cl﹣
(3)PbSO4难溶于水,易溶于醋酸钠溶液,反应的化学方程式为:PbSO4+2CH3COONa=Na2SO4+(CH3COO)2Pb
则下列关于Al(OH)3、AlCl3和(CH3COO)2Pb的说法中正确的是( )
A.均为强电解质 B.均为弱电解质 C.均为离子化合物 D.均为共价化合物
答案:D
力的区别.
解析:解答:A.Al(OH)3在水溶液中部分电离,属于弱电解质,所以A错误;
B.AlCl3在水溶液中完全电离,属于强电解质,所以B错误;
C.无水AlCl3晶体的沸点为182.9℃,沸点较低,所以氯化铝为共价化合物,所以C错误;
D.三者只含有共价键,不含有离子键,所以均为共价化合物,所以D正确,所以选D.
分析:本题考查强弱电解质、离子化合物和共价化合物的判断.根据物质中所含化学键来确定化合物类型,明确离子化合物和共价化合物的概念是解本题关键.
9.下列电离方程式书写正确的是( )
A.H2S 2H++S2﹣ B.Al(OH)3═Al3++3OH﹣
C.NH3 H2O NH4++OH﹣ D.NaHCO3═Na++H++CO32﹣
答案:C
解析:解答:A、硫化氢是多元弱酸,只写第一步电离,正确电离方程式为:H2S H++HS﹣,所以A错误;
B、氢氧化铝是弱碱,用可逆号,正确的电离方程式为:Al(OH)3 Al3++3OH﹣,所以B错误;
C、氨水是弱电解质,电离方程式为:NH3 H2O NH4++OH﹣,所以C正确;
D、碳酸是弱酸,碳酸氢根离子不能拆开,正确的电离方程式为:NaHCO3═Na++HCO3﹣,所以D错误;所以选C.
分析:本题考查电离方程式的书写,明确书写方法及弱酸根离子的书写时解答的关键,注意水合氢离子为解答的易错点.
10.下列电离方程式正确的是( )
A.NaHCO3(溶液):NaHCO3=Na++H++CO32﹣
B.NaHSO4(熔融):NaHSO4=Na++H++SO42﹣
C.(NH4)2SO4(溶液):(NH4)2SO4=(NH4)2++SO42﹣
D.NH3 H2O(溶液):NH3 H2O NH4++OH﹣
答案:D
解析:解答:A、NaHCO3(溶液)的电离方程式为:NaHCO3=Na++HCO3﹣,所以A错误;
B、NaHSO4(熔融)时,只能电离出两种离子,即:NaHSO4=Na++HSO4﹣,所以B错误;
C、(NH4)2SO4(溶液)的电离方程式为:(NH4)2SO4=2NH4++SO42﹣,所以C错误;
D、一水合氨是弱电解质,电离方程式为:NH3 H2O NH4++OH﹣,所以D正确.所以选D.
分析:书写电离方程式注意:弱电解质的电离要用可逆号;要注意电荷和粒子个数的书写.特别的是NaHSO4(熔融):NaHSO4=Na++HSO4﹣.
11.下列电离方程式中正确的是( )
A.HF溶于少量水中:HF+H2O F﹣+H3O+
B.H2S溶于水:H2S 2H++S2﹣
C.Na2HPO4溶于水:Na2HPO4═2Na++H++PO43﹣
D.NaHSO4熔融:NaHSO4═Na++H++SO42﹣
答案:A
解析:解答:A.HF溶于少量水中,氢氟酸为弱酸,存在电离平衡,其电离方程式为:HF+H2O F﹣+H3O+,所以A正确;
B.H2S溶于水,氢硫酸的电离分步进行,其电离方程式只写出第一步即可,正确的电离方程式为:H2S H++HS﹣,所以B错误;
C.Na2HPO4溶于水后完全电离,其中HPO42﹣不能拆开,正确的电离方程式为:Na2HPO4═2Na++HPO42﹣,所以C错误;
D.NaHSO4熔融中电离出钠离子和硫酸氢根离子,正确的电离方程式为:NaHSO4═Na++HSO4﹣,所以D错误;所以选A.
分析:本题考查了电离方程式的书写判断,题目难度中等,注意掌握电离方程式的书写原则,明确多元弱酸的电离分步进行,其电离方程式只写出第一步即可,选项D为易错点,注意熔融硫酸氢钠电离的阴离子为硫酸氢根离子.
12.下列说法正确的是( )
A.HClO和NaClO都是弱电解质
B.胶体能产生丁达尔效应,而溶液不能
C.1mol H2SO4与1mol Ba(OH)2反应放出的热量叫做中和热
D.HCl和NaCl溶于水破坏的化学键完全相同
答案:B
解析:解答:A.HClO是弱酸,在水溶液中部分电离,是弱电解质;NaClO是盐,在在水溶液中完全电离,是强电解质,所以A错误;
B.丁达尔效应是胶体的性质,溶液没有丁达尔效应,所以B正确;
C.1molH2SO4与1molBa(OH)2反应生成2mol水和1mol硫酸钡沉淀,所以C错误;
D.HCl溶于水破坏的是共价键,NaCl溶于水破坏的是离子键,化学键的种类不同,所以D错误,所以选B.
分析:本题考查强弱电解质的判断、胶体的性质、中和热的概念、化学键的判断,知识点较多.要注意基础知识的积累.
13.下列事实能说明某物质是强电解质的是( )
A.该物质在水中的溶解度大
B.该物质的水溶液导电能力强
C.该物质的水溶液中不存在溶质分子
D.该物质的水溶液中存在除水外的电离平衡
答案:C
解析:解答:A、易溶于水的物质不一定是强电解质,如醋酸,即电解质的强弱与溶解度无关,所以A错误;
B、水溶液能导电能力强的物质不一定是强电解质,如醋酸为弱电解质,导电能力强于硫酸钡(微溶,溶解部分完全电离),即导电能力与电解质强弱无关,所以B错误;
C、该物质的水溶液中不存在溶质分子,说明完全电离,是强电解质,所以C正确;
D、该物质的水溶液中存在除水外的电离平衡,说明有除水外还有不完全电离的物质,恰恰说明某物质是弱电解质,所以D错误;所以选C.
分析:本题考查了强电解质的判断,根据电解质的电离程度划分强弱电解质,与溶液的导电性、是否挥发、物质的溶解性等都无关,为易错点.
14.下列说法中正确的是( )
A.氯化钠水溶液在电流的作用下电离出Na+和Cl﹣
B.硫酸钡难溶于水,但硫酸钡属于强电解质
C.二氧化碳溶于水能部分电离,所以二氧化碳属于弱电解质
D.硫酸钠在水中的电离方程式可表示为Na2SO4═2Na++S6++4O2﹣
答案:B
解析:解答:A.氯化钠水溶液不需要电流,而是在溶液中水的作用下能够电离出Na+和Cl﹣,所以A错误;
B.硫酸钡在熔融状态下能够完全电离出钡离子和硫酸钡离子,硫酸钡属于强电解质,所以B正确;
C.二氧化碳溶于水,发生电离的是碳酸,碳酸为弱电解质,而二氧化碳不能电离出离子,属于二氧化碳为非电解质,所以C错误;
D.硫酸钠在水中完全电离出钠离子和硫酸根离子,硫酸根离子不能拆开,硫酸钠正确的电离方程式为Na2SO4═2Na++SO42﹣,所以D错误;所以选B.
分析:本题考查了电解质与非电解质、强电解质与弱电解质的判断及电离方程式的书写,注意掌握电解质与非电解质、强弱电解质的概念,明确强弱电解质与溶解度之间的关系,能够正确书写常见电解质的电离方程式.
15.下列有关电解质的说法错误的是( )
A.强电解质溶液的导电性不一定强于弱电解质溶液的导电性
B.电解质溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数
C.易溶物是强电解质,难溶物一定是弱电解质
D.硫酸钡在水里的溶解度很小,但溶于水的硫酸钡全部电离,所以硫酸钡是强电解质
答案:C
解析:解答:A.强电解质溶液的导电性不一定比弱电解质溶液的导电性强,溶液的导电性取决于离子浓度的大小,如氯化银为强电解质,但溶液浓度却很小,导电能力弱,所以A正确;
B.因为溶液不显电性,所以溶液中阳离子所带正电荷总数与阴离子所带负电荷总数相等.所以B正确;
C.电解质的强弱和溶解度无关,硫酸钡难溶于水,但它是强电解质,乙酸易溶于水,但它是弱酸,所以C错误;
D.强电解质指在水溶液中或熔融状态下,能完全电离,硫酸钡属于强电解质,虽在水溶液中很难溶解,但溶于水的部分能完全电离,所以D正确;所以选C.
分析:本题考查了强、弱电解质的概念辨析,解答时抓住选项中的关键词结合相关知识解答.
16.下列说法正确的一组是:①不溶于水的盐都是弱电解质;②可溶于水的盐一定都是强电解质;③0.5mol/L一元酸溶液H+浓度一定为0.5mol/L;④强酸溶液中的H+浓度一定大于弱酸溶液中的H+浓度;⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子;⑥熔融的电解质都能导电( )
A.①③⑤⑥ B.②④⑤⑥ C.只有⑤ D.只有⑥
答案:C
解析:解答:①电解质的强弱与溶解性无关,不溶于水的盐可能是强电解质,如硫酸钡,所以①错误;
②电解质的强弱与溶解性无关,可溶于水的盐可能是弱电解质,如醋酸铅,所以②错误;
③0.5mol/L一元酸溶液H+浓度不一定为0.5mol/L,如醋酸,所以③错误;
④强酸溶液中的H+浓度不一定大于弱酸溶液中的H+浓度,H+浓度与酸的浓度、分子中氢离子的个数以及电离程度有关,与电解质的强弱无关,所以④错误;
⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子,所以⑤正确;
⑥酸在熔融态时均不导电,只有溶于水时才导电,所以⑥错误;所以选C.
分析:本题考查学生强电解质和弱电解质的概念,可以根据所学知识进行回答,注意举例说明,难度中等.
17.可以证明次氯酸是弱酸的事实是( )
A.可与碱反应 B.有漂白性
C.见光能分解 D.次氯酸钙溶液可与碳酸反应生成次氯酸
答案:D
解析:解答:A、盐酸、硫酸属于强酸,碳酸属于弱酸,都能与碱反应,如与氢氧化钠反应,所以A错误;
B、次氯酸有漂白性,是因为次氯酸具有强氧化性,所以B错误;
C、见光能分解说明次氯酸不稳定,与酸性强弱无关,如硝酸属于强酸,见光易分解,所以C错误;
D、次氯酸钙溶液可与碳酸反应生成次氯酸,次氯酸的酸性比碳酸弱,碳酸是弱酸,属于次氯酸属于弱酸,所以D正确.
所以选D.
分析:本题考查弱酸的概念、弱酸性与性质关系等,注意弱酸的实质是酸不能完全电离.
18.下列事实能说明碳酸的酸性比乙酸弱的是( )
A.乙酸能发生酯化反应,而碳酸不能
B.碳酸和乙酸都能与碱反应
C.乙酸易挥发,而碳酸不稳定易分解
D.乙酸和Na2CO3反应可放出CO2
答案:比较弱酸的相对强弱的实验
解析:解答:A、乙酸能发生酯化反应是由于含有羧基,与酸性强弱无关,所以A错误;
B、碳酸和乙酸都能与碱反应,说明二者都具有酸性,但不能判断酸性的强弱,所以B错误;
C、挥发性和不稳定性与酸性强弱无关,所以C错误.
D、乙酸和Na2CO3反应可放出CO2,反应进行符合复分解反应发生的条件,应为强酸制备弱酸,酸性乙酸较强,所以D正确.所以选D.
分析:本题考查酸性强弱比较,比较基础,注意基础知识掌握.
19.对常温下 c(H+)=0.001 mol L﹣1的CH3COOH溶液,下列叙述不正确的是( )
A.c(H+)=c(CH3COO﹣)+c(OH﹣)
B.加入少量CH3COONa固体后,c(CH3COO﹣)增大
C.与等体积c(OH﹣)=0.001 mol L﹣1的NaOH溶液混合后所得溶液显碱性
D.与等体积c(OH﹣)=0.001 mol L﹣1的NaOH溶液混合后所得溶液显酸性
答案:C
解析:解答:A.醋酸溶液呈电中性,溶液中存在电荷守恒c(H+)=c(OH﹣)+c(CH3COO﹣),所以A正确;
B.加入少量CH3COONa固体后,虽然平衡向逆反应方向移动,但c(CH3COO﹣)增大,所以B正确;
C.等体积c(OH﹣)=0.001 mol L﹣1的NaOH溶液混合,则c(NaOH)=0.001 mol L﹣1,醋酸过量,反应后溶液呈酸性,所以C错误;
D.等体积c(OH﹣)=0.001 mol L﹣1的NaOH溶液混合,则c(NaOH)=0.001 mol L﹣1,醋酸过量,反应后溶液呈酸性,所以D正确.所以选C.
分析:本题考查了弱电解质的电离,为高频考点,侧重于学生的分析能力的考查,注意把握溶液中存在电荷守恒,注意离子浓度大小的判断方法.
20.室温下向10mL c(H+)=0.001 mol L﹣1的醋酸溶液中加水稀释后,下对说法正确的是( )
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中不变
D.再加入c(OH﹣)=0.001 mol L﹣1的NaOH溶液,混合液的PH=7
答案:C
解析:解答:A.弱电解质,浓度越稀,电离程度越大,醋酸溶液中加水稀释,促进电离,溶液中导电粒子的数目增多,所以A错误;
B.醋酸溶液中加水稀释,醋酸的电离程度增大,因溶液的体积增大的倍数大于n(H+)增加的倍数,则c(H+)减小,酸性减弱,所以B错误;
C.醋酸的电离平衡常数,温度不变,Ka不变,所以C正确;
D.等体积10mL c(H+)=0.001 mol L﹣1的醋酸与c(OH﹣)=0.001 mol L﹣1的NaOH溶液混合时,醋酸的浓度大于0.001mol/L,醋酸过量,则溶液的pH<7,所以D错误;所以选C.
分析:本题考查了弱电解质的稀释,明确温度与电离平衡常数的关系、溶液的pH与物质的量浓度的关系、稀释中溶液体积的变化与离子的物质的量的变化关系是解答本题的关键.
二、非选择题
21.在氢氟酸溶液中,存在下列电离平衡:HF H++F﹣,
(1)加入NaOH固体后,电离平衡向 (填“正”或“逆”)反应方向移动,C(H+) (填“增大”,“减小”或“不变”).
答案:正|减小
(2)加入NaF固体后,电离平衡向 (填“正”或“逆”)反应方向移动,C(H+) (填“增大”,“减小”或“不变”).
答案:逆|减小
(3)加水稀释,电离平衡向 (填“正”或“逆”)反应方向移动,C(H+) (填“增大”,“减小”或“不变”).
答案:正|减小
解析:解答:(1)加入氢氧化钠固体,氢氧化钠和氢离子反应生成水,促进氢氟酸电离,溶液中氢离子浓度减小,所以答案为:正;减小;
(2)向溶液中加入氟化钠固体,氟离子浓度增大,抑制氢氟酸电离,平衡向逆反应方向移动,溶液中氢离子浓度减小,所以答案为:逆;减小;
(3)弱电解质存在电离平衡,加水稀释促进电离,电离平衡正向进行,但平衡状态各微粒的浓度减小,所以答案为:正,减小;
分析:本题考查了弱电解质的电离,明确影响弱电解质电离的因素是解本题关键.
22.一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
(1)冰醋酸在O点时是否导电 (填是或否),理由是 .
答案:否|共价化合物在固态时不导电
(2)H+的物质的量最大的是 (填“a”、“b”或“c”).
答案:c
(3)若使c点溶液中的c(CH3COO﹣)增大,可以采取下列措施中的 (填序号).
A.加热 B.加很稀的NaOH溶液 C.加NaOH固体
D.加水 E.加固体CH3COONa F.加入锌粒.
答案:ACEF
解析:解答:(1)醋酸是共价化合物,冰醋酸中没有自由移动电子,不能导电,所以答案为:否;共价化合物在固态时不导电;
(2)醋酸是弱电解质,随着醋酸的稀释,醋酸电离程度越大,根据图片知,醋酸电离程度最大的是c点,则c点氢离子的物质的量最大,但氢离子浓度最大的是b,所以选c;
(3)若使c点溶液中的c(CH3COO﹣)增大,可以采用升高温度、加入含有醋酸根离子的可能性盐、加入固体碱或加入和氢离子反应的固体物质.
(3)A.醋酸是弱电解质,电离时需要吸收热量,所以加热促进醋酸电离,导致醋酸根离子浓度最大,所以正确;
B.加很稀的NaOH溶液,促进醋酸电离,但醋酸电离程度远远小于溶液体积增大程度,所以醋酸根离子浓度减小,所以错误;
C.加NaOH固体,NaOH和醋酸发生中和反应生成醋酸钠,促进醋酸电离,溶液体积不变,醋酸根离子浓度增大,所以正确;
D.加水促进醋酸电离,但醋酸电离程度远远小于溶液体积增大程度,所以醋酸根离子浓度减小,所以错误;
E.加固体CH3COONa,醋酸钠电离出醋酸根离子导致醋酸根离子浓度增大,所以正确;
F.加入锌粒,锌和氢离子发生置换反应而促进醋酸电离,则醋酸根离子浓度增大,所以正确;
所以选ACEF.
分析:本题考查弱电解质的电离,明确弱电解质电离影响因素是解本题关键,知道溶液导电能力与离子浓度成正比,与电解质强弱无关.
23.已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,回答下列问题:
(1)该溶液中c(H+)= .
答案:10﹣4mol/L
(2)HA的电离平衡常数K= ;
答案:1×10﹣7
(3)升高温度时,K (填“增大”,“减小”或“不变”).
答案:增大
解析:解答:(1)HA电离出的c(H+)为0.1mol/L×0.1%=10﹣4mol/L,所以答案为:10﹣4mol/L;
(2)由HA═H++Ac﹣,c(H+)=c(Ac﹣)=10﹣4mol/L,则电离平衡常数为Ka==1×10﹣7,所以答案为:1×10﹣7;
(3)因HA的电离是吸热过程,温度升高促进电离,氢氧根离子、氢离子浓度越大,则K增大,所以答案为:增大;
分析:本题考查弱酸的电离,为高频考点,侧重于学生的分析能力和计算能力的考查,明确离子的浓度、温度对电离平衡的影响及离子积的计算即可解答.
24.在稀氨水中存在下述电离平衡NH3+H2O NH3 H2O NH4++OH﹣,分别加入少量下列物质,溶液中c(OH﹣)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?
加入的物质 少量(NH4)2SO4固体 少量HNO3溶液 少量KOH溶液
c(OH﹣)的变化 ① ② ③
平衡移动方向 ④ ⑤ ⑥
答案:减小|减小|增大|左移|右移|左移
解析:解答:氨水中存在NH3+H2O NH3 H2O NH4++OH﹣,向氨水中加入少量硫酸铵,硫酸铵中含量铵根离子,导致溶液中铵根离子浓度增大,抑制氨水电离,平衡向左移动,所以溶液中氢氧根离子浓度减小;
向氨水中加入少量硝酸,氢离子和氢氧根离子反应,导致氢氧根离子浓度减小,促进氨水电离,平衡向右移动;
向氨水中加入少量氢氧化钾,导致氢氧根离子浓度增大,抑制氨水电离,平衡向左移动,
所以答案为:加入的物质-少量(NH4)2SO4固体-少量HNO3溶液-少量KOH溶液
c(OH﹣)的变化-①减小-②减小-③增大;平衡移动方向-④左移-⑤右移-⑥左移.
分析:本题考查弱电解质电离,加入相同的离子则抑制弱电解质电离,加入和溶液中离子反应的物质则促进其电离.
25.有浓度为0.1mol L﹣1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+) 依次为a mol L﹣1,b mol L﹣1,c mol L﹣1,其大小顺序为 .
答案:a=b>c
(2)等体积的以上三种酸分别与过量的NaOH 溶液反应,生成的盐的物质的量依次为n 1mol,n2 mol,n3 mol,它们的大小关系为
答案:n1 =n2=n3
(3)中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为
答案:V1=2V2=V3
(4)与锌反应时产生氢(气)的速率分别为v1、v2、v3,其大小关系为 .
答案:v2>v1>v3
解析:解答:(1)氯化氢和硫酸是强电解质,盐酸是一元酸,硫酸是二元酸,醋酸是弱电解质且是一元酸,所以盐酸中氢离子浓度与酸的浓度相等,硫酸中氢离子浓度是硫酸的浓度的2倍,醋酸中氢离子浓度小于醋酸的浓度,所以氢离子浓度其大小顺序为a=b>c,所以答案为:a=b>c;
(2)根据阴离子守恒知,盐的物质的量与酸的物质的量相等,所以生成的盐的物质的量大小关系为n1 =n2=n3,所以答案为:n1 =n2=n3;
(3)中和一定量NaOH溶液生成正盐时,酸的浓度相等,如果是一元酸,所用酸的体积相等,如果是二元酸,酸的体积是一元酸的一半,所以三种酸的体积大小关系是V1=2V2=V3,
所以答案为:V1=2V2=V3;
(4)与锌反应时产生氢(气)的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,三种酸中硫酸中氢离子浓度为0.2mol/L,盐酸中氢离子浓度为0.1mol/L,醋酸中氢离子浓度小于0.1mol/L,所以反应速率大小关系为v2>v1>v3,所以答案为:v2>v1>v3.
分析:本题考查了弱电解质的电离,难度不大,注意(4)中生成氢气的反应速率与氢离子浓度成正比,分清是初始速率还反应过程中的反应速率.
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网 www.21cnjy.com 精品资料·第 15 页 (共 15 页)版权所有@21世纪教育网
人教版化学高二选修4第三章第一节弱电解质的电离同步练习
一、选择题
1.相同体积、相同pH的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )
A. B. C. D.
答案:C
解析:解答:因为强酸完全电离,一元弱酸部分电离,因此要有相同的PH值,一元弱酸的浓度必须比强酸高,由于体积相等,因此一元弱酸的物质的量大于强酸,因此产生的H2也比强酸多.反应过程由于H+不断被消耗掉,促使一元弱酸继续电离,这就延缓了H+浓度下降的速率,而强酸没有H+的补充途径,浓度下降的更快,由于其他条件都相同,反应速率取决于H+浓度,由于开始时H+浓度相等,因此反应速率也相等(在图中反应速率就是斜率),后面强酸的反应速率下降得快,斜率也就更小,曲线更平坦.最终生成H2的体积也比一元弱酸少,因此曲线在一元弱酸下面;所以选C.
分析:本题考查了弱电解质溶液的电离平衡移动,主要考查溶液PH相同的强酸和弱酸与足量的锌粉发生反应,开始速率相同,反应过程中,弱电解质电离平衡正向进行,速率是弱酸大,生成氢气多,是解题关键,题目难度中等.
2.下列说法正确的是( )
A.电解质溶液的浓度越大,其导电性能一定越强
B.强酸和强碱一定是强电解质,不论其水溶液浓度大小,都能完全电离
C.强极性共价化合物不一定都是强电解质
D.多元酸、多元碱的导电性一定比一元酸、一元碱的导电性强
答案:C
解析:解答:A.溶液的导电能力与离子浓度与离子的电荷有关,浓度越大、所带电荷越多,导电能力越强,弱电解质在溶液中部分电离,电解质溶液浓度大,弱电解质的电离程度反而小,如冰醋酸浓度很大,但电离出来的离子却很少,导电能力弱,所以A错误;
B.98.3%浓硫酸是强酸硫酸的溶液,由于水太少,硫酸大部分以硫酸分子的形式存在,所以B错误;
C.氟的非金属性最强,HF强极性共价化合物,但HF在水溶液中部分电离,为弱电解质,所以C正确;
D.溶液的导电能力与离子浓度与离子的电荷有关,浓度越大、所带电荷越多,导电能力越强,与几元酸碱无关,如磷酸是三元酸,但其为弱酸,同浓度电离出的离子浓度不及二元酸硫酸,所以D错误;所以选C.
分析:本题综合性较大,涉及强电解质、导电能力、极性等,掌握物质的性质是解题的关键,平时注意基础知识的积累.
3.0.1mol L﹣1氨水10mL,加蒸馏水稀释到1L后,下列变化中正确的是( )
①电离程度增大 ②c(NH3 H2O)增大 ③NH4+数目增多
④c(OH﹣)增大 ⑤导电性增强 ⑥增大.
A.①②③ B.①③⑤ C.①③⑥ D.②④⑥
答案:C
解析:解答:①因加水促进弱电解质的电离,则氨水的电离程度增大,所以①正确;
②加水时电离平衡正向移动,n(NH3 H2O)减小,且溶液的体积变大,则c(NH3 H2O)减小,所以②错误;
③加水时电离平衡正向移动,n(NH4+)增大,由N=n×NA,则NH4+数目增多,所以③正确;
④加水时电离平衡正向移动,n(OH﹣)增大,但溶液的体积变大,则c(OH﹣)减小,所以④错误;
⑤加水稀释时,溶液中的离子的浓度减小,则导电性减弱,所以⑤错误;
⑥加水时电离平衡正向移动,n(NH4+)增大,n(NH3 H2O)减小,在同一溶液中体积相同,离子的浓度之比等于物质的量之比,则增大,所以⑥正确;所以选C.
分析:本题考查加水对氨水电离平衡的影响,明确离子的物质的量的变化与浓度的变化的区别是解答的关键,并注意稀释时溶液的体积增大来分析解答.
4.已知:HCl为强酸,下列对比实验不能用于证明CH3COOH为弱酸的是( )
A.对比等浓度的两种酸的pH
B.对比等浓度的两种酸,与相同大小镁条反应的初始速率
C.对比等浓度、等体积的两种酸,与等量NaOH溶液反应后放出的热量
D.对比等浓度、等体积的两种酸,与足量Zn反应,生成H2的体积
答案:D
解析:解答:A.对比等浓度的两种酸的pH,如醋酸pH比盐酸pH大,说明醋酸没有完全电离,可说明为弱酸,A不选;
B.氢离子浓度越大,反应速率越大,可对比等浓度的两种酸,与相同大小镁条反应的初始速率判断酸性的强弱,所以B不选;
C.电解质的电离为吸热过程,如醋酸为弱酸,也发生中和反应放出的热量少于盐酸,可证明酸性的强弱,所以C不选;
D.等浓度、等体积的两种酸,与足量Zn反应,生成H2的体积相等,不能证明酸性的强弱,所以D选.所以选D.
分析:本题考查弱电解质的实验方法设计,注意判断弱电解质的角度,把握正确的判断方法.
5.在0.1mol L﹣1CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO﹣+H+,对于该平衡,下列叙述不正确的是( )
A.加水稀释,电离平衡正向移动,溶液中n(H+)减小
B.加热,电离平衡正向移动,溶液中c(CH3COO﹣)增大
C.通入少量HCl气体,电离平衡逆向移动,溶液中c(H+)增大
D.加入少量CH3COONa固体,电离平衡逆向移动,溶液中c(H+)减小
答案:A
解析:解答:A.加水稀释,电离平衡正向移动,溶液中n(H+)增大,所以A错误;
B.弱电解质的电离为吸热过程,加热促进电离,溶液中c(CH3COO﹣)增大,所以B正确;
C.氯化氢是强电解质,在水溶液里完全电离,则向醋酸中加入等浓度的盐酸,溶液中氢离子浓度增大,抑制醋酸电离,所以C正确;
D.加入少量CH3COONa固体,由电离平衡可知,c(CH3COO﹣)增大,则电离平衡逆向移动,溶液中c(H+)减小,所以D正确.所以选A.
分析:本题考查了弱电解质的电离,明确加水稀释时促进弱电解质电离,但酸溶液中除了氢氧根离子外,其它离子浓度都减小,再结合平衡移动影响因素来分析解答.
6.下列说法正确的是( )
A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
B.因为CH3COOH是弱电解质,HCl是强电解质,所以中和等体积、等物质的量浓度的醋酸和盐酸时,中和醋酸消耗的NaOH比中和盐酸消耗的NaOH的量少
C.足量Zn分别与等体积、等物质的量浓度的盐酸和醋酸反应时,产生H2的量相同,放出H2的速率不同
D.在物质的量浓度相同的磷酸钠溶液和磷酸溶液中PO43-的物质的量浓度相同
答案:C
解析:解答:A、溶液导电能力取决于溶液中离子浓度大小,强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强,所以A错误;
B、中和等体积、等物质的量浓度的醋酸和盐酸时,醋酸和盐酸都是一元酸消耗氢氧化钠相同,所以B错误;
C、足量Zn分别与等体积、等物质的量浓度的盐酸和醋酸反应时,醋酸和氯化氢物质的量相同,产生H2的量相同,醋酸是弱酸存在电离平衡,氢离子浓度小于盐酸溶液中,放出H2的速率不同,所以C正确;
D、磷酸钠是强电解质溶于水是盐溶液,磷酸是弱酸存在电离平衡,在物质的量浓度相同的磷酸钠溶液和磷酸溶液中磷酸钠溶液中磷酸根离子浓度大,所以D错误;所以选C.
分析:本题考查电解质溶液导电能力,强弱电解质的分析判断,酸碱反应的电离分析应用,盐类水解和弱电解质电离平衡的理解.
7.可以证明乙酸是弱酸的事实是( )
A.乙酸和水能任意比例混溶
B.1mol L﹣1的醋酸水溶液能使紫色石蕊试液变红色
C.醋酸能与碳酸钠溶液反应生成CO2气体
D.醋酸溶液中存在醋酸分子
答案:D
解析:解答:完全电离的电解质为强电解质,只有部分电离的电解质为弱电解质,要证明乙酸是弱酸,只要证明乙酸部分电离即可,
A.乙酸和水以任意比例互溶,不能说明乙酸部分电离,所以不能证明乙酸是弱电解质,所以A错误;
B.1mol L﹣1的醋酸水溶液能使紫色石蕊试液变红色,说明醋酸水溶液呈酸性,则醋酸是酸,但不能说明醋酸部分电离,所以不能证明醋酸是弱电解质,所以B错误;
C.醋酸能与碳酸钠溶液反应生成CO2气体,说明醋酸酸性大于碳酸,但不能说明醋酸部分电离,所以不能证明醋酸是弱电解质,所以C错误;
D.醋酸溶液中存在醋酸分子,说明醋酸部分电离,所以证明醋酸是弱电解质,所以D正确;
所以选D.
分析:本题考查电解质强弱判断,强弱电解质的根本区别是电离程度,电解质强弱与溶解性无关.
8.已知:(1)Al(OH)3的电离方程式为:AlO2﹣+H++H2OAl(OH)3Al3++3OH﹣
(2)无水AlCl3晶体的沸点为182.9℃,溶于水的电离方程式为:AlCl3=Al3++3Cl﹣
(3)PbSO4难溶于水,易溶于醋酸钠溶液,反应的化学方程式为:PbSO4+2CH3COONa=Na2SO4+(CH3COO)2Pb
则下列关于Al(OH)3、AlCl3和(CH3COO)2Pb的说法中正确的是( )
A.均为强电解质 B.均为弱电解质 C.均为离子化合物 D.均为共价化合物
答案:D
力的区别.
解析:解答:A.Al(OH)3在水溶液中部分电离,属于弱电解质,所以A错误;
B.AlCl3在水溶液中完全电离,属于强电解质,所以B错误;
C.无水AlCl3晶体的沸点为182.9℃,沸点较低,所以氯化铝为共价化合物,所以C错误;
D.三者只含有共价键,不含有离子键,所以均为共价化合物,所以D正确,所以选D.
分析:本题考查强弱电解质、离子化合物和共价化合物的判断.根据物质中所含化学键来确定化合物类型,明确离子化合物和共价化合物的概念是解本题关键.
9.下列电离方程式书写正确的是( )
A.H2S 2H++S2﹣ B.Al(OH)3═Al3++3OH﹣
C.NH3 H2O NH4++OH﹣ D.NaHCO3═Na++H++CO32﹣
答案:C
解析:解答:A、硫化氢是多元弱酸,只写第一步电离,正确电离方程式为:H2S H++HS﹣,所以A错误;
B、氢氧化铝是弱碱,用可逆号,正确的电离方程式为:Al(OH)3 Al3++3OH﹣,所以B错误;
C、氨水是弱电解质,电离方程式为:NH3 H2O NH4++OH﹣,所以C正确;
D、碳酸是弱酸,碳酸氢根离子不能拆开,正确的电离方程式为:NaHCO3═Na++HCO3﹣,所以D错误;所以选C.
分析:本题考查电离方程式的书写,明确书写方法及弱酸根离子的书写时解答的关键,注意水合氢离子为解答的易错点.
10.下列电离方程式正确的是( )
A.NaHCO3(溶液):NaHCO3=Na++H++CO32﹣
B.NaHSO4(熔融):NaHSO4=Na++H++SO42﹣
C.(NH4)2SO4(溶液):(NH4)2SO4=(NH4)2++SO42﹣
D.NH3 H2O(溶液):NH3 H2O NH4++OH﹣
答案:D
解析:解答:A、NaHCO3(溶液)的电离方程式为:NaHCO3=Na++HCO3﹣,所以A错误;
B、NaHSO4(熔融)时,只能电离出两种离子,即:NaHSO4=Na++HSO4﹣,所以B错误;
C、(NH4)2SO4(溶液)的电离方程式为:(NH4)2SO4=2NH4++SO42﹣,所以C错误;
D、一水合氨是弱电解质,电离方程式为:NH3 H2O NH4++OH﹣,所以D正确.所以选D.
分析:书写电离方程式注意:弱电解质的电离要用可逆号;要注意电荷和粒子个数的书写.特别的是NaHSO4(熔融):NaHSO4=Na++HSO4﹣.
11.下列电离方程式中正确的是( )
A.HF溶于少量水中:HF+H2O F﹣+H3O+
B.H2S溶于水:H2S 2H++S2﹣
C.Na2HPO4溶于水:Na2HPO4═2Na++H++PO43﹣
D.NaHSO4熔融:NaHSO4═Na++H++SO42﹣
答案:A
解析:解答:A.HF溶于少量水中,氢氟酸为弱酸,存在电离平衡,其电离方程式为:HF+H2O F﹣+H3O+,所以A正确;
B.H2S溶于水,氢硫酸的电离分步进行,其电离方程式只写出第一步即可,正确的电离方程式为:H2S H++HS﹣,所以B错误;
C.Na2HPO4溶于水后完全电离,其中HPO42﹣不能拆开,正确的电离方程式为:Na2HPO4═2Na++HPO42﹣,所以C错误;
D.NaHSO4熔融中电离出钠离子和硫酸氢根离子,正确的电离方程式为:NaHSO4═Na++HSO4﹣,所以D错误;所以选A.
分析:本题考查了电离方程式的书写判断,题目难度中等,注意掌握电离方程式的书写原则,明确多元弱酸的电离分步进行,其电离方程式只写出第一步即可,选项D为易错点,注意熔融硫酸氢钠电离的阴离子为硫酸氢根离子.
12.下列说法正确的是( )
A.HClO和NaClO都是弱电解质
B.胶体能产生丁达尔效应,而溶液不能
C.1mol H2SO4与1mol Ba(OH)2反应放出的热量叫做中和热
D.HCl和NaCl溶于水破坏的化学键完全相同
答案:B
解析:解答:A.HClO是弱酸,在水溶液中部分电离,是弱电解质;NaClO是盐,在在水溶液中完全电离,是强电解质,所以A错误;
B.丁达尔效应是胶体的性质,溶液没有丁达尔效应,所以B正确;
C.1molH2SO4与1molBa(OH)2反应生成2mol水和1mol硫酸钡沉淀,所以C错误;
D.HCl溶于水破坏的是共价键,NaCl溶于水破坏的是离子键,化学键的种类不同,所以D错误,所以选B.
分析:本题考查强弱电解质的判断、胶体的性质、中和热的概念、化学键的判断,知识点较多.要注意基础知识的积累.
13.下列事实能说明某物质是强电解质的是( )
A.该物质在水中的溶解度大
B.该物质的水溶液导电能力强
C.该物质的水溶液中不存在溶质分子
D.该物质的水溶液中存在除水外的电离平衡
答案:C
解析:解答:A、易溶于水的物质不一定是强电解质,如醋酸,即电解质的强弱与溶解度无关,所以A错误;
B、水溶液能导电能力强的物质不一定是强电解质,如醋酸为弱电解质,导电能力强于硫酸钡(微溶,溶解部分完全电离),即导电能力与电解质强弱无关,所以B错误;
C、该物质的水溶液中不存在溶质分子,说明完全电离,是强电解质,所以C正确;
D、该物质的水溶液中存在除水外的电离平衡,说明有除水外还有不完全电离的物质,恰恰说明某物质是弱电解质,所以D错误;所以选C.
分析:本题考查了强电解质的判断,根据电解质的电离程度划分强弱电解质,与溶液的导电性、是否挥发、物质的溶解性等都无关,为易错点.
14.下列说法中正确的是( )
A.氯化钠水溶液在电流的作用下电离出Na+和Cl﹣
B.硫酸钡难溶于水,但硫酸钡属于强电解质
C.二氧化碳溶于水能部分电离,所以二氧化碳属于弱电解质
D.硫酸钠在水中的电离方程式可表示为Na2SO4═2Na++S6++4O2﹣
答案:B
解析:解答:A.氯化钠水溶液不需要电流,而是在溶液中水的作用下能够电离出Na+和Cl﹣,所以A错误;
B.硫酸钡在熔融状态下能够完全电离出钡离子和硫酸钡离子,硫酸钡属于强电解质,所以B正确;
C.二氧化碳溶于水,发生电离的是碳酸,碳酸为弱电解质,而二氧化碳不能电离出离子,属于二氧化碳为非电解质,所以C错误;
D.硫酸钠在水中完全电离出钠离子和硫酸根离子,硫酸根离子不能拆开,硫酸钠正确的电离方程式为Na2SO4═2Na++SO42﹣,所以D错误;所以选B.
分析:本题考查了电解质与非电解质、强电解质与弱电解质的判断及电离方程式的书写,注意掌握电解质与非电解质、强弱电解质的概念,明确强弱电解质与溶解度之间的关系,能够正确书写常见电解质的电离方程式.
15.下列有关电解质的说法错误的是( )
A.强电解质溶液的导电性不一定强于弱电解质溶液的导电性
B.电解质溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数
C.易溶物是强电解质,难溶物一定是弱电解质
D.硫酸钡在水里的溶解度很小,但溶于水的硫酸钡全部电离,所以硫酸钡是强电解质
答案:C
解析:解答:A.强电解质溶液的导电性不一定比弱电解质溶液的导电性强,溶液的导电性取决于离子浓度的大小,如氯化银为强电解质,但溶液浓度却很小,导电能力弱,所以A正确;
B.因为溶液不显电性,所以溶液中阳离子所带正电荷总数与阴离子所带负电荷总数相等.所以B正确;
C.电解质的强弱和溶解度无关,硫酸钡难溶于水,但它是强电解质,乙酸易溶于水,但它是弱酸,所以C错误;
D.强电解质指在水溶液中或熔融状态下,能完全电离,硫酸钡属于强电解质,虽在水溶液中很难溶解,但溶于水的部分能完全电离,所以D正确;所以选C.
分析:本题考查了强、弱电解质的概念辨析,解答时抓住选项中的关键词结合相关知识解答.
16.下列说法正确的一组是:①不溶于水的盐都是弱电解质;②可溶于水的盐一定都是强电解质;③0.5mol/L一元酸溶液H+浓度一定为0.5mol/L;④强酸溶液中的H+浓度一定大于弱酸溶液中的H+浓度;⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子;⑥熔融的电解质都能导电( )
A.①③⑤⑥ B.②④⑤⑥ C.只有⑤ D.只有⑥
答案:C
解析:解答:①电解质的强弱与溶解性无关,不溶于水的盐可能是强电解质,如硫酸钡,所以①错误;
②电解质的强弱与溶解性无关,可溶于水的盐可能是弱电解质,如醋酸铅,所以②错误;
③0.5mol/L一元酸溶液H+浓度不一定为0.5mol/L,如醋酸,所以③错误;
④强酸溶液中的H+浓度不一定大于弱酸溶液中的H+浓度,H+浓度与酸的浓度、分子中氢离子的个数以及电离程度有关,与电解质的强弱无关,所以④错误;
⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子,所以⑤正确;
⑥酸在熔融态时均不导电,只有溶于水时才导电,所以⑥错误;所以选C.
分析:本题考查学生强电解质和弱电解质的概念,可以根据所学知识进行回答,注意举例说明,难度中等.
17.可以证明次氯酸是弱酸的事实是( )
A.可与碱反应 B.有漂白性
C.见光能分解 D.次氯酸钙溶液可与碳酸反应生成次氯酸
答案:D
解析:解答:A、盐酸、硫酸属于强酸,碳酸属于弱酸,都能与碱反应,如与氢氧化钠反应,所以A错误;
B、次氯酸有漂白性,是因为次氯酸具有强氧化性,所以B错误;
C、见光能分解说明次氯酸不稳定,与酸性强弱无关,如硝酸属于强酸,见光易分解,所以C错误;
D、次氯酸钙溶液可与碳酸反应生成次氯酸,次氯酸的酸性比碳酸弱,碳酸是弱酸,属于次氯酸属于弱酸,所以D正确.
所以选D.
分析:本题考查弱酸的概念、弱酸性与性质关系等,注意弱酸的实质是酸不能完全电离.
18.下列事实能说明碳酸的酸性比乙酸弱的是( )
A.乙酸能发生酯化反应,而碳酸不能
B.碳酸和乙酸都能与碱反应
C.乙酸易挥发,而碳酸不稳定易分解
D.乙酸和Na2CO3反应可放出CO2
答案:比较弱酸的相对强弱的实验
解析:解答:A、乙酸能发生酯化反应是由于含有羧基,与酸性强弱无关,所以A错误;
B、碳酸和乙酸都能与碱反应,说明二者都具有酸性,但不能判断酸性的强弱,所以B错误;
C、挥发性和不稳定性与酸性强弱无关,所以C错误.
D、乙酸和Na2CO3反应可放出CO2,反应进行符合复分解反应发生的条件,应为强酸制备弱酸,酸性乙酸较强,所以D正确.所以选D.
分析:本题考查酸性强弱比较,比较基础,注意基础知识掌握.
19.对常温下 c(H+)=0.001 mol L﹣1的CH3COOH溶液,下列叙述不正确的是( )
A.c(H+)=c(CH3COO﹣)+c(OH﹣)
B.加入少量CH3COONa固体后,c(CH3COO﹣)增大
C.与等体积c(OH﹣)=0.001 mol L﹣1的NaOH溶液混合后所得溶液显碱性
D.与等体积c(OH﹣)=0.001 mol L﹣1的NaOH溶液混合后所得溶液显酸性
答案:C
解析:解答:A.醋酸溶液呈电中性,溶液中存在电荷守恒c(H+)=c(OH﹣)+c(CH3COO﹣),所以A正确;
B.加入少量CH3COONa固体后,虽然平衡向逆反应方向移动,但c(CH3COO﹣)增大,所以B正确;
C.等体积c(OH﹣)=0.001 mol L﹣1的NaOH溶液混合,则c(NaOH)=0.001 mol L﹣1,醋酸过量,反应后溶液呈酸性,所以C错误;
D.等体积c(OH﹣)=0.001 mol L﹣1的NaOH溶液混合,则c(NaOH)=0.001 mol L﹣1,醋酸过量,反应后溶液呈酸性,所以D正确.所以选C.
分析:本题考查了弱电解质的电离,为高频考点,侧重于学生的分析能力的考查,注意把握溶液中存在电荷守恒,注意离子浓度大小的判断方法.
20.室温下向10mL c(H+)=0.001 mol L﹣1的醋酸溶液中加水稀释后,下对说法正确的是( )
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中不变
D.再加入c(OH﹣)=0.001 mol L﹣1的NaOH溶液,混合液的PH=7
答案:C
解析:解答:A.弱电解质,浓度越稀,电离程度越大,醋酸溶液中加水稀释,促进电离,溶液中导电粒子的数目增多,所以A错误;
B.醋酸溶液中加水稀释,醋酸的电离程度增大,因溶液的体积增大的倍数大于n(H+)增加的倍数,则c(H+)减小,酸性减弱,所以B错误;
C.醋酸的电离平衡常数,温度不变,Ka不变,所以C正确;
D.等体积10mL c(H+)=0.001 mol L﹣1的醋酸与c(OH﹣)=0.001 mol L﹣1的NaOH溶液混合时,醋酸的浓度大于0.001mol/L,醋酸过量,则溶液的pH<7,所以D错误;所以选C.
分析:本题考查了弱电解质的稀释,明确温度与电离平衡常数的关系、溶液的pH与物质的量浓度的关系、稀释中溶液体积的变化与离子的物质的量的变化关系是解答本题的关键.
二、非选择题
21.在氢氟酸溶液中,存在下列电离平衡:HF H++F﹣,
(1)加入NaOH固体后,电离平衡向 (填“正”或“逆”)反应方向移动,C(H+) (填“增大”,“减小”或“不变”).
答案:正|减小
(2)加入NaF固体后,电离平衡向 (填“正”或“逆”)反应方向移动,C(H+) (填“增大”,“减小”或“不变”).
答案:逆|减小
(3)加水稀释,电离平衡向 (填“正”或“逆”)反应方向移动,C(H+) (填“增大”,“减小”或“不变”).
答案:正|减小
解析:解答:(1)加入氢氧化钠固体,氢氧化钠和氢离子反应生成水,促进氢氟酸电离,溶液中氢离子浓度减小,所以答案为:正;减小;
(2)向溶液中加入氟化钠固体,氟离子浓度增大,抑制氢氟酸电离,平衡向逆反应方向移动,溶液中氢离子浓度减小,所以答案为:逆;减小;
(3)弱电解质存在电离平衡,加水稀释促进电离,电离平衡正向进行,但平衡状态各微粒的浓度减小,所以答案为:正,减小;
分析:本题考查了弱电解质的电离,明确影响弱电解质电离的因素是解本题关键.
22.一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
(1)冰醋酸在O点时是否导电 (填是或否),理由是 .
答案:否|共价化合物在固态时不导电
(2)H+的物质的量最大的是 (填“a”、“b”或“c”).
答案:c
(3)若使c点溶液中的c(CH3COO﹣)增大,可以采取下列措施中的 (填序号).
A.加热 B.加很稀的NaOH溶液 C.加NaOH固体
D.加水 E.加固体CH3COONa F.加入锌粒.
答案:ACEF
解析:解答:(1)醋酸是共价化合物,冰醋酸中没有自由移动电子,不能导电,所以答案为:否;共价化合物在固态时不导电;
(2)醋酸是弱电解质,随着醋酸的稀释,醋酸电离程度越大,根据图片知,醋酸电离程度最大的是c点,则c点氢离子的物质的量最大,但氢离子浓度最大的是b,所以选c;
(3)若使c点溶液中的c(CH3COO﹣)增大,可以采用升高温度、加入含有醋酸根离子的可能性盐、加入固体碱或加入和氢离子反应的固体物质.
(3)A.醋酸是弱电解质,电离时需要吸收热量,所以加热促进醋酸电离,导致醋酸根离子浓度最大,所以正确;
B.加很稀的NaOH溶液,促进醋酸电离,但醋酸电离程度远远小于溶液体积增大程度,所以醋酸根离子浓度减小,所以错误;
C.加NaOH固体,NaOH和醋酸发生中和反应生成醋酸钠,促进醋酸电离,溶液体积不变,醋酸根离子浓度增大,所以正确;
D.加水促进醋酸电离,但醋酸电离程度远远小于溶液体积增大程度,所以醋酸根离子浓度减小,所以错误;
E.加固体CH3COONa,醋酸钠电离出醋酸根离子导致醋酸根离子浓度增大,所以正确;
F.加入锌粒,锌和氢离子发生置换反应而促进醋酸电离,则醋酸根离子浓度增大,所以正确;
所以选ACEF.
分析:本题考查弱电解质的电离,明确弱电解质电离影响因素是解本题关键,知道溶液导电能力与离子浓度成正比,与电解质强弱无关.
23.已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,回答下列问题:
(1)该溶液中c(H+)= .
答案:10﹣4mol/L
(2)HA的电离平衡常数K= ;
答案:1×10﹣7
(3)升高温度时,K (填“增大”,“减小”或“不变”).
答案:增大
解析:解答:(1)HA电离出的c(H+)为0.1mol/L×0.1%=10﹣4mol/L,所以答案为:10﹣4mol/L;
(2)由HA═H++Ac﹣,c(H+)=c(Ac﹣)=10﹣4mol/L,则电离平衡常数为Ka==1×10﹣7,所以答案为:1×10﹣7;
(3)因HA的电离是吸热过程,温度升高促进电离,氢氧根离子、氢离子浓度越大,则K增大,所以答案为:增大;
分析:本题考查弱酸的电离,为高频考点,侧重于学生的分析能力和计算能力的考查,明确离子的浓度、温度对电离平衡的影响及离子积的计算即可解答.
24.在稀氨水中存在下述电离平衡NH3+H2O NH3 H2O NH4++OH﹣,分别加入少量下列物质,溶液中c(OH﹣)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?
加入的物质 少量(NH4)2SO4固体 少量HNO3溶液 少量KOH溶液
c(OH﹣)的变化 ① ② ③
平衡移动方向 ④ ⑤ ⑥
答案:减小|减小|增大|左移|右移|左移
解析:解答:氨水中存在NH3+H2O NH3 H2O NH4++OH﹣,向氨水中加入少量硫酸铵,硫酸铵中含量铵根离子,导致溶液中铵根离子浓度增大,抑制氨水电离,平衡向左移动,所以溶液中氢氧根离子浓度减小;
向氨水中加入少量硝酸,氢离子和氢氧根离子反应,导致氢氧根离子浓度减小,促进氨水电离,平衡向右移动;
向氨水中加入少量氢氧化钾,导致氢氧根离子浓度增大,抑制氨水电离,平衡向左移动,
所以答案为:加入的物质-少量(NH4)2SO4固体-少量HNO3溶液-少量KOH溶液
c(OH﹣)的变化-①减小-②减小-③增大;平衡移动方向-④左移-⑤右移-⑥左移.
分析:本题考查弱电解质电离,加入相同的离子则抑制弱电解质电离,加入和溶液中离子反应的物质则促进其电离.
25.有浓度为0.1mol L﹣1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+) 依次为a mol L﹣1,b mol L﹣1,c mol L﹣1,其大小顺序为 .
答案:a=b>c
(2)等体积的以上三种酸分别与过量的NaOH 溶液反应,生成的盐的物质的量依次为n 1mol,n2 mol,n3 mol,它们的大小关系为
答案:n1 =n2=n3
(3)中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为
答案:V1=2V2=V3
(4)与锌反应时产生氢(气)的速率分别为v1、v2、v3,其大小关系为 .
答案:v2>v1>v3
解析:解答:(1)氯化氢和硫酸是强电解质,盐酸是一元酸,硫酸是二元酸,醋酸是弱电解质且是一元酸,所以盐酸中氢离子浓度与酸的浓度相等,硫酸中氢离子浓度是硫酸的浓度的2倍,醋酸中氢离子浓度小于醋酸的浓度,所以氢离子浓度其大小顺序为a=b>c,所以答案为:a=b>c;
(2)根据阴离子守恒知,盐的物质的量与酸的物质的量相等,所以生成的盐的物质的量大小关系为n1 =n2=n3,所以答案为:n1 =n2=n3;
(3)中和一定量NaOH溶液生成正盐时,酸的浓度相等,如果是一元酸,所用酸的体积相等,如果是二元酸,酸的体积是一元酸的一半,所以三种酸的体积大小关系是V1=2V2=V3,
所以答案为:V1=2V2=V3;
(4)与锌反应时产生氢(气)的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,三种酸中硫酸中氢离子浓度为0.2mol/L,盐酸中氢离子浓度为0.1mol/L,醋酸中氢离子浓度小于0.1mol/L,所以反应速率大小关系为v2>v1>v3,所以答案为:v2>v1>v3.
分析:本题考查了弱电解质的电离,难度不大,注意(4)中生成氢气的反应速率与氢离子浓度成正比,分清是初始速率还反应过程中的反应速率.
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网 www.21cnjy.com 精品资料·第 15 页 (共 15 页)版权所有@21世纪教育网
