2.3.1 共价键的极性 课件 (共18张PPT)
文档属性
| 名称 | 2.3.1 共价键的极性 课件 (共18张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-18 16:41:34 | ||
图片预览



文档简介
(共18张PPT)
第三节 分子结构与物质的性质
第1课时 共价键的极性
第二章 分子结构与性质
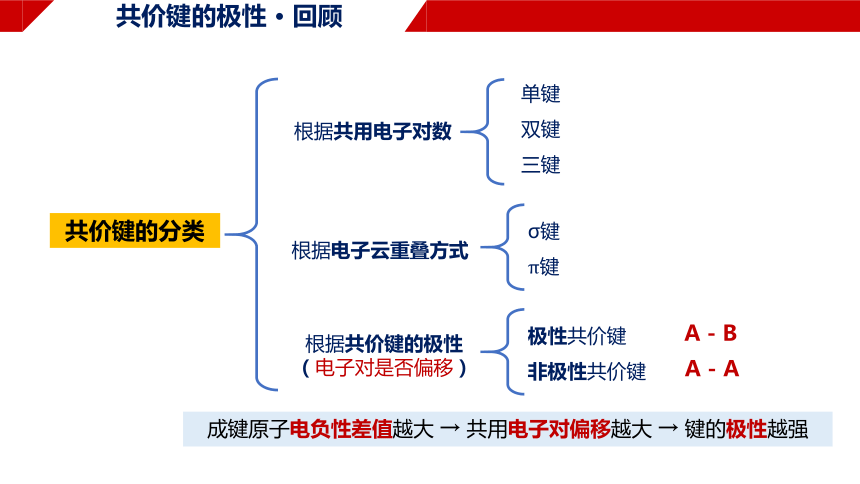
共价键的分类
共价键的极性 · 回顾
根据共用电子对数
根据电子云重叠方式
根据共价键的极性
(电子对是否偏移)
单键
双键
三键
σ键
π键
极性共价键
非极性共价键
A - A
A - B
成键原子电负性差值越大 → 共用电子对偏移越大 → 键的极性越强
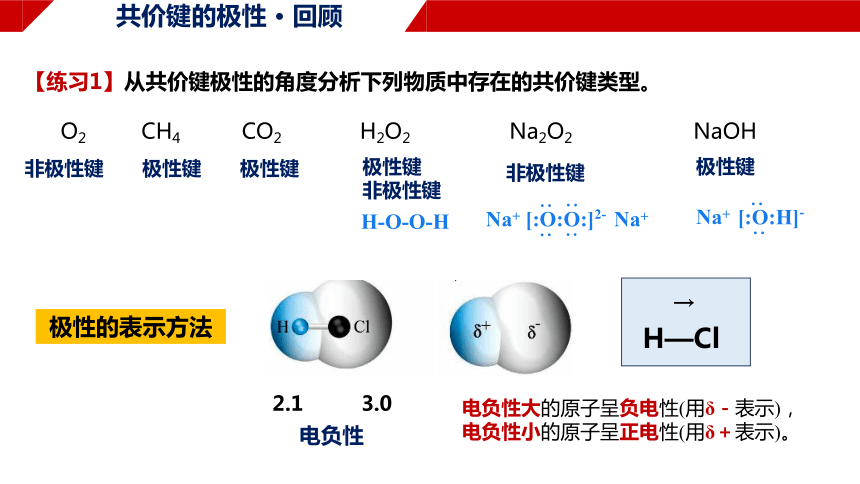
共价键的极性 · 回顾
【练习1】从共价键极性的角度分析下列物质中存在的共价键类型。
O2 CH4 CO2 H2O2 Na2O2 NaOH
非极性键
极性键
极性键
极性键
非极性键
非极性键
极性键
[:O:O:]2-
··
··
··
··
Na+
Na+
[:O:H]-
··
··
Na+
H-O-O-H
极性的表示方法
2.1 3.0
H—Cl
→
电负性
电负性大的原子呈负电性(用δ-表示),
电负性小的原子呈正电性(用δ+表示)。
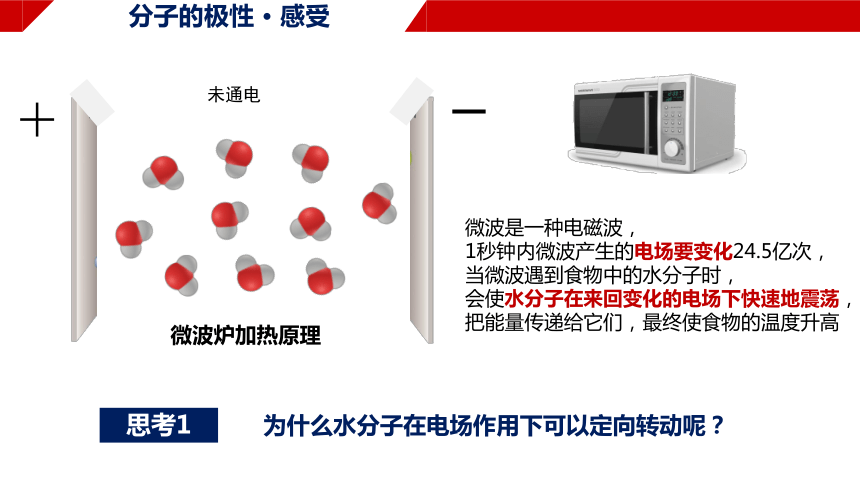
分子的极性 · 感受
+
通电
未通电
微波炉加热原理
微波是一种电磁波,
1秒钟内微波产生的电场要变化24.5亿次,
当微波遇到食物中的水分子时,
会使水分子在来回变化的电场下快速地震荡,
把能量传递给它们,最终使食物的温度升高
思考1
为什么水分子在电场作用下可以定向转动呢?
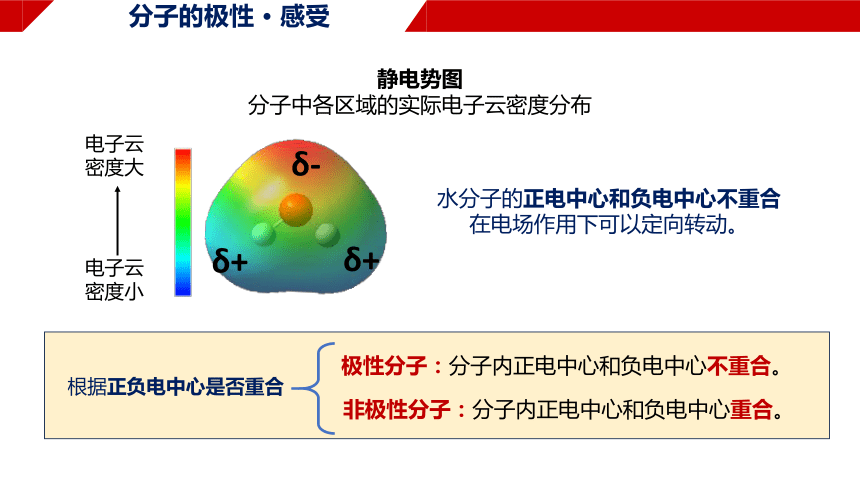
分子的极性 · 感受
电子云
密度大
电子云
密度小
静电势图
分子中各区域的实际电子云密度分布
水分子的正电中心和负电中心不重合
在电场作用下可以定向转动。
δ-
δ+
δ+
极性分子:分子内正电中心和负电中心不重合。
非极性分子:分子内正电中心和负电中心重合。
根据正负电中心是否重合
分子的极性 · 判断
思考2
共价键的极性与分子的极性有什么联系呢?
正电中心和负电中心不重合
正电中心和负电中心重合
δ-
δ+
δ-
CO2
H2O
δ-
δ+
δ+
极性分子
非极性分子
键的极性
分子的空间结构
正负电中心
是否重合
成键原子是否一致
决定
决定
决定
分子的极性
分子的极性 · 判断
方法总结
如何判断分子的极性
①、一般来说,完全由非极性键组成的多原子分子是非极性分子
C60
P4
(同种原子构成的多原子分子大多为非极性分子)
【特例:O3是极性分子】
O
O
O
δ-
δ-
δ+
臭氧分子的空间结构
与水分子相似,
分子中的共价键是极性键。
臭氧分子有极性,但很微弱,
分子的极性 · 判断
方法总结
如何判断分子的极性
②、极性键构成的多原子分子,需要考虑其空间结构,分析极性向量之和
NH3 BF3 CH4
3个N-H极性的
向量和≠0
极性分子
三角锥形
平面三角形
3个B-F极性的
向量和=0
非极性分子
正四面体形
4个C-H极性的
向量和=0
非极性分子
分子的极性 · 判断
方法总结
如何判断分子的极性
③、分子在空间结构上是否为空间对称,可以用来判断分子的极性
分子类型 价电子对数 空间结构 分子极性 代表物
A2
AB
AB2
AB3
AB4
2+0
2+1
2+2
直线形
V形
V形
非极性
极性
极性
CO2、CS2
SO2、
H2O、H2S
3+0
3+1
平面正三角形
三角锥
非极性
极性
BF3、AlCl3
NH3、PCl3
4+0
正四面体
非极性
CH4、CCl4
直线形
非极性
极性
O2、H2
HF、CO
若中心原子有孤电子对,
则为极性分子;
若无孤电子对,
则为非极性分子。
经验规律
【例1】正误判断
(1)以非极性键结合的双原子分子一定是非极性分子
(2)以极性键结合的分子一定是极性分子
(3)非极性分子只能是双原子单质分子
(4)非极性分子中,一定含有非极性共价键
(5)极性分子中不可能含有非极性键
√
×
×
×
×
【例2】下列跟氢原子形成的极性键最强的原子是
A.F B.Cl C.Br D.P
√
课堂练习
【例4】已知N、P均属于元素周期表的第ⅤA族元素。N在第二周期,P在第三周期。NH3分子呈三角锥形,N原子位于锥顶,3个H原子位于锥底,N—H间的夹角是107°。
(1)N4分子空间结构为 ,它是一种________(填“极性”或“非极性”)分子。
非极性
(2)PH3分子中P—H______(填“有”或“无”,下同)极性,PH3分子_____极性。
有
有
课堂练习
【例5】NCl3是一种淡黄色油状液体,下列对NCl3描述不正确的是_____(填字母)。
a.该分子呈平面三角形
b.该分子中的化学键为极性键
c.该分子为极性分子
a
课堂练习
键的极性与化学性质
影响键极性的因素:
受相邻原子团的影响
受成键原子电负性的影响
差值越大 → 极性越强 → 反应中越易断裂
有些原子团吸电子;有些原子团推电子
吸电子基团
推电子基团
-NO2 、-CN 、-F 、-Cl 、-Br 、-I 、C C 、-OH 、C=C
常见的吸电子基团:
常见的推电子基团:
-CH3(各种烷基,烷基链越长 → 推电子能力越强 )
键的极性与化学性质
思考3
H2O与乙醇均与钠反应,谁的反应现象更明显?根据键的极性分析原因
H
O
H
C2H5
O
H
δ+
δ-
δ+
δ-
乙醇分子中的C2H5—是推电子基团,
使得乙醇分子中的电子云向着远离乙基的方向偏移,
因此,乙醇中羟基的极性比水分子中的小,因而钠和乙醇的反应不如钠和水的剧烈
键的极性与化学性质
思考4
根据基团对键极性的影响,分析甲酸、乙酸、丙酸的酸性差异
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
pKa = -lgKa
总结: pKa越小,酸性越强
酸性:甲酸>乙酸>丙酸
CH3
O
H
δ+
δ-
O
C
C2H5
O
H
δ+
δ-
O
C
H
O
H
δ+
δ-
O
C
烃基是推电子基团,烃基越长,推电子效应越大,
使羧基中的羟基的极性越小,-COOH中H+越难电离,羧酸的酸性越弱
甲酸
乙酸
丙酸
键的极性与化学性质
思考5
根据基团对键极性的影响,分析氯乙酸、二氯乙酸、三氯乙酸酸性差异
羧酸 pKa
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
①、根据数据比较三者的酸性大小
②、根据以下结构分析原因
酸性:三氯乙酸 > 二氯乙酸 > 氯乙酸
-Cl是吸电子基团,-Cl越多,吸电子能力越强,
导致-COOH中O-H键的极性越强,越易断裂,使H+更易电离,酸性也就越强
键的极性与化学性质
思考6
根据键的极性,比较三氟乙酸与三氯乙酸的酸性
F、Cl是吸电子基团,F的电负性大于Cl ,F的吸电子能力大于Cl,
-CF3的极性大于-CCl3,使羧基中的羟基极性更大,更容易电离出H+。
分子结构修饰
不改变分子的主体骨架,保持分子的基本结构不变,
仅改变分子结构中的某些基团而得到新的分子,分子被修饰后,其性质也可以发生显著的变化。
键的极性与化学性质
分子结构修饰
布诺芬的成酯修饰
甜度增加600倍,热量值极低,
可供糖尿病患者食用
提高药物疗效、
降低对胃、肠道的刺激性
第三节 分子结构与物质的性质
第1课时 共价键的极性
第二章 分子结构与性质
共价键的分类
共价键的极性 · 回顾
根据共用电子对数
根据电子云重叠方式
根据共价键的极性
(电子对是否偏移)
单键
双键
三键
σ键
π键
极性共价键
非极性共价键
A - A
A - B
成键原子电负性差值越大 → 共用电子对偏移越大 → 键的极性越强
共价键的极性 · 回顾
【练习1】从共价键极性的角度分析下列物质中存在的共价键类型。
O2 CH4 CO2 H2O2 Na2O2 NaOH
非极性键
极性键
极性键
极性键
非极性键
非极性键
极性键
[:O:O:]2-
··
··
··
··
Na+
Na+
[:O:H]-
··
··
Na+
H-O-O-H
极性的表示方法
2.1 3.0
H—Cl
→
电负性
电负性大的原子呈负电性(用δ-表示),
电负性小的原子呈正电性(用δ+表示)。
分子的极性 · 感受
+
通电
未通电
微波炉加热原理
微波是一种电磁波,
1秒钟内微波产生的电场要变化24.5亿次,
当微波遇到食物中的水分子时,
会使水分子在来回变化的电场下快速地震荡,
把能量传递给它们,最终使食物的温度升高
思考1
为什么水分子在电场作用下可以定向转动呢?
分子的极性 · 感受
电子云
密度大
电子云
密度小
静电势图
分子中各区域的实际电子云密度分布
水分子的正电中心和负电中心不重合
在电场作用下可以定向转动。
δ-
δ+
δ+
极性分子:分子内正电中心和负电中心不重合。
非极性分子:分子内正电中心和负电中心重合。
根据正负电中心是否重合
分子的极性 · 判断
思考2
共价键的极性与分子的极性有什么联系呢?
正电中心和负电中心不重合
正电中心和负电中心重合
δ-
δ+
δ-
CO2
H2O
δ-
δ+
δ+
极性分子
非极性分子
键的极性
分子的空间结构
正负电中心
是否重合
成键原子是否一致
决定
决定
决定
分子的极性
分子的极性 · 判断
方法总结
如何判断分子的极性
①、一般来说,完全由非极性键组成的多原子分子是非极性分子
C60
P4
(同种原子构成的多原子分子大多为非极性分子)
【特例:O3是极性分子】
O
O
O
δ-
δ-
δ+
臭氧分子的空间结构
与水分子相似,
分子中的共价键是极性键。
臭氧分子有极性,但很微弱,
分子的极性 · 判断
方法总结
如何判断分子的极性
②、极性键构成的多原子分子,需要考虑其空间结构,分析极性向量之和
NH3 BF3 CH4
3个N-H极性的
向量和≠0
极性分子
三角锥形
平面三角形
3个B-F极性的
向量和=0
非极性分子
正四面体形
4个C-H极性的
向量和=0
非极性分子
分子的极性 · 判断
方法总结
如何判断分子的极性
③、分子在空间结构上是否为空间对称,可以用来判断分子的极性
分子类型 价电子对数 空间结构 分子极性 代表物
A2
AB
AB2
AB3
AB4
2+0
2+1
2+2
直线形
V形
V形
非极性
极性
极性
CO2、CS2
SO2、
H2O、H2S
3+0
3+1
平面正三角形
三角锥
非极性
极性
BF3、AlCl3
NH3、PCl3
4+0
正四面体
非极性
CH4、CCl4
直线形
非极性
极性
O2、H2
HF、CO
若中心原子有孤电子对,
则为极性分子;
若无孤电子对,
则为非极性分子。
经验规律
【例1】正误判断
(1)以非极性键结合的双原子分子一定是非极性分子
(2)以极性键结合的分子一定是极性分子
(3)非极性分子只能是双原子单质分子
(4)非极性分子中,一定含有非极性共价键
(5)极性分子中不可能含有非极性键
√
×
×
×
×
【例2】下列跟氢原子形成的极性键最强的原子是
A.F B.Cl C.Br D.P
√
课堂练习
【例4】已知N、P均属于元素周期表的第ⅤA族元素。N在第二周期,P在第三周期。NH3分子呈三角锥形,N原子位于锥顶,3个H原子位于锥底,N—H间的夹角是107°。
(1)N4分子空间结构为 ,它是一种________(填“极性”或“非极性”)分子。
非极性
(2)PH3分子中P—H______(填“有”或“无”,下同)极性,PH3分子_____极性。
有
有
课堂练习
【例5】NCl3是一种淡黄色油状液体,下列对NCl3描述不正确的是_____(填字母)。
a.该分子呈平面三角形
b.该分子中的化学键为极性键
c.该分子为极性分子
a
课堂练习
键的极性与化学性质
影响键极性的因素:
受相邻原子团的影响
受成键原子电负性的影响
差值越大 → 极性越强 → 反应中越易断裂
有些原子团吸电子;有些原子团推电子
吸电子基团
推电子基团
-NO2 、-CN 、-F 、-Cl 、-Br 、-I 、C C 、-OH 、C=C
常见的吸电子基团:
常见的推电子基团:
-CH3(各种烷基,烷基链越长 → 推电子能力越强 )
键的极性与化学性质
思考3
H2O与乙醇均与钠反应,谁的反应现象更明显?根据键的极性分析原因
H
O
H
C2H5
O
H
δ+
δ-
δ+
δ-
乙醇分子中的C2H5—是推电子基团,
使得乙醇分子中的电子云向着远离乙基的方向偏移,
因此,乙醇中羟基的极性比水分子中的小,因而钠和乙醇的反应不如钠和水的剧烈
键的极性与化学性质
思考4
根据基团对键极性的影响,分析甲酸、乙酸、丙酸的酸性差异
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
pKa = -lgKa
总结: pKa越小,酸性越强
酸性:甲酸>乙酸>丙酸
CH3
O
H
δ+
δ-
O
C
C2H5
O
H
δ+
δ-
O
C
H
O
H
δ+
δ-
O
C
烃基是推电子基团,烃基越长,推电子效应越大,
使羧基中的羟基的极性越小,-COOH中H+越难电离,羧酸的酸性越弱
甲酸
乙酸
丙酸
键的极性与化学性质
思考5
根据基团对键极性的影响,分析氯乙酸、二氯乙酸、三氯乙酸酸性差异
羧酸 pKa
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
①、根据数据比较三者的酸性大小
②、根据以下结构分析原因
酸性:三氯乙酸 > 二氯乙酸 > 氯乙酸
-Cl是吸电子基团,-Cl越多,吸电子能力越强,
导致-COOH中O-H键的极性越强,越易断裂,使H+更易电离,酸性也就越强
键的极性与化学性质
思考6
根据键的极性,比较三氟乙酸与三氯乙酸的酸性
F、Cl是吸电子基团,F的电负性大于Cl ,F的吸电子能力大于Cl,
-CF3的极性大于-CCl3,使羧基中的羟基极性更大,更容易电离出H+。
分子结构修饰
不改变分子的主体骨架,保持分子的基本结构不变,
仅改变分子结构中的某些基团而得到新的分子,分子被修饰后,其性质也可以发生显著的变化。
键的极性与化学性质
分子结构修饰
布诺芬的成酯修饰
甜度增加600倍,热量值极低,
可供糖尿病患者食用
提高药物疗效、
降低对胃、肠道的刺激性
