2.3.2 范德华力与氢键 课件 (共16张PPT)
文档属性
| 名称 | 2.3.2 范德华力与氢键 课件 (共16张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 838.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-18 16:38:36 | ||
图片预览



文档简介
(共16张PPT)
第三节 分子结构与物质的性质
第2课时 范德华力与氢键
第二章 分子结构与性质
分子间作用力 · 感受
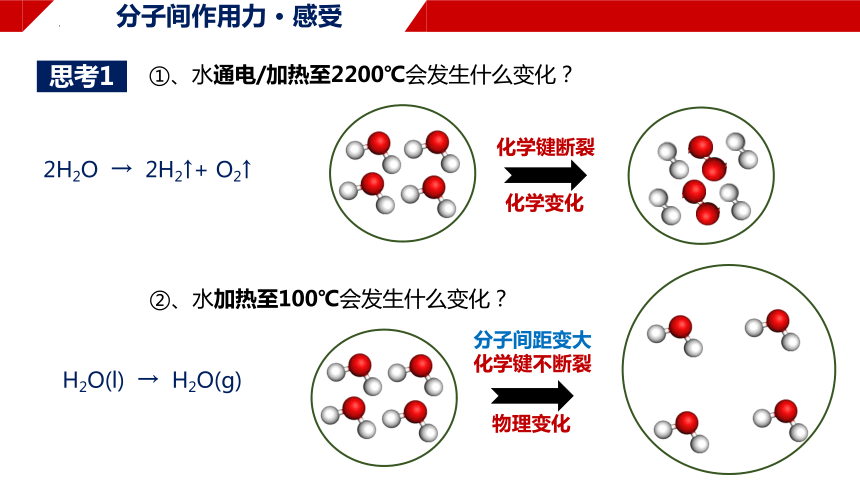
①、水通电/加热至2200℃会发生什么变化?
②、水加热至100℃会发生什么变化?
思考1
2H2O → 2H2↑+ O2↑
化学键断裂
化学变化
H2O(l) → H2O(g)
分子间距变大
化学键不断裂
物理变化
分子间作用力 · 感受
分子间作用力
化学键
(原子间作用力)
影响化学性质
(例如:稳定性)
影响物理性质
(例如:熔沸点)
共价键
离子键
氢键
范德华力
分子间作用力
①、本质:分子间的静电作用
②、强度:分子间作用力<<化学键
③、存在:分子之间普遍存在
④、存在条件:分子间距较近
分子间作用力 · 范德华力
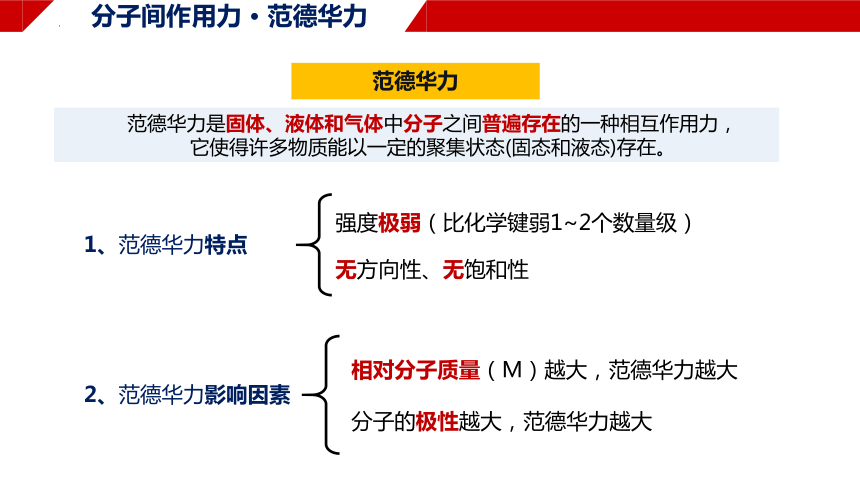
范德华力
范德华力是固体、液体和气体中分子之间普遍存在的一种相互作用力,
它使得许多物质能以一定的聚集状态(固态和液态)存在。
强度极弱(比化学键弱1~2个数量级)
无方向性、无饱和性
1、范德华力特点
相对分子质量(M)越大,范德华力越大
分子的极性越大,范德华力越大
2、范德华力影响因素
分子间作用力 · 范德华力
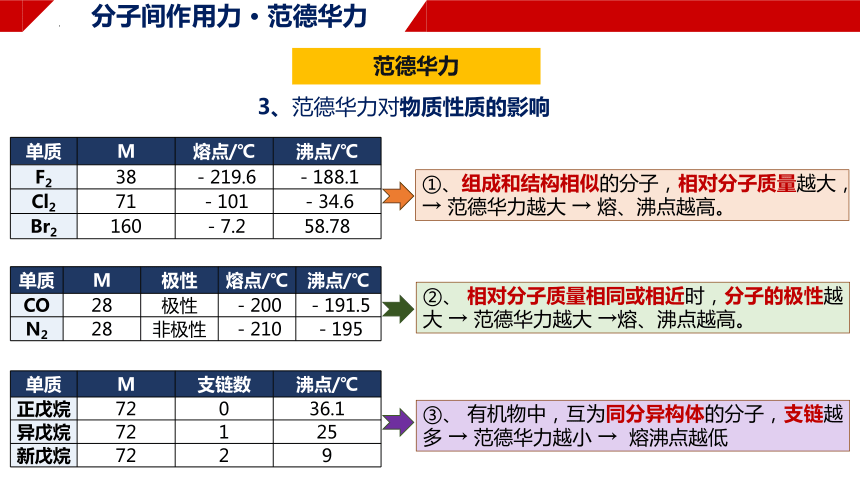
单质 M 熔点/℃ 沸点/℃
F2 38 -219.6 -188.1
Cl2 71 -101 -34.6
Br2 160 -7.2 58.78
单质 M 极性 熔点/℃ 沸点/℃
CO 28 极性 -200 -191.5
N2 28 非极性 -210 -195
①、组成和结构相似的分子,相对分子质量越大,
→ 范德华力越大 → 熔、沸点越高。
②、 相对分子质量相同或相近时,分子的极性越大 → 范德华力越大 →熔、沸点越高。
3、范德华力对物质性质的影响
范德华力
单质 M 支链数 沸点/℃
正戊烷 72 0 36.1
异戊烷 72 1 25
新戊烷 72 2 9
③、 有机物中,互为同分异构体的分子,支链越多 → 范德华力越小 → 熔沸点越低
【练习1】下列有关范德华力的叙述正确的是
A.范德华力的实质也是一种电性作用,所以范德华力是一种特殊的化学键
B.范德华力与化学键的作用力的强弱不同
C.任何分子间在任意情况下都会产生范德华力
D.范德华力非常微弱,故破坏范德华力不需要消耗能量
√
不是化学键
若分子间的距离足够远,
则分子间没有范德华力
虽然范德华力非常微弱,但破坏它时也要消耗能量
分子间作用力 · 范德华力
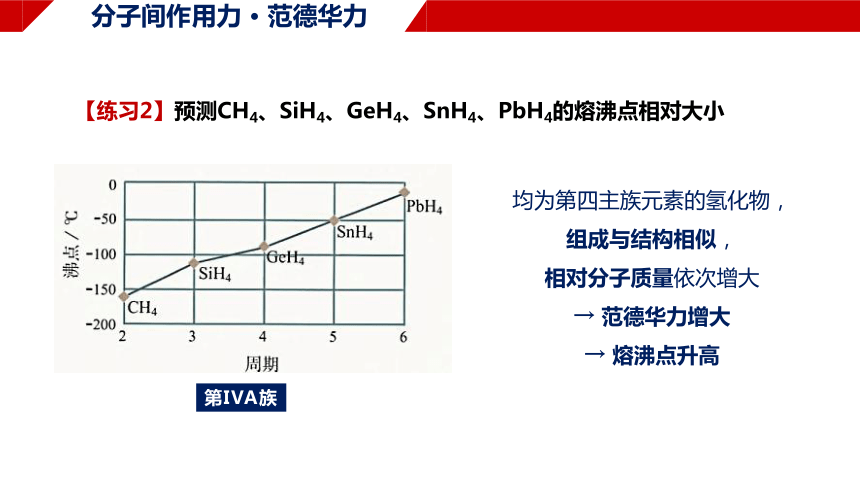
【练习2】预测CH4、SiH4、GeH4、SnH4、PbH4的熔沸点相对大小
分子间作用力 · 范德华力
第IVA族
均为第四主族元素的氢化物,
组成与结构相似,
相对分子质量依次增大
→ 范德华力增大
→ 熔沸点升高
分子间作用力 · 氢键
一些氢化物的沸点
【质疑】HF、H2O、NH3的
相对分子质量是所在主族中最小的,但沸点却反常增大,
HF、H2O、NH3分子间
除了受范德华力影响,
还受到氢键的影响
分子间作用力 · 氢键
氢键
由已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间的作用力
【典例】水中氢键的形成
电负性大,半径小
O
H
H
O
H
H
δ-
δ-
H—O键极性很强
无内层电子
几乎成为“裸露”的质子,有空轨道
氢键
δ+
(静电作用)
分子间作用力 · 氢键
氢键
1、氢键的形成条件
电负性大且半径小的原子——N、O、F
2、氢键的表示方法
X—H…Y
其中X、Y一般为N、O、F,XY可以相同也可以不相同,“—”表示共价键,
“…”表示形成的氢键。氢键的键长一般定义为A—H…B的长度,而非H…B的长度。
3、氢键的本质
是一种静电作用,不属于化学键,而是比较强的分子间作用力,
因此氢键影响物理性质,而非化学性质
分子间作用力 · 氢键
氢键
4、氢键的特征
①、键能:共价键 >> 氢键 > 范德华力
(所以:氢键对熔沸点的影响能力比范德华力更大)
②、氢键具有一定的饱和性和方向性(这一点与范德华力不同)
饱和性:一个H只能形成一个氢键
方向性:
分子间作用力 · 氢键
氢键
5、氢键强弱的判断
形成氢键的原子电负性越大 → 氢键越强
【F—H F 是最强的氢键】
6、氢键的类型
分子间氢键:使物质沸点升高
分子内氢键:使物质沸点降低
水分子间的氢键:
邻羟基苯甲醛内的氢键:
分子间氢键对沸点的影响能力比分子内氢键更强
分子间作用力 · 氢键
氢键
7、氢键对物质性质的影响
①、影响沸点:
分子间氢键升高沸点、分子内氢键降低沸点(多存在于邻位有机物中)
②、影响溶解性:
溶质与溶剂之间形成氢键,可以增大溶解性(例如:NH3极易溶于水、醇与水互溶)
③、影响物质密度:
例如:形成冰时水分子间因形成氢键而排列规整,
形成疏松晶体,体积膨胀,密度小
【例1】正误判断
(1)HI分子间的范德华力大于HCl分子间的范德华力,故HI的沸点比HCl的高
(2)CO的沸点大于N2
(3)氢键的键长是指“X—H…Y”中“H…Y”的长度
(4)H2O的热稳定性大于H2S,是因为H2O分子间存在氢键
(5)冰融化成水,仅仅破坏氢键
(6)氢键均能使物质的熔、沸点升高
√
×
√
×
×
×
课堂练习
课堂练习
【例2】试表示HF水溶液中的氢键。
F—H…F、 O—H…F、 F—H…O、 O—H…O
【例3】下列说法中正确的是
A.分子间作用力越大,分子越稳定
B.分子间作用力越大,物质的熔、沸点越高
C.相对分子质量越大,其分子间作用力越大
D.分子间只存在范德华力
B
【例4】下列说法不正确的是( )
A.由于H-O键比H--S键牢固,所以水的熔沸点比H2S高
B.HF的沸点在同族元素的氢化物中出现反常,是因为HF分子间存在氢键
C.F2、Cl2、Br2、I2熔沸点逐渐升高,是因为它们的组成结构相似,分子间的范德华力增大
D.氯化铵固体受热分解既破坏了离子键又破坏了共价键
A
课堂练习
第三节 分子结构与物质的性质
第2课时 范德华力与氢键
第二章 分子结构与性质
分子间作用力 · 感受
①、水通电/加热至2200℃会发生什么变化?
②、水加热至100℃会发生什么变化?
思考1
2H2O → 2H2↑+ O2↑
化学键断裂
化学变化
H2O(l) → H2O(g)
分子间距变大
化学键不断裂
物理变化
分子间作用力 · 感受
分子间作用力
化学键
(原子间作用力)
影响化学性质
(例如:稳定性)
影响物理性质
(例如:熔沸点)
共价键
离子键
氢键
范德华力
分子间作用力
①、本质:分子间的静电作用
②、强度:分子间作用力<<化学键
③、存在:分子之间普遍存在
④、存在条件:分子间距较近
分子间作用力 · 范德华力
范德华力
范德华力是固体、液体和气体中分子之间普遍存在的一种相互作用力,
它使得许多物质能以一定的聚集状态(固态和液态)存在。
强度极弱(比化学键弱1~2个数量级)
无方向性、无饱和性
1、范德华力特点
相对分子质量(M)越大,范德华力越大
分子的极性越大,范德华力越大
2、范德华力影响因素
分子间作用力 · 范德华力
单质 M 熔点/℃ 沸点/℃
F2 38 -219.6 -188.1
Cl2 71 -101 -34.6
Br2 160 -7.2 58.78
单质 M 极性 熔点/℃ 沸点/℃
CO 28 极性 -200 -191.5
N2 28 非极性 -210 -195
①、组成和结构相似的分子,相对分子质量越大,
→ 范德华力越大 → 熔、沸点越高。
②、 相对分子质量相同或相近时,分子的极性越大 → 范德华力越大 →熔、沸点越高。
3、范德华力对物质性质的影响
范德华力
单质 M 支链数 沸点/℃
正戊烷 72 0 36.1
异戊烷 72 1 25
新戊烷 72 2 9
③、 有机物中,互为同分异构体的分子,支链越多 → 范德华力越小 → 熔沸点越低
【练习1】下列有关范德华力的叙述正确的是
A.范德华力的实质也是一种电性作用,所以范德华力是一种特殊的化学键
B.范德华力与化学键的作用力的强弱不同
C.任何分子间在任意情况下都会产生范德华力
D.范德华力非常微弱,故破坏范德华力不需要消耗能量
√
不是化学键
若分子间的距离足够远,
则分子间没有范德华力
虽然范德华力非常微弱,但破坏它时也要消耗能量
分子间作用力 · 范德华力
【练习2】预测CH4、SiH4、GeH4、SnH4、PbH4的熔沸点相对大小
分子间作用力 · 范德华力
第IVA族
均为第四主族元素的氢化物,
组成与结构相似,
相对分子质量依次增大
→ 范德华力增大
→ 熔沸点升高
分子间作用力 · 氢键
一些氢化物的沸点
【质疑】HF、H2O、NH3的
相对分子质量是所在主族中最小的,但沸点却反常增大,
HF、H2O、NH3分子间
除了受范德华力影响,
还受到氢键的影响
分子间作用力 · 氢键
氢键
由已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间的作用力
【典例】水中氢键的形成
电负性大,半径小
O
H
H
O
H
H
δ-
δ-
H—O键极性很强
无内层电子
几乎成为“裸露”的质子,有空轨道
氢键
δ+
(静电作用)
分子间作用力 · 氢键
氢键
1、氢键的形成条件
电负性大且半径小的原子——N、O、F
2、氢键的表示方法
X—H…Y
其中X、Y一般为N、O、F,XY可以相同也可以不相同,“—”表示共价键,
“…”表示形成的氢键。氢键的键长一般定义为A—H…B的长度,而非H…B的长度。
3、氢键的本质
是一种静电作用,不属于化学键,而是比较强的分子间作用力,
因此氢键影响物理性质,而非化学性质
分子间作用力 · 氢键
氢键
4、氢键的特征
①、键能:共价键 >> 氢键 > 范德华力
(所以:氢键对熔沸点的影响能力比范德华力更大)
②、氢键具有一定的饱和性和方向性(这一点与范德华力不同)
饱和性:一个H只能形成一个氢键
方向性:
分子间作用力 · 氢键
氢键
5、氢键强弱的判断
形成氢键的原子电负性越大 → 氢键越强
【F—H F 是最强的氢键】
6、氢键的类型
分子间氢键:使物质沸点升高
分子内氢键:使物质沸点降低
水分子间的氢键:
邻羟基苯甲醛内的氢键:
分子间氢键对沸点的影响能力比分子内氢键更强
分子间作用力 · 氢键
氢键
7、氢键对物质性质的影响
①、影响沸点:
分子间氢键升高沸点、分子内氢键降低沸点(多存在于邻位有机物中)
②、影响溶解性:
溶质与溶剂之间形成氢键,可以增大溶解性(例如:NH3极易溶于水、醇与水互溶)
③、影响物质密度:
例如:形成冰时水分子间因形成氢键而排列规整,
形成疏松晶体,体积膨胀,密度小
【例1】正误判断
(1)HI分子间的范德华力大于HCl分子间的范德华力,故HI的沸点比HCl的高
(2)CO的沸点大于N2
(3)氢键的键长是指“X—H…Y”中“H…Y”的长度
(4)H2O的热稳定性大于H2S,是因为H2O分子间存在氢键
(5)冰融化成水,仅仅破坏氢键
(6)氢键均能使物质的熔、沸点升高
√
×
√
×
×
×
课堂练习
课堂练习
【例2】试表示HF水溶液中的氢键。
F—H…F、 O—H…F、 F—H…O、 O—H…O
【例3】下列说法中正确的是
A.分子间作用力越大,分子越稳定
B.分子间作用力越大,物质的熔、沸点越高
C.相对分子质量越大,其分子间作用力越大
D.分子间只存在范德华力
B
【例4】下列说法不正确的是( )
A.由于H-O键比H--S键牢固,所以水的熔沸点比H2S高
B.HF的沸点在同族元素的氢化物中出现反常,是因为HF分子间存在氢键
C.F2、Cl2、Br2、I2熔沸点逐渐升高,是因为它们的组成结构相似,分子间的范德华力增大
D.氯化铵固体受热分解既破坏了离子键又破坏了共价键
A
课堂练习
