3.3.1 金属晶体和离子晶体 课件 (共18张PPT)
文档属性
| 名称 | 3.3.1 金属晶体和离子晶体 课件 (共18张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-18 16:42:39 | ||
图片预览



文档简介
(共18张PPT)
第三节 金属晶体与离子晶体
第1课时 金属晶体 + 离子晶体
第三章 晶体结构与性质
金属晶体
金属晶体:
由金属键结合形成的晶体
金属键
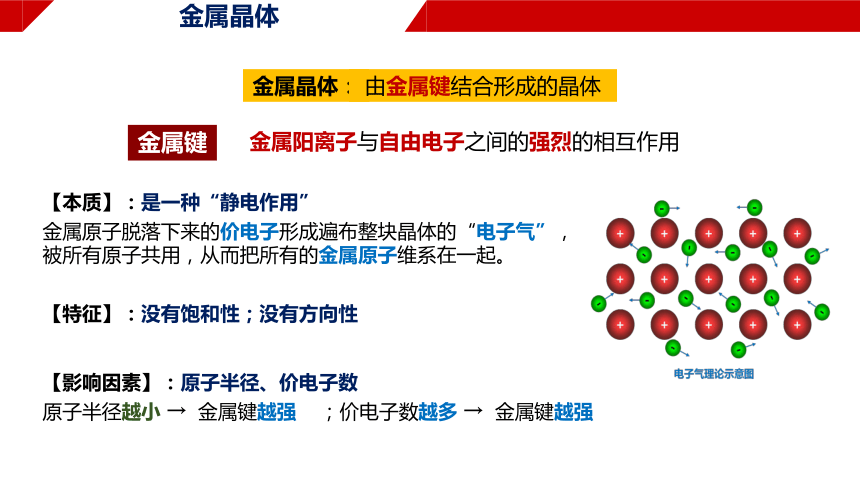
金属阳离子与自由电子之间的强烈的相互作用
【本质】:是一种“静电作用”
金属原子脱落下来的价电子形成遍布整块晶体的“电子气”,被所有原子共用,从而把所有的金属原子维系在一起。
【特征】:没有饱和性;没有方向性
【影响因素】:原子半径、价电子数
原子半径越小 → 金属键越强 ;价电子数越多 → 金属键越强
金属晶体
思考1
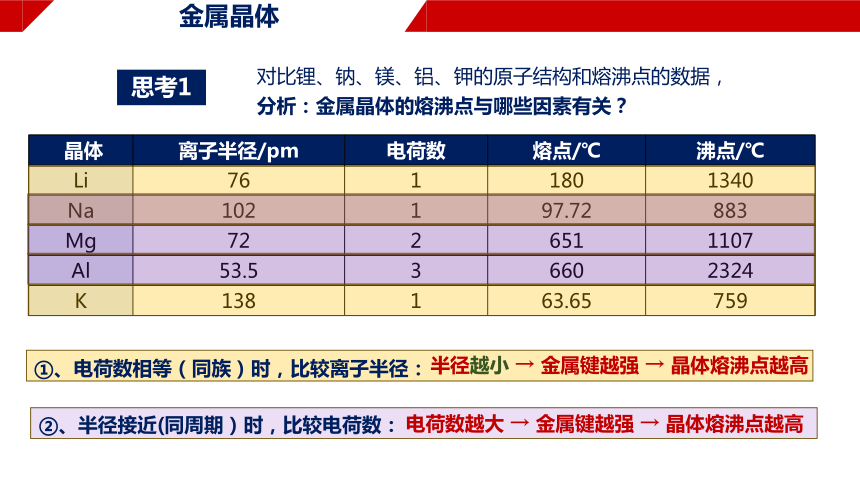
对比锂、钠、镁、铝、钾的原子结构和熔沸点的数据,
分析:金属晶体的熔沸点与哪些因素有关?
晶体 离子半径/pm 电荷数 熔点/℃ 沸点/℃
Li 76 1 180 1340
Na 102 1 97.72 883
Mg 72 2 651 1107
Al 53.5 3 660 2324
K 138 1 63.65 759
①、电荷数相等(同族)时,比较离子半径:
半径越小 → 金属键越强 → 晶体熔沸点越高
②、半径接近(同周期)时,比较电荷数:
电荷数越大 → 金属键越强 → 晶体熔沸点越高
金属晶体
金属晶体 · 物理性质特点
①、受金属键影响,金属晶体的熔沸点差异巨大
例如:汞 — 熔点最低 (-38.87 ℃),钨 — 熔点最高(3 410 ℃)
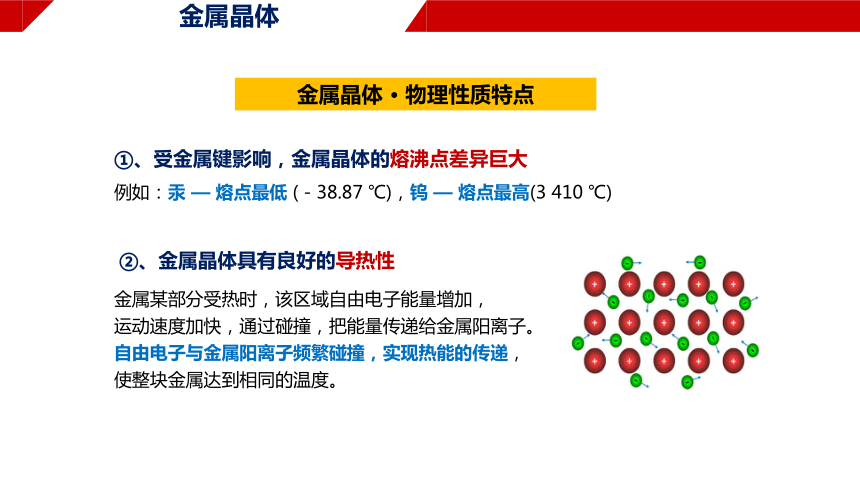
②、金属晶体具有良好的导热性
金属某部分受热时,该区域自由电子能量增加,
运动速度加快,通过碰撞,把能量传递给金属阳离子。
自由电子与金属阳离子频繁碰撞,实现热能的传递,
使整块金属达到相同的温度。
金属晶体
金属晶体 · 物理性质特点
③、金属晶体具有良好的导电性
在金属晶体中,存在许多自由电子,这些电子移动是没有方向的,
但是在外加电场的作用下,自由电子就会发生定向移动,形成电流,使金属表现出导电性。
金属晶体的电导率随温度升高而降低。
金属晶体
金属晶体 · 物理性质特点
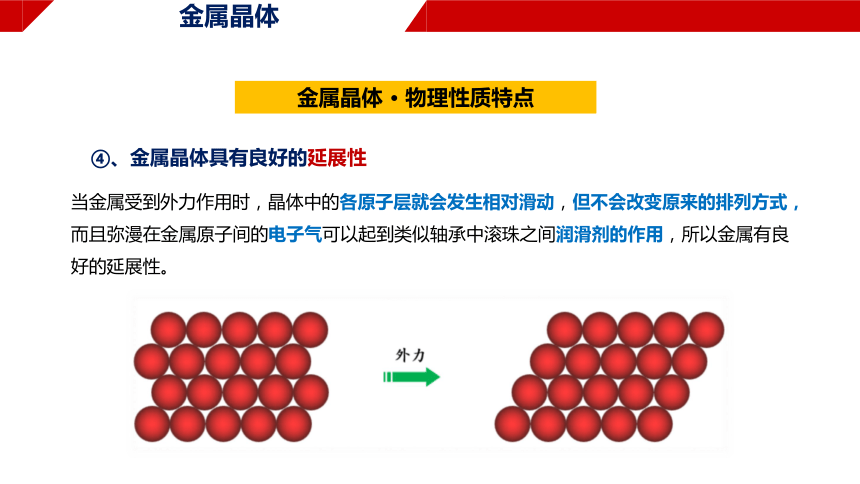
④、金属晶体具有良好的延展性
当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但不会改变原来的排列方式,而且弥漫在金属原子间的电子气可以起到类似轴承中滚珠之间润滑剂的作用,所以金属有良好的延展性。
金属晶体
金属晶体 · 物理性质特点
⑤、金属晶体具有“金属光泽”
由于金属内部原子以最紧密堆积状态排列,且存在自由电子,所以当光线照射到金属表面时,自由电子可以吸收所有频率的光并很快放出,使金属不透明且具有金属光泽。
金属晶体
①、构成金属晶体的粒子有哪些?
②、金属导电与电解质在熔融状态下导电、电解质溶液导电有什么不同?
③、金属在导热过程中粒子的运动情况如何?热量是通过什么方式传递的?
④、金属在受到外力时为什么不易断裂?其晶体结构是如何变化的?
金属阳离子、自由电子
金属:自由电子的定向移动,物理变化
电解质:自由离子的定向移动后得失电子,化学变化
金属阳离子和自由电子的运动加速,碰撞。
金属晶体中原子相对滑动,但排列方式不变。
(因为自由电子也随之移动,“电子气”将金属阳离子紧密联系)
金属晶体
金属晶体 · 堆积方式
①、在二维空间中排列的两种方式
非密置层
配位数:4
密置层
配位数:6
金属晶体
金属晶体 · 堆积方式
②、在三维空间中的常见堆积方式
简单立方堆积
(钋)
体心立方堆积
(钠、钾、铬、钼、钨等)
面心立方堆积
(金、银、铜、铅等)
【例1】正误判断
(1)、金属在常温下都是晶体
(2)、金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
(3)、金属阳离子与自由电子之间的强烈作用,在一定外力作用下,不因形变而消失
(4)、共价晶体的熔点一定比金属晶体的高,分子晶体的熔点一定比金属晶体的低
(5)、金属晶体除了纯金属,还有大量的合金( )
(7)、金属的电导率随温度的升高而降低( )
金属晶体
Hg常温液体
静电作用 ≠ 静电吸引
金属晶体熔沸点差异极大
【补充】:相较于构成合金的单纯金属,合金的硬度更大,熔点更低
离子晶体
离子晶体 · 基本概念
定义:由阳离子和阴离子相互作用形成的晶体
相互作用力:离子键(可能还含有共价键,甚至是氢键)
大量离子晶体的阴离子或阳离子不是单原子离子,有的还存在电中性分子(如H2O、NH3)
离子晶体
离子晶体 · 物理性质特点
物理性质:硬度较大,难以压缩;熔沸点较高;
(不同类型的离子晶体,熔沸点差异可能较大)
固体不导电,熔融状态或水溶液中能导电
离子晶体的形变、融、沸需要破坏离子键,
离子键强度较大,决定了离子晶体的硬度、熔沸点都较高
【补充】
离子键的强弱与离子半径、离子所带电荷有关
离子半径越小 → 离子键越强; 所带电荷越多 → 离子键越强
离子晶体
典型离子晶体① —— NaCl
NaCl晶体中
不含NaCl分子
、每个晶胞中实际拥有______个Na+,_______个Cl-,
晶体的化学式为 。
(2)、每个Na+周围与之等距且距离最近有_____个Cl-
(3)、每个Cl- 周围与之等距且距离最近有______个Na+
(4)、每个Na+周围与之等距且距离最近有______个Na+
(5)、每个Cl-周围与之等距且距离最近有______个Cl-
4
4
NaCl
6
6
Na+的配位数为6,Cl-的配位数为6
12
12
离子晶体
典型离子晶体② —— CsCl
、每个晶胞中实际拥有______个Cs+,_______个Cl-,
晶体的化学式为 。
(2)、Cs+的配位数为_______,Cl-的配位数为__________
(3)、每个Cs+周围与之等距且距离最近有______个Cs+
1
1
CsCl
8
6
晶胞
晶体
8
(4)、每个Cl-周围与之等距且距离最近有______个Cl-
6
【例2】正误判断
(1)离子晶体一定是离子化合物
(2)离子晶体中只含离子键
(3)含有离子的晶体一定是离子晶体
(4)由金属与非金属形成的晶体,属于离子晶体
(5)离子晶体的熔点一定低于共价晶体的熔点
(6)离子晶体受热熔化,破坏化学键,吸收能量,属于化学变化
√
×
×
×
×
×
课堂练习
【例3】关于晶体的下列说法中,正确的是( )
A、共价晶体中可能含有离子键
B、离子晶体中可能含有共价键
C、离子晶体中只含有离子键,不含有共价键
D、任何晶体中,若含有阳离子就一定有阴离子
B
课堂练习
【例4】下列各物质的晶体中,晶体类型相同的是( )
A、CO2和SiO2 B、NaCl和HCl
C、CO2和CS2 D、CCl4和MgCl2
C
课堂练习
【例5】下列叙述中,正确的是( )
A、离子晶体都是化合物 B、共价晶体都是单质
C、金属在常温下都以晶体形式存在 D、分子晶体在常温下不可能为固态
A
第三节 金属晶体与离子晶体
第1课时 金属晶体 + 离子晶体
第三章 晶体结构与性质
金属晶体
金属晶体:
由金属键结合形成的晶体
金属键
金属阳离子与自由电子之间的强烈的相互作用
【本质】:是一种“静电作用”
金属原子脱落下来的价电子形成遍布整块晶体的“电子气”,被所有原子共用,从而把所有的金属原子维系在一起。
【特征】:没有饱和性;没有方向性
【影响因素】:原子半径、价电子数
原子半径越小 → 金属键越强 ;价电子数越多 → 金属键越强
金属晶体
思考1
对比锂、钠、镁、铝、钾的原子结构和熔沸点的数据,
分析:金属晶体的熔沸点与哪些因素有关?
晶体 离子半径/pm 电荷数 熔点/℃ 沸点/℃
Li 76 1 180 1340
Na 102 1 97.72 883
Mg 72 2 651 1107
Al 53.5 3 660 2324
K 138 1 63.65 759
①、电荷数相等(同族)时,比较离子半径:
半径越小 → 金属键越强 → 晶体熔沸点越高
②、半径接近(同周期)时,比较电荷数:
电荷数越大 → 金属键越强 → 晶体熔沸点越高
金属晶体
金属晶体 · 物理性质特点
①、受金属键影响,金属晶体的熔沸点差异巨大
例如:汞 — 熔点最低 (-38.87 ℃),钨 — 熔点最高(3 410 ℃)
②、金属晶体具有良好的导热性
金属某部分受热时,该区域自由电子能量增加,
运动速度加快,通过碰撞,把能量传递给金属阳离子。
自由电子与金属阳离子频繁碰撞,实现热能的传递,
使整块金属达到相同的温度。
金属晶体
金属晶体 · 物理性质特点
③、金属晶体具有良好的导电性
在金属晶体中,存在许多自由电子,这些电子移动是没有方向的,
但是在外加电场的作用下,自由电子就会发生定向移动,形成电流,使金属表现出导电性。
金属晶体的电导率随温度升高而降低。
金属晶体
金属晶体 · 物理性质特点
④、金属晶体具有良好的延展性
当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但不会改变原来的排列方式,而且弥漫在金属原子间的电子气可以起到类似轴承中滚珠之间润滑剂的作用,所以金属有良好的延展性。
金属晶体
金属晶体 · 物理性质特点
⑤、金属晶体具有“金属光泽”
由于金属内部原子以最紧密堆积状态排列,且存在自由电子,所以当光线照射到金属表面时,自由电子可以吸收所有频率的光并很快放出,使金属不透明且具有金属光泽。
金属晶体
①、构成金属晶体的粒子有哪些?
②、金属导电与电解质在熔融状态下导电、电解质溶液导电有什么不同?
③、金属在导热过程中粒子的运动情况如何?热量是通过什么方式传递的?
④、金属在受到外力时为什么不易断裂?其晶体结构是如何变化的?
金属阳离子、自由电子
金属:自由电子的定向移动,物理变化
电解质:自由离子的定向移动后得失电子,化学变化
金属阳离子和自由电子的运动加速,碰撞。
金属晶体中原子相对滑动,但排列方式不变。
(因为自由电子也随之移动,“电子气”将金属阳离子紧密联系)
金属晶体
金属晶体 · 堆积方式
①、在二维空间中排列的两种方式
非密置层
配位数:4
密置层
配位数:6
金属晶体
金属晶体 · 堆积方式
②、在三维空间中的常见堆积方式
简单立方堆积
(钋)
体心立方堆积
(钠、钾、铬、钼、钨等)
面心立方堆积
(金、银、铜、铅等)
【例1】正误判断
(1)、金属在常温下都是晶体
(2)、金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
(3)、金属阳离子与自由电子之间的强烈作用,在一定外力作用下,不因形变而消失
(4)、共价晶体的熔点一定比金属晶体的高,分子晶体的熔点一定比金属晶体的低
(5)、金属晶体除了纯金属,还有大量的合金( )
(7)、金属的电导率随温度的升高而降低( )
金属晶体
Hg常温液体
静电作用 ≠ 静电吸引
金属晶体熔沸点差异极大
【补充】:相较于构成合金的单纯金属,合金的硬度更大,熔点更低
离子晶体
离子晶体 · 基本概念
定义:由阳离子和阴离子相互作用形成的晶体
相互作用力:离子键(可能还含有共价键,甚至是氢键)
大量离子晶体的阴离子或阳离子不是单原子离子,有的还存在电中性分子(如H2O、NH3)
离子晶体
离子晶体 · 物理性质特点
物理性质:硬度较大,难以压缩;熔沸点较高;
(不同类型的离子晶体,熔沸点差异可能较大)
固体不导电,熔融状态或水溶液中能导电
离子晶体的形变、融、沸需要破坏离子键,
离子键强度较大,决定了离子晶体的硬度、熔沸点都较高
【补充】
离子键的强弱与离子半径、离子所带电荷有关
离子半径越小 → 离子键越强; 所带电荷越多 → 离子键越强
离子晶体
典型离子晶体① —— NaCl
NaCl晶体中
不含NaCl分子
、每个晶胞中实际拥有______个Na+,_______个Cl-,
晶体的化学式为 。
(2)、每个Na+周围与之等距且距离最近有_____个Cl-
(3)、每个Cl- 周围与之等距且距离最近有______个Na+
(4)、每个Na+周围与之等距且距离最近有______个Na+
(5)、每个Cl-周围与之等距且距离最近有______个Cl-
4
4
NaCl
6
6
Na+的配位数为6,Cl-的配位数为6
12
12
离子晶体
典型离子晶体② —— CsCl
、每个晶胞中实际拥有______个Cs+,_______个Cl-,
晶体的化学式为 。
(2)、Cs+的配位数为_______,Cl-的配位数为__________
(3)、每个Cs+周围与之等距且距离最近有______个Cs+
1
1
CsCl
8
6
晶胞
晶体
8
(4)、每个Cl-周围与之等距且距离最近有______个Cl-
6
【例2】正误判断
(1)离子晶体一定是离子化合物
(2)离子晶体中只含离子键
(3)含有离子的晶体一定是离子晶体
(4)由金属与非金属形成的晶体,属于离子晶体
(5)离子晶体的熔点一定低于共价晶体的熔点
(6)离子晶体受热熔化,破坏化学键,吸收能量,属于化学变化
√
×
×
×
×
×
课堂练习
【例3】关于晶体的下列说法中,正确的是( )
A、共价晶体中可能含有离子键
B、离子晶体中可能含有共价键
C、离子晶体中只含有离子键,不含有共价键
D、任何晶体中,若含有阳离子就一定有阴离子
B
课堂练习
【例4】下列各物质的晶体中,晶体类型相同的是( )
A、CO2和SiO2 B、NaCl和HCl
C、CO2和CS2 D、CCl4和MgCl2
C
课堂练习
【例5】下列叙述中,正确的是( )
A、离子晶体都是化合物 B、共价晶体都是单质
C、金属在常温下都以晶体形式存在 D、分子晶体在常温下不可能为固态
A
