1.1.2 有机物的共价键 课件 (共17张PPT)
文档属性
| 名称 | 1.1.2 有机物的共价键 课件 (共17张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 16.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-18 16:46:41 | ||
图片预览


文档简介
(共17张PPT)
第一节 有机化合物的结构特点
第2课时 有机物的共价键
第一章 有机化合物的结构特点与研究方法
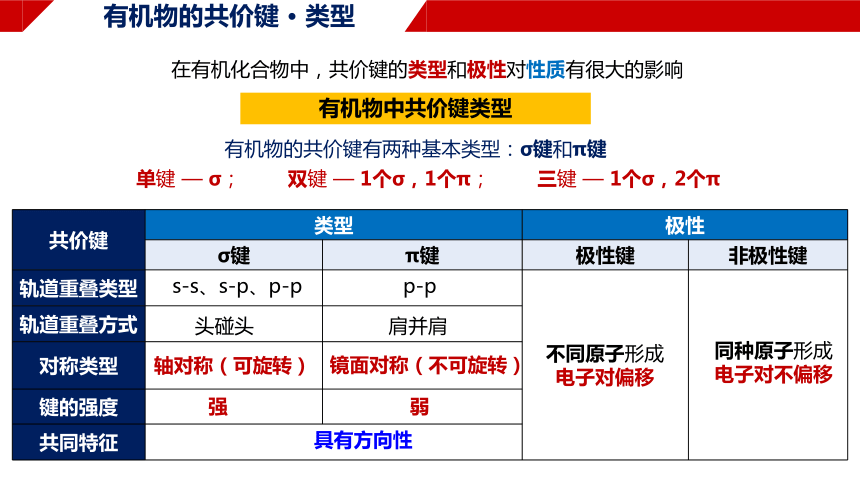
有机物的共价键 · 类型
有机物中共价键类型
有机物的共价键有两种基本类型:σ键和π键
单键 — σ; 双键 — 1个σ,1个π; 三键 — 1个σ,2个π
在有机化合物中,共价键的类型和极性对性质有很大的影响
共价键 类型 极性 σ键 π键 极性键 非极性键
轨道重叠类型
轨道重叠方式 对称类型 键的强度 共同特征 s-s、s-p、p-p
p-p
头碰头
肩并肩
轴对称(可旋转)
镜面对称(不可旋转)
强
弱
具有方向性
不同原子形成
电子对偏移
同种原子形成
电子对不偏移
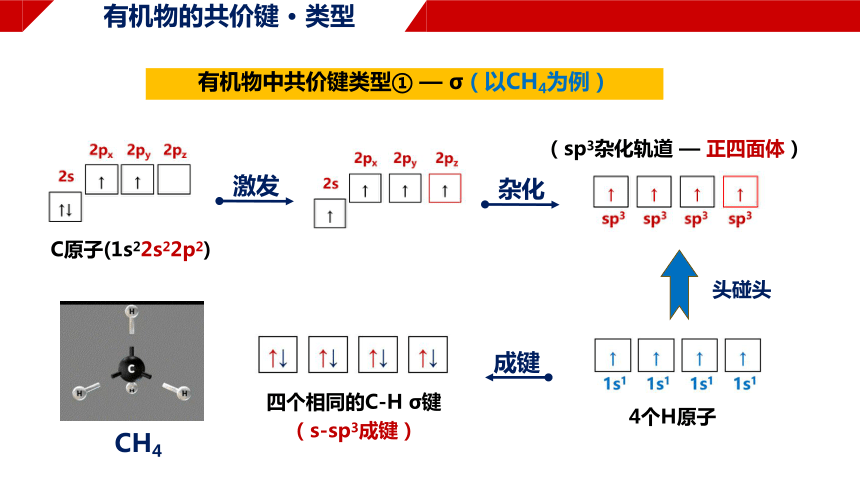
有机物的共价键 · 类型
有机物中共价键类型① — σ(以CH4为例)
CH4
C原子(1s22s22p2)
激发
杂化
(sp3杂化轨道 — 正四面体)
4个H原子
头碰头
成键
四个相同的C-H σ键
(s-sp3成键)
有机物的共价键 · 类型
有机物中共价键类型① — σ
CH4
在甲烷分子中,氢原子的1s轨道与碳原子的sp3杂化轨道沿着两个原子核间的键轴,
以“头碰头”的形式相互重叠,形成σ键;
“烷”中的C原子均为sp3杂化,
4个键以109°28′的角度延申,形成四面体结构,
每个σ键(单键)均可旋转, σ键较牢固,
“烷”的性质稳定
表现为:能取代、不加成
结构
性质
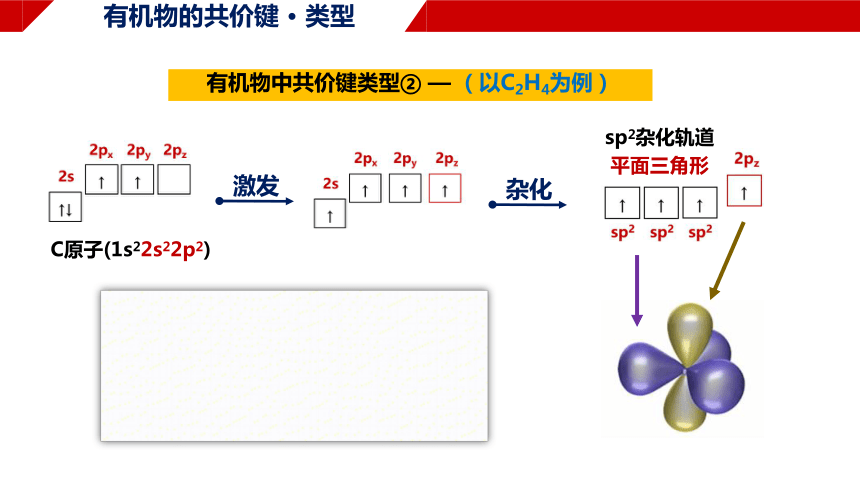
有机物的共价键 · 类型
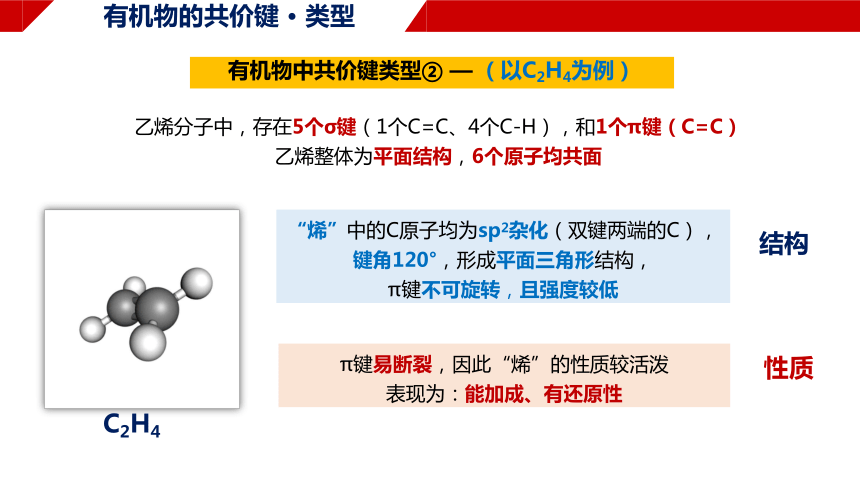
有机物中共价键类型② — (以C2H4为例)
C原子(1s22s22p2)
激发
杂化
sp2杂化轨道
平面三角形
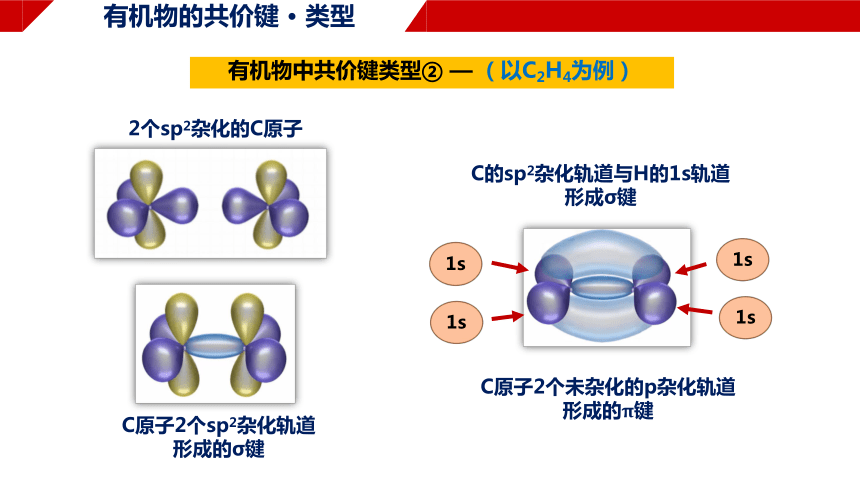
有机物的共价键 · 类型
有机物中共价键类型② — (以C2H4为例)
C原子2个sp2杂化轨道
形成的σ键
C原子2个未杂化的p杂化轨道
形成的π键
1s
1s
1s
1s
C的sp2杂化轨道与H的1s轨道
形成σ键
2个sp2杂化的C原子
有机物的共价键 · 类型
有机物中共价键类型② — (以C2H4为例)
“烯”中的C原子均为sp2杂化(双键两端的C),
键角120°,形成平面三角形结构,
π键不可旋转,且强度较低
乙烯分子中,存在5个σ键(1个C=C、4个C-H),和1个π键(C=C)
乙烯整体为平面结构,6个原子均共面
π键易断裂,因此“烯”的性质较活泼
表现为:能加成、有还原性
结构
性质
C2H4
【例1】在CH2=CHCl分子中,C—Cl 键采用的成键轨道是
A.sp-p B.sp2-s
C.sp2-p D.sp3-p
课堂练习
C
有机物的共价键 · 极性
有机物中共价键的极性
共价键的极性越强,在反应中越易断键
影响共价键
极性的因素
键两端原子的电负性
相邻基团的影响
电负性差异越大,键的极性越强
有些基团吸电子,有些基团推电子
导致键的极性发生变化
官能团及其邻近的键是发生反应的活性部位
有机物的共价键 · 极性
有机物中共价键的极性
【实验1】:两只分别盛有蒸馏水和无水乙醇的烧杯中各加入同样大小的钠
两只烧杯中均有气泡产生,乙醇与钠反应缓慢,蒸馏水与钠反应剧烈
乙醇与钠反应
蒸馏水与钠反应
有机物的共价键 · 极性
思考
①、为什么钠与乙醇反应能放出氢气?
②、同样的条件下,为什么乙醇与钠反应没有水与钠的反应剧烈?
2
+ 2Na
+ H2↑
2
O─H的极性减弱
烃基推电子效应
O─H不易断裂
取代反应
有机物的共价键 · 极性
思考
③、分析:乙酸与钠反应能否放出氢气?反应现象是否比钠与水反应更剧烈?
2
+ 2Na
+ H2↑
2
O─H的极性增强
羰基吸电子效应
O─H更易断裂
有机物的共价键 · 极性
思考
④、乙醇中的C-O是否容易断裂?
羟基中氧原子的电负性较大,乙醇分子中的碳氧键极性也较强,也可断裂,
【例:乙醇与氢溴酸的反应】
H Br
C
H
O
H
C
H
H
H
H
C
H
Br
C
H
H
H
H
H2O↑
请从化学键和官能团的角度分析下列反应中有机化合物的变化。
①、甲烷和乙烯中分别有哪种类型的共价键?
②、乙烯、一氯甲烷和1,2─二溴乙烷中有哪些官能团?
有机物的共价键 · 极性
思考
【甲烷】:极性共价键 / σ键 【乙烯】:极性键和非极性键 / σ键和π键
【乙烯】:碳碳双键 【一氯甲烷】:碳氯键 【 1,2─二溴乙烷】:碳溴键
请从化学键和官能团的角度分析下列反应中有机化合物的变化。
④、乙烯与溴反应后,官能团有什么变化?断裂的化学键是什么?形成的化学键是什么?
有机物的共价键 · 极性
思考
③、甲烷与氯发生反应后,产生了什么官能团?断裂的化学键是什么?形成的化学键是什么?
取代反应:产生了碳氯键 、断裂C-H键,形成C-Cl键
加成反应:产生了碳溴键 、断裂C=C键,形成C-Br键
根据共价键的类型和极性可推测该物质可发生_____反应和_____反应,与钠反应的剧烈程度比水与钠反应的_________ 。原因是
_______________________________________________________________
【例2】某有机物分子的结构简式为 ,
该分子中有____个σ键,_____个π键,_____(填“有”或“无”)非极性键
CH
O
H
CH2
C
O
8
2
有
加成
取代
大
CH2==CHCOOH中 的O-H受酮羰基影响,极性更强,更易断裂
O
H
C
O
课堂练习
【例3】多位化学家用简单的偶联反应合成了如下这个有趣的“纳米小人”分子。有关该分子的结构说法不正确的是
A.该分子中的C原子采取的杂化方式有:sp、sp2、sp3
B.该分子中的O原子采取sp3杂化
C.“纳米小人”头部的所有原子不能在同一平面内
D.“纳米小人”手、脚部位的碳原子不杂化
课堂练习
D
第一节 有机化合物的结构特点
第2课时 有机物的共价键
第一章 有机化合物的结构特点与研究方法
有机物的共价键 · 类型
有机物中共价键类型
有机物的共价键有两种基本类型:σ键和π键
单键 — σ; 双键 — 1个σ,1个π; 三键 — 1个σ,2个π
在有机化合物中,共价键的类型和极性对性质有很大的影响
共价键 类型 极性 σ键 π键 极性键 非极性键
轨道重叠类型
轨道重叠方式 对称类型 键的强度 共同特征 s-s、s-p、p-p
p-p
头碰头
肩并肩
轴对称(可旋转)
镜面对称(不可旋转)
强
弱
具有方向性
不同原子形成
电子对偏移
同种原子形成
电子对不偏移
有机物的共价键 · 类型
有机物中共价键类型① — σ(以CH4为例)
CH4
C原子(1s22s22p2)
激发
杂化
(sp3杂化轨道 — 正四面体)
4个H原子
头碰头
成键
四个相同的C-H σ键
(s-sp3成键)
有机物的共价键 · 类型
有机物中共价键类型① — σ
CH4
在甲烷分子中,氢原子的1s轨道与碳原子的sp3杂化轨道沿着两个原子核间的键轴,
以“头碰头”的形式相互重叠,形成σ键;
“烷”中的C原子均为sp3杂化,
4个键以109°28′的角度延申,形成四面体结构,
每个σ键(单键)均可旋转, σ键较牢固,
“烷”的性质稳定
表现为:能取代、不加成
结构
性质
有机物的共价键 · 类型
有机物中共价键类型② — (以C2H4为例)
C原子(1s22s22p2)
激发
杂化
sp2杂化轨道
平面三角形
有机物的共价键 · 类型
有机物中共价键类型② — (以C2H4为例)
C原子2个sp2杂化轨道
形成的σ键
C原子2个未杂化的p杂化轨道
形成的π键
1s
1s
1s
1s
C的sp2杂化轨道与H的1s轨道
形成σ键
2个sp2杂化的C原子
有机物的共价键 · 类型
有机物中共价键类型② — (以C2H4为例)
“烯”中的C原子均为sp2杂化(双键两端的C),
键角120°,形成平面三角形结构,
π键不可旋转,且强度较低
乙烯分子中,存在5个σ键(1个C=C、4个C-H),和1个π键(C=C)
乙烯整体为平面结构,6个原子均共面
π键易断裂,因此“烯”的性质较活泼
表现为:能加成、有还原性
结构
性质
C2H4
【例1】在CH2=CHCl分子中,C—Cl 键采用的成键轨道是
A.sp-p B.sp2-s
C.sp2-p D.sp3-p
课堂练习
C
有机物的共价键 · 极性
有机物中共价键的极性
共价键的极性越强,在反应中越易断键
影响共价键
极性的因素
键两端原子的电负性
相邻基团的影响
电负性差异越大,键的极性越强
有些基团吸电子,有些基团推电子
导致键的极性发生变化
官能团及其邻近的键是发生反应的活性部位
有机物的共价键 · 极性
有机物中共价键的极性
【实验1】:两只分别盛有蒸馏水和无水乙醇的烧杯中各加入同样大小的钠
两只烧杯中均有气泡产生,乙醇与钠反应缓慢,蒸馏水与钠反应剧烈
乙醇与钠反应
蒸馏水与钠反应
有机物的共价键 · 极性
思考
①、为什么钠与乙醇反应能放出氢气?
②、同样的条件下,为什么乙醇与钠反应没有水与钠的反应剧烈?
2
+ 2Na
+ H2↑
2
O─H的极性减弱
烃基推电子效应
O─H不易断裂
取代反应
有机物的共价键 · 极性
思考
③、分析:乙酸与钠反应能否放出氢气?反应现象是否比钠与水反应更剧烈?
2
+ 2Na
+ H2↑
2
O─H的极性增强
羰基吸电子效应
O─H更易断裂
有机物的共价键 · 极性
思考
④、乙醇中的C-O是否容易断裂?
羟基中氧原子的电负性较大,乙醇分子中的碳氧键极性也较强,也可断裂,
【例:乙醇与氢溴酸的反应】
H Br
C
H
O
H
C
H
H
H
H
C
H
Br
C
H
H
H
H
H2O↑
请从化学键和官能团的角度分析下列反应中有机化合物的变化。
①、甲烷和乙烯中分别有哪种类型的共价键?
②、乙烯、一氯甲烷和1,2─二溴乙烷中有哪些官能团?
有机物的共价键 · 极性
思考
【甲烷】:极性共价键 / σ键 【乙烯】:极性键和非极性键 / σ键和π键
【乙烯】:碳碳双键 【一氯甲烷】:碳氯键 【 1,2─二溴乙烷】:碳溴键
请从化学键和官能团的角度分析下列反应中有机化合物的变化。
④、乙烯与溴反应后,官能团有什么变化?断裂的化学键是什么?形成的化学键是什么?
有机物的共价键 · 极性
思考
③、甲烷与氯发生反应后,产生了什么官能团?断裂的化学键是什么?形成的化学键是什么?
取代反应:产生了碳氯键 、断裂C-H键,形成C-Cl键
加成反应:产生了碳溴键 、断裂C=C键,形成C-Br键
根据共价键的类型和极性可推测该物质可发生_____反应和_____反应,与钠反应的剧烈程度比水与钠反应的_________ 。原因是
_______________________________________________________________
【例2】某有机物分子的结构简式为 ,
该分子中有____个σ键,_____个π键,_____(填“有”或“无”)非极性键
CH
O
H
CH2
C
O
8
2
有
加成
取代
大
CH2==CHCOOH中 的O-H受酮羰基影响,极性更强,更易断裂
O
H
C
O
课堂练习
【例3】多位化学家用简单的偶联反应合成了如下这个有趣的“纳米小人”分子。有关该分子的结构说法不正确的是
A.该分子中的C原子采取的杂化方式有:sp、sp2、sp3
B.该分子中的O原子采取sp3杂化
C.“纳米小人”头部的所有原子不能在同一平面内
D.“纳米小人”手、脚部位的碳原子不杂化
课堂练习
D
