1.1.3 有机物的同分异构现象 课件 (共20张PPT)
文档属性
| 名称 | 1.1.3 有机物的同分异构现象 课件 (共20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 833.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-18 23:04:13 | ||
图片预览


文档简介
(共20张PPT)
第一节 有机化合物的结构特点
第3课时 有机物的同分异构现象
第一章 有机化合物的结构特点与研究方法
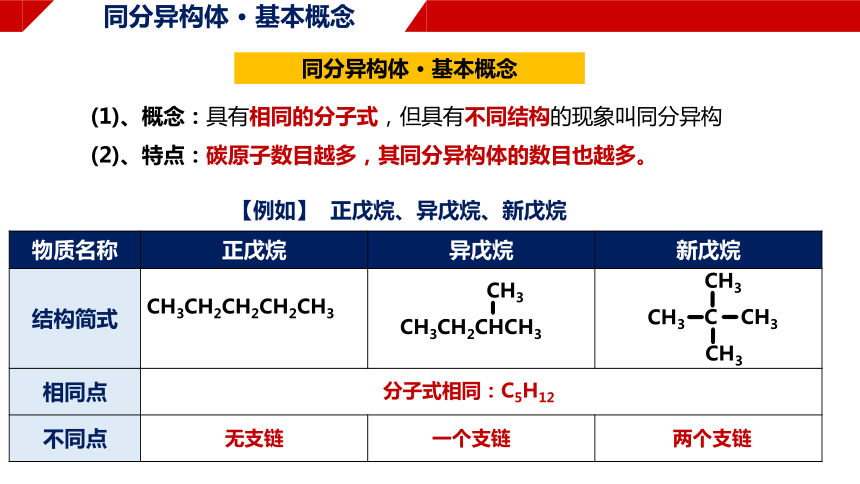
同分异构体 · 基本概念
同分异构体 · 基本概念
(1)、概念:具有相同的分子式,但具有不同结构的现象叫同分异构
(2)、特点:碳原子数目越多,其同分异构体的数目也越多。
【例如】 正戊烷、异戊烷、新戊烷
物质名称 正戊烷 异戊烷 新戊烷
结构简式
相同点
不同点
CH3
C
CH3
CH3
CH3
CH3CH2CH2CH2CH3
CH3
CH3CH2CHCH3
分子式相同:C5H12
无支链
一个支链
两个支链
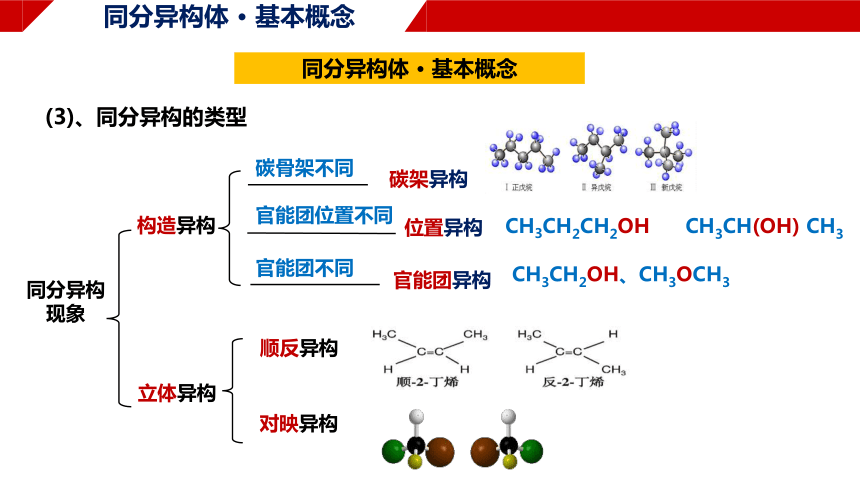
同分异构体 · 基本概念
同分异构体 · 基本概念
(3)、同分异构的类型
构造异构
碳架异构
位置异构
官能团异构
立体异构
同分异构
现象
碳骨架不同
官能团位置不同
官能团不同
顺反异构
对映异构
CH3CH2OH、CH3OCH3
CH3CH2CH2OH CH3CH(OH) CH3
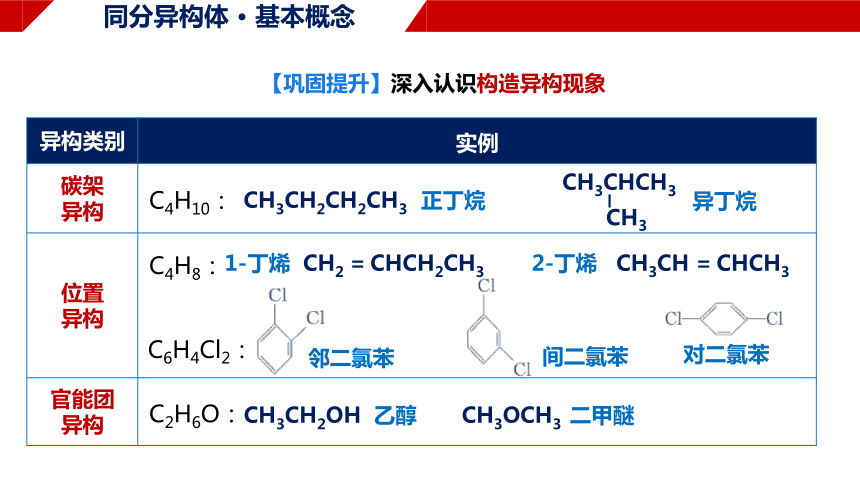
异构类别 实例
碳架 异构 C4H10:
位置 异构 C4H8:
C6H4Cl2:
官能团 异构 C2H6O:
CH3CH2CH2CH3
正丁烷
异丁烷
1-丁烯 CH2 = CHCH2CH3 2-丁烯 CH3CH = CHCH3
CH3CH2OH 乙醇 CH3OCH3 二甲醚
CH3
CH3CHCH3
【巩固提升】深入认识构造异构现象
邻二氯苯
间二氯苯
对二氯苯
同分异构体 · 基本概念
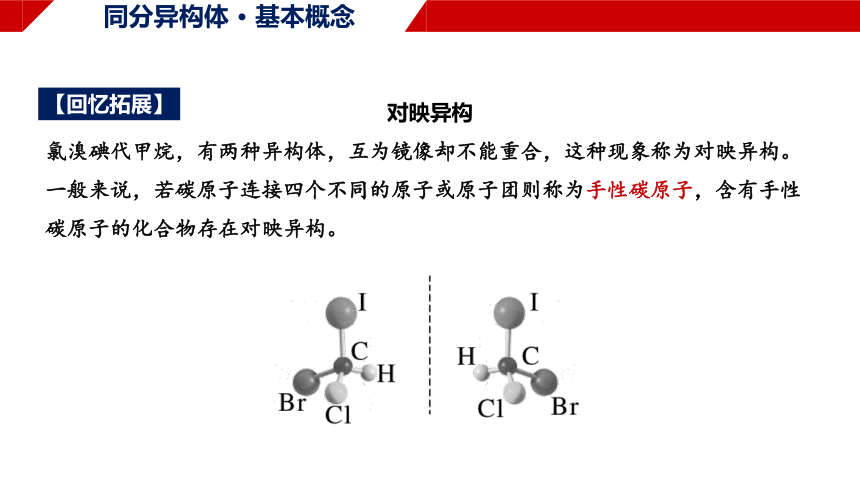
对映异构
氯溴碘代甲烷,有两种异构体,互为镜像却不能重合,这种现象称为对映异构。一般来说,若碳原子连接四个不同的原子或原子团则称为手性碳原子,含有手性碳原子的化合物存在对映异构。
【回忆拓展】
同分异构体 · 基本概念
同分异构体 · 书写
同分异构体 · 书写
【方法一】减碳法
针对“烷烃”同分异构体的书写
第一步:定骨架
第二步:补齐氢
主链由长到短;支链由心到边
甲基不放倒一;乙基不放倒二
一个C四个键,剩余位置补齐H
同分异构体 · 书写
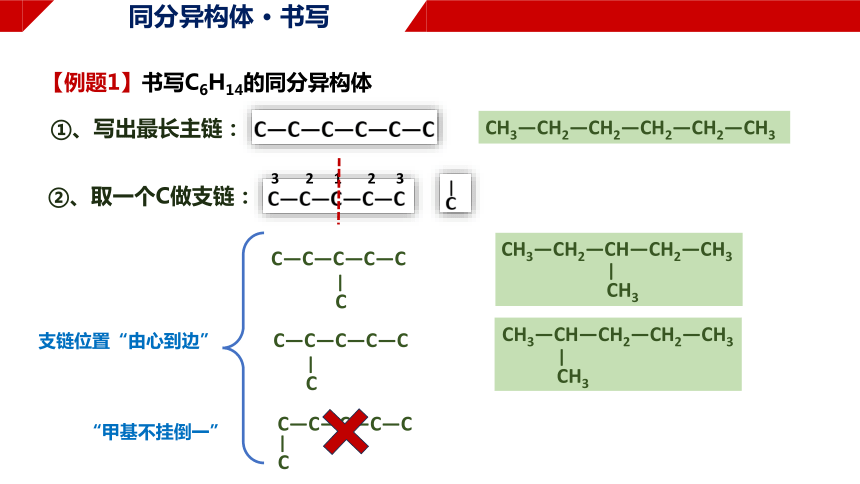
【例题1】书写C6H14的同分异构体
①、写出最长主链:
CH3—CH2—CH2—CH2—CH2—CH3
②、取一个C做支链:
3
2
1
2
3
支链位置“由心到边”
C—C—C—C—C
C
—
C—C—C—C—C
C
—
C—C—C—C—C
C
—
“甲基不挂倒一”
CH3—CH—CH2—CH2—CH3
CH3
—
CH3—CH2—CH—CH2—CH3
CH3
—
同分异构体 · 书写
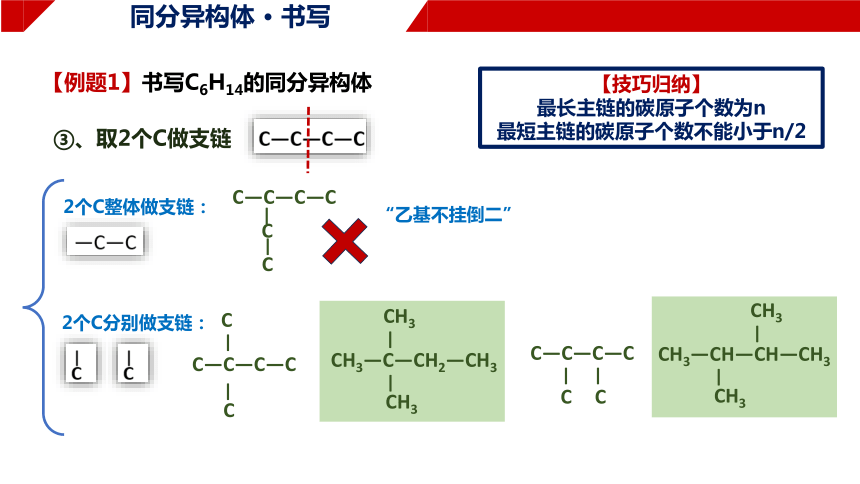
【例题1】书写C6H14的同分异构体
③、取2个C做支链
2个C整体做支链:
2个C分别做支链:
C—C—C—C
C
—
C
—
“乙基不挂倒二”
C—C—C—C
C
—
C
—
C
—
C—C—C—C
C
—
CH3—C—CH2—CH3
CH3
—
CH3
—
CH3—CH—CH—CH3
CH3
—
CH3
—
【技巧归纳】
最长主链的碳原子个数为n
最短主链的碳原子个数不能小于n/2
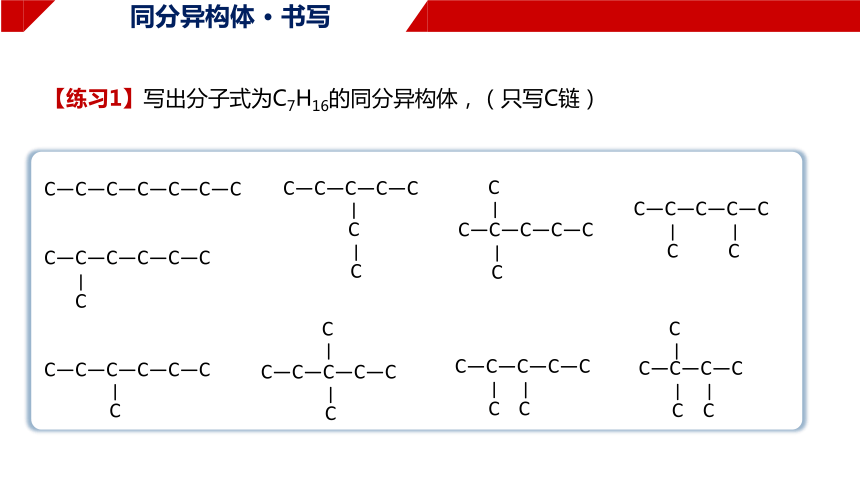
【练习1】写出分子式为C7H16的同分异构体,(只写C链)
C—C—C—C—C—C—C
C—C—C—C—C—C
C
—
C—C—C—C—C—C
C
—
C—C—C—C—C
C
—
C
—
C—C—C—C—C
C
—
C
—
C—C—C—C—C
C
—
C
—
C—C—C—C—C
C
—
C
—
C—C—C—C
C
—
C
—
C
—
C—C—C—C—C
C
—
C
—
同分异构体 · 书写
同分异构体 · 书写
同分异构体 · 书写
【方法二】插入法
针对“烯烃/炔烃”同分异构体的书写
第一步:定骨架
第三步:补齐氢
第二步:定双键
1.定骨架
2.定双键
C—C—C—C—C
C—C—C—C
C
—
1
2
1
2
3
C—C—C
C
—
C
—
1
【例题2】书写戊烯(C5H10)同分异构体
同分异构体 · 书写
同分异构体 · 书写
【方法三】等效氢法
针对“一取代物”同分异构体的书写
等效氢:处于相同化学环境的氢原子
① 、同C上的H等效
②、 同C上连的甲基上的H等效
③ 、对称位置上的H等效
3种H
CH3CH2CH2CH2CH3
4种H
1种H
一元取代物的数目 = H的种类
【例题3】以下3种物质分别有多少种H原子
【练习3】分子式为C4H10O的属于醇的同分异构体有几种?
C4H10O
C4H9OH
C4H10中的一个H被-OH取代
(一取代物同分异构体的数目 = H的种类)
C4H10中的H种类数目
C4H10O属于醇的同分异构体数目为:4种
CH3CH2CH2CH3
CH3—CH—CH3
CH3
—
2种等效氢
2种等效氢
同分异构体 · 书写
【练习4】正误判断
(1)同素异形体、同分异构体之间的转化是物理变化
(2)同系物之间可以互为同分异构体
(3)淀粉与纤维素是化学式为(C6H10O5)n的同分异构体
(4)CH3COOH与HCOOCH3互为同分异构体,属于官能团异构
(5) 与 互为同分异构体,属于立体异构
×
×
×
√
×
同分异构体 · 书写
CH2==CH2
结构简式
最简式(实验式)
CH2
球棍模型
空间填充模型
分子式
C2H4
【知识拓展】键线式
将C、H省略,只表示键的连接情况和官能团,每个拐点或终点均表示一个C原子。
电子式
结构式
【符号表征】.以乙烯为例,总结有机物的各种表示方法
如丙烯可表示为 ,乙醇可表示为 。
补充延伸
【练习5】 的一氯代物有
A.1种 B.2种 C.3种 D.4种
课堂练习
【练习6】分子式为C6H12O且含有“-CHO”的同分异构体共有(不考虑立体异构)
A.6种 B.8种 C.4种 D.10种
B
B
【课堂补充】
有机物不饱和度的计算
(互为同分异构体的物质,不饱和度相等)
1、【概念】:不饱和度又称缺氢指数,通常用Ω表示。
2、【计算方法】
①、已知结构算不饱和度:
链状烷烃(CnH2n+2)为饱和烃, 不饱和度 Ω = 0
双键Ω=1; 三键Ω=2; 环Ω=1; 苯环Ω=4
【例1】计算下列物质的不饱和度
Ω=1
Ω=2
Ω=5
Ω=14
2、【计算方法】
②、已知组成算不饱和度:
(1)烃(CnHm)的不饱和度的计算
(2)含氧衍生物(CnHmOx)的不饱和度的计算
即:O原子不影响不饱和度的计算
(3)含卤素衍生物(CnHmClx)的不饱和度的计算
(4)含氮衍生物(CnHmNx)的不饱和度的计算
即:卤原子相当于H
即:N原子相当于减掉1个H
CH3CH2CH2-OH
CH3 - O - CH3
CH3-C-H
O
Ω=0
Ω=0
Ω=1
【例2】计算下列物质的不饱和度
C2H5NH2
C8H11NO2
Ω=0
Ω=4
Ω=4
C2H5Cl
C3H5Cl
C4H4Br2
Ω=0
Ω=1
Ω=2
【例3】请写出下列物质的分子式(可以用不饱和度帮助检查H原子数)
C7H8O5
C8H7NOCl2
C15H20O4
第一节 有机化合物的结构特点
第3课时 有机物的同分异构现象
第一章 有机化合物的结构特点与研究方法
同分异构体 · 基本概念
同分异构体 · 基本概念
(1)、概念:具有相同的分子式,但具有不同结构的现象叫同分异构
(2)、特点:碳原子数目越多,其同分异构体的数目也越多。
【例如】 正戊烷、异戊烷、新戊烷
物质名称 正戊烷 异戊烷 新戊烷
结构简式
相同点
不同点
CH3
C
CH3
CH3
CH3
CH3CH2CH2CH2CH3
CH3
CH3CH2CHCH3
分子式相同:C5H12
无支链
一个支链
两个支链
同分异构体 · 基本概念
同分异构体 · 基本概念
(3)、同分异构的类型
构造异构
碳架异构
位置异构
官能团异构
立体异构
同分异构
现象
碳骨架不同
官能团位置不同
官能团不同
顺反异构
对映异构
CH3CH2OH、CH3OCH3
CH3CH2CH2OH CH3CH(OH) CH3
异构类别 实例
碳架 异构 C4H10:
位置 异构 C4H8:
C6H4Cl2:
官能团 异构 C2H6O:
CH3CH2CH2CH3
正丁烷
异丁烷
1-丁烯 CH2 = CHCH2CH3 2-丁烯 CH3CH = CHCH3
CH3CH2OH 乙醇 CH3OCH3 二甲醚
CH3
CH3CHCH3
【巩固提升】深入认识构造异构现象
邻二氯苯
间二氯苯
对二氯苯
同分异构体 · 基本概念
对映异构
氯溴碘代甲烷,有两种异构体,互为镜像却不能重合,这种现象称为对映异构。一般来说,若碳原子连接四个不同的原子或原子团则称为手性碳原子,含有手性碳原子的化合物存在对映异构。
【回忆拓展】
同分异构体 · 基本概念
同分异构体 · 书写
同分异构体 · 书写
【方法一】减碳法
针对“烷烃”同分异构体的书写
第一步:定骨架
第二步:补齐氢
主链由长到短;支链由心到边
甲基不放倒一;乙基不放倒二
一个C四个键,剩余位置补齐H
同分异构体 · 书写
【例题1】书写C6H14的同分异构体
①、写出最长主链:
CH3—CH2—CH2—CH2—CH2—CH3
②、取一个C做支链:
3
2
1
2
3
支链位置“由心到边”
C—C—C—C—C
C
—
C—C—C—C—C
C
—
C—C—C—C—C
C
—
“甲基不挂倒一”
CH3—CH—CH2—CH2—CH3
CH3
—
CH3—CH2—CH—CH2—CH3
CH3
—
同分异构体 · 书写
【例题1】书写C6H14的同分异构体
③、取2个C做支链
2个C整体做支链:
2个C分别做支链:
C—C—C—C
C
—
C
—
“乙基不挂倒二”
C—C—C—C
C
—
C
—
C
—
C—C—C—C
C
—
CH3—C—CH2—CH3
CH3
—
CH3
—
CH3—CH—CH—CH3
CH3
—
CH3
—
【技巧归纳】
最长主链的碳原子个数为n
最短主链的碳原子个数不能小于n/2
【练习1】写出分子式为C7H16的同分异构体,(只写C链)
C—C—C—C—C—C—C
C—C—C—C—C—C
C
—
C—C—C—C—C—C
C
—
C—C—C—C—C
C
—
C
—
C—C—C—C—C
C
—
C
—
C—C—C—C—C
C
—
C
—
C—C—C—C—C
C
—
C
—
C—C—C—C
C
—
C
—
C
—
C—C—C—C—C
C
—
C
—
同分异构体 · 书写
同分异构体 · 书写
同分异构体 · 书写
【方法二】插入法
针对“烯烃/炔烃”同分异构体的书写
第一步:定骨架
第三步:补齐氢
第二步:定双键
1.定骨架
2.定双键
C—C—C—C—C
C—C—C—C
C
—
1
2
1
2
3
C—C—C
C
—
C
—
1
【例题2】书写戊烯(C5H10)同分异构体
同分异构体 · 书写
同分异构体 · 书写
【方法三】等效氢法
针对“一取代物”同分异构体的书写
等效氢:处于相同化学环境的氢原子
① 、同C上的H等效
②、 同C上连的甲基上的H等效
③ 、对称位置上的H等效
3种H
CH3CH2CH2CH2CH3
4种H
1种H
一元取代物的数目 = H的种类
【例题3】以下3种物质分别有多少种H原子
【练习3】分子式为C4H10O的属于醇的同分异构体有几种?
C4H10O
C4H9OH
C4H10中的一个H被-OH取代
(一取代物同分异构体的数目 = H的种类)
C4H10中的H种类数目
C4H10O属于醇的同分异构体数目为:4种
CH3CH2CH2CH3
CH3—CH—CH3
CH3
—
2种等效氢
2种等效氢
同分异构体 · 书写
【练习4】正误判断
(1)同素异形体、同分异构体之间的转化是物理变化
(2)同系物之间可以互为同分异构体
(3)淀粉与纤维素是化学式为(C6H10O5)n的同分异构体
(4)CH3COOH与HCOOCH3互为同分异构体,属于官能团异构
(5) 与 互为同分异构体,属于立体异构
×
×
×
√
×
同分异构体 · 书写
CH2==CH2
结构简式
最简式(实验式)
CH2
球棍模型
空间填充模型
分子式
C2H4
【知识拓展】键线式
将C、H省略,只表示键的连接情况和官能团,每个拐点或终点均表示一个C原子。
电子式
结构式
【符号表征】.以乙烯为例,总结有机物的各种表示方法
如丙烯可表示为 ,乙醇可表示为 。
补充延伸
【练习5】 的一氯代物有
A.1种 B.2种 C.3种 D.4种
课堂练习
【练习6】分子式为C6H12O且含有“-CHO”的同分异构体共有(不考虑立体异构)
A.6种 B.8种 C.4种 D.10种
B
B
【课堂补充】
有机物不饱和度的计算
(互为同分异构体的物质,不饱和度相等)
1、【概念】:不饱和度又称缺氢指数,通常用Ω表示。
2、【计算方法】
①、已知结构算不饱和度:
链状烷烃(CnH2n+2)为饱和烃, 不饱和度 Ω = 0
双键Ω=1; 三键Ω=2; 环Ω=1; 苯环Ω=4
【例1】计算下列物质的不饱和度
Ω=1
Ω=2
Ω=5
Ω=14
2、【计算方法】
②、已知组成算不饱和度:
(1)烃(CnHm)的不饱和度的计算
(2)含氧衍生物(CnHmOx)的不饱和度的计算
即:O原子不影响不饱和度的计算
(3)含卤素衍生物(CnHmClx)的不饱和度的计算
(4)含氮衍生物(CnHmNx)的不饱和度的计算
即:卤原子相当于H
即:N原子相当于减掉1个H
CH3CH2CH2-OH
CH3 - O - CH3
CH3-C-H
O
Ω=0
Ω=0
Ω=1
【例2】计算下列物质的不饱和度
C2H5NH2
C8H11NO2
Ω=0
Ω=4
Ω=4
C2H5Cl
C3H5Cl
C4H4Br2
Ω=0
Ω=1
Ω=2
【例3】请写出下列物质的分子式(可以用不饱和度帮助检查H原子数)
C7H8O5
C8H7NOCl2
C15H20O4
