3.4.1 配合物 课件 (共20张PPT)
文档属性
| 名称 | 3.4.1 配合物 课件 (共20张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 76.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-18 00:00:00 | ||
图片预览






文档简介
(共20张PPT)
第四节 配合物与超分子
第1课时 配合物
第三章 晶体结构与性质
认识 · 配合物
Mg
叶绿素
血红素
Fe
维生素B12
Co +
认识 · 配合物
实验1
下表中的少量固体溶于足量的水,观察实验现象
Na+、K+、SO42-、Cl-、Br -无色
【对照组】
Cu2+溶于水呈蓝色
认识 · 配合物
(无水) CuSO4
CuSO4 · 5H2O
思考1
为什么:无水CuSO4固体是白色的,但CuSO4·5H2O晶体是蓝色的
Cu2+与水结合
四水合铜离子
Cu(H2O) 4
2+
理解 · 配合物
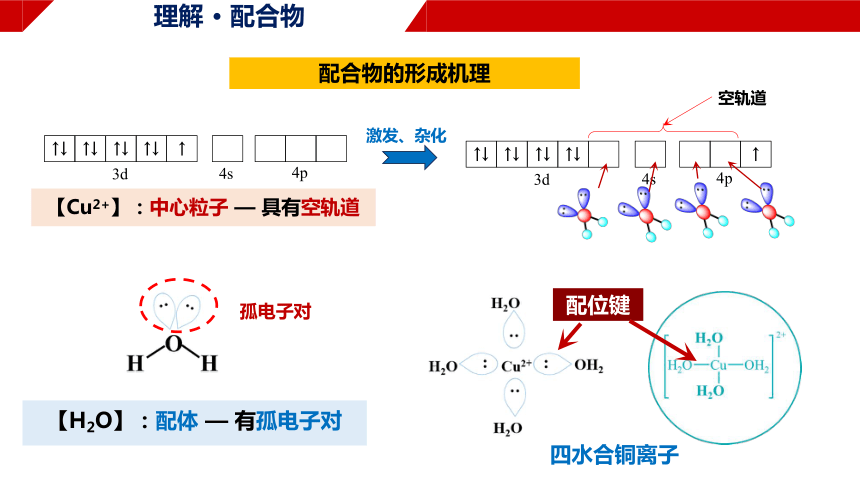
配合物的形成机理
↑↓
↑↓
↑
3d
↑↓
↑↓
4s
4p
↑↓
↑↓
3d
↑↓
↑↓
4s
↑
4p
空轨道
【Cu2+】:中心粒子 — 具有空轨道
激发、杂化
【H2O】:配体 — 有孤电子对
孤电子对
配位键
四水合铜离子
理解 · 配合物
配合物基本概念
含有配位键的化合物称为配位化合物,简称配合物
Cu
OH2
H2O
H2O
H2O
2+
配体
配位键
配离子
中心离子
配位数=4
Cu(H2O) 4
2+
4
【例】:硫酸四水合铜(配合物)
[Cu(H2O)4] SO4
内界(配离子)
外界
离子键
配位键是一种特殊的共价键,具有方向性和饱和性。(配位键与共价键性质完全相同)
理解 · 配合物
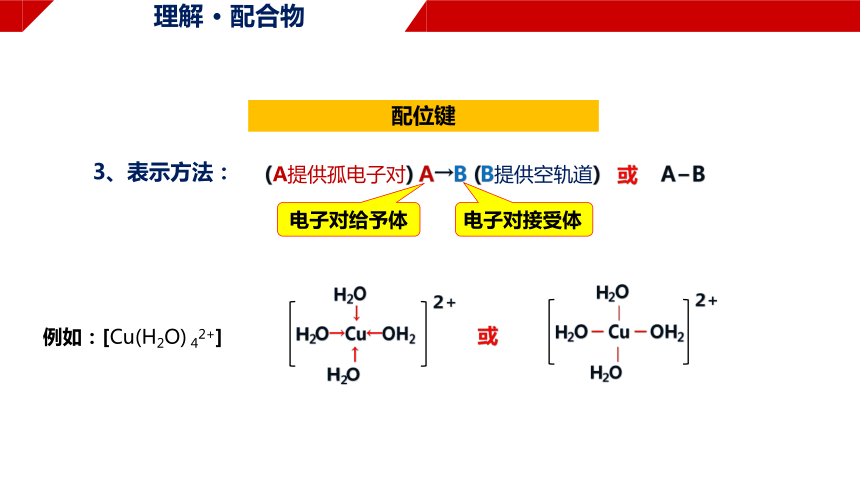
配位键
1、特点:
2、形成条件:
一方能提供孤电子对,另一方具有能接受孤电子对的空轨道
过渡金属的原子或离子
常见含有孤电子对的微粒:
分子:CO、NH3、H2O 离子:Cl-、CN-、NO2-
一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,
如Ag+形成2个配位键;Cu2+形成4个配位键等。
或
(A提供孤电子对) A→B (B提供空轨道) 或 A B
电子对给予体
电子对接受体
H2O
↓
H2O→Cu←OH2
↑
H2O
2+
H2O
∣
H2O ─ Cu ─ OH2
∣
H2O
2+
理解 · 配合物
配位键
例如:[Cu(H2O) 42+]
3、表示方法:
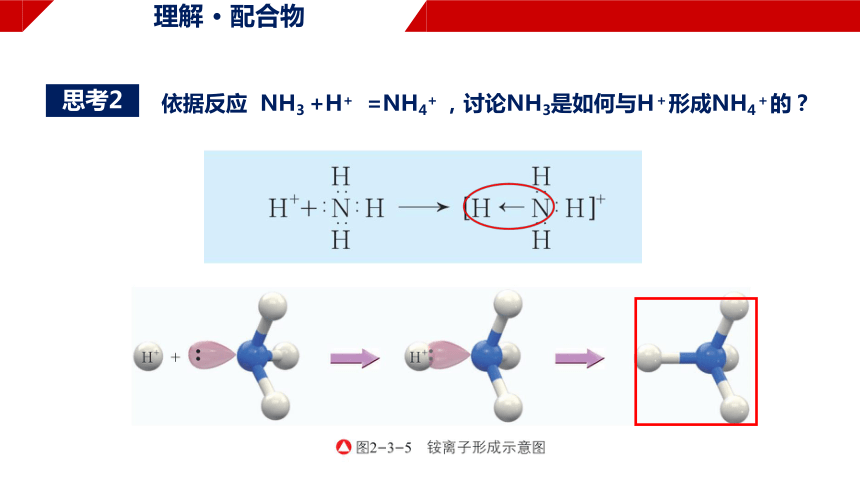
依据反应 NH3 +H+ =NH4+ ,讨论NH3是如何与H+形成NH4+的?
理解 · 配合物
思考2
配合物 配离子 中心离子 配位体 配位原子 配位数
4
6
4
理解 · 配合物
练习1
找出下列配合物中的配离子、中心离子、配体、配位原子、配位数
1、有些配合物没有外界;如 Ni(CO)4 、Fe(CO)5
2、中心粒子可以是阳离子,也可以是中性原子;
3、配位体可以是离子或分子,可以有一种或同时存在多种;
4、配位数通常为2、4、6、8这样的偶数。
【特别提醒】
制备 · 配合物
实验2
制备配合物:硫酸四氨合铜
①、实验步骤:
向盛有4 mL 0.1 mol/L CuSO4溶液的试管里滴加几滴1 mol/L氨水,首先形成难溶物,
继续添加氨水并振荡试管,观察实验现象;
再向试管中加入8 mL 95%乙醇,并用玻璃棒摩擦试管壁,观察实验现象。
制备 · 配合物
实验2
制备配合物:硫酸四氨合铜
加入
氨水
蓝色沉淀
继续加
入氨水
蓝色沉淀溶解
加入
乙醇
深蓝色晶体
Cu(OH)2
[Cu(NH3)4]2+
[Cu(NH3)4]SO4·H2O
Cu2++2NH3·H2O = Cu(OH)2↓+ 2NH4+
①、加入氨水:
Cu(OH)2+4NH3 = [Cu(NH3)4]2++2OH-
②、继续加入氨水:
[Cu(NH3)4]2++ 2SO42- +H2O ==== [Cu(NH3)4]SO4·H2O↓
乙醇
③、加入乙醇:
制备 · 配合物
实验2
制备配合物:硫酸四氨合铜
制备 · 配合物
实验2
制备配合物:硫酸四氨合铜
Cu
NH3
NH3
H3N
NH3
2+
2-
SO4
硫酸四氨合铜
中心离子:Cu2+
配位数:4
NH3的N给出孤电子对
Cu2+接受电子对
N
H
H
H
配体
思考2
Cu2+与NH3形成的配位键更强,还是与H2O形成的配位键强?
H2O、NH3同为中性分子,但电负性N<O,N比O更容易给出孤对电子,
因此,Cu2+与NH3形成的配位键更强
制备 · 配合物
实验3
制备:硫氰化铁配离子
向盛有少量0.1 mol/L FeCl3溶液(或任何含Fe3+的溶液)的试管中
滴加1滴0.1 mol/L硫氰化钾(KSCN)溶液,观察实验现象。
SCN-作为配体与Fe3+配位
显红色,用于检验Fe3+
Fe3+ + n SCN- [Fe(SCN)n]3-n
n = 1∽6,随SCN-的浓度而异
制备 · 配合物
实验4
制备:二氨合银离子
①、实验步骤:
向盛有少量 0.1 mol/L NaCl 溶液的试管里滴几滴0.1 mol/L AgNO3溶液,
产生难溶于水的白色的AgCl沉淀,再滴入1 mol/L氨水,振荡,观察实验现象。
制备 · 配合物
实验4
制备:二氨合银离子
Ag++Cl- = AgCl↓
AgCl+2NH3 = [Ag(NH3)2]++Cl-
①、对溶解性的影响
一些难溶于水的金属氢氧化物、氯化物、溴化物、碘化物、氰化物,可以溶解于氨水中,
或依次溶解于含过量的OH-、Cl-、Br-、I-、CN-的溶液中,形成可溶性的配合物。
【例如】:Cu(OH)2+4NH3 = [Cu(NH3)4]2++2OH-
蓝色沉淀溶解
加入氨水
制备 · 配合物
配合物的形成对性质的影响
②、对颜色的影响
当简单离子形成配离子时,其性质往往有很大差异。
颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。
制备 · 配合物
配合物的形成对性质的影响
【例如】:Fe3+与SCN-形成硫氰化铁配离子,其溶液显红色
FeCl3溶液
加入KSCN溶液
③、增强稳定性
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。
当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。
制备 · 配合物
配合物的形成对性质的影响
【例如】:血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,
因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,
血红素失去输送氧气的功能,从而导致人体CO中毒。
第四节 配合物与超分子
第1课时 配合物
第三章 晶体结构与性质
认识 · 配合物
Mg
叶绿素
血红素
Fe
维生素B12
Co +
认识 · 配合物
实验1
下表中的少量固体溶于足量的水,观察实验现象
Na+、K+、SO42-、Cl-、Br -无色
【对照组】
Cu2+溶于水呈蓝色
认识 · 配合物
(无水) CuSO4
CuSO4 · 5H2O
思考1
为什么:无水CuSO4固体是白色的,但CuSO4·5H2O晶体是蓝色的
Cu2+与水结合
四水合铜离子
Cu(H2O) 4
2+
理解 · 配合物
配合物的形成机理
↑↓
↑↓
↑
3d
↑↓
↑↓
4s
4p
↑↓
↑↓
3d
↑↓
↑↓
4s
↑
4p
空轨道
【Cu2+】:中心粒子 — 具有空轨道
激发、杂化
【H2O】:配体 — 有孤电子对
孤电子对
配位键
四水合铜离子
理解 · 配合物
配合物基本概念
含有配位键的化合物称为配位化合物,简称配合物
Cu
OH2
H2O
H2O
H2O
2+
配体
配位键
配离子
中心离子
配位数=4
Cu(H2O) 4
2+
4
【例】:硫酸四水合铜(配合物)
[Cu(H2O)4] SO4
内界(配离子)
外界
离子键
配位键是一种特殊的共价键,具有方向性和饱和性。(配位键与共价键性质完全相同)
理解 · 配合物
配位键
1、特点:
2、形成条件:
一方能提供孤电子对,另一方具有能接受孤电子对的空轨道
过渡金属的原子或离子
常见含有孤电子对的微粒:
分子:CO、NH3、H2O 离子:Cl-、CN-、NO2-
一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,
如Ag+形成2个配位键;Cu2+形成4个配位键等。
或
(A提供孤电子对) A→B (B提供空轨道) 或 A B
电子对给予体
电子对接受体
H2O
↓
H2O→Cu←OH2
↑
H2O
2+
H2O
∣
H2O ─ Cu ─ OH2
∣
H2O
2+
理解 · 配合物
配位键
例如:[Cu(H2O) 42+]
3、表示方法:
依据反应 NH3 +H+ =NH4+ ,讨论NH3是如何与H+形成NH4+的?
理解 · 配合物
思考2
配合物 配离子 中心离子 配位体 配位原子 配位数
4
6
4
理解 · 配合物
练习1
找出下列配合物中的配离子、中心离子、配体、配位原子、配位数
1、有些配合物没有外界;如 Ni(CO)4 、Fe(CO)5
2、中心粒子可以是阳离子,也可以是中性原子;
3、配位体可以是离子或分子,可以有一种或同时存在多种;
4、配位数通常为2、4、6、8这样的偶数。
【特别提醒】
制备 · 配合物
实验2
制备配合物:硫酸四氨合铜
①、实验步骤:
向盛有4 mL 0.1 mol/L CuSO4溶液的试管里滴加几滴1 mol/L氨水,首先形成难溶物,
继续添加氨水并振荡试管,观察实验现象;
再向试管中加入8 mL 95%乙醇,并用玻璃棒摩擦试管壁,观察实验现象。
制备 · 配合物
实验2
制备配合物:硫酸四氨合铜
加入
氨水
蓝色沉淀
继续加
入氨水
蓝色沉淀溶解
加入
乙醇
深蓝色晶体
Cu(OH)2
[Cu(NH3)4]2+
[Cu(NH3)4]SO4·H2O
Cu2++2NH3·H2O = Cu(OH)2↓+ 2NH4+
①、加入氨水:
Cu(OH)2+4NH3 = [Cu(NH3)4]2++2OH-
②、继续加入氨水:
[Cu(NH3)4]2++ 2SO42- +H2O ==== [Cu(NH3)4]SO4·H2O↓
乙醇
③、加入乙醇:
制备 · 配合物
实验2
制备配合物:硫酸四氨合铜
制备 · 配合物
实验2
制备配合物:硫酸四氨合铜
Cu
NH3
NH3
H3N
NH3
2+
2-
SO4
硫酸四氨合铜
中心离子:Cu2+
配位数:4
NH3的N给出孤电子对
Cu2+接受电子对
N
H
H
H
配体
思考2
Cu2+与NH3形成的配位键更强,还是与H2O形成的配位键强?
H2O、NH3同为中性分子,但电负性N<O,N比O更容易给出孤对电子,
因此,Cu2+与NH3形成的配位键更强
制备 · 配合物
实验3
制备:硫氰化铁配离子
向盛有少量0.1 mol/L FeCl3溶液(或任何含Fe3+的溶液)的试管中
滴加1滴0.1 mol/L硫氰化钾(KSCN)溶液,观察实验现象。
SCN-作为配体与Fe3+配位
显红色,用于检验Fe3+
Fe3+ + n SCN- [Fe(SCN)n]3-n
n = 1∽6,随SCN-的浓度而异
制备 · 配合物
实验4
制备:二氨合银离子
①、实验步骤:
向盛有少量 0.1 mol/L NaCl 溶液的试管里滴几滴0.1 mol/L AgNO3溶液,
产生难溶于水的白色的AgCl沉淀,再滴入1 mol/L氨水,振荡,观察实验现象。
制备 · 配合物
实验4
制备:二氨合银离子
Ag++Cl- = AgCl↓
AgCl+2NH3 = [Ag(NH3)2]++Cl-
①、对溶解性的影响
一些难溶于水的金属氢氧化物、氯化物、溴化物、碘化物、氰化物,可以溶解于氨水中,
或依次溶解于含过量的OH-、Cl-、Br-、I-、CN-的溶液中,形成可溶性的配合物。
【例如】:Cu(OH)2+4NH3 = [Cu(NH3)4]2++2OH-
蓝色沉淀溶解
加入氨水
制备 · 配合物
配合物的形成对性质的影响
②、对颜色的影响
当简单离子形成配离子时,其性质往往有很大差异。
颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。
制备 · 配合物
配合物的形成对性质的影响
【例如】:Fe3+与SCN-形成硫氰化铁配离子,其溶液显红色
FeCl3溶液
加入KSCN溶液
③、增强稳定性
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。
当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。
制备 · 配合物
配合物的形成对性质的影响
【例如】:血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,
因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,
血红素失去输送氧气的功能,从而导致人体CO中毒。
