中考化学二轮复习专题七化学计算课件
图片预览










文档简介
(共46张PPT)
专题七 化学计算
化学计算是枣庄市中考每年必考的内容,考查考生分析、推理、归纳等逻辑思维能力和解决实际问题的能力。从题型上讲,化学计算常出现在选择题、填空题、计算题里;从内容上讲,计算题类型包括化学式计算、溶液组成及溶液中溶质质量分数计算、利用化学方程式计算等;从命题规律上讲,近几年的中考题不再是单纯的考查计算,而是把计算题和生活中的实际情景结合起来,以实验探究为载体,数据也不是直接给出,而是通过函数图像、表格的形式间接给出,这样来考查学生的各种能力。
1.(2024·聊城中考)兴趣小组在跨学科实践活动中,了解到尿液通常显黄色的主要原因是含有尿胆素[C33H42N4O6]。下列说法不正确的是( )
A.尿胆素分子由碳、氢、氮、氧四种原子构成
B.尿胆素中氮元素的质量分数最小
C.尿胆素中氢元素与氮元素的质量比为3∶4
D.尿胆素的化学式量为590
根据化学式的计算
√
B [尿胆素分子中含有C、H、N、O四种原子,A正确;尿胆素中C、H、N、O的质量比为12×33∶1×42∶14×4∶16×6,故氢元素的质量分数最小,B错误;氢元素与氮元素的质量比为1×42∶14×4=3∶4,C正确;尿胆素的化学式量为12×33+1×42+14×4+16×6=590,D正确。]
2.(2024·常州中考)《本草纲目》记载食肉桂能“面生光华”。肉桂酸(C9H8O2)是肉桂的主要有效成分,下列说法正确的是( )
A.肉桂酸由碳、氢、氧三种原子构成
B.肉桂酸中碳与氢元素质量比为9∶8
C.肉桂酸中氧元素的质量分数为21.6%
D.一个肉桂酸分子中含有一个氧分子
√
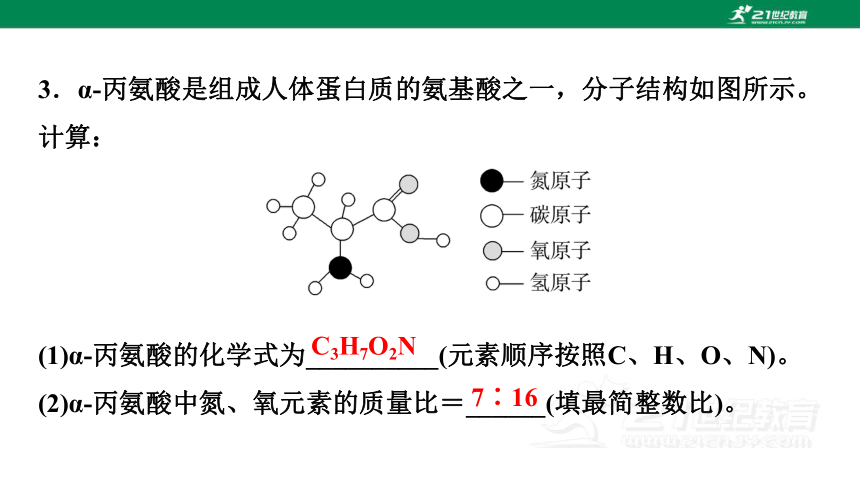
3.α-丙氨酸是组成人体蛋白质的氨基酸之一,分子结构如图所示。计算:
(1)α-丙氨酸的化学式为__________(元素顺序按照C、H、O、N)。
(2)α-丙氨酸中氮、氧元素的质量比=______(填最简整数比)。
C3H7O2N
7∶16
解析:(1)由图可知,每个α-丙氨酸分子由3个碳原子、7个氢原子、2个氧原子、1个氮原子构成,故化学式为C3H7O2N。
(2)α-丙氨酸中氮、氧元素的质量比=(14×1)∶(16×2)=7∶16。
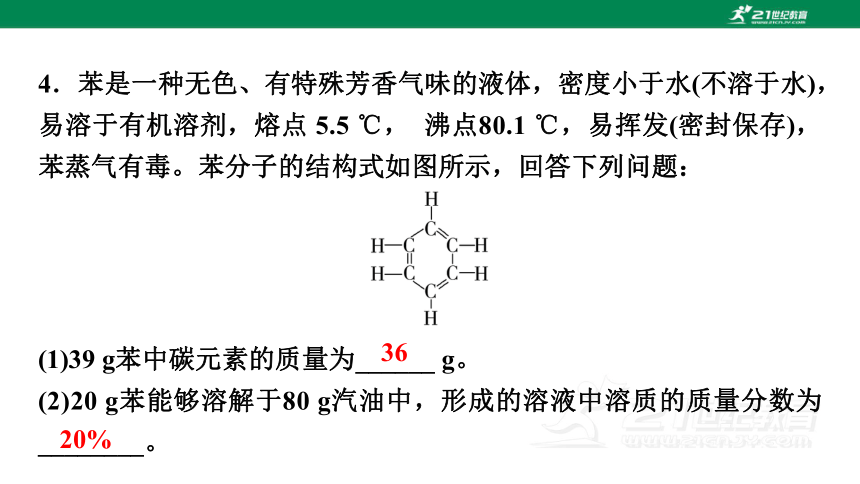
4.苯是一种无色、有特殊芳香气味的液体,密度小于水(不溶于水),易溶于有机溶剂,熔点 5.5 ℃, 沸点80.1 ℃,易挥发(密封保存),苯蒸气有毒。苯分子的结构式如图所示,回答下列问题:
(1)39 g苯中碳元素的质量为______ g。
(2)20 g苯能够溶解于80 g汽油中,形成的溶液中溶质的质量分数为________。
36
20%
5.甲醇是一种无色、有特殊香味、易挥发的液体。已知甲醇由碳、氢、氧三种元素组成,其中氢元素的质量分数为12.5%,氧元素的质量分数为50%;一个甲醇分子中含有1个氧原子。回答下列问题:
(1)甲醇的相对分子质量是________。
(2)一个甲醇分子中含氢原子的个数是_____。
32
4
【专题攻略】
1.解题依据
此类试题解题时要抓住两个关键量,即相对原子质量和各原子个数,计算公式如下所示。
2.解题技巧
(1)计算各元素原子个数比,计算时注意化学式元素符号右下角没有数字的即为“1”;相同元素符号的数字要合算。
(2)计算各元素质量比,一定要写清楚各元素质量比顺序或按题目要求的顺序来算,因为顺序不一,比值也不同;计算的结果最好化成整数比。
6.某葡萄糖(C6H12O6)注射液的标签如图所示,
请计算:
关于溶液的计算
(1)要把10 g这种葡萄糖注射液稀释为溶质质量分数为2.5%的溶液,稀释所加水的质量为________ g。
(2)现有10 g这种葡萄糖注射液,若使这10 g注射液的溶质质量分数增加一倍,应蒸发掉水的质量为_____ g。
10
5
7.我国科学家首次突破以二氧化碳为原料获得淀粉的人工合成工艺技术。其中关键一步反应的微观示意图如图,回答下列问题。
(1)64 g丙中含有碳元素的质量为_____ g。
(2)现将溶质质量分数为20%的丙溶液50 g,加水稀释成溶质质量分数为5%的溶液,需要加入水的质量为______ g。
24
150
8.(2024·成都中考)几种作物的无土栽培营养液部分溶质的质量分数如表,配制溶液的仪器如图。
几种作物营养液溶质的质量分数(%)
番茄 甜瓜 茄子
硝酸钾(KNO3) 4.04 6.07 7.08
磷酸二氢铵(NH4H2PO4) 0.77 1.53 1.15
(1)表中对磷元素需求最多的作物是________。
(2)硝酸钾和磷酸二氢铵均属于______肥。
(3)配制质量分数为7.08%的硝酸钾溶液200 g,需要硝酸钾_____ g
(精确到0.1 g)。
(4)将质量分数为7.08%的硝酸钾溶液稀释为 4.04%, 需选择图中的烧杯和__________(填序号)。
甜瓜
复合
14.2
③④⑤
解析:(1)由表中数据知,对磷元素需求最多的作物是甜瓜。(2)硝酸钾含氮、磷、钾三种营养元素中的氮元素和钾元素,磷酸二氢铵含氮、磷、钾三种营养元素中的氮元素和磷元素,均属于复合肥。(3)配制质量分数为7.08%的硝酸钾溶液200 g,需要硝酸钾200 g×
7.08%≈14.2 g。(4)将质量分数为 7.08% 的硝酸钾溶液稀释为4.04%,需选择图中的烧杯、胶头滴管、玻璃棒和量筒。
2.解题技巧
在解答关于溶液稀释、浓缩、配制或者结合化学方程式的计算题时可以采用“虚拟容器法”,即假设有一个烧杯,所有操作都在烧杯中进行,通过分析烧杯中物质质量的变化,结合上述公式进行计算。
9.小华同学在参加学校组织的研究性学习活动时,进行了一次有趣的实验探究:取氯化镁和氯化钾固体的混合物50 g,向其中加入一定量的蒸馏水,使其完全溶解。将100 g一定溶质质量分数的氢氧化钠溶液平均分成5等份,依次加入上述溶液中,生成沉淀的质量与NaOH溶液的质量关系如下表格:
根据化学方程式的计算
请回答下列问题:
(1)表中m的值是________。
(2)该固体混合物中氯化镁的质量分数为多少(写出计算过程)
实验次数 第一次 第二次 第三次 第四次 第五次
氢氧化钠溶液的质量/g 20 20 20 20 20
产生沉淀的质量/g 1.45 m 4.35 5.8 5.8
2.9
解析:(1)氯化镁和氢氧化钠反应生成氢氧化镁沉淀和氯化钠,第一次加入20 g氢氧化钠溶液,生成1.45 g氢氧化镁沉淀;第三次加入20 g氢氧化钠溶液,共产生4.35 g沉淀,生成的沉淀是第一次的3倍,说明每20 g氢氧化钠溶液完全反应,能生成1.45 g氢氧化镁沉淀。则第二次加入 20 g 氢氧化钠溶液,共产生氢氧化镁沉淀的质量为 1.45 g×2=2.9 g, 则m=2.9 g。
(2)详见答案。
10.现有碳酸钠和氯化钠的固体混合物10.9 g,加入93.5 g水,固体完全溶解,向该溶液中加入稀盐酸,所得溶液质量与加入稀盐酸质量的关系如图所示。请计算:
(1)恰好完全反应时,生成二氧化碳的质量是______g。
(2)恰好完全反应时,所得溶液中溶质的质量分数是多少(写出计算过程)
4.4
解析:(1)从图像可知,加入稀盐酸质量为100 g时恰好完全反应,此时溶液的质量为200 g。根据反应前后物质的总质量不变,则溶液减少的质量为碳酸钠和盐酸反应生成二氧化碳的质量,则二氧化碳的质量为100 g+10.9 g+93.5 g-200 g=4.4 g。
(2)详见答案。
11.高速钢是制造冰鞋冰刀的重要材料,其性能与含碳量关系密切。为测试冰刀中碳元素的质量分数,现取一定质量的冰刀于烧杯中,分3次每次加入100 g溶质质量分数相同的稀硫酸,实验过程和数据如图所示。请根据相关信息
回答下列问题。
(1)推算图中m的数值为________。
(2)计算冰刀中碳元素的质量分数(不考虑杂质,写出计算过程,结果精确到0.01%)。
319.4
解析:(1)第一次加入100 g稀硫酸时,质量减少了120 g+100 g-219.6 g=0.4 g,后再加入两次,共200 g稀硫酸时,质量减少了219.6 g+200 g-419.4 g=0.2 g,则说明第2次加入100 g稀硫酸时,稀硫酸没有完全反应,第3次加入的稀硫酸根本没有反应,则m的数值为419.4 g-100 g=319.4 g。
(2)详见答案。
12.(2024·广元中考)小明为了测定某硫酸中溶质的质量分数,如图甲,向60 g硫酸中缓缓注入质量分数为10%的氢氧化钠溶液,测得溶液的pH与氢氧化钠溶液的质量对应关系如图乙。请回答下列问题:
(1)配制质量分数为10%的氢氧化钠溶液,若量筒量取水时俯视读数,会导致所配氢氧化钠溶液的溶质质量分数________(填“偏大”“偏小”或“不变”)。
(2)图乙中a点溶液含有的溶质是____________________________。
(3)请计算硫酸中溶质的质量分数(写出计算过程,结果精确到0.1%)。
偏大
氢氧化钠、硫酸钠
解析:(1)用量筒量取水时,俯视读数,读数比实际液体体积大,会造成实际量取的水的体积偏小,使溶质质量分数偏大。(2)氢氧化钠和硫酸反应生成硫酸钠和水,a点溶液的pH大于7,显碱性,溶液含有的溶质是氢氧化钠、硫酸钠。(3)根据恰好完全反应时消耗的氢氧化钠溶液的质量、溶质质量分数,结合反应的化学方程式列式计算出参加反应的H2SO4的质量,进而计算出硫酸中溶质的质量分数。
13.(2024·包头中考)某实验室测定刚购进的大理石中碳酸钙的质量分数。取12 g大理石样品于烧杯中,加入一定质量的溶质质量分数为10%稀盐酸至恰好完全反应,反应后将烧杯中的物质过滤、洗涤、干燥,得到不溶物2 g(杂质不溶于水也不与酸反应)。
计算:
(1)该大理石中碳酸钙的质量分数(写出计算过程,结果精确到0.1%,下同)。
(2)所用稀盐酸的质量。
(3)恰好完全反应时所得溶液的质量。
解析:(1)根据杂质的质量为2 g,求出碳酸钙的质量,进而求出碳酸钙的质量分数。(2)根据碳酸钙的质量和化学方程式求出盐酸的质量即可。(3)根据化学反应前后物质的总质量不变来解答。
(3)根据化学反应前后物质的总质量不变可知,反应后溶液的总质量为12 g+73 g-2 g-4.4 g=78.6 g。
答:恰好完全反应时所得溶液的质量为78.6 g。
【答题模板】 “根据化学方程式的计算”时,可从以下几个方面入手:
1.一般步骤:设(未知量)、写(化学方程式)、找(已知物质和未知物质并计算相对分子质量与化学计量数的积)、列(比例式)、求(计算出结果,整数或小数呈现)、答。
2.解题技巧
(1)含杂质的计算:有些题目中的试剂含杂质(杂质一般不参加反应),在解题时要先将不纯物质的质量转化为纯净物质的质量带入化学方程式进行计算,计算公式为纯净物的质量=混合物的质量×纯度(或质量分数)。
(2)解答表格数据型计算题时,应根据化学反应,对比表格中的相邻数据,找出数据的变化规律,以及某一物质完全反应或两种物质恰好完全反应时所消耗的质量,由此进行其他计算。
(3)解答坐标图像类计算题时,应该抓住“化学反应”这一“质”的变化,厘清量的关系,读出并正确理解图像中一些特殊的“点”。一般曲线上的拐点对应着一个反应的结束,可从拐点的坐标中找到计算所需的数据。
(4)反应后溶液的计算方法:①辨别最终的溶质是哪一种物质;②溶质的来源(生成、原来代入);③反应后溶液质量=所有加入物质质量-生成气体质量-生成沉淀质量-原来不溶性(不反应)杂质质量。
专题七 化学计算
化学计算是枣庄市中考每年必考的内容,考查考生分析、推理、归纳等逻辑思维能力和解决实际问题的能力。从题型上讲,化学计算常出现在选择题、填空题、计算题里;从内容上讲,计算题类型包括化学式计算、溶液组成及溶液中溶质质量分数计算、利用化学方程式计算等;从命题规律上讲,近几年的中考题不再是单纯的考查计算,而是把计算题和生活中的实际情景结合起来,以实验探究为载体,数据也不是直接给出,而是通过函数图像、表格的形式间接给出,这样来考查学生的各种能力。
1.(2024·聊城中考)兴趣小组在跨学科实践活动中,了解到尿液通常显黄色的主要原因是含有尿胆素[C33H42N4O6]。下列说法不正确的是( )
A.尿胆素分子由碳、氢、氮、氧四种原子构成
B.尿胆素中氮元素的质量分数最小
C.尿胆素中氢元素与氮元素的质量比为3∶4
D.尿胆素的化学式量为590
根据化学式的计算
√
B [尿胆素分子中含有C、H、N、O四种原子,A正确;尿胆素中C、H、N、O的质量比为12×33∶1×42∶14×4∶16×6,故氢元素的质量分数最小,B错误;氢元素与氮元素的质量比为1×42∶14×4=3∶4,C正确;尿胆素的化学式量为12×33+1×42+14×4+16×6=590,D正确。]
2.(2024·常州中考)《本草纲目》记载食肉桂能“面生光华”。肉桂酸(C9H8O2)是肉桂的主要有效成分,下列说法正确的是( )
A.肉桂酸由碳、氢、氧三种原子构成
B.肉桂酸中碳与氢元素质量比为9∶8
C.肉桂酸中氧元素的质量分数为21.6%
D.一个肉桂酸分子中含有一个氧分子
√
3.α-丙氨酸是组成人体蛋白质的氨基酸之一,分子结构如图所示。计算:
(1)α-丙氨酸的化学式为__________(元素顺序按照C、H、O、N)。
(2)α-丙氨酸中氮、氧元素的质量比=______(填最简整数比)。
C3H7O2N
7∶16
解析:(1)由图可知,每个α-丙氨酸分子由3个碳原子、7个氢原子、2个氧原子、1个氮原子构成,故化学式为C3H7O2N。
(2)α-丙氨酸中氮、氧元素的质量比=(14×1)∶(16×2)=7∶16。
4.苯是一种无色、有特殊芳香气味的液体,密度小于水(不溶于水),易溶于有机溶剂,熔点 5.5 ℃, 沸点80.1 ℃,易挥发(密封保存),苯蒸气有毒。苯分子的结构式如图所示,回答下列问题:
(1)39 g苯中碳元素的质量为______ g。
(2)20 g苯能够溶解于80 g汽油中,形成的溶液中溶质的质量分数为________。
36
20%
5.甲醇是一种无色、有特殊香味、易挥发的液体。已知甲醇由碳、氢、氧三种元素组成,其中氢元素的质量分数为12.5%,氧元素的质量分数为50%;一个甲醇分子中含有1个氧原子。回答下列问题:
(1)甲醇的相对分子质量是________。
(2)一个甲醇分子中含氢原子的个数是_____。
32
4
【专题攻略】
1.解题依据
此类试题解题时要抓住两个关键量,即相对原子质量和各原子个数,计算公式如下所示。
2.解题技巧
(1)计算各元素原子个数比,计算时注意化学式元素符号右下角没有数字的即为“1”;相同元素符号的数字要合算。
(2)计算各元素质量比,一定要写清楚各元素质量比顺序或按题目要求的顺序来算,因为顺序不一,比值也不同;计算的结果最好化成整数比。
6.某葡萄糖(C6H12O6)注射液的标签如图所示,
请计算:
关于溶液的计算
(1)要把10 g这种葡萄糖注射液稀释为溶质质量分数为2.5%的溶液,稀释所加水的质量为________ g。
(2)现有10 g这种葡萄糖注射液,若使这10 g注射液的溶质质量分数增加一倍,应蒸发掉水的质量为_____ g。
10
5
7.我国科学家首次突破以二氧化碳为原料获得淀粉的人工合成工艺技术。其中关键一步反应的微观示意图如图,回答下列问题。
(1)64 g丙中含有碳元素的质量为_____ g。
(2)现将溶质质量分数为20%的丙溶液50 g,加水稀释成溶质质量分数为5%的溶液,需要加入水的质量为______ g。
24
150
8.(2024·成都中考)几种作物的无土栽培营养液部分溶质的质量分数如表,配制溶液的仪器如图。
几种作物营养液溶质的质量分数(%)
番茄 甜瓜 茄子
硝酸钾(KNO3) 4.04 6.07 7.08
磷酸二氢铵(NH4H2PO4) 0.77 1.53 1.15
(1)表中对磷元素需求最多的作物是________。
(2)硝酸钾和磷酸二氢铵均属于______肥。
(3)配制质量分数为7.08%的硝酸钾溶液200 g,需要硝酸钾_____ g
(精确到0.1 g)。
(4)将质量分数为7.08%的硝酸钾溶液稀释为 4.04%, 需选择图中的烧杯和__________(填序号)。
甜瓜
复合
14.2
③④⑤
解析:(1)由表中数据知,对磷元素需求最多的作物是甜瓜。(2)硝酸钾含氮、磷、钾三种营养元素中的氮元素和钾元素,磷酸二氢铵含氮、磷、钾三种营养元素中的氮元素和磷元素,均属于复合肥。(3)配制质量分数为7.08%的硝酸钾溶液200 g,需要硝酸钾200 g×
7.08%≈14.2 g。(4)将质量分数为 7.08% 的硝酸钾溶液稀释为4.04%,需选择图中的烧杯、胶头滴管、玻璃棒和量筒。
2.解题技巧
在解答关于溶液稀释、浓缩、配制或者结合化学方程式的计算题时可以采用“虚拟容器法”,即假设有一个烧杯,所有操作都在烧杯中进行,通过分析烧杯中物质质量的变化,结合上述公式进行计算。
9.小华同学在参加学校组织的研究性学习活动时,进行了一次有趣的实验探究:取氯化镁和氯化钾固体的混合物50 g,向其中加入一定量的蒸馏水,使其完全溶解。将100 g一定溶质质量分数的氢氧化钠溶液平均分成5等份,依次加入上述溶液中,生成沉淀的质量与NaOH溶液的质量关系如下表格:
根据化学方程式的计算
请回答下列问题:
(1)表中m的值是________。
(2)该固体混合物中氯化镁的质量分数为多少(写出计算过程)
实验次数 第一次 第二次 第三次 第四次 第五次
氢氧化钠溶液的质量/g 20 20 20 20 20
产生沉淀的质量/g 1.45 m 4.35 5.8 5.8
2.9
解析:(1)氯化镁和氢氧化钠反应生成氢氧化镁沉淀和氯化钠,第一次加入20 g氢氧化钠溶液,生成1.45 g氢氧化镁沉淀;第三次加入20 g氢氧化钠溶液,共产生4.35 g沉淀,生成的沉淀是第一次的3倍,说明每20 g氢氧化钠溶液完全反应,能生成1.45 g氢氧化镁沉淀。则第二次加入 20 g 氢氧化钠溶液,共产生氢氧化镁沉淀的质量为 1.45 g×2=2.9 g, 则m=2.9 g。
(2)详见答案。
10.现有碳酸钠和氯化钠的固体混合物10.9 g,加入93.5 g水,固体完全溶解,向该溶液中加入稀盐酸,所得溶液质量与加入稀盐酸质量的关系如图所示。请计算:
(1)恰好完全反应时,生成二氧化碳的质量是______g。
(2)恰好完全反应时,所得溶液中溶质的质量分数是多少(写出计算过程)
4.4
解析:(1)从图像可知,加入稀盐酸质量为100 g时恰好完全反应,此时溶液的质量为200 g。根据反应前后物质的总质量不变,则溶液减少的质量为碳酸钠和盐酸反应生成二氧化碳的质量,则二氧化碳的质量为100 g+10.9 g+93.5 g-200 g=4.4 g。
(2)详见答案。
11.高速钢是制造冰鞋冰刀的重要材料,其性能与含碳量关系密切。为测试冰刀中碳元素的质量分数,现取一定质量的冰刀于烧杯中,分3次每次加入100 g溶质质量分数相同的稀硫酸,实验过程和数据如图所示。请根据相关信息
回答下列问题。
(1)推算图中m的数值为________。
(2)计算冰刀中碳元素的质量分数(不考虑杂质,写出计算过程,结果精确到0.01%)。
319.4
解析:(1)第一次加入100 g稀硫酸时,质量减少了120 g+100 g-219.6 g=0.4 g,后再加入两次,共200 g稀硫酸时,质量减少了219.6 g+200 g-419.4 g=0.2 g,则说明第2次加入100 g稀硫酸时,稀硫酸没有完全反应,第3次加入的稀硫酸根本没有反应,则m的数值为419.4 g-100 g=319.4 g。
(2)详见答案。
12.(2024·广元中考)小明为了测定某硫酸中溶质的质量分数,如图甲,向60 g硫酸中缓缓注入质量分数为10%的氢氧化钠溶液,测得溶液的pH与氢氧化钠溶液的质量对应关系如图乙。请回答下列问题:
(1)配制质量分数为10%的氢氧化钠溶液,若量筒量取水时俯视读数,会导致所配氢氧化钠溶液的溶质质量分数________(填“偏大”“偏小”或“不变”)。
(2)图乙中a点溶液含有的溶质是____________________________。
(3)请计算硫酸中溶质的质量分数(写出计算过程,结果精确到0.1%)。
偏大
氢氧化钠、硫酸钠
解析:(1)用量筒量取水时,俯视读数,读数比实际液体体积大,会造成实际量取的水的体积偏小,使溶质质量分数偏大。(2)氢氧化钠和硫酸反应生成硫酸钠和水,a点溶液的pH大于7,显碱性,溶液含有的溶质是氢氧化钠、硫酸钠。(3)根据恰好完全反应时消耗的氢氧化钠溶液的质量、溶质质量分数,结合反应的化学方程式列式计算出参加反应的H2SO4的质量,进而计算出硫酸中溶质的质量分数。
13.(2024·包头中考)某实验室测定刚购进的大理石中碳酸钙的质量分数。取12 g大理石样品于烧杯中,加入一定质量的溶质质量分数为10%稀盐酸至恰好完全反应,反应后将烧杯中的物质过滤、洗涤、干燥,得到不溶物2 g(杂质不溶于水也不与酸反应)。
计算:
(1)该大理石中碳酸钙的质量分数(写出计算过程,结果精确到0.1%,下同)。
(2)所用稀盐酸的质量。
(3)恰好完全反应时所得溶液的质量。
解析:(1)根据杂质的质量为2 g,求出碳酸钙的质量,进而求出碳酸钙的质量分数。(2)根据碳酸钙的质量和化学方程式求出盐酸的质量即可。(3)根据化学反应前后物质的总质量不变来解答。
(3)根据化学反应前后物质的总质量不变可知,反应后溶液的总质量为12 g+73 g-2 g-4.4 g=78.6 g。
答:恰好完全反应时所得溶液的质量为78.6 g。
【答题模板】 “根据化学方程式的计算”时,可从以下几个方面入手:
1.一般步骤:设(未知量)、写(化学方程式)、找(已知物质和未知物质并计算相对分子质量与化学计量数的积)、列(比例式)、求(计算出结果,整数或小数呈现)、答。
2.解题技巧
(1)含杂质的计算:有些题目中的试剂含杂质(杂质一般不参加反应),在解题时要先将不纯物质的质量转化为纯净物质的质量带入化学方程式进行计算,计算公式为纯净物的质量=混合物的质量×纯度(或质量分数)。
(2)解答表格数据型计算题时,应根据化学反应,对比表格中的相邻数据,找出数据的变化规律,以及某一物质完全反应或两种物质恰好完全反应时所消耗的质量,由此进行其他计算。
(3)解答坐标图像类计算题时,应该抓住“化学反应”这一“质”的变化,厘清量的关系,读出并正确理解图像中一些特殊的“点”。一般曲线上的拐点对应着一个反应的结束,可从拐点的坐标中找到计算所需的数据。
(4)反应后溶液的计算方法:①辨别最终的溶质是哪一种物质;②溶质的来源(生成、原来代入);③反应后溶液质量=所有加入物质质量-生成气体质量-生成沉淀质量-原来不溶性(不反应)杂质质量。
同课章节目录
