中考化学二轮复习专题三坐标曲线课件
图片预览






文档简介
(共29张PPT)
专题三 坐标曲线
坐标曲线题是枣庄中考的常考内容,近 8 年考过 8 次。 从题型上来说,图像题常出现在选择题、填空题、计算题里;从内容上来说,主要涉及质量变化曲线、物质溶解曲线、溶液 pH 变化曲线、反应速率曲线等;从命题规律上来说主要分单独曲线型和综合曲线型两种考查方式。 此类题除以文字方式给出部分信息外,还借助数学方法中的坐标图,把多个因素对各种量变化的影响用坐标图的形式直观地表示出来,考查学生看图、识图、分析图及数据处理等综合分析能力,综合性较强,难度较大。
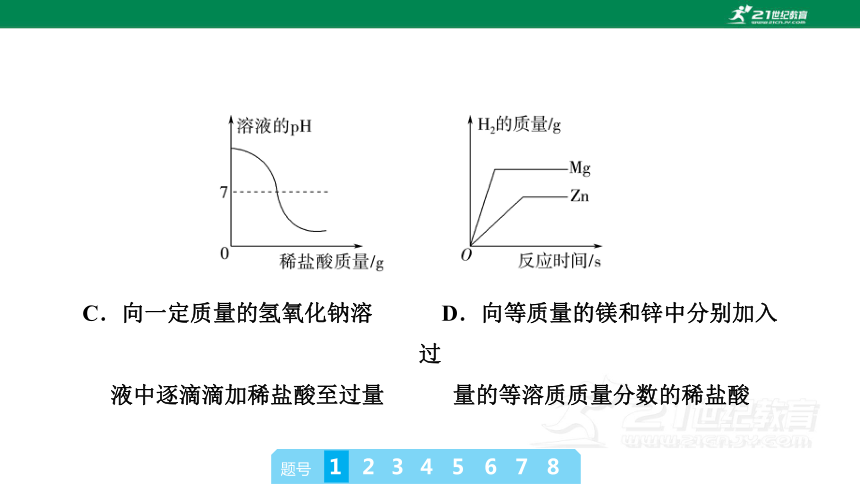
1.(2024·聊城中考)下列图像不能正确反映其对应变化关系的是
( )
题号
1
3
5
2
4
6
8
7
分层评价 即时反馈
A.高温煅烧一定 B.向表面生锈的铁钉中
质量的石灰石 加入稀盐酸至过量
题号
1
3
5
2
4
6
8
7
C.向一定质量的氢氧化钠溶 D.向等质量的镁和锌中分别加入过
液中逐滴滴加稀盐酸至过量 量的等溶质质量分数的稀盐酸
B [碳酸钙高温煅烧时,碳酸钙变为氧化钙,该元素质量保持不变,A正确;表面生锈的铁钉加入盐酸时,盐酸会先与表面的铁锈(Fe2O3)反应,然后才会与铁反应产生氢气,B不正确;氢氧化钠溶液中逐滴滴加稀盐酸时,刚开始pH>7,随着盐酸的加入pH逐渐变小,恰好完全反应时pH=7,盐酸过量时pH<7,C正确;等质量的镁、锌与足量盐酸反应,产生的氢气与相对原子质量成反比,由于镁的活动性顺序比锌强,故完全反应时镁用时较短,D正确。]
题号
1
3
5
2
4
6
8
7
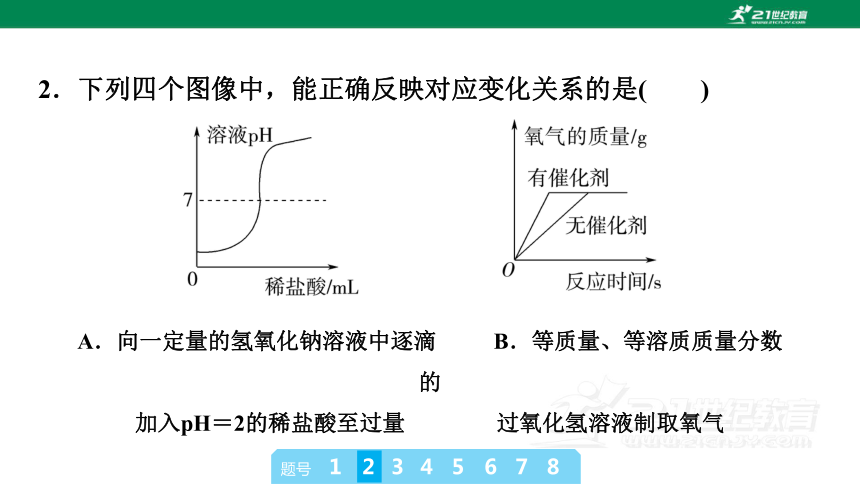
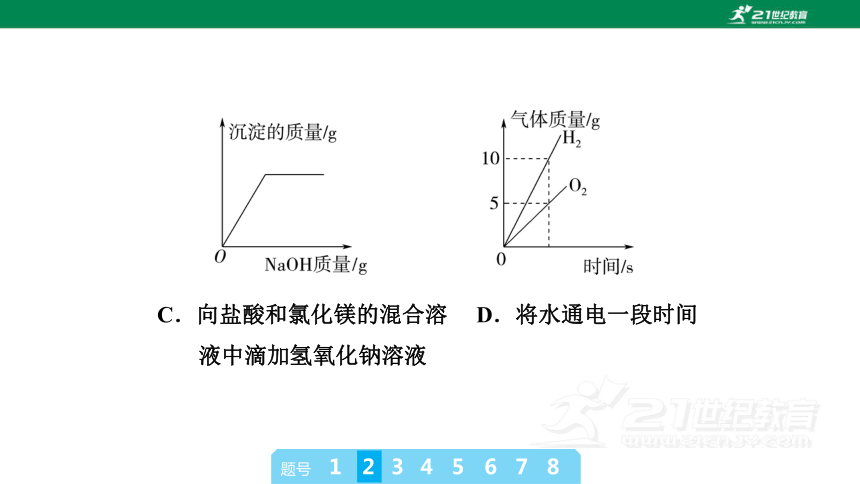
2.下列四个图像中,能正确反映对应变化关系的是( )
题号
1
3
5
2
4
6
8
7
A.向一定量的氢氧化钠溶液中逐滴 B.等质量、等溶质质量分数的
加入pH=2的稀盐酸至过量 过氧化氢溶液制取氧气
题号
1
3
5
2
4
6
8
7
C.向盐酸和氯化镁的混合溶 D.将水通电一段时间
液中滴加氢氧化钠溶液
B [氢氧化钠溶液显碱性,pH大于7,因此向一定量的氢氧化钠溶液中逐滴加入pH=2的稀盐酸至过量时,溶液的pH应该从大于7逐渐减小,A错误;催化剂只能改变化学反应速率,不会影响生成物质量,因此等质量、等溶质质量分数的过氧化氢溶液分解时,在有无催化剂条件下生成氧气的质量相等,有催化剂时,反应速率较快,B正确;向盐酸和氯化镁的混合溶液中滴加氢氧化钠溶液时,氢氧化钠先和盐酸反应生成氯化钠和水,后和氯化镁反应生成氢氧化镁沉淀和氯化钠,开始不产生沉淀,盐酸完全消耗后才产生,氯化镁完全消耗后,沉淀量不再增加,C错误;电解水时,正极产生的是氧气,负极产生的是氢气,氧气和氢气的体积比约为1∶2,质量比是8∶1,D错误。]
题号
1
3
5
2
4
6
8
7
3.图像可以形象直观地揭示化学变化中的数量关系,正确分析图像是中学生需掌握的一种学习方法。相同质量的镁、铁、锌三种金属,分别与足量的、相同质量分数的稀硫酸充分反应,生成氢气质量与反应时间关系如图,分析图像判断,下面说法正确的是( )
A.金属锌反应速率最大
B.金属锌的活动性最强
C.金属镁生成氢气质量最多
D.金属铁消耗稀硫酸质量最多
题号
1
3
5
2
4
6
8
7
√
C [由题图知金属镁与酸反应产生氢气的质量上升是最快的,所以金属镁反应速率最大,A错误;镁反应速率最大,金属活动性最强,B错误;由题图可知,金属镁生成的氢气质量最多,C正确;产生的氢气中氢元素全部来自稀硫酸,产生的氢气越多,消耗的稀硫酸质量越多,镁是消耗稀硫酸质量最多的金属,D错误。]
题号
1
3
5
2
4
6
8
7
4.下列图像不能正确反映所对应叙述关系的是( )
题号
1
3
5
2
4
6
8
7
A.向等质量的水中分别加入相同 B.电解水实验
质量的NaOH和NH4NO3固体
题号
1
3
5
2
4
6
8
7
C.向氯化铜和盐酸的混合溶液中 D.在充满空气的密闭容器
加入氢氧化钠溶液至过量 中点燃红磷
√
D [氢氧化钠溶于水放热,温度升高,硝酸铵溶于水吸热,温度降低,A正确;电解水正极产生氧气,负极产生氢气,体积比为1∶2,B正确;向氯化铜和盐酸的混合溶液中加入氢氧化钠溶液至过量,氢氧化钠先与盐酸反应生成氯化钠和水,这一过程中没有沉淀生成,再与氯化铜反应生成氢氧化铜沉淀和氯化钠,此过程中沉淀逐渐增加,直至氯化铜完全反应,沉淀质量不再变化,C正确;红磷燃烧放出大量的热,温度升高,压强增大,随着反应的进行氧气被消耗,温度逐渐恢复至室温,压强逐渐减小,最终压强比反应前小,D错误。]
题号
1
3
5
2
4
6
8
7
5.实验室用过氧化氢与二氧化锰制取氧气,下图是四位同学根据实验数据绘制的图像,其中不正确的是( )
题号
1
3
5
2
4
6
8
7
A.用等质量、等浓度的 B.向一定量的MnO2中加
H2O2溶液制氧气 入H2O2溶液
题号
1
3
5
2
4
6
8
7
C.向MnO2中加入一定 D.向一定量的H2O2溶液
量的H2O2溶液 中加入MnO2
√
D [用等质量、等浓度的H2O2溶液制氧气时,使用催化剂产生氧气速度快,但不影响氧气产量,A正确;二氧化锰作为催化剂,改变了反应速率,其本身的质量保持不变,B正确;向MnO2中逐滴加入一定量的H2O2溶液时,会立即产生氧气,当H2O2完全反应时,不再产生氧气,C正确;向一定量的H2O2溶液中加入MnO2时,过氧化氢会被完全反应,质量变为零,D错误。]
题号
1
3
5
2
4
6
8
7
题号
1
3
5
2
4
6
8
7
√
题号
1
3
5
2
4
6
8
7
7.某实验小组用一定量大理石(杂质不与盐酸反应也不溶于水)和 30 g 溶质质量分数为 7.3% 的稀盐酸反应制取二氧化碳,充分反应后,将反应后的剩余物过滤(不考虑溶质损失),向滤液中逐滴滴加溶质质量分数为10.6%的碳酸钠溶液,测得滤液的pH与加入溶液质量的关系如图所示。已知氯化钙溶液呈中
性,碳酸钠溶液呈碱性。下列有关分
析正确的是( )
题号
1
3
5
2
4
6
8
7
A.大理石和稀盐酸反应产生CO2的质量为0.44 g
B.c点对应的溶液中溶质的质量为3.51 g
C.a点对应的溶液中有两种溶质
D.bc段发生反应的化学方程式为Na2CO3+2HCl===CO2↑+2NaCl+H2O
题号
1
3
5
2
4
6
8
7
√
题号
1
3
5
2
4
6
8
7
题号
1
3
5
2
4
6
8
7
解得:z=3.51 g,B正确;a点对应溶液pH小于7,说明a点对应的溶液中有HCl、NaCl、CaCl2三种溶质,C错误;溶液pH小于7,说明大理石与稀盐酸反应后,稀盐酸过量,滤液中含有HCl、CaCl2,加入的碳酸钠先与HCl反应,HCl反应完后,碳酸钠与氯化钙反应生成碳酸钙和氯化钠,溶液在该阶段呈中性,所以bc段发生反应的化学方程式为CaCl2+Na2CO3===CaCO3↓+2NaCl,D错误。]
题号
1
3
5
2
4
6
8
7
8.小芳同学在实验室发现一瓶敞口放置在空气中的NaOH固体,她想探究这瓶NaOH是否变质,于是取样品10 g向其中逐渐加入一定质量分数的稀盐酸,产生气体的质量与加入稀盐酸的质量关系如图所示,请回答:
题号
1
3
5
2
4
6
8
7
(1)生成二氧化碳的质量是______g。
(2)样品中氢氧化钠的质量分数是多少?(写出计算过程)
题号
1
3
5
2
4
6
8
7
2.2
解析:(1)根据题图可知,生成二氧化碳的质量为2.2 g。
(2)见答案。
题号
1
3
5
2
4
6
8
7
题号
1
3
5
2
4
6
8
7
【专题攻略】
1.解题思路和方法
解决此类问题常采用五步法:①厘清图像所描述的物质变化的过程→②分析横、纵坐标及曲线表示的意义→③分析曲线的变化趋势(上升还是下降)→④分析特殊点(起点、拐点、终点、交点)及其含义→⑤把图像表示的意义与化学知识结合起来,找出图像与化学反应的量的关系,或列出方程式或关系式,或依据图像走势分析作答。
2.解题技巧
(1)识标:理解坐标图中纵、横坐标的含义,找出纵、横坐标的关系,再结合所学知识,联系相应的知识点。
(2)明点:曲线中的特殊点(起点、终点、顶点、转折点、交点等)表示的化学意义。
(3)析线:曲线的走向、变化趋势。 揭示各段曲线的变化趋势及其含义。
注意:当两条或两条以上的曲线在同一坐标系中表示时,要注意数值大小关系,揭示其变化趋势,然后对比分析,找出符合题意的曲线或结论。
专题三 坐标曲线
坐标曲线题是枣庄中考的常考内容,近 8 年考过 8 次。 从题型上来说,图像题常出现在选择题、填空题、计算题里;从内容上来说,主要涉及质量变化曲线、物质溶解曲线、溶液 pH 变化曲线、反应速率曲线等;从命题规律上来说主要分单独曲线型和综合曲线型两种考查方式。 此类题除以文字方式给出部分信息外,还借助数学方法中的坐标图,把多个因素对各种量变化的影响用坐标图的形式直观地表示出来,考查学生看图、识图、分析图及数据处理等综合分析能力,综合性较强,难度较大。
1.(2024·聊城中考)下列图像不能正确反映其对应变化关系的是
( )
题号
1
3
5
2
4
6
8
7
分层评价 即时反馈
A.高温煅烧一定 B.向表面生锈的铁钉中
质量的石灰石 加入稀盐酸至过量
题号
1
3
5
2
4
6
8
7
C.向一定质量的氢氧化钠溶 D.向等质量的镁和锌中分别加入过
液中逐滴滴加稀盐酸至过量 量的等溶质质量分数的稀盐酸
B [碳酸钙高温煅烧时,碳酸钙变为氧化钙,该元素质量保持不变,A正确;表面生锈的铁钉加入盐酸时,盐酸会先与表面的铁锈(Fe2O3)反应,然后才会与铁反应产生氢气,B不正确;氢氧化钠溶液中逐滴滴加稀盐酸时,刚开始pH>7,随着盐酸的加入pH逐渐变小,恰好完全反应时pH=7,盐酸过量时pH<7,C正确;等质量的镁、锌与足量盐酸反应,产生的氢气与相对原子质量成反比,由于镁的活动性顺序比锌强,故完全反应时镁用时较短,D正确。]
题号
1
3
5
2
4
6
8
7
2.下列四个图像中,能正确反映对应变化关系的是( )
题号
1
3
5
2
4
6
8
7
A.向一定量的氢氧化钠溶液中逐滴 B.等质量、等溶质质量分数的
加入pH=2的稀盐酸至过量 过氧化氢溶液制取氧气
题号
1
3
5
2
4
6
8
7
C.向盐酸和氯化镁的混合溶 D.将水通电一段时间
液中滴加氢氧化钠溶液
B [氢氧化钠溶液显碱性,pH大于7,因此向一定量的氢氧化钠溶液中逐滴加入pH=2的稀盐酸至过量时,溶液的pH应该从大于7逐渐减小,A错误;催化剂只能改变化学反应速率,不会影响生成物质量,因此等质量、等溶质质量分数的过氧化氢溶液分解时,在有无催化剂条件下生成氧气的质量相等,有催化剂时,反应速率较快,B正确;向盐酸和氯化镁的混合溶液中滴加氢氧化钠溶液时,氢氧化钠先和盐酸反应生成氯化钠和水,后和氯化镁反应生成氢氧化镁沉淀和氯化钠,开始不产生沉淀,盐酸完全消耗后才产生,氯化镁完全消耗后,沉淀量不再增加,C错误;电解水时,正极产生的是氧气,负极产生的是氢气,氧气和氢气的体积比约为1∶2,质量比是8∶1,D错误。]
题号
1
3
5
2
4
6
8
7
3.图像可以形象直观地揭示化学变化中的数量关系,正确分析图像是中学生需掌握的一种学习方法。相同质量的镁、铁、锌三种金属,分别与足量的、相同质量分数的稀硫酸充分反应,生成氢气质量与反应时间关系如图,分析图像判断,下面说法正确的是( )
A.金属锌反应速率最大
B.金属锌的活动性最强
C.金属镁生成氢气质量最多
D.金属铁消耗稀硫酸质量最多
题号
1
3
5
2
4
6
8
7
√
C [由题图知金属镁与酸反应产生氢气的质量上升是最快的,所以金属镁反应速率最大,A错误;镁反应速率最大,金属活动性最强,B错误;由题图可知,金属镁生成的氢气质量最多,C正确;产生的氢气中氢元素全部来自稀硫酸,产生的氢气越多,消耗的稀硫酸质量越多,镁是消耗稀硫酸质量最多的金属,D错误。]
题号
1
3
5
2
4
6
8
7
4.下列图像不能正确反映所对应叙述关系的是( )
题号
1
3
5
2
4
6
8
7
A.向等质量的水中分别加入相同 B.电解水实验
质量的NaOH和NH4NO3固体
题号
1
3
5
2
4
6
8
7
C.向氯化铜和盐酸的混合溶液中 D.在充满空气的密闭容器
加入氢氧化钠溶液至过量 中点燃红磷
√
D [氢氧化钠溶于水放热,温度升高,硝酸铵溶于水吸热,温度降低,A正确;电解水正极产生氧气,负极产生氢气,体积比为1∶2,B正确;向氯化铜和盐酸的混合溶液中加入氢氧化钠溶液至过量,氢氧化钠先与盐酸反应生成氯化钠和水,这一过程中没有沉淀生成,再与氯化铜反应生成氢氧化铜沉淀和氯化钠,此过程中沉淀逐渐增加,直至氯化铜完全反应,沉淀质量不再变化,C正确;红磷燃烧放出大量的热,温度升高,压强增大,随着反应的进行氧气被消耗,温度逐渐恢复至室温,压强逐渐减小,最终压强比反应前小,D错误。]
题号
1
3
5
2
4
6
8
7
5.实验室用过氧化氢与二氧化锰制取氧气,下图是四位同学根据实验数据绘制的图像,其中不正确的是( )
题号
1
3
5
2
4
6
8
7
A.用等质量、等浓度的 B.向一定量的MnO2中加
H2O2溶液制氧气 入H2O2溶液
题号
1
3
5
2
4
6
8
7
C.向MnO2中加入一定 D.向一定量的H2O2溶液
量的H2O2溶液 中加入MnO2
√
D [用等质量、等浓度的H2O2溶液制氧气时,使用催化剂产生氧气速度快,但不影响氧气产量,A正确;二氧化锰作为催化剂,改变了反应速率,其本身的质量保持不变,B正确;向MnO2中逐滴加入一定量的H2O2溶液时,会立即产生氧气,当H2O2完全反应时,不再产生氧气,C正确;向一定量的H2O2溶液中加入MnO2时,过氧化氢会被完全反应,质量变为零,D错误。]
题号
1
3
5
2
4
6
8
7
题号
1
3
5
2
4
6
8
7
√
题号
1
3
5
2
4
6
8
7
7.某实验小组用一定量大理石(杂质不与盐酸反应也不溶于水)和 30 g 溶质质量分数为 7.3% 的稀盐酸反应制取二氧化碳,充分反应后,将反应后的剩余物过滤(不考虑溶质损失),向滤液中逐滴滴加溶质质量分数为10.6%的碳酸钠溶液,测得滤液的pH与加入溶液质量的关系如图所示。已知氯化钙溶液呈中
性,碳酸钠溶液呈碱性。下列有关分
析正确的是( )
题号
1
3
5
2
4
6
8
7
A.大理石和稀盐酸反应产生CO2的质量为0.44 g
B.c点对应的溶液中溶质的质量为3.51 g
C.a点对应的溶液中有两种溶质
D.bc段发生反应的化学方程式为Na2CO3+2HCl===CO2↑+2NaCl+H2O
题号
1
3
5
2
4
6
8
7
√
题号
1
3
5
2
4
6
8
7
题号
1
3
5
2
4
6
8
7
解得:z=3.51 g,B正确;a点对应溶液pH小于7,说明a点对应的溶液中有HCl、NaCl、CaCl2三种溶质,C错误;溶液pH小于7,说明大理石与稀盐酸反应后,稀盐酸过量,滤液中含有HCl、CaCl2,加入的碳酸钠先与HCl反应,HCl反应完后,碳酸钠与氯化钙反应生成碳酸钙和氯化钠,溶液在该阶段呈中性,所以bc段发生反应的化学方程式为CaCl2+Na2CO3===CaCO3↓+2NaCl,D错误。]
题号
1
3
5
2
4
6
8
7
8.小芳同学在实验室发现一瓶敞口放置在空气中的NaOH固体,她想探究这瓶NaOH是否变质,于是取样品10 g向其中逐渐加入一定质量分数的稀盐酸,产生气体的质量与加入稀盐酸的质量关系如图所示,请回答:
题号
1
3
5
2
4
6
8
7
(1)生成二氧化碳的质量是______g。
(2)样品中氢氧化钠的质量分数是多少?(写出计算过程)
题号
1
3
5
2
4
6
8
7
2.2
解析:(1)根据题图可知,生成二氧化碳的质量为2.2 g。
(2)见答案。
题号
1
3
5
2
4
6
8
7
题号
1
3
5
2
4
6
8
7
【专题攻略】
1.解题思路和方法
解决此类问题常采用五步法:①厘清图像所描述的物质变化的过程→②分析横、纵坐标及曲线表示的意义→③分析曲线的变化趋势(上升还是下降)→④分析特殊点(起点、拐点、终点、交点)及其含义→⑤把图像表示的意义与化学知识结合起来,找出图像与化学反应的量的关系,或列出方程式或关系式,或依据图像走势分析作答。
2.解题技巧
(1)识标:理解坐标图中纵、横坐标的含义,找出纵、横坐标的关系,再结合所学知识,联系相应的知识点。
(2)明点:曲线中的特殊点(起点、终点、顶点、转折点、交点等)表示的化学意义。
(3)析线:曲线的走向、变化趋势。 揭示各段曲线的变化趋势及其含义。
注意:当两条或两条以上的曲线在同一坐标系中表示时,要注意数值大小关系,揭示其变化趋势,然后对比分析,找出符合题意的曲线或结论。
同课章节目录
