中考化学二轮复习专题四工艺流程课件
图片预览










文档简介
(共30张PPT)
专题四 工艺流程
工艺流程题是枣庄中考的常考内容,近5年考过 3 次。从命题形式上讲,本专题以“生产工艺”或“实验操作流程”为素材,将化工生产过程和实验室操作中的主要步骤用框图形式表示出来,是无机框图的创新;从内容上讲,工艺流程题主要以物质的生产和除杂为背景,考查化学式和化学方程式的书写、过滤操作、物质的转化等相关内容;从题型上讲,工艺流程题常出现在选择题、填空题里,难度相对较大。
1.芯片是用高纯硅制成的。如图是以石英砂为原料制备高纯硅的工艺流程(石英砂主要成分是SiO2,含有少量的Fe2O3和Al2O3)。下列说法正确的是( )
A.溶液a中的溶质是FeCl2和AlCl3
B.①中发生反应时,碳元素的化合价降低
C.②中反应需要在无氧环境下进行
D.该流程中可以循环利用的物质是CO和HCl
题号
1
3
5
2
4
6
7
√
C [石英砂主要成分是SiO2,含有少量的Fe2O3和Al2O3,Fe2O3能和稀盐酸反应生成氯化铁和水,Al2O3能和稀盐酸反应生成氯化铝和水,SiO2不和稀盐酸反应,稀盐酸过量,故a溶液中的溶质为FeCl3、AlCl3、HCl,A错误;二氧化硅和焦炭在高温条件下反应生成粗硅和CO,碳元素由0价转变成+2价,B错误;为防止生成的硅在高温条件下再次被氧化,防止氢气和氧气的混合气体在高温时发生爆炸,②中反应需要在无氧环境下进行,C正确;既是反应物又是生成物的物质通常可以循环使用,由该反应的流程图可知,在生产过程中可以循环使用的物质只有HCl,D错误。]
题号
1
3
5
2
4
6
7
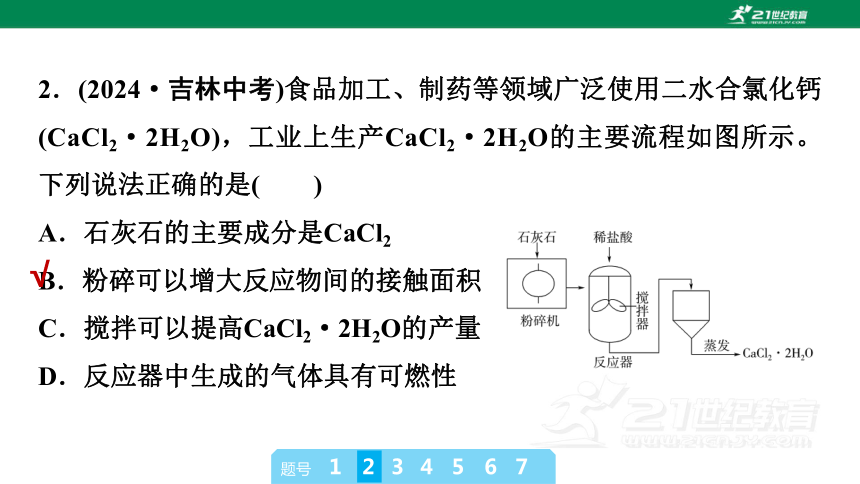
2.(2024·吉林中考)食品加工、制药等领域广泛使用二水合氯化钙(CaCl2·2H2O),工业上生产CaCl2·2H2O的主要流程如图所示。下列说法正确的是( )
A.石灰石的主要成分是CaCl2
B.粉碎可以增大反应物间的接触面积
C.搅拌可以提高CaCl2·2H2O的产量
D.反应器中生成的气体具有可燃性
题号
1
3
5
2
4
6
7
√
B [石灰石的主要成分是碳酸钙(CaCO3),不是CaCl2,A错误;粉碎可以增大反应物间的接触面积,从而加快反应速率,B正确;搅拌可以使反应更充分,加快反应速率,但不能提高CaCl2·2H2O的产量,C错误;反应器中发生的反应是碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,生成的气体是二氧化碳,二氧化碳不可燃,D错误。]
题号
1
3
5
2
4
6
7
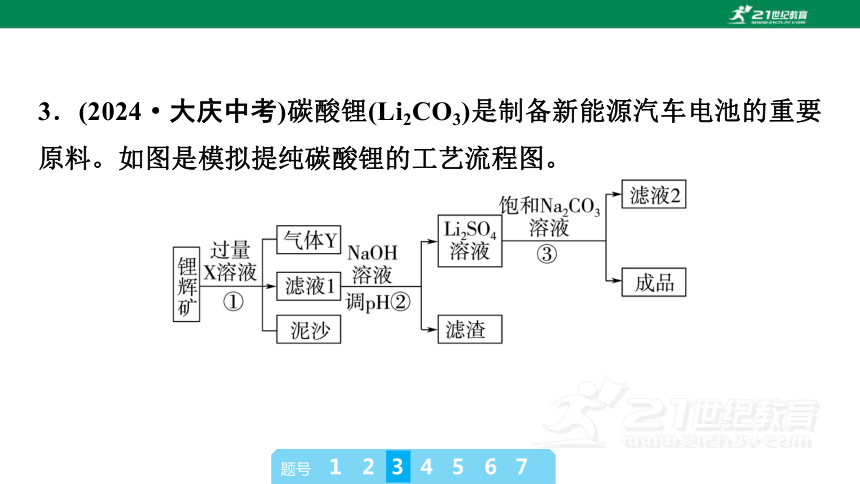
3.(2024·大庆中考)碳酸锂(Li2CO3)是制备新能源汽车电池的重要原料。如图是模拟提纯碳酸锂的工艺流程图。
题号
1
3
5
2
4
6
7
已知:Ⅰ.锂辉矿的主要成分为Li2CO3,含泥沙等杂质。
Ⅱ.Li2CO3为无色晶体,室温时微溶于水,在冷水中的溶解度比热水中大。
下列说法错误的是( )
A.X可以是稀硫酸,常用澄清石灰水检验气体Y
B.将滤液2蒸发,当有较多固体出现时,停止加热
C.②中适宜用冷饱和Na2CO3溶液
D.此工艺可获得副产品Na2SO4
题号
1
3
5
2
4
6
7
√
C [根据流程分析,X可以是稀硫酸,常用澄清石灰水检验气体二氧化碳,A正确;将滤液2蒸发,当有较多固体出现时,停止加热,利用余热将固体蒸干,B正确;Li2CO3为无色晶体,室温时微溶于水,在冷水中的溶解度比热水中大,因此②中适宜用热的饱和Na2CO3溶液,可以促进Li2CO3的析出,提高产率,C错误;根据流程分析,此工艺可获得副产品Na2SO4,D正确。]
题号
1
3
5
2
4
6
7
4.(2024·赤峰中考)以蛋壳为原料生产高纯碳酸钙可以实现资源的综合利用。其生产流程如图所示(蛋壳主要含CaCO3,不考虑其他成分的影响)。
题号
1
3
5
2
4
6
7
(1)蛋壳需要经过粉碎处理,目的是____________________________。
(2)反应Ⅰ涉及的化学方程式为________________________________
___________________________________________________________。
(3)操作a的名称为________。
(4)反应所得的NH4Cl在农业上可用作_______。
题号
1
3
5
2
4
6
7
增大接触面积,促进反应
CaCO3+2HCl===CaCl2+H2O+
CO2↑
过滤
氮肥
解析:(1)蛋壳需要经过粉碎处理,目的是增大接触面积,促进反应。(2)反应Ⅰ中碳酸钙与稀盐酸反应生成了氯化钙、二氧化碳和水,涉及的化学方程式为CaCO3+2HCl===CaCl2+H2O+CO2↑。(3)操作a能将固液分离,名称为过滤。(4)反应所得的NH4Cl中含有农作物生长需要的氮元素,在农业上可用作氮肥。
题号
1
3
5
2
4
6
7
5.(2024·内江中考)海洋是巨大的资源宝库,海水综合利用的部分工艺流程图如图。请回答以下问题:
题号
1
3
5
2
4
6
7
(1)粗盐含有的主要杂质为MgCl2、CaCl2,则固体B的主要成分是__________和CaCO3。
(2)步骤①加入适量盐酸的目的是____________________________。
(3)用NaCl制取纯碱(Na2CO3),从元素守恒的角度,还需要含有________、氧元素的物质参加反应。
题号
1
3
5
2
4
6
7
Mg(OH)2
除去氢氧化钠和碳酸钠
碳
(4)步骤②中加入石灰乳充分反应后,还需进行的操作是________。
(5)步骤③中试剂D为________。
(6)钛(Ti)被称为航空金属,常用于建造空间站。工业上利用步骤④制备金属钛,其反应的化学方程式为__________________________
_____________________________。
题号
1
3
5
2
4
6
7
过滤
稀盐酸
Ti+2MgCl2
解析:(1)粗盐含有的主要杂质为MgCl2、CaCl2,加入过量的氢氧化钠和碳酸钠溶液,氢氧化钠和氯化镁反应生成氢氧化镁白色沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙白色沉淀和氯化钠,过滤后,则固体B的主要成分是Mg(OH)2和CaCO3。
(2)溶液A中含有氯化钠、氢氧化钠和碳酸钠,盐酸与氢氧化钠反应生成氯化钠和水、和碳酸钠反应生成氯化钠、水和二氧化碳,故步骤①加入适量盐酸的目的是除去氢氧化钠和碳酸钠。
题号
1
3
5
2
4
6
7
题号
1
3
5
2
4
6
7
6.从废旧电脑的某些零部件中回收金属银,设计流程如图所示。
题号
1
3
5
2
4
6
7
(1)步骤Ⅰ操作名称是________。
(2)溶液X中只含有一种溶质,该溶质的化学式为___________。
过滤
Cu(NO3)2
(3)步骤Ⅱ中发生反应的化学方程式为_________________________
___________________________________________________________。
(4)据此判断,铜、银、铝的金属活动性由强到弱的顺序是_____________________________(填元素符号)。
题号
1
3
5
2
4
6
7
Cu+2AgNO3===Cu(NO3)2
+2Ag
Al>Cu>Ag(或Al、Cu、Ag)
解析:(1)步骤Ⅰ可以将固体和液体分离,其操作名称是过滤。
(2)粗产品中加入稀硫酸,铝能与稀硫酸反应,铜和银不能与稀硫酸反应,因此固体中含有铜和银,铜能与硝酸银反应生成硝酸铜和银,溶液X中只含有一种溶质,则溶质是铜和硝酸银反应生成的硝酸铜,化学式为Cu(NO3)2。
题号
1
3
5
2
4
6
7
(3)步骤Ⅱ中铜能与硝酸银反应生成硝酸铜和银,反应的化学方程式为Cu+2AgNO3===Cu(NO3)2+2Ag。
(4)铝能与稀硫酸反应,铜和银不能与稀硫酸反应,说明铝最活泼,铜能与硝酸银反应,说明铜比银活泼,据此可得出铜、银、铝的金属活动性由强到弱的顺序是Al>Cu>Ag。
题号
1
3
5
2
4
6
7
题号
1
3
5
2
4
6
7
(1)在实验室中,操作a使用的玻璃仪器有烧杯和________________。
(2)吸收塔内发生反应的化学方程式是__________________________
_________________________________________________________。
(3)流程中,可以循环利用的物质是____________(填化学式)。
题号
1
3
5
2
4
6
7
漏斗、玻璃棒
SO2+2NaOH===Na2SO3
+H2O
NaOH
(4)理论上只需不断加入_________(填化学式),便可持续实现烟气的脱硫处理。
(5)氧化塔中,反应前后化合价升高的元素是________。
题号
1
3
5
2
4
6
7
Ca(OH)2
S
解析:(1)熟石灰是氢氧化钙的俗称,由流程图可知,“制碱釜”中发生的是亚硫酸钠与氢氧化钙的反应,生成亚硫酸钙沉淀和氢氧化钠,则操作a为分离固液的过滤操作,在实验室中,过滤使用的玻璃仪器有烧杯和漏斗、玻璃棒。
(2)烧碱是氢氧化钠的俗称,SO2与CO2的某些化学性质相似,二氧化碳能与氢氧化钠反应生成碳酸钠和水,则由流程图可知,“吸收塔”中发生的是二氧化硫与氢氧化钠的反应,化学方程式为SO2+2NaOH===Na2SO3+H2O。
题号
1
3
5
2
4
6
7
(3)由流程图可知,可以循环利用的物质是烧碱溶液,烧碱是氢氧化钠的俗称,其化学式为NaOH。
(4)由流程图可知,理论上只需不断加入熟石灰,便可持续实现烟气的脱硫处理,熟石灰是氢氧化钙的俗称,其化学式为Ca(OH)2。
题号
1
3
5
2
4
6
7
(5)CaSO3中钙元素的化合价为+2价,氧元素的化合价为-2价,设硫元素的化合价为x,根据在化合物中各元素化合价的代数和为零,则(+2)+x+(-2)×3=0,解得x=+4, 故CaSO3中硫元素的化合价为+4价;CaSO4·2H2O中钙元素的化合价为+2价,氧元素的化合价为-2价,设硫元素的化合价为y,根据在化合物中各元素化合价的代数和为零,则(+2)+y+(-2)×4=0,解得y=+6,故CaSO4·2H2O中硫元素的化合价为+6价;故氧化塔中CaSO3―→CaSO4·2H2O,硫元素化合价由 +4 价―→+6价,故化合价升高的元素是S。
题号
1
3
5
2
4
6
7
【答题模板】
1.解题思路
2.解题技巧
(1)关注流程图中的“三线”:出线和进线均表示物料流向或操作流程,可逆线表示物质可循环利用。
(2)判断流程中所加的试剂:可以从加入试剂的目的、反应的产物入手进行分析。
(3)推断流程图某一步中的物质:可从上一步操作中反应物可能发生的反应入手分析,同时需注意所加试剂是否有剩余。
(4)化学方程式的书写:①根据箭头方向找出反应物和生成物(箭头进入的是反应物,出去的是生成物),然后根据化学方程式的书写步骤正确书写。②若从已知信息中找出的反应物和生成物不满足质量守恒定律,可在反应物或生成物中加上水,然后进行配平,若在空气中煅烧或通入空气则还需考虑空气中的氧气是否参与反应。
(5)判断可循环利用的物质:步骤中某一步的产物是另一步的原料,根据图中箭头方向(可逆线)即可判断出可循环利用的物质。
专题四 工艺流程
工艺流程题是枣庄中考的常考内容,近5年考过 3 次。从命题形式上讲,本专题以“生产工艺”或“实验操作流程”为素材,将化工生产过程和实验室操作中的主要步骤用框图形式表示出来,是无机框图的创新;从内容上讲,工艺流程题主要以物质的生产和除杂为背景,考查化学式和化学方程式的书写、过滤操作、物质的转化等相关内容;从题型上讲,工艺流程题常出现在选择题、填空题里,难度相对较大。
1.芯片是用高纯硅制成的。如图是以石英砂为原料制备高纯硅的工艺流程(石英砂主要成分是SiO2,含有少量的Fe2O3和Al2O3)。下列说法正确的是( )
A.溶液a中的溶质是FeCl2和AlCl3
B.①中发生反应时,碳元素的化合价降低
C.②中反应需要在无氧环境下进行
D.该流程中可以循环利用的物质是CO和HCl
题号
1
3
5
2
4
6
7
√
C [石英砂主要成分是SiO2,含有少量的Fe2O3和Al2O3,Fe2O3能和稀盐酸反应生成氯化铁和水,Al2O3能和稀盐酸反应生成氯化铝和水,SiO2不和稀盐酸反应,稀盐酸过量,故a溶液中的溶质为FeCl3、AlCl3、HCl,A错误;二氧化硅和焦炭在高温条件下反应生成粗硅和CO,碳元素由0价转变成+2价,B错误;为防止生成的硅在高温条件下再次被氧化,防止氢气和氧气的混合气体在高温时发生爆炸,②中反应需要在无氧环境下进行,C正确;既是反应物又是生成物的物质通常可以循环使用,由该反应的流程图可知,在生产过程中可以循环使用的物质只有HCl,D错误。]
题号
1
3
5
2
4
6
7
2.(2024·吉林中考)食品加工、制药等领域广泛使用二水合氯化钙(CaCl2·2H2O),工业上生产CaCl2·2H2O的主要流程如图所示。下列说法正确的是( )
A.石灰石的主要成分是CaCl2
B.粉碎可以增大反应物间的接触面积
C.搅拌可以提高CaCl2·2H2O的产量
D.反应器中生成的气体具有可燃性
题号
1
3
5
2
4
6
7
√
B [石灰石的主要成分是碳酸钙(CaCO3),不是CaCl2,A错误;粉碎可以增大反应物间的接触面积,从而加快反应速率,B正确;搅拌可以使反应更充分,加快反应速率,但不能提高CaCl2·2H2O的产量,C错误;反应器中发生的反应是碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,生成的气体是二氧化碳,二氧化碳不可燃,D错误。]
题号
1
3
5
2
4
6
7
3.(2024·大庆中考)碳酸锂(Li2CO3)是制备新能源汽车电池的重要原料。如图是模拟提纯碳酸锂的工艺流程图。
题号
1
3
5
2
4
6
7
已知:Ⅰ.锂辉矿的主要成分为Li2CO3,含泥沙等杂质。
Ⅱ.Li2CO3为无色晶体,室温时微溶于水,在冷水中的溶解度比热水中大。
下列说法错误的是( )
A.X可以是稀硫酸,常用澄清石灰水检验气体Y
B.将滤液2蒸发,当有较多固体出现时,停止加热
C.②中适宜用冷饱和Na2CO3溶液
D.此工艺可获得副产品Na2SO4
题号
1
3
5
2
4
6
7
√
C [根据流程分析,X可以是稀硫酸,常用澄清石灰水检验气体二氧化碳,A正确;将滤液2蒸发,当有较多固体出现时,停止加热,利用余热将固体蒸干,B正确;Li2CO3为无色晶体,室温时微溶于水,在冷水中的溶解度比热水中大,因此②中适宜用热的饱和Na2CO3溶液,可以促进Li2CO3的析出,提高产率,C错误;根据流程分析,此工艺可获得副产品Na2SO4,D正确。]
题号
1
3
5
2
4
6
7
4.(2024·赤峰中考)以蛋壳为原料生产高纯碳酸钙可以实现资源的综合利用。其生产流程如图所示(蛋壳主要含CaCO3,不考虑其他成分的影响)。
题号
1
3
5
2
4
6
7
(1)蛋壳需要经过粉碎处理,目的是____________________________。
(2)反应Ⅰ涉及的化学方程式为________________________________
___________________________________________________________。
(3)操作a的名称为________。
(4)反应所得的NH4Cl在农业上可用作_______。
题号
1
3
5
2
4
6
7
增大接触面积,促进反应
CaCO3+2HCl===CaCl2+H2O+
CO2↑
过滤
氮肥
解析:(1)蛋壳需要经过粉碎处理,目的是增大接触面积,促进反应。(2)反应Ⅰ中碳酸钙与稀盐酸反应生成了氯化钙、二氧化碳和水,涉及的化学方程式为CaCO3+2HCl===CaCl2+H2O+CO2↑。(3)操作a能将固液分离,名称为过滤。(4)反应所得的NH4Cl中含有农作物生长需要的氮元素,在农业上可用作氮肥。
题号
1
3
5
2
4
6
7
5.(2024·内江中考)海洋是巨大的资源宝库,海水综合利用的部分工艺流程图如图。请回答以下问题:
题号
1
3
5
2
4
6
7
(1)粗盐含有的主要杂质为MgCl2、CaCl2,则固体B的主要成分是__________和CaCO3。
(2)步骤①加入适量盐酸的目的是____________________________。
(3)用NaCl制取纯碱(Na2CO3),从元素守恒的角度,还需要含有________、氧元素的物质参加反应。
题号
1
3
5
2
4
6
7
Mg(OH)2
除去氢氧化钠和碳酸钠
碳
(4)步骤②中加入石灰乳充分反应后,还需进行的操作是________。
(5)步骤③中试剂D为________。
(6)钛(Ti)被称为航空金属,常用于建造空间站。工业上利用步骤④制备金属钛,其反应的化学方程式为__________________________
_____________________________。
题号
1
3
5
2
4
6
7
过滤
稀盐酸
Ti+2MgCl2
解析:(1)粗盐含有的主要杂质为MgCl2、CaCl2,加入过量的氢氧化钠和碳酸钠溶液,氢氧化钠和氯化镁反应生成氢氧化镁白色沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙白色沉淀和氯化钠,过滤后,则固体B的主要成分是Mg(OH)2和CaCO3。
(2)溶液A中含有氯化钠、氢氧化钠和碳酸钠,盐酸与氢氧化钠反应生成氯化钠和水、和碳酸钠反应生成氯化钠、水和二氧化碳,故步骤①加入适量盐酸的目的是除去氢氧化钠和碳酸钠。
题号
1
3
5
2
4
6
7
题号
1
3
5
2
4
6
7
6.从废旧电脑的某些零部件中回收金属银,设计流程如图所示。
题号
1
3
5
2
4
6
7
(1)步骤Ⅰ操作名称是________。
(2)溶液X中只含有一种溶质,该溶质的化学式为___________。
过滤
Cu(NO3)2
(3)步骤Ⅱ中发生反应的化学方程式为_________________________
___________________________________________________________。
(4)据此判断,铜、银、铝的金属活动性由强到弱的顺序是_____________________________(填元素符号)。
题号
1
3
5
2
4
6
7
Cu+2AgNO3===Cu(NO3)2
+2Ag
Al>Cu>Ag(或Al、Cu、Ag)
解析:(1)步骤Ⅰ可以将固体和液体分离,其操作名称是过滤。
(2)粗产品中加入稀硫酸,铝能与稀硫酸反应,铜和银不能与稀硫酸反应,因此固体中含有铜和银,铜能与硝酸银反应生成硝酸铜和银,溶液X中只含有一种溶质,则溶质是铜和硝酸银反应生成的硝酸铜,化学式为Cu(NO3)2。
题号
1
3
5
2
4
6
7
(3)步骤Ⅱ中铜能与硝酸银反应生成硝酸铜和银,反应的化学方程式为Cu+2AgNO3===Cu(NO3)2+2Ag。
(4)铝能与稀硫酸反应,铜和银不能与稀硫酸反应,说明铝最活泼,铜能与硝酸银反应,说明铜比银活泼,据此可得出铜、银、铝的金属活动性由强到弱的顺序是Al>Cu>Ag。
题号
1
3
5
2
4
6
7
题号
1
3
5
2
4
6
7
(1)在实验室中,操作a使用的玻璃仪器有烧杯和________________。
(2)吸收塔内发生反应的化学方程式是__________________________
_________________________________________________________。
(3)流程中,可以循环利用的物质是____________(填化学式)。
题号
1
3
5
2
4
6
7
漏斗、玻璃棒
SO2+2NaOH===Na2SO3
+H2O
NaOH
(4)理论上只需不断加入_________(填化学式),便可持续实现烟气的脱硫处理。
(5)氧化塔中,反应前后化合价升高的元素是________。
题号
1
3
5
2
4
6
7
Ca(OH)2
S
解析:(1)熟石灰是氢氧化钙的俗称,由流程图可知,“制碱釜”中发生的是亚硫酸钠与氢氧化钙的反应,生成亚硫酸钙沉淀和氢氧化钠,则操作a为分离固液的过滤操作,在实验室中,过滤使用的玻璃仪器有烧杯和漏斗、玻璃棒。
(2)烧碱是氢氧化钠的俗称,SO2与CO2的某些化学性质相似,二氧化碳能与氢氧化钠反应生成碳酸钠和水,则由流程图可知,“吸收塔”中发生的是二氧化硫与氢氧化钠的反应,化学方程式为SO2+2NaOH===Na2SO3+H2O。
题号
1
3
5
2
4
6
7
(3)由流程图可知,可以循环利用的物质是烧碱溶液,烧碱是氢氧化钠的俗称,其化学式为NaOH。
(4)由流程图可知,理论上只需不断加入熟石灰,便可持续实现烟气的脱硫处理,熟石灰是氢氧化钙的俗称,其化学式为Ca(OH)2。
题号
1
3
5
2
4
6
7
(5)CaSO3中钙元素的化合价为+2价,氧元素的化合价为-2价,设硫元素的化合价为x,根据在化合物中各元素化合价的代数和为零,则(+2)+x+(-2)×3=0,解得x=+4, 故CaSO3中硫元素的化合价为+4价;CaSO4·2H2O中钙元素的化合价为+2价,氧元素的化合价为-2价,设硫元素的化合价为y,根据在化合物中各元素化合价的代数和为零,则(+2)+y+(-2)×4=0,解得y=+6,故CaSO4·2H2O中硫元素的化合价为+6价;故氧化塔中CaSO3―→CaSO4·2H2O,硫元素化合价由 +4 价―→+6价,故化合价升高的元素是S。
题号
1
3
5
2
4
6
7
【答题模板】
1.解题思路
2.解题技巧
(1)关注流程图中的“三线”:出线和进线均表示物料流向或操作流程,可逆线表示物质可循环利用。
(2)判断流程中所加的试剂:可以从加入试剂的目的、反应的产物入手进行分析。
(3)推断流程图某一步中的物质:可从上一步操作中反应物可能发生的反应入手分析,同时需注意所加试剂是否有剩余。
(4)化学方程式的书写:①根据箭头方向找出反应物和生成物(箭头进入的是反应物,出去的是生成物),然后根据化学方程式的书写步骤正确书写。②若从已知信息中找出的反应物和生成物不满足质量守恒定律,可在反应物或生成物中加上水,然后进行配平,若在空气中煅烧或通入空气则还需考虑空气中的氧气是否参与反应。
(5)判断可循环利用的物质:步骤中某一步的产物是另一步的原料,根据图中箭头方向(可逆线)即可判断出可循环利用的物质。
同课章节目录
