中考化学二轮复习专题一物质的检验与鉴别、分离与除杂课件
文档属性
| 名称 | 中考化学二轮复习专题一物质的检验与鉴别、分离与除杂课件 |  | |
| 格式 | ppt | ||
| 文件大小 | 764.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-18 15:58:52 | ||
图片预览








文档简介
(共26张PPT)
专题一 物质的检验与鉴别、分离与除杂
物质的检验与鉴别、分离与除杂,是对物质的性质、特征反应、特征现象的综合性考查,需要熟悉不同物质的物理和化学性质。考查形式有选择题、科学探究题等,该部分内容注重考查学生综合应用化学知识、解决实际问题的能力。命题内容将密切联系生产和生活实际,注重考核学生运用化学知识、科学方法来分析、解决问题的能力。
1.(2024·聊城中考)下列实验设计及操作不能达到实验目的的是
( )
物质的检验与鉴别
选项 实验目的 实验设计及操作
A 检验一瓶无色气体是否为CO2 向瓶中伸入燃着的木条,观察现象
B 鉴别稀盐酸与稀硫酸 取样,分别滴加少量BaCl2溶液,观察现象
选项 实验目的 实验设计及操作
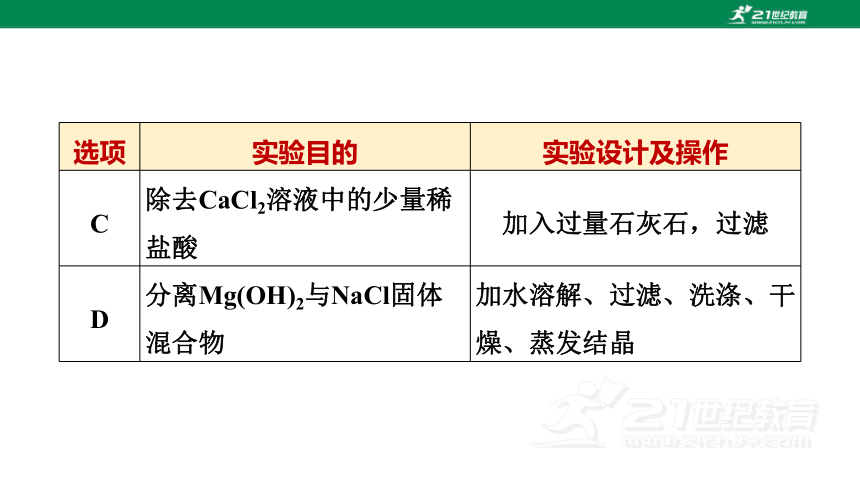
C 除去CaCl2溶液中的少量稀盐酸 加入过量石灰石,过滤
D 分离Mg(OH)2与NaCl固体混合物 加水溶解、过滤、洗涤、干燥、蒸发结晶
A [能使燃着的木条熄灭的不一定是二氧化碳,氮气、稀有气体也能,A达不到实验目的;硫酸能与氯化钡反应生成白色沉淀,盐酸不与氯化钡反应,无明显现象,B能达到实验目的;氯化钙中含有盐酸时,加入过量碳酸钙,碳酸钙会与盐酸反应生成氯化钙,同时当盐酸完全反应后,碳酸钙也不会溶解,不会引入新杂质,C能达到实验目的;Mg(OH)2与NaCl固体混合物放入水中,前者不溶解,后者溶解,通过过滤、洗涤、干燥可获得Mg(OH)2,通过蒸发结晶可以获得氯化钠固体,D能达到实验目的。]
2.下列实验操作不能达到实验目的的是( )
选项 实验目的 主要实验操作
A 鉴别铵态氮肥和钾肥 取样,分别加入熟石灰混合研磨,闻气味
B 滴加足量的稀盐酸,然后蒸发结晶
C 除去NaCl溶液中混有的CaCl2 滴加碳酸钠溶液至恰好不再产生沉淀为止,然后过滤
D 检验NaOH溶液在空气中部分变质 滴加过量的氯化钡溶液,静置,再向上层清液中滴加酚酞试液
√
B [取样,分别加入熟石灰混合研磨,闻气味,产生有刺激性气味气体的是铵态氮肥,无明显气味的是钾肥,可以鉴别,A能达到实验目的;滴加足量的稀盐酸,碳酸钙能与稀盐酸反应生成氯化钙、水和二氧化碳,然后蒸发结晶,能分离出氯化钙,但无法分离出碳酸钙,B不能达到实验目的;碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,滴加碳酸钠溶液至恰好不再产生沉淀为止,所加试剂为适量,能除去杂质,且没有引入新杂质,经过过滤,就能得到纯净的氯化钠溶液,C能达到实验目的;变质后的氢氧化钠溶液中含有碳酸钠,滴加过量的氯化钡溶液,碳酸钠能与氯化钡反应生成碳酸钡沉淀和氯化钠,静置,再向上层清液中滴加酚酞试液,酚酞试液变红色,说明含有氢氧化钠,可检验溶液在空气中部分变质,D能达到实验目的。]
3.(2024·河南中考)生产、生活中常要区分物质。下列区分物质的试剂或方法正确的是( )
A.用食盐水区分硬水、软水
B.用熟石灰区分氯化铵、硫酸铵
C.用灼烧法区分涤纶、羊毛
D.用燃着的木条区分氮气、二氧化碳
√
C [不能用食盐水区分硬水、软水,可以用肥皂水区分硬水和软水,加入肥皂水后浮渣较多的是硬水,泡沫较多的是软水,故A错误;氯化铵、硫酸铵和熟石灰混合研磨都会产生有刺激性气味的氨气,不能用熟石灰来区分氯化铵、硫酸铵,故B错误;涤纶灼烧有特殊气味,羊毛灼烧有烧焦羽毛的气味,能用灼烧法来区分涤纶、羊毛,故C正确;氮气、二氧化碳都不能燃烧也不支持燃烧,都能使燃着的木条熄灭,不能用燃着的木条区分氮气、二氧化碳,故D错误。]
4.(2024·深圳中考)下列做法不可以完成的是( )
A.辨别空气、N2和O2——将燃着的木条伸入
B.辨别黄铜合金和黄金——用酒精灯烧
C.辨别纯净水和海水——晒干
D.将溶解色素的水分离——静置沉淀
√
D [氧气有助燃性,可以支持燃烧,氮气没有助燃性,不支持燃烧。燃着的木条在空气中继续燃烧,在N2中很快熄灭,在O2中剧烈燃烧,因此,可用燃着的木条辨别空气、N2和O2,A正确;黄铜是铜和锌的合金,用酒精灯灼烧时,铜会与空气中的氧气反应生成黑色的氧化铜,现象是黄铜表面变黑,而金的化学性质不活泼,高温下也不会与氧气反应,灼烧时黄金表面无明显现象,所以可用酒精灯灼烧来辨别黄铜合金和黄金,B正确;海水中含有NaCl等溶质,晒干纯净水时,水变为气态逸散到空气中,没有物质剩余,晒干海水时,有固体剩余,所以通过晒干能辨别纯净水和海水,C正确;静置沉淀能分离水与不溶性固体,但色素能溶于水,静置沉淀无法将水与色素分离,D错误。]
5.(2024·滨州中考)下列各组物质的鉴别方法、现象及结论均正确的是
( )
选项 物质 鉴别方法 现象及结论
A 一氧化碳和二氧化碳 闻气味 有刺激性气味的气体为一氧化碳,无味的气体为二氧化碳
B 食盐水和蒸馏水 测pH pH<7的液体为食盐水,pH=7的液体为蒸馏水
选项 物质 鉴别方法 现象及结论
C 硫酸铁溶液和硫酸亚铁溶液 观察颜色 浅绿色溶液为硫酸铁溶液,黄色溶液为硫酸亚铁溶液
D 碳酸氢钠和碳酸钠 充分加热 产生使澄清石灰水变浑浊的气体的物质为碳酸氢钠,无明显现象的物质为碳酸钠
√
D [一氧化碳和二氧化碳均没有气味,用闻气味的方法不能鉴别,A错误;食盐水和蒸馏水均呈中性,测pH,均等于7,不能鉴别,B错误;观察颜色,浅绿色溶液为硫酸亚铁溶液,黄色溶液为硫酸铁溶液,C错误;碳酸氢钠在加热条件下生成碳酸钠、水和二氧化碳,充分加热,产生使澄清石灰水变浑浊的气体的物质为碳酸氢钠,无明显现象的物质为碳酸钠,D正确。]
【专题攻略】 物质的检验与鉴别的思路与方法
物质的检验与鉴别是根据物质特有的性质及明显的反应现象,确认某物质是否存在或是否为该物质的实验过程。
1.解题思路
第1步:确定需要检验的物质。
第2步:从物质特有的性质找突破点。
第3步:确定合适的试剂或方法。
2.解题方法
(1)物理方法:根据物质的特殊物理性质,如颜色、气味、水溶性、溶解时放热或者吸热等。
(2)化学方法:利用物质的特殊化学性质或反应时产生的特殊现象(如:颜色改变、放出气体、生成沉淀、放热等),对所给物质进行检验。
3.注意事项
(1)“最少、最简、明显”,即取最少量的试剂,用最简单的方法,可观察到明显不同的现象。
(2)“不许原瓶操作、不许指名道姓”,即鉴别固体、液体时若要加入别的试剂,一定要注意取样方式,防止试剂受到污染。取样时,不能直接指出试剂名称,即不能未检先知。
6.除杂和鉴别都是进行科学探究的重要方式,下列实验设计不能达到目的的是( )
物质的分离与除杂
选项 实验目的 实验设计
A 除去H2中混有的少量HCl气体 先通过NaOH溶液,再通过浓硫酸
B 鉴别稀盐酸与NaCl溶液 分别滴加无色酚酞试液,观察颜色
C 除去Cu粉中混有的少量Fe粉 用磁铁充分吸引
D 鉴别化肥NH4Cl和KNO3 取样,分别加熟石灰研磨,闻气味
√
B [NaOH溶液可与HCl气体反应,而不与氢气反应,再通过浓硫酸进行干燥,故先通过NaOH溶液,再通过浓硫酸,可以除去H2中混有的少量HCl气体,A能达到目的;稀盐酸呈酸性,NaCl溶液呈中性,都不能使无色酚酞试液变色,无法鉴别,B不能达到目的;铁能被磁铁吸引,铜不能被磁铁吸引,用磁铁充分吸引,可以除去Cu粉中混有的少量Fe粉,C能达到目的;氢氧化钙可与氯化铵产生刺激性气味的氨气,和硝酸钾不反应,取样,分别加熟石灰研磨,闻气味,可以鉴别化肥NH4Cl和KNO3,D能达到目的。]
7.除去下列物质中所含的少量杂质,所选试剂正确的是( )
选项 物质 所含杂质 除杂质试剂
A 碳酸钠 氯化钾 适量的水
B 氧化钙 碳酸钙 稀盐酸
C 硫酸亚铁溶液 硫酸铜溶液 过量的铁粉
D 氯化钾溶液 稀盐酸 过量的碳酸钠溶液
√
C [氯化钾、碳酸钠均易溶于水,不能用水除去杂质,不符合除杂原则,A错误;CaO和CaCO3均能与稀盐酸反应,不但能把杂质除去,还会把原物质除去,不符合除杂原则,B错误;过量的铁粉能与硫酸铜溶液反应生成硫酸亚铁溶液和铜,能除去杂质且没有引入新的杂质,符合除杂原则,C正确;稀盐酸能与过量的碳酸钠溶液反应生成氯化钠、水和二氧化碳,能除去杂质但引入了新的杂质氯化钠,不符合除杂原则,D错误。]
8.下列实验设计不能达到实验目的的是( )
选项 实验目的 实验设计
A 除去粗盐中混有的泥沙 溶解、过滤、蒸发
B 分离Cu粉和Fe粉 加入足量稀硫酸,过滤、洗涤、干燥
C 除去KNO3中混有的少量NaCl 降温结晶、过滤
D 除去NaCl中少量Na2CO3 加入足量的稀盐酸充分反应,再蒸发结晶
√
B [泥沙难溶于水,故除去粗盐中的泥沙,可通过溶解、过滤、蒸发的方法,A能达到实验目的;加入足量稀硫酸,铁和稀硫酸反应生成硫酸亚铁和氢气,铜和稀硫酸不反应,过滤、洗涤、干燥,可得到铜,但没有得到铁,达不到分离的目的,B不能达到实验目的;硝酸钾、氯化钠的溶解度均随温度的升高而增加,硝酸钾的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,故硝酸钾中混有少量氯化钠,可采取降温结晶的方法,C能达到实验目的;加入足量稀盐酸,碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,盐酸具有挥发性,氯化氢会挥发出去,可除去杂质,D能达到实验目的。]
【答题模板】 物质的分离与除杂
物质的分离是通过适当的方法,把混合物中的各种物质彼此分开的过程;物质的除杂是通过适当的方法,把混入某物质里的少量杂质除去的过程。
1.解题思路
(1)找出杂质物质或杂质离子。
(2)找出与杂质反应生成气体或沉淀或水的除杂物质或离子。
(3)检查除杂物质或离子是否与被提纯物质反应,应不与提纯物质反应。
(4)确定除杂、分离过程中的主要操作步骤。
2.除杂原则
(1)杂不增:不能引入新的杂质。
(2)主不减:不减少被提纯的物质。
(3)易分离:被提纯的物质与杂质容易分离。
(4)好复原:除杂后要将所得物质恢复为原状态,即原物质是固体的恢复为固体,是溶液的恢复为溶液。
3.常用方法
(1)物理方法:过滤法、结晶法、吸附法。
(2)化学方法:把杂质转化为气体、沉淀、水。
专题一 物质的检验与鉴别、分离与除杂
物质的检验与鉴别、分离与除杂,是对物质的性质、特征反应、特征现象的综合性考查,需要熟悉不同物质的物理和化学性质。考查形式有选择题、科学探究题等,该部分内容注重考查学生综合应用化学知识、解决实际问题的能力。命题内容将密切联系生产和生活实际,注重考核学生运用化学知识、科学方法来分析、解决问题的能力。
1.(2024·聊城中考)下列实验设计及操作不能达到实验目的的是
( )
物质的检验与鉴别
选项 实验目的 实验设计及操作
A 检验一瓶无色气体是否为CO2 向瓶中伸入燃着的木条,观察现象
B 鉴别稀盐酸与稀硫酸 取样,分别滴加少量BaCl2溶液,观察现象
选项 实验目的 实验设计及操作
C 除去CaCl2溶液中的少量稀盐酸 加入过量石灰石,过滤
D 分离Mg(OH)2与NaCl固体混合物 加水溶解、过滤、洗涤、干燥、蒸发结晶
A [能使燃着的木条熄灭的不一定是二氧化碳,氮气、稀有气体也能,A达不到实验目的;硫酸能与氯化钡反应生成白色沉淀,盐酸不与氯化钡反应,无明显现象,B能达到实验目的;氯化钙中含有盐酸时,加入过量碳酸钙,碳酸钙会与盐酸反应生成氯化钙,同时当盐酸完全反应后,碳酸钙也不会溶解,不会引入新杂质,C能达到实验目的;Mg(OH)2与NaCl固体混合物放入水中,前者不溶解,后者溶解,通过过滤、洗涤、干燥可获得Mg(OH)2,通过蒸发结晶可以获得氯化钠固体,D能达到实验目的。]
2.下列实验操作不能达到实验目的的是( )
选项 实验目的 主要实验操作
A 鉴别铵态氮肥和钾肥 取样,分别加入熟石灰混合研磨,闻气味
B 滴加足量的稀盐酸,然后蒸发结晶
C 除去NaCl溶液中混有的CaCl2 滴加碳酸钠溶液至恰好不再产生沉淀为止,然后过滤
D 检验NaOH溶液在空气中部分变质 滴加过量的氯化钡溶液,静置,再向上层清液中滴加酚酞试液
√
B [取样,分别加入熟石灰混合研磨,闻气味,产生有刺激性气味气体的是铵态氮肥,无明显气味的是钾肥,可以鉴别,A能达到实验目的;滴加足量的稀盐酸,碳酸钙能与稀盐酸反应生成氯化钙、水和二氧化碳,然后蒸发结晶,能分离出氯化钙,但无法分离出碳酸钙,B不能达到实验目的;碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,滴加碳酸钠溶液至恰好不再产生沉淀为止,所加试剂为适量,能除去杂质,且没有引入新杂质,经过过滤,就能得到纯净的氯化钠溶液,C能达到实验目的;变质后的氢氧化钠溶液中含有碳酸钠,滴加过量的氯化钡溶液,碳酸钠能与氯化钡反应生成碳酸钡沉淀和氯化钠,静置,再向上层清液中滴加酚酞试液,酚酞试液变红色,说明含有氢氧化钠,可检验溶液在空气中部分变质,D能达到实验目的。]
3.(2024·河南中考)生产、生活中常要区分物质。下列区分物质的试剂或方法正确的是( )
A.用食盐水区分硬水、软水
B.用熟石灰区分氯化铵、硫酸铵
C.用灼烧法区分涤纶、羊毛
D.用燃着的木条区分氮气、二氧化碳
√
C [不能用食盐水区分硬水、软水,可以用肥皂水区分硬水和软水,加入肥皂水后浮渣较多的是硬水,泡沫较多的是软水,故A错误;氯化铵、硫酸铵和熟石灰混合研磨都会产生有刺激性气味的氨气,不能用熟石灰来区分氯化铵、硫酸铵,故B错误;涤纶灼烧有特殊气味,羊毛灼烧有烧焦羽毛的气味,能用灼烧法来区分涤纶、羊毛,故C正确;氮气、二氧化碳都不能燃烧也不支持燃烧,都能使燃着的木条熄灭,不能用燃着的木条区分氮气、二氧化碳,故D错误。]
4.(2024·深圳中考)下列做法不可以完成的是( )
A.辨别空气、N2和O2——将燃着的木条伸入
B.辨别黄铜合金和黄金——用酒精灯烧
C.辨别纯净水和海水——晒干
D.将溶解色素的水分离——静置沉淀
√
D [氧气有助燃性,可以支持燃烧,氮气没有助燃性,不支持燃烧。燃着的木条在空气中继续燃烧,在N2中很快熄灭,在O2中剧烈燃烧,因此,可用燃着的木条辨别空气、N2和O2,A正确;黄铜是铜和锌的合金,用酒精灯灼烧时,铜会与空气中的氧气反应生成黑色的氧化铜,现象是黄铜表面变黑,而金的化学性质不活泼,高温下也不会与氧气反应,灼烧时黄金表面无明显现象,所以可用酒精灯灼烧来辨别黄铜合金和黄金,B正确;海水中含有NaCl等溶质,晒干纯净水时,水变为气态逸散到空气中,没有物质剩余,晒干海水时,有固体剩余,所以通过晒干能辨别纯净水和海水,C正确;静置沉淀能分离水与不溶性固体,但色素能溶于水,静置沉淀无法将水与色素分离,D错误。]
5.(2024·滨州中考)下列各组物质的鉴别方法、现象及结论均正确的是
( )
选项 物质 鉴别方法 现象及结论
A 一氧化碳和二氧化碳 闻气味 有刺激性气味的气体为一氧化碳,无味的气体为二氧化碳
B 食盐水和蒸馏水 测pH pH<7的液体为食盐水,pH=7的液体为蒸馏水
选项 物质 鉴别方法 现象及结论
C 硫酸铁溶液和硫酸亚铁溶液 观察颜色 浅绿色溶液为硫酸铁溶液,黄色溶液为硫酸亚铁溶液
D 碳酸氢钠和碳酸钠 充分加热 产生使澄清石灰水变浑浊的气体的物质为碳酸氢钠,无明显现象的物质为碳酸钠
√
D [一氧化碳和二氧化碳均没有气味,用闻气味的方法不能鉴别,A错误;食盐水和蒸馏水均呈中性,测pH,均等于7,不能鉴别,B错误;观察颜色,浅绿色溶液为硫酸亚铁溶液,黄色溶液为硫酸铁溶液,C错误;碳酸氢钠在加热条件下生成碳酸钠、水和二氧化碳,充分加热,产生使澄清石灰水变浑浊的气体的物质为碳酸氢钠,无明显现象的物质为碳酸钠,D正确。]
【专题攻略】 物质的检验与鉴别的思路与方法
物质的检验与鉴别是根据物质特有的性质及明显的反应现象,确认某物质是否存在或是否为该物质的实验过程。
1.解题思路
第1步:确定需要检验的物质。
第2步:从物质特有的性质找突破点。
第3步:确定合适的试剂或方法。
2.解题方法
(1)物理方法:根据物质的特殊物理性质,如颜色、气味、水溶性、溶解时放热或者吸热等。
(2)化学方法:利用物质的特殊化学性质或反应时产生的特殊现象(如:颜色改变、放出气体、生成沉淀、放热等),对所给物质进行检验。
3.注意事项
(1)“最少、最简、明显”,即取最少量的试剂,用最简单的方法,可观察到明显不同的现象。
(2)“不许原瓶操作、不许指名道姓”,即鉴别固体、液体时若要加入别的试剂,一定要注意取样方式,防止试剂受到污染。取样时,不能直接指出试剂名称,即不能未检先知。
6.除杂和鉴别都是进行科学探究的重要方式,下列实验设计不能达到目的的是( )
物质的分离与除杂
选项 实验目的 实验设计
A 除去H2中混有的少量HCl气体 先通过NaOH溶液,再通过浓硫酸
B 鉴别稀盐酸与NaCl溶液 分别滴加无色酚酞试液,观察颜色
C 除去Cu粉中混有的少量Fe粉 用磁铁充分吸引
D 鉴别化肥NH4Cl和KNO3 取样,分别加熟石灰研磨,闻气味
√
B [NaOH溶液可与HCl气体反应,而不与氢气反应,再通过浓硫酸进行干燥,故先通过NaOH溶液,再通过浓硫酸,可以除去H2中混有的少量HCl气体,A能达到目的;稀盐酸呈酸性,NaCl溶液呈中性,都不能使无色酚酞试液变色,无法鉴别,B不能达到目的;铁能被磁铁吸引,铜不能被磁铁吸引,用磁铁充分吸引,可以除去Cu粉中混有的少量Fe粉,C能达到目的;氢氧化钙可与氯化铵产生刺激性气味的氨气,和硝酸钾不反应,取样,分别加熟石灰研磨,闻气味,可以鉴别化肥NH4Cl和KNO3,D能达到目的。]
7.除去下列物质中所含的少量杂质,所选试剂正确的是( )
选项 物质 所含杂质 除杂质试剂
A 碳酸钠 氯化钾 适量的水
B 氧化钙 碳酸钙 稀盐酸
C 硫酸亚铁溶液 硫酸铜溶液 过量的铁粉
D 氯化钾溶液 稀盐酸 过量的碳酸钠溶液
√
C [氯化钾、碳酸钠均易溶于水,不能用水除去杂质,不符合除杂原则,A错误;CaO和CaCO3均能与稀盐酸反应,不但能把杂质除去,还会把原物质除去,不符合除杂原则,B错误;过量的铁粉能与硫酸铜溶液反应生成硫酸亚铁溶液和铜,能除去杂质且没有引入新的杂质,符合除杂原则,C正确;稀盐酸能与过量的碳酸钠溶液反应生成氯化钠、水和二氧化碳,能除去杂质但引入了新的杂质氯化钠,不符合除杂原则,D错误。]
8.下列实验设计不能达到实验目的的是( )
选项 实验目的 实验设计
A 除去粗盐中混有的泥沙 溶解、过滤、蒸发
B 分离Cu粉和Fe粉 加入足量稀硫酸,过滤、洗涤、干燥
C 除去KNO3中混有的少量NaCl 降温结晶、过滤
D 除去NaCl中少量Na2CO3 加入足量的稀盐酸充分反应,再蒸发结晶
√
B [泥沙难溶于水,故除去粗盐中的泥沙,可通过溶解、过滤、蒸发的方法,A能达到实验目的;加入足量稀硫酸,铁和稀硫酸反应生成硫酸亚铁和氢气,铜和稀硫酸不反应,过滤、洗涤、干燥,可得到铜,但没有得到铁,达不到分离的目的,B不能达到实验目的;硝酸钾、氯化钠的溶解度均随温度的升高而增加,硝酸钾的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,故硝酸钾中混有少量氯化钠,可采取降温结晶的方法,C能达到实验目的;加入足量稀盐酸,碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,盐酸具有挥发性,氯化氢会挥发出去,可除去杂质,D能达到实验目的。]
【答题模板】 物质的分离与除杂
物质的分离是通过适当的方法,把混合物中的各种物质彼此分开的过程;物质的除杂是通过适当的方法,把混入某物质里的少量杂质除去的过程。
1.解题思路
(1)找出杂质物质或杂质离子。
(2)找出与杂质反应生成气体或沉淀或水的除杂物质或离子。
(3)检查除杂物质或离子是否与被提纯物质反应,应不与提纯物质反应。
(4)确定除杂、分离过程中的主要操作步骤。
2.除杂原则
(1)杂不增:不能引入新的杂质。
(2)主不减:不减少被提纯的物质。
(3)易分离:被提纯的物质与杂质容易分离。
(4)好复原:除杂后要将所得物质恢复为原状态,即原物质是固体的恢复为固体,是溶液的恢复为溶液。
3.常用方法
(1)物理方法:过滤法、结晶法、吸附法。
(2)化学方法:把杂质转化为气体、沉淀、水。
同课章节目录
