中考化学复习第七单元微专题4碱“变质”的探究课件
文档属性
| 名称 | 中考化学复习第七单元微专题4碱“变质”的探究课件 |  | |
| 格式 | ppt | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-18 15:58:59 | ||
图片预览









文档简介
(共34张PPT)
微专题4 碱“变质”的探究
第七单元 认识酸和碱
氢氧化钠、氢氧化钙变质的探究是枣庄中考的常考点,考查内容包括:①变质反应的化学方程式;②除杂方法;③变质程度的探究;④保存方法;⑤以及有氢氧化钠、氢氧化钙变质延伸出来的题目,题型多以探究性实验题的形式出现,属于难度较大的题目。
1.为探究一瓶久置的NaOH溶液样品是否变质,进行如下实验:
实验一:取少量样品于试管中,滴加1~2滴酚酞试液,溶液显红色。
实验二:取少量样品于试管中,加入适量稀硫酸,有气泡放出。
实验三:取少量样品于试管中,加入足量的BaCl2溶液,有白色沉淀生成。过滤,向滤液中滴加1~2滴酚酞试液,溶液显红色。
氢氧化钠的变质
下列结论正确的是( )
A.实验一说明NaOH溶液没有变质
B.实验二说明NaOH溶液全部变质
C.实验三中生成的沉淀为Ba(OH)2
D.实验三说明NaOH溶液部分变质
√
D [氢氧化钠溶液和碳酸钠溶液都显碱性,都能使酚酞变红色,A不正确;稀硫酸和氢氧化钠反应生成硫酸钠和水,和碳酸钠反应生成硫酸钠、水和二氧化碳,B不正确;实验三中生成的沉淀是碳酸钠和氯化钡反应生成的碳酸钡沉淀,C不正确;取少量样品于试管中,加入足量的BaCl2溶液,有白色沉淀生成(溶液中含有碳酸钠),过滤,向滤液中滴加1~2滴酚酞试液,溶液显红色,说明溶液中含有氢氧化钠,D项正确。]
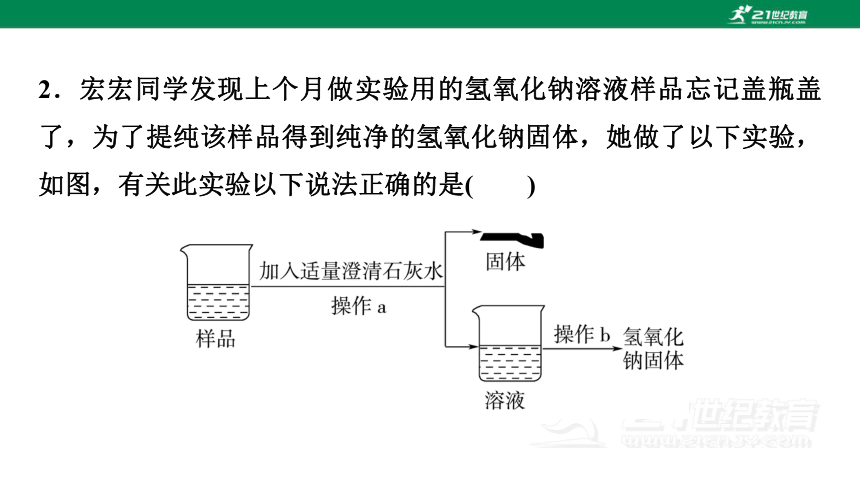
2.宏宏同学发现上个月做实验用的氢氧化钠溶液样品忘记盖瓶盖了,为了提纯该样品得到纯净的氢氧化钠固体,她做了以下实验,如图,有关此实验以下说法正确的是( )
A.操作b是过滤
B.样品没有变质
C.最终所得氢氧化钠固体的质量大于变质后样品中氢氧化钠的质量
D.操作a后得到的溶液中有两种溶质
√
3.(2024·牡丹江中考)兴趣小组对一瓶久置的NaOH固体的变质情况进行了实验探究。
【提出问题】NaOH变质了吗?
【作出猜想】①没有变质 ②已经变质
(1)请用化学方程式表示NaOH能变质的原因
__________________________________________________________。
2NaOH+CO2===Na2CO3+H2O
任务一 定性实验 探究该NaOH固体是否变质
【实验活动1】
(2)兴趣小组设计方案进行如下实验
实验方案 实验现象 实验结论
取少量该NaOH固体样品完全溶于水,加入过量稀盐酸 __________ 猜想②成立依据是____________________
____________________
(用化学方程式表示)
【反思评价】有的同学提出此实验无法确定该NaOH固体变质程度。
产生气泡
Na2CO3+2HCl===
2NaCl+H2O+CO2↑
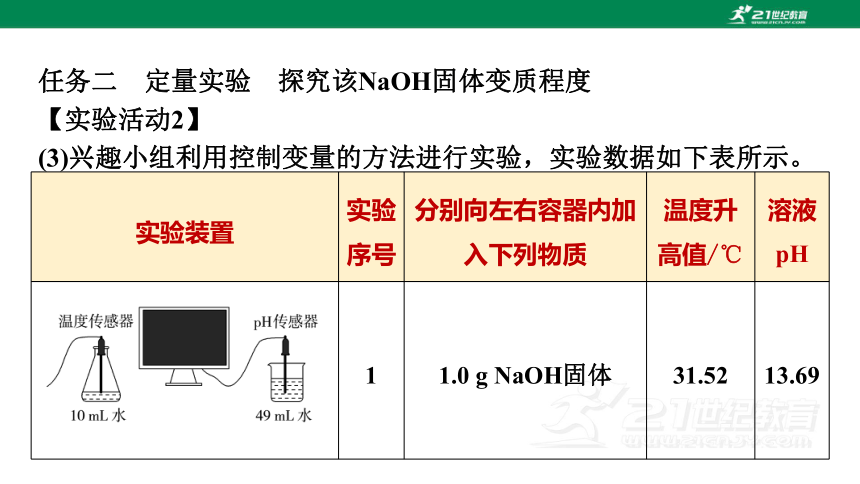
实验装置 实验序号 分别向左右容器内加入下列物质 温度升
高值/℃ 溶液
pH
1 1.0 g NaOH固体 31.52 13.69
任务二 定量实验 探究该NaOH固体变质程度
【实验活动2】
(3)兴趣小组利用控制变量的方法进行实验,实验数据如下表所示。
实验装置 实验序号 分别向左右容器内加入下列物质 温度升
高值/℃ 溶液
pH
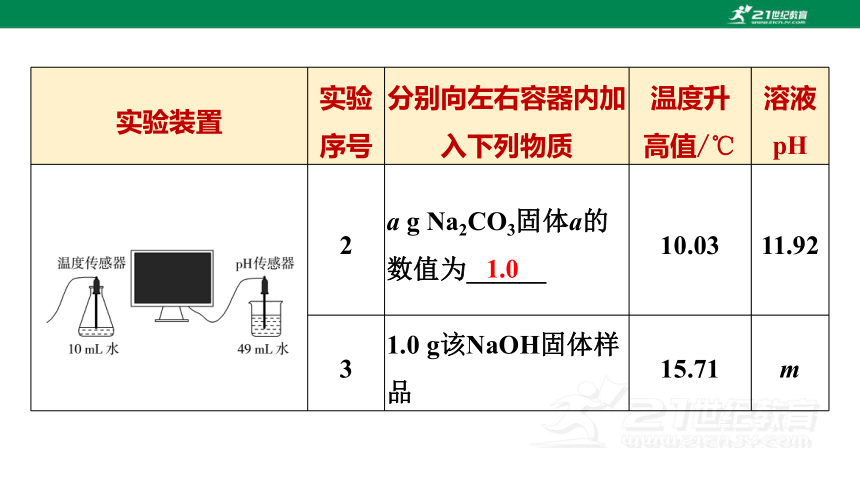
2 a g Na2CO3固体a的数值为______ 10.03 11.92
3 1.0 g该NaOH固体样品 15.71 m
1.0
【实验结论】
(4)小组同学分析温度升高值数据,确定该NaOH固体变质程度是__________,请推测m的取值范围是_____________。
【反思评价】兴趣小组充分认识到定量研究在化学实验中的重要作用。
【拓展延伸】
(5)生活中的管道疏通剂和炉具清洁剂成分中都含有NaOH,包装标签上应注明的注意事项是________(写一条)。
部分变质
11.92密封保存
解析:(1)氢氧化钠能与空气中的二氧化碳反应生成碳酸钠和水,从而变质,该反应的化学方程式为CO2+2NaOH===Na2CO3+H2O。
(2)碳酸钠能与稀盐酸反应生成氯化钠、二氧化碳和水,产生气泡,说明含碳酸钠,说明氢氧化钠已经变质,该反应的化学方程式为Na2CO3+2HCl===2NaCl+H2O+CO2↑。
(3)该实验的目的是探究氢氧化钠固体变质程度,根据控制变量法,加入物质的种类不同,其他因素相同,故加入碳酸钠固体的质量也应是1.0 g,即a的数值为1.0。
(4)由表中数据可知,相同条件下,该氢氧化钠固体样品的温度升高值介于氢氧化钠固体和碳酸钠固体之间,说明该 NaOH 固体变质程度是部分变质;该氢氧化钠固体部分变质,即该氢氧化钠固体样品中含氢氧化钠和碳酸钠,故其溶液的pH应介于实验1和实验2之间,即m的取值范围是11.92<m<13.69。
(5)生活中的管道疏通剂和炉具清洁剂成分中都含有 NaOH ,氢氧化钠能与空气中的二氧化碳反应,故包装标签上应注明的注意事项是密封保存。
【专题攻略】 解答氢氧化钠变质问题的解题模型如下:
说明:(1)检验氢氧化钠是否变质,必须加入过量的酸,因为当氢氧化钠和碳酸钠同时存在时,酸先与氢氧化钠反应。
(2)不能用氢氧化钡或氢氧化钙除去碳酸钠的原因:氢氧化钡或氢氧化钙在除去碳酸钠的同时会引入OH-,对后面OH-的检验造成干扰。
4.为了探究存放于实验室的半瓶氢氧化钙粉末是否变质,某化学实验兴趣小组进行了下述实验:
提出问题:这瓶氢氧化钙是否已经变质?
猜想与假设:
(1)同学们经过讨论认为样品存在三种可能情况,Ⅰ.没有变质;Ⅱ.部分变质;Ⅲ.完全变质,成分是________(填化学式)。
氢氧化钙的变质
CaCO3
(2)设计方案、进行实验:
a.取少量样品于小烧杯中,加入适量水,充分搅拌,过滤,得滤液A和滤渣B。
b.取少量滤渣B于试管中,加适量_________________,有大量气泡产生,说明氢氧化钙已经变质。
c.取少量滤液A于试管中,滴加______________,试液变红,确定氢氧化钙部分变质。
稀盐酸(或稀硝酸)
无色酚酞试液
(3)氢氧化钙变质的原因是:__________________________________
(用化学方程式表示)。
(4)氢氧化钙俗称熟石灰,用途广泛,农业上常用来_______________。
Ca(OH)2+CO2===CaCO3↓+H2O
中和酸性土壤
解析:(1)氢氧化钙变质是由于Ca(OH)2与空气中的二氧化碳发生化学反应的缘故,反应生成碳酸钙和水,若氢氧化钙完全变质,则成分是CaCO3。
(2)b.氢氧化钙变质后,生成碳酸钙,检验氢氧化钙是否变质,即证明存在碳酸钙,可加入稀盐酸(或稀硝酸),酸与碳酸钙反应生成二氧化碳,根据有气泡产生,说明氢氧化钙已经变质;
c.氢氧化钙的溶液显碱性,加入无色酚酞试液,根据酚酞试液变红,确定氢氧化钙部分变质。
5.为提高实验探究能力,某化学兴趣小组的同学在老师的指导下,对一瓶久置出现变质硬化的氢氧化钙固体进行如下探究活动。
【探究活动一】检验硬化的氢氧化钙样品是否完全变质
(1)用化学方程式表示氢氧化钙变质的原因:
_____________________________________。
Ca(OH)2+CO2===CaCO3↓+H2O
(2)检验氢氧化钙样品是否完全变质,进行如下实验:
实验步骤 实验现象 实验结论
取氢氧化钙样品少量,研细后加适量蒸馏水充分混合后静置,滴入2~3滴无色酚酞试液 ___________ 该样品还含有氢氧化钙
溶液变红色
【探究活动二】测定样品中含有的变质固体(以下用R表示)的质量分数。
取3 g部分变质的氢氧化钙样品与足量的稀盐酸反应,测量生成气体的体积(气体不溶于植物油),从而计算出样品中R的质量,便可求出样品中R的质量分数。实验装置(气密性良好)如图1所示。
(3)将稀盐酸滴入样品中,发生中和反应的化学方程式为__________
_________________________,反应一段时间后,当观察到____________(填实验现象),停止滴加稀盐酸。
Ca(OH)2+
2HCl===CaCl2+2H2O
不再产生气泡
(4)实验结束后,量筒内进入水的体积如图2所示,其读数为________ mL。将量筒内进入水的体积作为生成二氧化碳体积来计算,R的质量分数为________(已知在该实验条件下,生成气体的密度为2 g·L-1)。
165.0
25%
(5)如(4)中测出的R的质量分数不够准确,若要较准确测出样品中R的质量分数,还应测得的实验数据是__________________________。
加入烧瓶中稀盐酸的体积
(3)将稀盐酸滴入样品中,发生的中和反应是样品中的氢氧化钙与稀盐酸反应生成氯化钙和水,故反应的化学方程式为Ca(OH)2+2HCl===CaCl2+2H2O;向样品中加入稀盐酸,由于中和反应优先发生,则稀盐酸先与氢氧化钙反应,当氢氧化钙完全反应后,加入的稀盐酸与碳酸钙反应生成氯化钙、水和二氧化碳,产生气泡,所以当观察到不再产生气泡时,表明碳酸钙完全反应,停止滴加稀盐酸。
(4)由图可知,量筒内液体的体积数为165.0 mL。
(5)滴加稀盐酸后,烧瓶内稀盐酸也占用部分体积,计算时应减去这部分体积,所以要较准确测出样品中R的质量分数,还应测得的实验数据是加入烧瓶中稀盐酸的体积。
【专题攻略】 解答氢氧化钙变质问题的答题模板:
要注意在探究CaO是否变质时,应先加水观察是否有放热现象,确定样品中是否含有CaO。
微专题4 碱“变质”的探究
第七单元 认识酸和碱
氢氧化钠、氢氧化钙变质的探究是枣庄中考的常考点,考查内容包括:①变质反应的化学方程式;②除杂方法;③变质程度的探究;④保存方法;⑤以及有氢氧化钠、氢氧化钙变质延伸出来的题目,题型多以探究性实验题的形式出现,属于难度较大的题目。
1.为探究一瓶久置的NaOH溶液样品是否变质,进行如下实验:
实验一:取少量样品于试管中,滴加1~2滴酚酞试液,溶液显红色。
实验二:取少量样品于试管中,加入适量稀硫酸,有气泡放出。
实验三:取少量样品于试管中,加入足量的BaCl2溶液,有白色沉淀生成。过滤,向滤液中滴加1~2滴酚酞试液,溶液显红色。
氢氧化钠的变质
下列结论正确的是( )
A.实验一说明NaOH溶液没有变质
B.实验二说明NaOH溶液全部变质
C.实验三中生成的沉淀为Ba(OH)2
D.实验三说明NaOH溶液部分变质
√
D [氢氧化钠溶液和碳酸钠溶液都显碱性,都能使酚酞变红色,A不正确;稀硫酸和氢氧化钠反应生成硫酸钠和水,和碳酸钠反应生成硫酸钠、水和二氧化碳,B不正确;实验三中生成的沉淀是碳酸钠和氯化钡反应生成的碳酸钡沉淀,C不正确;取少量样品于试管中,加入足量的BaCl2溶液,有白色沉淀生成(溶液中含有碳酸钠),过滤,向滤液中滴加1~2滴酚酞试液,溶液显红色,说明溶液中含有氢氧化钠,D项正确。]
2.宏宏同学发现上个月做实验用的氢氧化钠溶液样品忘记盖瓶盖了,为了提纯该样品得到纯净的氢氧化钠固体,她做了以下实验,如图,有关此实验以下说法正确的是( )
A.操作b是过滤
B.样品没有变质
C.最终所得氢氧化钠固体的质量大于变质后样品中氢氧化钠的质量
D.操作a后得到的溶液中有两种溶质
√
3.(2024·牡丹江中考)兴趣小组对一瓶久置的NaOH固体的变质情况进行了实验探究。
【提出问题】NaOH变质了吗?
【作出猜想】①没有变质 ②已经变质
(1)请用化学方程式表示NaOH能变质的原因
__________________________________________________________。
2NaOH+CO2===Na2CO3+H2O
任务一 定性实验 探究该NaOH固体是否变质
【实验活动1】
(2)兴趣小组设计方案进行如下实验
实验方案 实验现象 实验结论
取少量该NaOH固体样品完全溶于水,加入过量稀盐酸 __________ 猜想②成立依据是____________________
____________________
(用化学方程式表示)
【反思评价】有的同学提出此实验无法确定该NaOH固体变质程度。
产生气泡
Na2CO3+2HCl===
2NaCl+H2O+CO2↑
实验装置 实验序号 分别向左右容器内加入下列物质 温度升
高值/℃ 溶液
pH
1 1.0 g NaOH固体 31.52 13.69
任务二 定量实验 探究该NaOH固体变质程度
【实验活动2】
(3)兴趣小组利用控制变量的方法进行实验,实验数据如下表所示。
实验装置 实验序号 分别向左右容器内加入下列物质 温度升
高值/℃ 溶液
pH
2 a g Na2CO3固体a的数值为______ 10.03 11.92
3 1.0 g该NaOH固体样品 15.71 m
1.0
【实验结论】
(4)小组同学分析温度升高值数据,确定该NaOH固体变质程度是__________,请推测m的取值范围是_____________。
【反思评价】兴趣小组充分认识到定量研究在化学实验中的重要作用。
【拓展延伸】
(5)生活中的管道疏通剂和炉具清洁剂成分中都含有NaOH,包装标签上应注明的注意事项是________(写一条)。
部分变质
11.92
解析:(1)氢氧化钠能与空气中的二氧化碳反应生成碳酸钠和水,从而变质,该反应的化学方程式为CO2+2NaOH===Na2CO3+H2O。
(2)碳酸钠能与稀盐酸反应生成氯化钠、二氧化碳和水,产生气泡,说明含碳酸钠,说明氢氧化钠已经变质,该反应的化学方程式为Na2CO3+2HCl===2NaCl+H2O+CO2↑。
(3)该实验的目的是探究氢氧化钠固体变质程度,根据控制变量法,加入物质的种类不同,其他因素相同,故加入碳酸钠固体的质量也应是1.0 g,即a的数值为1.0。
(4)由表中数据可知,相同条件下,该氢氧化钠固体样品的温度升高值介于氢氧化钠固体和碳酸钠固体之间,说明该 NaOH 固体变质程度是部分变质;该氢氧化钠固体部分变质,即该氢氧化钠固体样品中含氢氧化钠和碳酸钠,故其溶液的pH应介于实验1和实验2之间,即m的取值范围是11.92<m<13.69。
(5)生活中的管道疏通剂和炉具清洁剂成分中都含有 NaOH ,氢氧化钠能与空气中的二氧化碳反应,故包装标签上应注明的注意事项是密封保存。
【专题攻略】 解答氢氧化钠变质问题的解题模型如下:
说明:(1)检验氢氧化钠是否变质,必须加入过量的酸,因为当氢氧化钠和碳酸钠同时存在时,酸先与氢氧化钠反应。
(2)不能用氢氧化钡或氢氧化钙除去碳酸钠的原因:氢氧化钡或氢氧化钙在除去碳酸钠的同时会引入OH-,对后面OH-的检验造成干扰。
4.为了探究存放于实验室的半瓶氢氧化钙粉末是否变质,某化学实验兴趣小组进行了下述实验:
提出问题:这瓶氢氧化钙是否已经变质?
猜想与假设:
(1)同学们经过讨论认为样品存在三种可能情况,Ⅰ.没有变质;Ⅱ.部分变质;Ⅲ.完全变质,成分是________(填化学式)。
氢氧化钙的变质
CaCO3
(2)设计方案、进行实验:
a.取少量样品于小烧杯中,加入适量水,充分搅拌,过滤,得滤液A和滤渣B。
b.取少量滤渣B于试管中,加适量_________________,有大量气泡产生,说明氢氧化钙已经变质。
c.取少量滤液A于试管中,滴加______________,试液变红,确定氢氧化钙部分变质。
稀盐酸(或稀硝酸)
无色酚酞试液
(3)氢氧化钙变质的原因是:__________________________________
(用化学方程式表示)。
(4)氢氧化钙俗称熟石灰,用途广泛,农业上常用来_______________。
Ca(OH)2+CO2===CaCO3↓+H2O
中和酸性土壤
解析:(1)氢氧化钙变质是由于Ca(OH)2与空气中的二氧化碳发生化学反应的缘故,反应生成碳酸钙和水,若氢氧化钙完全变质,则成分是CaCO3。
(2)b.氢氧化钙变质后,生成碳酸钙,检验氢氧化钙是否变质,即证明存在碳酸钙,可加入稀盐酸(或稀硝酸),酸与碳酸钙反应生成二氧化碳,根据有气泡产生,说明氢氧化钙已经变质;
c.氢氧化钙的溶液显碱性,加入无色酚酞试液,根据酚酞试液变红,确定氢氧化钙部分变质。
5.为提高实验探究能力,某化学兴趣小组的同学在老师的指导下,对一瓶久置出现变质硬化的氢氧化钙固体进行如下探究活动。
【探究活动一】检验硬化的氢氧化钙样品是否完全变质
(1)用化学方程式表示氢氧化钙变质的原因:
_____________________________________。
Ca(OH)2+CO2===CaCO3↓+H2O
(2)检验氢氧化钙样品是否完全变质,进行如下实验:
实验步骤 实验现象 实验结论
取氢氧化钙样品少量,研细后加适量蒸馏水充分混合后静置,滴入2~3滴无色酚酞试液 ___________ 该样品还含有氢氧化钙
溶液变红色
【探究活动二】测定样品中含有的变质固体(以下用R表示)的质量分数。
取3 g部分变质的氢氧化钙样品与足量的稀盐酸反应,测量生成气体的体积(气体不溶于植物油),从而计算出样品中R的质量,便可求出样品中R的质量分数。实验装置(气密性良好)如图1所示。
(3)将稀盐酸滴入样品中,发生中和反应的化学方程式为__________
_________________________,反应一段时间后,当观察到____________(填实验现象),停止滴加稀盐酸。
Ca(OH)2+
2HCl===CaCl2+2H2O
不再产生气泡
(4)实验结束后,量筒内进入水的体积如图2所示,其读数为________ mL。将量筒内进入水的体积作为生成二氧化碳体积来计算,R的质量分数为________(已知在该实验条件下,生成气体的密度为2 g·L-1)。
165.0
25%
(5)如(4)中测出的R的质量分数不够准确,若要较准确测出样品中R的质量分数,还应测得的实验数据是__________________________。
加入烧瓶中稀盐酸的体积
(3)将稀盐酸滴入样品中,发生的中和反应是样品中的氢氧化钙与稀盐酸反应生成氯化钙和水,故反应的化学方程式为Ca(OH)2+2HCl===CaCl2+2H2O;向样品中加入稀盐酸,由于中和反应优先发生,则稀盐酸先与氢氧化钙反应,当氢氧化钙完全反应后,加入的稀盐酸与碳酸钙反应生成氯化钙、水和二氧化碳,产生气泡,所以当观察到不再产生气泡时,表明碳酸钙完全反应,停止滴加稀盐酸。
(4)由图可知,量筒内液体的体积数为165.0 mL。
(5)滴加稀盐酸后,烧瓶内稀盐酸也占用部分体积,计算时应减去这部分体积,所以要较准确测出样品中R的质量分数,还应测得的实验数据是加入烧瓶中稀盐酸的体积。
【专题攻略】 解答氢氧化钙变质问题的答题模板:
要注意在探究CaO是否变质时,应先加水观察是否有放热现象,确定样品中是否含有CaO。
同课章节目录
