中考化学复习第五单元跨学科实践活动3基于绿色化学探究实验室制氧气的原理课件
文档属性
| 名称 | 中考化学复习第五单元跨学科实践活动3基于绿色化学探究实验室制氧气的原理课件 |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-18 15:58:59 | ||
图片预览











文档简介
(共39张PPT)
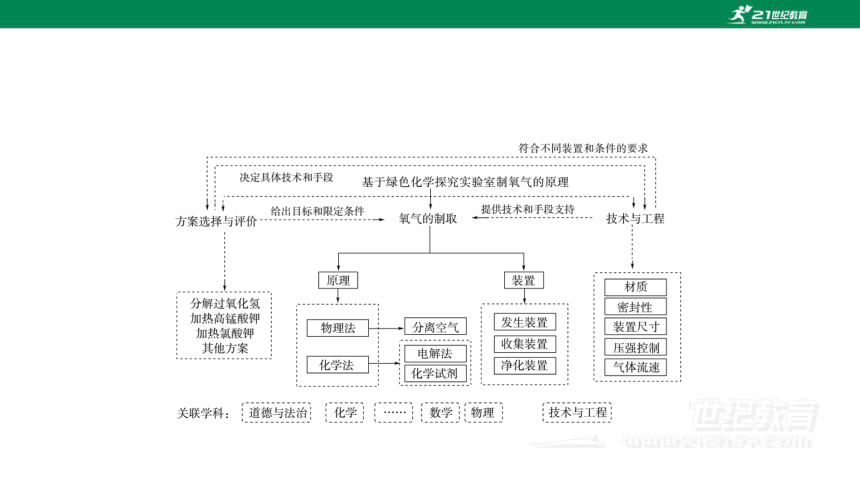
跨学科实践活动3 基于绿色化学探究实验室制氧气的原理
第五单元 定量研究化学反应
学科串联
知识储备
1.任务界定:了解绿色化学原则,明确绿色化学的原则及操作规程;明确可以评估一个化学反应对环境的友好程度的具体项目、标准。
2.建构模型:设计并完成各种装置、条件下制取氧气的实验,初步建立基于绿色化学探究实验室制氧气的一般程序和方法,形成模型。
3.制作产品:建立模型之后,应用模型,从实际需求出发,尽量选择日常生活中常见的一些材料,小组合作动手制作供氧器,通过多轮次的“设计—行动—反思”对涉及的方案进行实验和优化。
4.反思交流:展示、交流和评价设计的实验方案及评价方式,反思和总结基于绿色化学探究实验室制氧气方案的设计和评价的经验,提炼解决作品制作类问题的思路与方法。
1.绿色化学又称为环境友好化学,下列有关“绿色化学”的理解,不正确的是( )
A.其核心是利用化学原理从源头消除污染
B.原料及产物均无毒无害或低毒低害
C.不需要化学工艺的纯天然产品的开发和研制
D.充分利用资源和能源,最大限度地提高生产效率,力图使原料的原子全部转化为最终产品
体验探究
题号
1
3
5
2
4
6
7
√
C [绿色化学的核心是要利用化学原理从源头上减少或消除污染,A正确;绿色化学所用原料及产物均无毒无害或低毒低害,B正确;“绿色化学”要求化学反应产率高,副产物少,即“化学反应绿色化”,要求原料物质中的所有原子完全被利用,全部转入期望的产物中,而不是不需要化学工艺的纯天然产品的开发和研制,C错误;“绿色化学”要求化学反应产率高,副产物少,最大限度地提高生产效率,D正确。]
题号
1
3
5
2
4
6
7
2.鱼苗在长途运输中,通常将鱼苗养在相对密闭的容器内,加入某种药品,使容器内满足下列条件才能保持鱼苗的存活:充足的氧气、及时除去鱼苗呼出的CO2,水的pH调节在8左右,碱性不能太强。现有以下四种物质供选择:双氧水、过氧化钙(CaO2)、过氧化钠(Na2O2)、氯酸钾。它们的有关化学性质如下:
(1)2H2O2===2H2O+O2↑
(2)2Na2O2+2H2O===4NaOH+O2↑
(3)2Na2 O2+2CO2===2Na2CO3+O2
题号
1
3
5
2
4
6
7
(4)2CaO2+2H2O===2Ca(OH)2+O2↑
(5)2CaO2+2CO2===2CaCO3↓+O2
(6)KClO3不与H2 O、CO2反应
在鱼苗长途运输中你认为最适合加入的物质是( )
A.双氧水 B.过氧化钙
C.过氧化钠 D.氯酸钾
√
题号
1
3
5
2
4
6
7
B [双氧水虽能制取氧气,但不能消耗二氧化碳,A不符合题意;因为2CaO2+2H2O===2Ca(OH)2+O2↑,有氧气生成,且Ca(OH)2在水中的溶解性较弱,也可以同时消耗二氧化碳,可维持氧气和二氧化碳的平衡,B符合题意;过氧化钠虽能制取氧气,但与水反应生成的氢氧化钠为强碱,碱性太强,C不符合题意;氯酸钾不与H2O、CO2反应,而它需要加热与二氧化锰作催化剂的条件下,才能进行反应,D不符合题意。]
题号
1
3
5
2
4
6
7
3.绿色化学期望化工生产时原料中的原子全部转入产品中,即为零排放。一定条件下CO2、H2按不同比例反应获得以下产品,其中能实现零排放的是( )
A.乙醇(C2H6O) B.甲醇(CH4O)
C.乙烯(C2H4) D.甲酸(CH2O2)
√
题号
1
3
5
2
4
6
7
D [反应前是CO2和H2,H2中不含氧元素,所以生成物中的氧元素全部来自CO2,化学反应前后原子个数不变,二氧化碳分子中的碳原子和氧原子个数比是1∶2,要实现零排放,生成物中的碳原子和氧原子个数比是1∶2,据此分析可知:乙醇(C2H6O)分子中碳原子和氧原子个数比是2∶1,不是1∶2,A错误;甲醇(CH4O)分子中碳原子和氧原子个数比是1∶1,不是1∶2,B错误;乙烯(C2H4)分子中不含有氧元素,不符合质量守恒定律,C错误;甲酸(CH2O2)分子中碳原子和氧原子个数比是1∶2,D正确。]
题号
1
3
5
2
4
6
7
√
题号
1
3
5
2
4
6
7
C [因为A和B都要消耗能源,D尽管不消耗能源,但不如C既不消耗能源又能消耗潜水艇中工作人员呼吸过程中产生的二氧化碳,故选C。]
题号
1
3
5
2
4
6
7
5.有六种途径可以制得氧气,如图所示:
(1)写出A、F两种途径反应的化学方程式。
A:____________________________________________________;
F:____________________________________________________。
题号
1
3
5
2
4
6
7
(2)A、F这两种途径的基本反应类型是____________。
(3)______(填字母)途径发生的是物理变化。
(4)为了使A、F两种途径更快地制取氧气,还需要加入_________。
(5)根据“绿色化学”理念,____(填字母)途径是实验室制氧气的最佳方法。
(6)使用C途径制氧之前要在水中加入硫酸钠或氢氧化钠,其目的是_______________________。
分解反应
D
二氧化锰
A
增强溶液的导电性
题号
1
3
5
2
4
6
7
题号
1
3
5
2
4
6
7
(4)为了使 A、F 两种途径更快地制取氧气,还需要加入催化剂,加快化学反应速率,在这两个反应中,通常加入二氧化锰作催化剂。
(5)过氧化氢在二氧化锰的催化下分解生成水和氧气,无污染,且在常温下进行,节约能源,是实验室制取氧气的最佳方法,故填:A。
(6)C途径制氧气为通电分解水,水是电的弱导体,因此通电前在水中加入硫酸钠或氢氧化钠,来增强溶液的导电性。
题号
1
3
5
2
4
6
7
6.氧气是我们赖以生存的物质。请同学们随着以下线索开展研究之旅。
【生物学知识回顾】
(1)空气中氧气的来源主要是通过植物的___________产生。
【实验室制氧气】
实验室制取氧气的方法有三种:加热高锰酸钾,在二氧化锰作催化剂的条件下分解过氧化氢,在加热和二氧化锰作催化剂的条件下分解氯酸钾。
光合作用
题号
1
3
5
2
4
6
7
(2)上述方案中,符合“绿色化学”要求的是____________________
____________________,写出其发生反应的化学方程式:________
______________________。
(3)实验室用高锰酸钾制取氧气,在图1中选用的发生装置和收集装置是____________。
在二氧化锰作催化剂
条件下分解过氧化氢
2H2O2
AC(或AE)
题号
1
3
5
2
4
6
7
【家用供氧机制氧气】
(4)图2是学生制作的简易供氧器。在供氧使用时,左瓶中可放置的药品是____;
A.高锰酸钾
B.氯酸钾和二氧化锰
C.大理石和稀盐酸
D.过氧化氢溶液和二氧化锰
D
题号
1
3
5
2
4
6
7
(5)简易供氧器的右瓶中需加入适量的水,水的作用是________。
A.可通过气泡观察氧气生成速率
B.提高氧气浓度
C.加快氧气的生成
D.增加氧气的湿度
AD
题号
1
3
5
2
4
6
7
【太空舱中制氧气】
(6)太空舱常利用高铁酸镍(NiFe2O4)作催化剂将宇航员呼出的二氧化碳分解为氧气和碳。假设一名宇航员平均每天消耗720 g氧气,则每天参加反应的二氧化碳质量至少________g。
【医用分子筛式制氧机】
(7)运用分子筛将电机抽入的空气中的二氧化碳和氮气进行吸附,得到较纯的氧气。这种制氧机很难在户外急救供氧使用,可能的原因之一是_________________________。
990
需要消耗电能(合理即可)
题号
1
3
5
2
4
6
7
题号
1
3
5
2
4
6
7
(3)高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,该反应的反应物是固体,反应条件是加热,属于固体加热型,氧气密度大于空气,不易溶于水,可用向上排空气法收集或排水法收集,在图1中选用的发生装置和收集装置是AC或AE。
(4)图2是学生制作的简易供氧器。由于不需要加热,在供氧使用时,左瓶中可放置的药品是过氧化氢溶液和二氧化锰,D符合题意。
题号
1
3
5
2
4
6
7
题号
1
3
5
2
4
6
7
(7)这种制氧机很难用在户外急救供氧,其可能的原因之一是这种制氧机需消耗电能,户外不能满足此条件(答案合理即可)。
题号
1
3
5
2
4
6
7
7.氧气是人类无法离开的物质,氧气的获得有多种方法。
Ⅰ.自然界获得氧气
如图1所示,自然界通过绿色植物的光合作用获得O2
题号
1
3
5
2
4
6
7
(1)光合作用是大自然利用________(填一种能量名称)最成功的范例。
(2)试写出绿色植物光合作用的化学方程式:____________________
___________________。
Ⅱ.工业获得氧气
在低温条件下加压,使空气变为液态,然后升温,使氮气首先从液态空气中蒸发出来,剩下的主要是液态氧,将其贮存在钢瓶中。
(3)空气变为液态,微粒间的空隙________(填“变大”“变小”或“不变”)。
(4)液氮的沸点________液氧的沸点(填“>”“<”或“=”)。
太阳能
C6H12O6+6O2
变小
<
题号
1
3
5
2
4
6
7
Ⅲ.实验室获得氧气
实验室里常用加热KMnO4或MnO2催化H2O2溶液分解制取氧气。
(5)从图2选择仪器组装装置,完成用KMnO4制取并用排水法收集氧气实验,需选择a、b、c、e、g、________(填字母序号);该反应的化学方程式为_____________________________________。
h
题号
1
3
5
2
4
6
7
(6)用H2O2溶液和MnO2制备氧气,发生装置从图2选择仪器d、f后,还需增加____________(填一种仪器名称)。若利用图3所示空塑料输液袋收集制得的氧气,氧气应从________(填“a”或“b”)端进入。
长颈漏斗
a
题号
1
3
5
2
4
6
7
Ⅳ.家庭获得氧气
某品牌家庭制氧机是利用分子筛制氧,空气经过分子筛时氮气被吸附、氧气通过,获得高浓度的氧气。其微观示意图如图4:
题号
1
3
5
2
4
6
7
(7)分子筛制氧的过程属于________(填“物理”或“化学”)变化。
(8)分子筛制氧的原理类似于化学实验中的________(填操作名称)。
物理
过滤
题号
1
3
5
2
4
6
7
Ⅴ.空间站获得氧气
基于图5所示原理,研制的氧气循环再生组件成功应用于我国天宫空间站。
题号
1
3
5
2
4
6
7
(9)反应Ⅰ需要在催化剂和加热的条件下才能发生,写出该反应的化
学方程式:_________________________________________。
(10)氧气循环再生过程中需要定期补充一定量的水,可能的原因是___________________________________________________________
_______。
循环再生过程中生成了CH4,而CH4不参与循环再生过程,消耗了氢元素
题号
1
3
5
2
4
6
7
题号
1
3
5
2
4
6
7
题号
1
3
5
2
4
6
7
(6)用H2O2溶液和MnO2制备氧气,属于固液不加热反应,发生装置从图2选择仪器d、f后,由于f是双孔塞,故还需要增加的仪器是长颈漏斗。若利用图3所示空塑料输液袋收集制得的氧气,氧气的密度比空气大,氧气应从a端进入。
(7)分子筛制氧的原理是空气经过分子筛时氮气被吸附、氧气通过,无新物质生成,属于物理变化。
题号
1
3
5
2
4
6
7
题号
1
3
5
2
4
6
7
(10)氧气循环再生过程中,水电解生成H2和O2,再通过呼吸作用产生CO2,CO2和H2在催化剂、加热的条件下生成CH4和H2O,由于循环再生过程中生成了CH4,而CH4不参与循环再生过程,消耗了氢元素,根据质量守恒定律,反应前后元素种类和质量不变,因此要定期补充一定量的水,故填:循环再生过程中生成了CH4,而CH4不参与循环再生过程,消耗了氢元素。
题号
1
3
5
2
4
6
7
跨学科实践活动3 基于绿色化学探究实验室制氧气的原理
第五单元 定量研究化学反应
学科串联
知识储备
1.任务界定:了解绿色化学原则,明确绿色化学的原则及操作规程;明确可以评估一个化学反应对环境的友好程度的具体项目、标准。
2.建构模型:设计并完成各种装置、条件下制取氧气的实验,初步建立基于绿色化学探究实验室制氧气的一般程序和方法,形成模型。
3.制作产品:建立模型之后,应用模型,从实际需求出发,尽量选择日常生活中常见的一些材料,小组合作动手制作供氧器,通过多轮次的“设计—行动—反思”对涉及的方案进行实验和优化。
4.反思交流:展示、交流和评价设计的实验方案及评价方式,反思和总结基于绿色化学探究实验室制氧气方案的设计和评价的经验,提炼解决作品制作类问题的思路与方法。
1.绿色化学又称为环境友好化学,下列有关“绿色化学”的理解,不正确的是( )
A.其核心是利用化学原理从源头消除污染
B.原料及产物均无毒无害或低毒低害
C.不需要化学工艺的纯天然产品的开发和研制
D.充分利用资源和能源,最大限度地提高生产效率,力图使原料的原子全部转化为最终产品
体验探究
题号
1
3
5
2
4
6
7
√
C [绿色化学的核心是要利用化学原理从源头上减少或消除污染,A正确;绿色化学所用原料及产物均无毒无害或低毒低害,B正确;“绿色化学”要求化学反应产率高,副产物少,即“化学反应绿色化”,要求原料物质中的所有原子完全被利用,全部转入期望的产物中,而不是不需要化学工艺的纯天然产品的开发和研制,C错误;“绿色化学”要求化学反应产率高,副产物少,最大限度地提高生产效率,D正确。]
题号
1
3
5
2
4
6
7
2.鱼苗在长途运输中,通常将鱼苗养在相对密闭的容器内,加入某种药品,使容器内满足下列条件才能保持鱼苗的存活:充足的氧气、及时除去鱼苗呼出的CO2,水的pH调节在8左右,碱性不能太强。现有以下四种物质供选择:双氧水、过氧化钙(CaO2)、过氧化钠(Na2O2)、氯酸钾。它们的有关化学性质如下:
(1)2H2O2===2H2O+O2↑
(2)2Na2O2+2H2O===4NaOH+O2↑
(3)2Na2 O2+2CO2===2Na2CO3+O2
题号
1
3
5
2
4
6
7
(4)2CaO2+2H2O===2Ca(OH)2+O2↑
(5)2CaO2+2CO2===2CaCO3↓+O2
(6)KClO3不与H2 O、CO2反应
在鱼苗长途运输中你认为最适合加入的物质是( )
A.双氧水 B.过氧化钙
C.过氧化钠 D.氯酸钾
√
题号
1
3
5
2
4
6
7
B [双氧水虽能制取氧气,但不能消耗二氧化碳,A不符合题意;因为2CaO2+2H2O===2Ca(OH)2+O2↑,有氧气生成,且Ca(OH)2在水中的溶解性较弱,也可以同时消耗二氧化碳,可维持氧气和二氧化碳的平衡,B符合题意;过氧化钠虽能制取氧气,但与水反应生成的氢氧化钠为强碱,碱性太强,C不符合题意;氯酸钾不与H2O、CO2反应,而它需要加热与二氧化锰作催化剂的条件下,才能进行反应,D不符合题意。]
题号
1
3
5
2
4
6
7
3.绿色化学期望化工生产时原料中的原子全部转入产品中,即为零排放。一定条件下CO2、H2按不同比例反应获得以下产品,其中能实现零排放的是( )
A.乙醇(C2H6O) B.甲醇(CH4O)
C.乙烯(C2H4) D.甲酸(CH2O2)
√
题号
1
3
5
2
4
6
7
D [反应前是CO2和H2,H2中不含氧元素,所以生成物中的氧元素全部来自CO2,化学反应前后原子个数不变,二氧化碳分子中的碳原子和氧原子个数比是1∶2,要实现零排放,生成物中的碳原子和氧原子个数比是1∶2,据此分析可知:乙醇(C2H6O)分子中碳原子和氧原子个数比是2∶1,不是1∶2,A错误;甲醇(CH4O)分子中碳原子和氧原子个数比是1∶1,不是1∶2,B错误;乙烯(C2H4)分子中不含有氧元素,不符合质量守恒定律,C错误;甲酸(CH2O2)分子中碳原子和氧原子个数比是1∶2,D正确。]
题号
1
3
5
2
4
6
7
√
题号
1
3
5
2
4
6
7
C [因为A和B都要消耗能源,D尽管不消耗能源,但不如C既不消耗能源又能消耗潜水艇中工作人员呼吸过程中产生的二氧化碳,故选C。]
题号
1
3
5
2
4
6
7
5.有六种途径可以制得氧气,如图所示:
(1)写出A、F两种途径反应的化学方程式。
A:____________________________________________________;
F:____________________________________________________。
题号
1
3
5
2
4
6
7
(2)A、F这两种途径的基本反应类型是____________。
(3)______(填字母)途径发生的是物理变化。
(4)为了使A、F两种途径更快地制取氧气,还需要加入_________。
(5)根据“绿色化学”理念,____(填字母)途径是实验室制氧气的最佳方法。
(6)使用C途径制氧之前要在水中加入硫酸钠或氢氧化钠,其目的是_______________________。
分解反应
D
二氧化锰
A
增强溶液的导电性
题号
1
3
5
2
4
6
7
题号
1
3
5
2
4
6
7
(4)为了使 A、F 两种途径更快地制取氧气,还需要加入催化剂,加快化学反应速率,在这两个反应中,通常加入二氧化锰作催化剂。
(5)过氧化氢在二氧化锰的催化下分解生成水和氧气,无污染,且在常温下进行,节约能源,是实验室制取氧气的最佳方法,故填:A。
(6)C途径制氧气为通电分解水,水是电的弱导体,因此通电前在水中加入硫酸钠或氢氧化钠,来增强溶液的导电性。
题号
1
3
5
2
4
6
7
6.氧气是我们赖以生存的物质。请同学们随着以下线索开展研究之旅。
【生物学知识回顾】
(1)空气中氧气的来源主要是通过植物的___________产生。
【实验室制氧气】
实验室制取氧气的方法有三种:加热高锰酸钾,在二氧化锰作催化剂的条件下分解过氧化氢,在加热和二氧化锰作催化剂的条件下分解氯酸钾。
光合作用
题号
1
3
5
2
4
6
7
(2)上述方案中,符合“绿色化学”要求的是____________________
____________________,写出其发生反应的化学方程式:________
______________________。
(3)实验室用高锰酸钾制取氧气,在图1中选用的发生装置和收集装置是____________。
在二氧化锰作催化剂
条件下分解过氧化氢
2H2O2
AC(或AE)
题号
1
3
5
2
4
6
7
【家用供氧机制氧气】
(4)图2是学生制作的简易供氧器。在供氧使用时,左瓶中可放置的药品是____;
A.高锰酸钾
B.氯酸钾和二氧化锰
C.大理石和稀盐酸
D.过氧化氢溶液和二氧化锰
D
题号
1
3
5
2
4
6
7
(5)简易供氧器的右瓶中需加入适量的水,水的作用是________。
A.可通过气泡观察氧气生成速率
B.提高氧气浓度
C.加快氧气的生成
D.增加氧气的湿度
AD
题号
1
3
5
2
4
6
7
【太空舱中制氧气】
(6)太空舱常利用高铁酸镍(NiFe2O4)作催化剂将宇航员呼出的二氧化碳分解为氧气和碳。假设一名宇航员平均每天消耗720 g氧气,则每天参加反应的二氧化碳质量至少________g。
【医用分子筛式制氧机】
(7)运用分子筛将电机抽入的空气中的二氧化碳和氮气进行吸附,得到较纯的氧气。这种制氧机很难在户外急救供氧使用,可能的原因之一是_________________________。
990
需要消耗电能(合理即可)
题号
1
3
5
2
4
6
7
题号
1
3
5
2
4
6
7
(3)高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,该反应的反应物是固体,反应条件是加热,属于固体加热型,氧气密度大于空气,不易溶于水,可用向上排空气法收集或排水法收集,在图1中选用的发生装置和收集装置是AC或AE。
(4)图2是学生制作的简易供氧器。由于不需要加热,在供氧使用时,左瓶中可放置的药品是过氧化氢溶液和二氧化锰,D符合题意。
题号
1
3
5
2
4
6
7
题号
1
3
5
2
4
6
7
(7)这种制氧机很难用在户外急救供氧,其可能的原因之一是这种制氧机需消耗电能,户外不能满足此条件(答案合理即可)。
题号
1
3
5
2
4
6
7
7.氧气是人类无法离开的物质,氧气的获得有多种方法。
Ⅰ.自然界获得氧气
如图1所示,自然界通过绿色植物的光合作用获得O2
题号
1
3
5
2
4
6
7
(1)光合作用是大自然利用________(填一种能量名称)最成功的范例。
(2)试写出绿色植物光合作用的化学方程式:____________________
___________________。
Ⅱ.工业获得氧气
在低温条件下加压,使空气变为液态,然后升温,使氮气首先从液态空气中蒸发出来,剩下的主要是液态氧,将其贮存在钢瓶中。
(3)空气变为液态,微粒间的空隙________(填“变大”“变小”或“不变”)。
(4)液氮的沸点________液氧的沸点(填“>”“<”或“=”)。
太阳能
C6H12O6+6O2
变小
<
题号
1
3
5
2
4
6
7
Ⅲ.实验室获得氧气
实验室里常用加热KMnO4或MnO2催化H2O2溶液分解制取氧气。
(5)从图2选择仪器组装装置,完成用KMnO4制取并用排水法收集氧气实验,需选择a、b、c、e、g、________(填字母序号);该反应的化学方程式为_____________________________________。
h
题号
1
3
5
2
4
6
7
(6)用H2O2溶液和MnO2制备氧气,发生装置从图2选择仪器d、f后,还需增加____________(填一种仪器名称)。若利用图3所示空塑料输液袋收集制得的氧气,氧气应从________(填“a”或“b”)端进入。
长颈漏斗
a
题号
1
3
5
2
4
6
7
Ⅳ.家庭获得氧气
某品牌家庭制氧机是利用分子筛制氧,空气经过分子筛时氮气被吸附、氧气通过,获得高浓度的氧气。其微观示意图如图4:
题号
1
3
5
2
4
6
7
(7)分子筛制氧的过程属于________(填“物理”或“化学”)变化。
(8)分子筛制氧的原理类似于化学实验中的________(填操作名称)。
物理
过滤
题号
1
3
5
2
4
6
7
Ⅴ.空间站获得氧气
基于图5所示原理,研制的氧气循环再生组件成功应用于我国天宫空间站。
题号
1
3
5
2
4
6
7
(9)反应Ⅰ需要在催化剂和加热的条件下才能发生,写出该反应的化
学方程式:_________________________________________。
(10)氧气循环再生过程中需要定期补充一定量的水,可能的原因是___________________________________________________________
_______。
循环再生过程中生成了CH4,而CH4不参与循环再生过程,消耗了氢元素
题号
1
3
5
2
4
6
7
题号
1
3
5
2
4
6
7
题号
1
3
5
2
4
6
7
(6)用H2O2溶液和MnO2制备氧气,属于固液不加热反应,发生装置从图2选择仪器d、f后,由于f是双孔塞,故还需要增加的仪器是长颈漏斗。若利用图3所示空塑料输液袋收集制得的氧气,氧气的密度比空气大,氧气应从a端进入。
(7)分子筛制氧的原理是空气经过分子筛时氮气被吸附、氧气通过,无新物质生成,属于物理变化。
题号
1
3
5
2
4
6
7
题号
1
3
5
2
4
6
7
(10)氧气循环再生过程中,水电解生成H2和O2,再通过呼吸作用产生CO2,CO2和H2在催化剂、加热的条件下生成CH4和H2O,由于循环再生过程中生成了CH4,而CH4不参与循环再生过程,消耗了氢元素,根据质量守恒定律,反应前后元素种类和质量不变,因此要定期补充一定量的水,故填:循环再生过程中生成了CH4,而CH4不参与循环再生过程,消耗了氢元素。
题号
1
3
5
2
4
6
7
同课章节目录
