中考化学复习第二单元认识物质的构成课件
图片预览






文档简介
(共172张PPT)
第二单元 认识物质的构成
枣庄考情分析
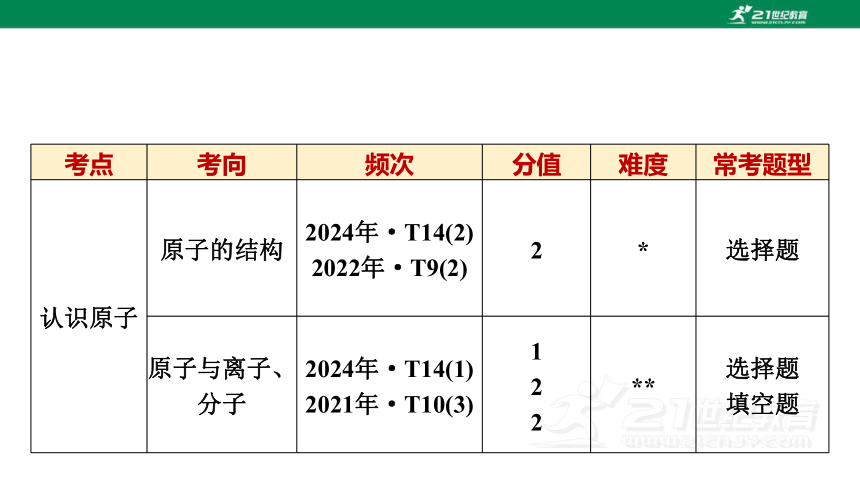
考点 考向 频次 分值 难度 常考题型
认识原子 原子的结构 2024年·T14(2)
2022年·T9(2) 2 * 选择题
原子与离子、分子 2024年·T14(1)
2021年·T10(3) 1
2
2 ** 选择题
填空题
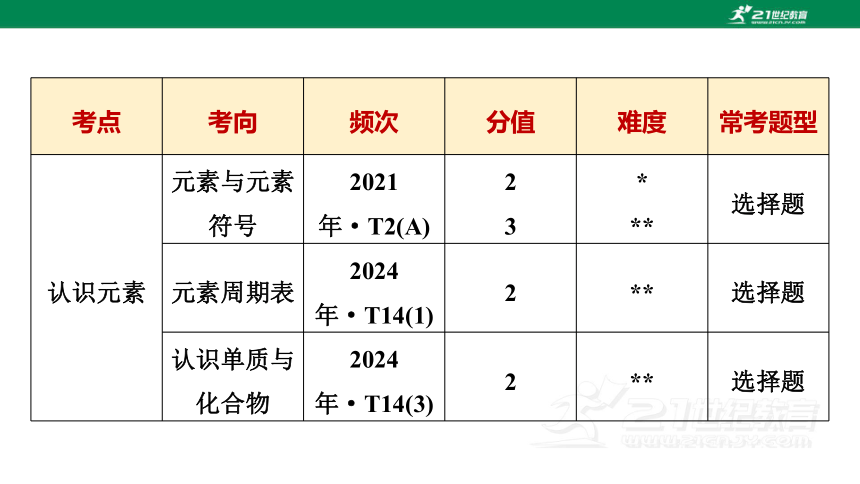
考点 考向 频次 分值 难度 常考题型
认识元素 元素与元素符号 2021年·T2(A) 2
3 *
** 选择题
元素周期表 2024年·T14(1) 2 ** 选择题
认识单质与化合物 2024年·T14(3) 2 ** 选择题
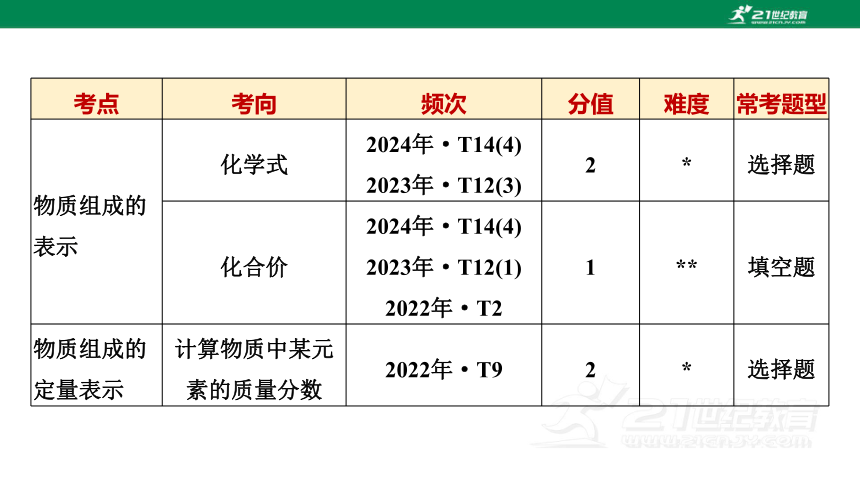
考点 考向 频次 分值 难度 常考题型
物质组成的表示 化学式 2024年·T14(4)
2023年·T12(3) 2 * 选择题
化合价 2024年·T14(4)
2023年·T12(1)
2022年·T2 1 ** 填空题
物质组成的定量表示 计算物质中某元
素的质量分数 2022年·T9 2 * 选择题
单元体系构建
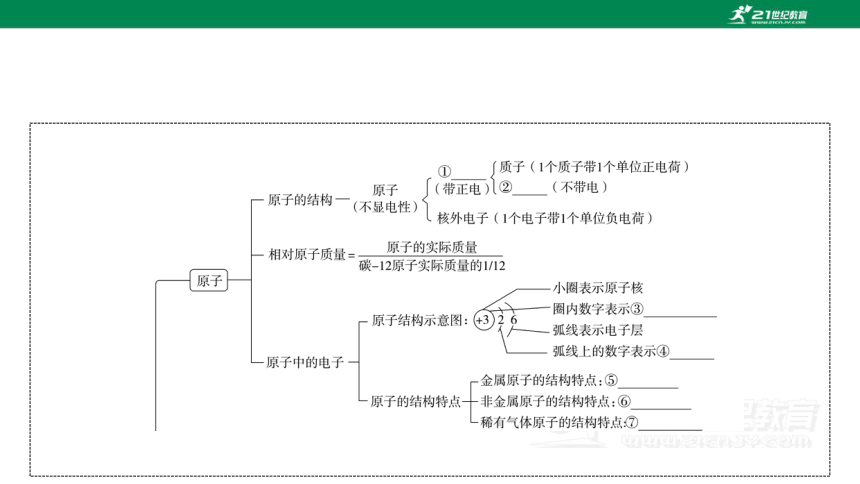
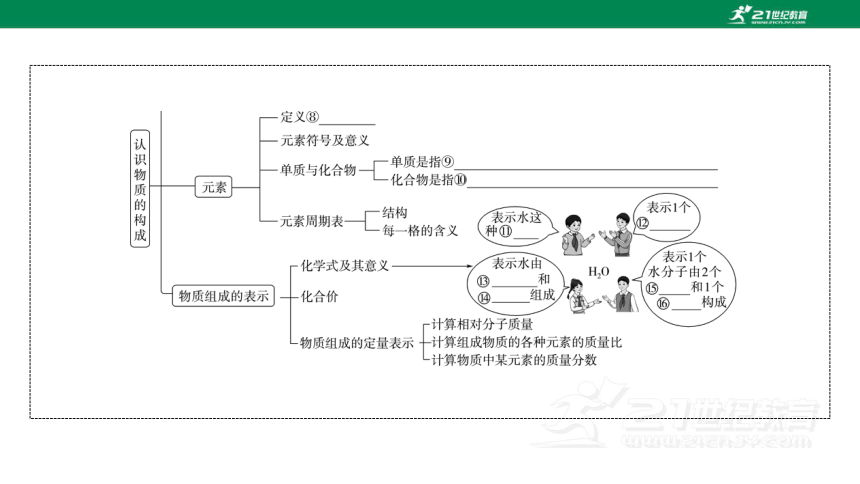
①原子核 ②中子 ③核内质子数 ④该层的电子数 ⑤最外层电子数一般小于4,易失电子,形成阳离子 ⑥最外层电子数一般大于4,易得电子,形成阴离子 ⑦最外层电子数为8(氦为2),既不易得电子,也不易失电子,是一种稳定结构 ⑧具有相同质子数的一类原子的总称 ⑨只由一种元素组成的纯净物 ⑩由两种或两种以上元素组成的纯净物 物质 水分子 氢元素 氧元素 氢原子 氧原子
1.[知识填充]分子和原子的区别是____________________________
________________,实验证明原子也可以再分,原子是由________和__________构成的。原子中各粒子间的关系:核电荷数=________= ____________。
深化研讨 任务达成
任务一 认识原子
在化学变化中,分子可以再分,
原子不能再分
原子核
核外电子
质子数
核外电子数
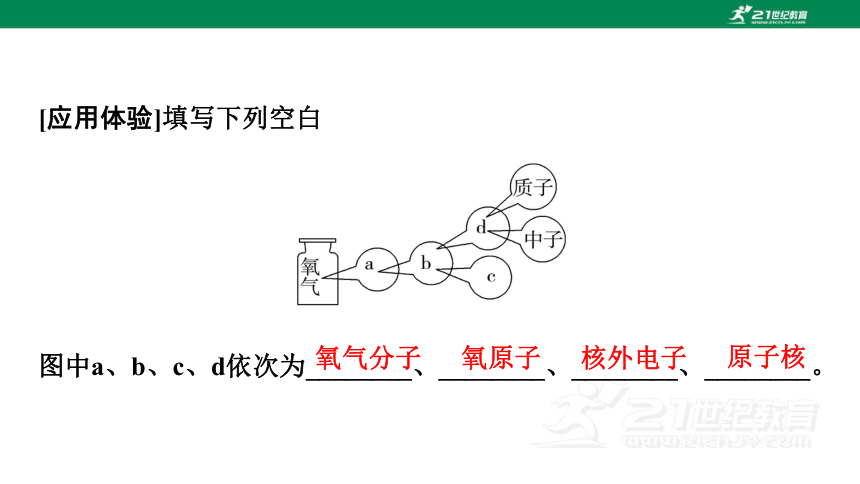
[应用体验]填写下列空白
图中a、b、c、d依次为________、________、________、________。
氧气分子
氧原子
核外电子
原子核
2.[问题思考]针对卢瑟福用带正电的α粒子轰击金箔的下列现象思考下列问题:
(1)绝大多数α粒子穿过金箔后仍沿原来方向前进说明_____________
_______________________。
(2)少数α粒子发生较大偏转说明________________。
(3)极少数α粒子偏转几乎达到180°说明________________________
_____________。
原子核很小,
原子核外有很大的空间
原子核带正电
原子核体积很小,但质量
却很大
3.[知识填充]相对原子质量 =________________________;相对原子质量≈________+________。
质子数
中子数
[应用体验]判断下列说法的正误
(1)相对原子质量就是原子质量的简称。 ( )
(2)碳原子的相对原子质量为12 g。 ( )
(3)两种原子的相对原子质量之比等于它们的质量之比。 ( )
(4)采用了相对原子质量后,就增大了原子的质量。 ( )
×
×
√
×
4.[知识填充]分子、原子、离子的关系
分子
离子
稀有气体
阳离子
阴离子
原子的结构
1.人类认识原子不同阶段的模型示意图如下,其中卢瑟福的著名的“α粒子轰击金箔”实验起到了关键作用。他们用一束带正电的、质量比电子大得多的高速运动的 α粒子轰击金箔时,发现:大多数α粒子能穿透金箔而不改变原来的运动方向,一小部分α粒子改变了原来的运动方向,有极少数α粒子被弹了回来。结合你所学的知识判断下列有关说法错误的是( )
A.汤姆孙发现了电子,推翻了道尔顿原子不可再分的认识
B.科学的发展道路是漫长而曲折的,探索永无止境
C.电子云模型形象地说明电子在原子核外作无规则的高速运动
D.“α粒子轰击金箔”实验证实了原子内的正电荷集中在居于原子中心的原子核上,相对于整个原子而言,原子核的质量和体积都很小
√
D [汤姆孙发现了电子,提出“葡萄干布丁”模型,推翻了道尔顿原子不可再分的认识,A正确;科学的发展道路是漫长而曲折的,探索永无止境,B正确;电子云模型形象地说明电子在原子核外作无规则的高速运动,C正确; “α粒子轰击金箔”实验证实了原子内的正电荷集中在居于原子中心的原子核上,相对于整个原子而言,原子核的质量占了原子质量的绝大部分,D错误。]
2.(2024·烟台中考)元素观、微粒观是重要的化学观念。下列有关说法错误的是( )
A.繁多复杂的物质世界是由种类有限的元素组成的
B.原子中的质子数和中子数一定相等
C.原子核体积很小,但集中了原子的主要质量
D.原子得失电子变成离子后,元素种类不变
√
B [物质是由元素组成的,虽然元素的种类是有限的,但由元素组成的物质种类是繁多的,A正确;同种元素的原子核内质子数和中子数不一定相等,例如碳-12、碳-13、碳-14的质子数相同,但中子数不同,则原子中质子数和中子数不一定相等,B错误;原子核体积相对于原子体积来说很小,原子的质量主要集中在原子核上,所以原子核的质量大约相当于原子的质量,C正确;元素种类由质子数决定,原子得失电子变成离子,其质子数不变,因此元素的种类不变,D正确。]
相对原子质量
√
4.碳-12原子的实际质量为 1.993×10-26 kg,氧原子的质量为2.657×10-26 kg,那么氧原子的相对原子质量是________(计算结果保留整数),那么由2个氧原子构成的氧气分子(O2)的相对分子质量是________。
16
32
5.(2024·云南中考)如图为金属钠与氯气反应生成氯化钠的示意图,下列说法错误的是( )
原子、离子和分子
A.每个氯离子带一个单位负电荷
B.钠原子在该反应中形成了阴离子
C.氯化钠是由钠离子和氯离子构成的
D.钠离子和氯离子的结构都相对稳定
√
B [氯离子是氯原子得到1个电子后形成的,故每个氯离子带一个单位的负电荷,A正确;在该反应中,钠原子失去电子形成阳离子,B错误;氯化钠是由金属元素和非金属元素组成的化合物,由钠离子和氯离子构成,C正确;钠离子和氯离子的最外层电子数均是8,均达到了相对稳定结构,D正确。]
6.分子、原子和离子都是构成物质的基本粒子。下列说法正确的是( )
A.分子由原子构成,分子比原子大
B.氯化钠是由钠离子和氯离子构成的
C.所有的原子中都含有质子、中子和电子
D.H2O2和H2O中都含有氢分子
√
B [分子由原子构成,同种物质对应的分子比原子大,不同种物质的分子和原子的质量、大小没有可比性,A错误;氯化钠是由钠离子和氯离子构成的,B正确;所有的原子中都含有质子和电子,不一定含有中子,例如普通氢原子中没有中子,C错误;H2O2和H2O分别是由H2O2分子、H2O分子构成,不含有氢分子,错误。]
1.认识原子结构中的几个易错点
(1)氢原子中没有中子。
(2)氦原子最外层电子数为2,但是稳定结构,与镁、钙(最外层电子数也为2)化学性质不同。
(3)质子数不一定等于中子数。
(4)决定原子化学性质的是其最外层电子数,即最外层电子数相同的化学性质相似。
2.判断离子所带电荷数的方法
判断离子所带电荷数可结合相应原子的原子结构示意图进行分析。一般来说,金属原子最外层电子数为几,其离子就带几个单位的正电荷;非金属原子得几个电子变为8电子稳定结构,其离子就带几个单位负电荷。
3.判断原子、阳离子、阴离子的方法
(1)阳离子:质子数>核外电子数。
(2)原子:质子数=核外电子数。
(3)阴离子:质子数<核外电子数。
4.相对原子质量不是原子的实际质量,它是一个比值,它与原子的实际质量成正比,即原子的实际质量越大,它的相对原子质量也就越大,反之,亦然。
1.[知识填充]
(1)元素是指具有相同________(即________)的一类_______的总称。元素可分为金属元素、____________和_____________三类。
(2)分布:地壳中含量最多的元素是____,其他含量前几位的元素是_____、_____、_____、_____。
任务二 认识元素
质子数
核电荷数
原子
非金属元素
稀有气体元素
O
Si
Al
Fe
Ca
(3)两个决定:决定元素种类的是__________,决定元素化学性质的是________________________________。
(4)元素符号的意义:①宏观:表示一种________;②微观:表示这种元素的__________;③由原子直接构成的物质,元素符号还可表示该物质。例如:H a.表示_________;b.表示一个_________。
质子数
原子的最外层电子数
元素
一个原子
氢元素
氢原子
(5)元素周期表中横行称为________,元素周期表中共有_____个,元素的周期数=原子的___________。元素周期表中“格”的含义有:
周期
七
电子层数
元素符号
元素名称
相对原子质量
原子序数
2.[应用体验]判断下列说法的正误
(1)地壳中含量最多的金属元素是铁。 ( )
(2)两种元素的根本区别在于相对原子质量不同。 ( )
(3)Fe2+和Fe3+ 核外电子数不同,但属于同种元素。 ( )
(4)水(H2O)中不含金属元素。 ( )
(5)镁的元素符号可表示为MG。 ( )
(6)2H表示两个氢元素。 ( )
×
×
√
√
×
×
3.[概念对比]
单质是__________组成的________;化合物是__________________组成的________;氧化物是指由__________组成的_________,其中一种元素是氧元素。
请将单质、化合物、氧化物填入下表①②③。
一种元素
纯净物
两种或两种以上元素
纯净物
两种元素
化合物
单质
化合物
氧化物
元素与元素符号
1.下列符号既可表示一种物质,又可表示一种元素,还可以表示一个原子的是( )
A.O B.2C C.Fe D.N2
√
C [O可表示氧元素,表示一个氧原子,但不能表示物质,氧气应表示为O2,A不符合题意;2C可表示2个碳原子,不是元素符号,B不符合题意;Fe属于金属元素,可表示铁元素,表示一个铁原子,还能表示铁这一物质,C符合题意;N2是氮气的化学式,不是元素符号,D不符合题意。]
2.(2024·陕西中考)下列生活中常见物质的成分只含金属元素的是
( )
A.小苏打:NaHCO3 B.纯金:Au
C.酒精:C2H5OH D.木炭:C
√
B [小苏打是碳酸氢钠的俗称,化学式为NaHCO3,含有氢、碳、氧、钠元素,其中碳、氢、氧元素属于非金属元素,钠元素属于金属元素,A不符合题意;纯金的化学式为Au,只含有金属元素,B符合题意;酒精的化学式为C2H5OH,含有碳、氢、氧三种非金属元素,C不符合题意;木炭的主要成分是碳,属于非金属元素,D不符合题意。]
3.5G通信技术是一大科技亮点,5G通信芯片由氮化镓材料制成。已知镓原子的结构示意图和镓元素在元素周期表中的信息如图所示,下列说法不正确的是( )
A.镓元素属于金属元素
B.镓原子的中子数为31
C.镓元素的相对原子质量为69.72
D.镓元素在化合物中的化合价通常显+3价
元素周期表
√
B [镓元素带有“钅”字旁,属于金属元素,A正确;在原子结构示意图中,圆圈内数字表示核内质子数,镓元素的质子数是31,而不是中子数为31,B错误;根据元素周期表中的信息图可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为69.72,C正确;由镓原子结构示意图可知,镓原子的最外层电子数是3,在反应过程中容易失去三个电子形成带三个正电荷的离子,则Ga通常为+3价,D正确。]
4.图1是几种元素在元素周期表中的部分信息,图2是几个微粒的结构示意图。下列说法不正确的是( )
A.图1中X名称为硫,元素符号为S,与氧元素化学性质相似
B.图1中X元素与磷、氯元素位于同周期
C.图2中表示镁原子的结构示意图是b
D.图2中属于同一种元素的是c与d
√
C [X元素为第16号元素,元素名称为硫,元素符号为S,硫和氧原子的最外层电子数均为6,化学性质相似,A正确;X元素与磷、氯元素的原子的核外电子层数都为3,位于同周期,B正确;图2中的 b中质子数为12,电子数为10,表示镁离子的结构示意图,C不正确;质子数相同,属于同一种元素,故图2中属于同一种元素的是c与d,D正确。]
5.(2024·福建中考)下列物质可制造用于治疗癌症等疾病的纳米酶,其中属于单质的是( )
A.金 B.氧化铁
C.氧化铈 D.四氧化三铁
认识单质与化合物
√
A [金是由金元素组成的纯净物,属于单质,A符合题意;氧化铁是由铁、氧元素组成的纯净物,氧化铈是由铈、氧元素组成的纯净物,四氧化三铁是由铁、氧元素组成的纯净物,均属于化合物,B、C、D不符合题意。]
6.(2024·眉山中考)下列各图中“●”和“○”分别表示不同元素的原子,其中表示化合物的是( )
A B
C D
√
B [该物质由三种分子混合而成,A属于混合物;该物质由同种分子构成,该分子由两种原子构成,B属于化合物;该物质由同种分子构成,该分子由同种原子构成,C属于单质;该物质由同种分子构成,该分子由同种原子构成,D属于单质。]
1.元素与原子的区别
元素只讲种类,不讲个数;原子既讲种类又讲个数。
2.元素周期表的应用
(1)元素的周期数=元素原子的电子层数。
(2)同一族(纵列)最外层电子数相等,化学性质相似。
(3)单元格的应用:可判断元素的类别,依据元素名称的偏旁确定该元素是金属元素还是非金属元素:一般带“钅”字旁的为金属元素(汞是唯一不带“钅”的金属元素);带“气”“氵”或“石”字旁的为非金属元素,稀有气体元素包括:氦、氖、氩、氪等元素。
[知识填充]
(1)概念:用________和______表示________________,叫作化学式。如过氧化氢的化学式为________,二氧化碳的化学式为________。
任务三 物质组成的表示
元素符号
数字
物质组成的式子
H2O2
CO2
(2)化学式代表的含义
氢元素
氧元素
过氧化氢
两个氢原子
两个氧原子
过氧化氢这种物质
过氧化氢分子
(3)化合价可确定不同元素原子化合时的________比。化合价的表示方法有以下三点:
①化合价的正、负和数目标在元素和原子团符号的_______方;
②符号(即正、负)在____,数目在_____;
③价数为“1”时,不能省略。
(4)化合价原则:在化合物中,各元素的正负化合价之和为_____。
个数
正上
前
后
零
化学式
1.(2024·宁夏中考)水是生命之源,在化学上可以用“H2O”表示,有关水的组成和构成的下列说法正确的是( )
A.水是由水分子构成的
B.水是由氢气和氧气组成的
C.水是由氢原子和氧原子构成的
D.水是由两个氢元素和一个氧元素组成的
√
A [水是由水分子构成的,A正确;水是纯净物,水中既不含氢气也不含氧气,B错误;在描述物质组成时,分子和原子要互相对应,如:水分子是由氢原子和氧原子构成的,是正确的,C表述方法错误;元素只讲种类,不讲个数,D错误。]
√
3.太原北齐壁画博物馆于2023年12月20日正式对外开放,展示了古墓中的千年华彩。下列壁画颜料所含主要物质中,元素化合价标注正确的是( )
化合价
A.白垩: B.赭石:
C.密陀僧: D.炭黑:
√
C [A.钙元素为+2价,氧元素为-2价,设碳元素化合价为a,(+2)+a+(-2)×3=0,a=+4,错误;B.氧元素为 -2价, 设铁元素化合价为b,2b+(-2)×3=0,b=+3,错误;C.氧元素为-2价,设铅元素化合价为c,c+(-2)=0,c=+2,正确;D.单质中元素化合价为0,错误。]
4.下列物质的化学式中,书写正确的是( )
A.碳酸钙 CaCO3 B.氯化铁 FeCl2
C.氧化钙 CaOH D.碳酸钠 NaCO3
√
A [碳酸钙中钙元素显+2价,碳酸根离子显-2价,其化学式为CaCO3,A正确;氯化铁中铁元素显+3价,氯元素显-1价,其化学式为FeCl3,B错误;氧化钙中钙元素显+2价,氧元素显-2价,其化学式为CaO,C错误;碳酸钠中钠元素显-1价,碳酸根离子显-2价,其化学式为Na2CO3,D错误。]
1.化学符号周围的数字
(1)前:写在元素符号、化学式、离子前面的数字仅表示其对应的原子、分子、离子的个数(数字可改变)。
(2)后:写在离子符号或原子团右上角的数字表示该离子或原子团的1个粒子所带的电荷数(数字不可改变)。注意:离子符号右上角先写数字再写正负号,数字为“1”时要省略。
(3)上:写在元素符号或原子团正上方的数字表示该元素或原子团的化合价。注意:正上方先写正负号再写数字,数字为“1”时不能省略。
(4)下:写在化学式右下角的数字表示一个分子中含有该原子或原子团的个数(数字不可改变)。
2.化合价的应用
(1)据化学式求化合价(“知式推价”)
依据:在化合物中,各元素的正负化合价之和为零。
(2)根据化合价书写化学式(“知价写式”)
方法:“十字交叉”法:先排序,后标价,再约简,后交叉。
1.[知识填充]
(1)化学式中各原子的_____________的总和,就是该物质的化学式量,对于由分子构成的物质,其化学式量也叫相对分子质量。如:H2SO4的相对分子质量=___________________________(列式子)。
(2)各元素的质量比=_____________×________之比。
(3)物质中某元素的质量分数=______________________×100%。
任务四 物质组成的定量表示
相对原子质量
1×2+32+16×4=98
相对原子质量
原子个数
×
×
×
计算相对分子质量
1.下列相对分子质量计算正确的是( )
A.NO2:相对分子质量=14×16×2=448
B.CuSO4·5H2O :相对分子质量=64+32+16×4+5+1×2+16×1
C.H2O2:相对分子质量=1×2+16×2=34克
D.Ca(OH)2:相对分子质量=40+(16+1)×2=74
√
D [NO2的相对分子质量=14+16×2=46,A错误;CuSO4·5H2O的相对分子质量=64+32+16×4+5×(1×2+16)=250,B错误;H2O2的相对分子质量=1×2+16×2=34,但相对分子质量的单位不是克,C错误;氢氧化钙的相对分子质量=40+(16+1)×2=74,D正确。]
2.(2024·乐山中考)将充满空气的气球放置在盛有空气的密闭容器中,气球沉入底部(如图甲)。若要使气球位置出现图乙中的变化,可以将密闭容器中的空气换成下列气体中的( )
A.氢气 B.甲烷
C.二氧化碳 D.一氧化碳
√
C [将充满空气的气球放置在盛有空气的密闭容器中,气球沉入底部,若要使气球位置出现图乙中的变化,可以将密闭容器中的空气换成密度比空气大的气体,一般在相同条件下,相对分子质量越大,其气体密度越大,空气平均相对分子质量为29,气体相对分子质量大于29的,气体密度就大于空气的密度,据此可知:氢气的相对分子质量为2、甲烷(CH4)的相对分子质量为16、二氧化碳的相对分子质量为44、一氧化碳的相对分子质量为28,C符合题意。]
3.(2024·山西中考)早在距今约六千年的半坡文化时期,陶制品上便出现了最早的彩绘。彩绘颜料种类多样,有红彩、黑彩和白彩(主要成分是硫酸钙等),硫酸钙(CaSO4)中,氧元素与钙元素的质量比为( )
A.5∶8 B.8∶5
C.5∶6 D.6∶5
计算组成物质的各元素的质量比
√
B [硫酸钙(CaSO4)中,氧元素与钙元素的质量比为(16×4)∶(40×1)=8∶5,故选B。]
4.景德镇被称为“瓷都”,得益于景德镇的高岭土[主要成分:Al2(Si2O5)(OH)x],它是制造陶瓷器的优良原料。经分析,其中铝、氧元素质量比为3∶8,则( )
A.x=1 B.x=2
C.x=3 D.x=4
√
5.我国科学家发现的千金藤素(C37H38N2O6)获得国家发明专利授权。以下关于千金藤素的说法不正确的是( )
A.千金藤素由碳、氢、氮、氧四种元素组成
B.千金藤素中碳、氢、氮、氧四种元素的质量比是37∶38∶2∶6
C.千金藤素分子是由碳原子、氢原子、氮原子和氧原子构成
D.千金藤素中碳元素的质量分数最大
计算物质中某元素的质量分数
√
B [由化学式可知,千金藤素由C、H、N、O四种元素组成,A正确;千金藤素中碳、氢、氮、氧四种元素的质量比是 (12×37)∶38∶(14×2)∶(16×6)=222∶19∶14∶48,B错误;千金藤素由千金藤素分子构成,千金藤素分子由碳原子、氢原子、氮原子和氧原子构成,C正确;千金藤素中碳、氢、氮、氧四种元素的质量比是222∶19∶14∶48,故碳元素的质量分数最大,D正确。]
6.“开门七件事,柴米油盐酱醋茶”。食醋中含有醋酸(CH3COOH)。计算:
(1)一个醋酸分子中含有____个原子;
(2)醋酸的相对分子质量为_____;
(3)醋酸中碳、氢元素的质量比为________(填最简比);
(4)醋酸中碳元素的质量分数为________。
8
60
6∶1
40%
7.(2024·长春中考)2024年4月,我国搭载了神舟十八号载人飞船的火箭发射成功。化学为航空航天领域的发展提供了强有力的支撑。
宇航员在太空中钙质流失严重,需要补钙。如图是某钙片标签的部分信息,下列说法正确的是( )
综合计算
碳酸钙D3片
【成分】碳酸钙(CaCO3)、维生素D3等。
【规格】每片含碳酸钙0.75 g。
【用法用量】口服,咀嚼后咽下。
成人:一次2片,一日1次,儿童酌量。
A.服用钙片可预防甲状腺肿大
B.碳酸钙由3种元素组成
C.碳酸钙的相对分子质量是100 g
D.按用量服用,成人每天从钙片中摄取钙元素的质量为0.3 g
√
8.中华文化博大精深,茶道、中医等处处蕴含着古代劳动人民的智慧。
(1)茶韵悠长,科学研究证实茶叶中含茶氨酸(化学式为C7H14N2O3)、锌、硒等多种对人体有益的成分。请计算:
①茶氨酸的相对分子质量为________。
②茶氨酸中氢、氮元素的质量比为________。
③________g茶氨酸中氮元素的质量为5.6 g。
174
1∶2
34.8
(2)黄芩是中药中的常见药,具有清热燥湿、消炎抗菌、消肿的功能。汉黄芩素(C6H12O5),是从黄芩中提取出来的,具有抗癌作用,28.4 g汉黄芩素中碳元素质量为________。
12.47 g
化学式的计算要根据相关的公式和概念进行,几种计算间的关系可用如图反映:
1.下列物质是由分子构成的是( )
A.氢氧化钾 B.铝
C.金刚石 D.甲烷
题号
1
3
5
2
4
6
8
7
9
10
分层评价 即时反馈
√
题号
1
3
5
2
4
6
8
7
9
10
D [大多数固态非金属单质、金属和稀有气体是由原子直接构成的,气态的非金属单质和由非金属元素组成的化合物是由分子构成的,一般含有金属元素和非金属元素的化合物是由离子构成的。根据上述分析可知:氢氧化钾是由钾离子和氢氧根离子构成的,铝是由铝原子构成的,金刚石是由碳原子构成的,A、B、C均不符合题意;甲烷是由甲烷分子构成的,D符合题意。]
2.2024年6月25日,嫦娥六号探测器返回地球,带回了月背土壤
1 935.3克。经检测月球矿物中含有丰富的氦-3,氦-3是可控核聚变的重要原料。如图是氦-3原子的构成示意图,下列说法正确的是
( )
A.含有2个中子
B.电子数和质子数相等
C.核电荷数为1
D.相对原子质量为4
题号
1
3
5
2
4
6
8
7
9
10
√
B [由题图中可看出:氦-3原子含有1个中子,A项不正确;氦-3原子中电子数和质子数都是2,相等,B项正确;核内质子数是2,所以核电荷数为2,C项不正确;相对原子质量≈质子数+中子数,即为3,D项不正确。]
题号
1
3
5
2
4
6
8
7
9
10
3.构成物质的微粒有分子、原子、离子等。下列物质由离子构成的是( )
题号
1
3
5
2
4
6
8
7
9
10
A.氧气 B.水
C.氯化钠 D.金刚石
√
C [氧气和水均由分子构成,A、B项不符合题意;氯化钠由钠离子和氯离子构成,C项符合题意;金刚石由碳原子构成,D项不符合题意。]
题号
1
3
5
2
4
6
8
7
9
10
4.镍元素可以维持生理结构、刺激生血、影响酶活性等作用,但是需要合理使用才可以防止产生不利影响。镍元素在元素周期表中的相关信息如图所示,下列关于该元素说法错误的是( )
A.图2中x=2
B.该元素位于元素周期表的第四周期
C.该元素的相对原子质量为58.69 g
D.该元素在化学反应中容易失去电子变
成阳离子
题号
1
3
5
2
4
6
8
7
9
10
√
C [原子中,核电荷数=核内质子数=核外电子数=原子序数,所以x=28-2-16-8=2,A正确;原子核外电子层数是几,所处周期就是几,镍原子核外电子层数是4,位于元素周期表的第四周期,B正确;镍元素的相对原子质量为58.69,C错误;镍原子最外层电子数是2,在反应中易失去电子,D正确。]
题号
1
3
5
2
4
6
8
7
9
10
5.“宏观—微观—符号”相结合是化学学科独有的思维方式。下列化学用语书写正确的是( )
A.2个氮原子—N2
B.氧化镁—MgO2
C.2个水分子—2H2O
D.氯离子—Cl-1
题号
1
3
5
2
4
6
8
7
9
10
√
C [2个氮原子表示为2N,A错误;氧化镁中镁元素显+2价,氧元素显-2价,根据化学式的书写规则可知,氧化镁的化学式为MgO,B错误;正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,所以2个水分子表示为2H2O,C正确;在表示该离子时,离子符号右上角先写数字再写正负号,带1个电荷时,1要省略,所以氯离子表示为Cl-,D错误。]
题号
1
3
5
2
4
6
8
7
9
10
6.如图是四种微粒的结构示意图。下列有关说法错误的是( )
题号
1
3
5
2
4
6
8
7
9
10
A.①③属于同种元素
B.②的微粒符号可表示为O2-
C.②③可形成化合物NaO
D.④中x的值为8
√
C [质子数决定元素种类,①③质子数相同都是11,属于同种元素,A正确;②的质子数为8,表示氧元素,核外电子数=2+8=10>8,表示阴离子,即为氧离子,故②微粒符号可表示为O2-,B正确;②质子数=8<核外电子数(2+8=10),表示带2个负电荷的氧离子,③质子数=11<核外电子数(2+8=10),表示带1个正电荷的钠离子,故可形成化合物Na2O,C错误;由于④中质子数=18=原子序数,是氩元素,属于稀有气体元素,则最外层电子数x的值为8,为稳定结构,D正确。]
题号
1
3
5
2
4
6
8
7
9
10
题号
1
3
5
2
4
6
8
7
9
10
√
B [由唾液酸的化学式为C11H19NO9可知,唾液酸由碳、氢、氮、氧四种元素组成,A正确;由唾液酸的化学式为C11H19NO9 可知,唾液酸由唾液酸分子构成,1个唾液酸分子由11+19+1+9=40个原子构成,B错误;由唾液酸的化学式为C11H19NO9可知,唾液酸中碳、氧元素的原子个数比为11∶9,C正确;由唾液酸的化学式为C11H19NO9可知,唾液酸中碳、氢、氮、氧四种元素的质量比为(12×11)∶(1×19)∶14∶(16×9)=132∶19∶14∶144,所以唾液酸中氧元素的质量分数最大,D正确。]
题号
1
3
5
2
4
6
8
7
9
10
8.下列各组物质,按单质、化合物、混合物顺序排列的是( )
A.固态氮、干冰、冰水共存物
B.稀有气体、氯化氢气体、液化石油气
C.液态氧、蒸馏水、透明的河水
D.天然气、煤、石油
题号
1
3
5
2
4
6
8
7
9
10
√
C [固态氮由氮元素一种物质组成,属于单质,干冰由碳和氧两种元素组成,属于化合物,冰水共存物由氢和氧两种元素组成,属于化合物,A错误;稀有气体中可能含有氦气、氖气等多种气体,属于混合物,氯化氢气体中含有氢和氯两种元素组成,属于化合物,液化石油气中含有氢气、一氧化碳等气体,属于混合物,B错误;液态氧由氧元素组成,属于单质,蒸馏水由氢和氧两种元素组成,属于化合物,透明的河水中含有水和溶进去的空气等物质属于混合物,C正确;天然气、煤、石油三大化石燃料都属于混合物,D错误。]
题号
1
3
5
2
4
6
8
7
9
10
9.俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形,如表为元素周期表的部分元素的相关信息,利用该表回答相关问题。
题号
1
3
5
2
4
6
8
7
9
10
题号
1
3
5
2
4
6
8
7
9
10
周期 ⅠA 0
1 1 H
1.008 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 2 He
4.003
2 3 Li
6.94 4 Be
9.012 5 B
10.81 6 C
12.01 7 N
14.01 8 O
16.00 9 F
19.00 10 Ne
20.18
3 11 Na
22.99 12 Mg
24.30 13 Al
26.98 14 Si
28.08 15 P
30.97 16 S
32.06 17 Cl
35.45 18 Ar
39.95
(1)第16号元素的原子在化学反应中易______(填“得到”或“失去”)电子,第11号元素和第16号元素形成的化合物的化学式是________。
(2)以下是A、B、C三种粒子的结构示意图,其中属于同种元素的是________(填字母,下同)。
题号
1
3
5
2
4
6
8
7
9
10
得到
Na2S
AC
(3)“芯片”是电子产品的核心部件,氮化镓是制造芯片的材料之一,如图是镓元素(Ga)的原子结构示意图及元素周期表的一部分。下列说法不正确的是________。
题号
1
3
5
2
4
6
8
7
9
10
B
A.镓属于金属元素,m=3
B.镓化学性质比较活泼,易形成阳离子Ga+3
C.镓元素的位置应该在Z处
D.镓的最外层电子数与Al相同
题号
1
3
5
2
4
6
8
7
9
10
(4)原子由质子、中子、电子等粒子构成,若以“ ”“ ”“ ”分别代表电子、中子、质子,如图为各微粒的结构示意图,其中属于同种元素的是________,带正电的是______。
题号
1
3
5
2
4
6
8
7
9
10
AD
C
解析:(1)最外层电子数大于4易得到电子,最外层电子数小于4易失去电子,第16号元素的原子最外层有6个电子,所以易得到2个电子;第11号元素为Na,钠最外层有1个电子,容易失去1个电子,化合价为+1价,Na和S形成的化合物的化学式为Na2S。
(2)质子数决定元素的种类,图中AC的质子数相同,故选:AC。
题号
1
3
5
2
4
6
8
7
9
10
(3)镓带“钅”字旁,属于金属元素,原子中,质子数=核外电子数,即31=2+8+18+m,解得m=3,A正确;镓原子最外层电子数是3,在化学反应中易失去3个电子而形成带3个单位正电荷的阳离子,镓化学性质比较活泼,易形成阳离子Ga3+,B错误;根据元素周期表中的表格可知,左上角的数字表示原子序数,原子中原子序数=核电荷数=质子数=核外电子数,由镓原子的结构示意图可知,其核内质子数为31,则该元素的原子序数为31,所以镓元素的位置应该在Z处,C正确;由元素周期律可知,同一主族元素的原子最外层电子数相同,镓的最外层电子数应与Al相同,D正确。
(4)由题图可知,AD质子数都为1,属于同种元素,C质子数为3,核外电子数2,属于阳离子带正电。
题号
1
3
5
2
4
6
8
7
9
10
10.如图为某厂生产的补钙片标签上的部分文字,请仔细阅读后回答下列问题:
题号
1
3
5
2
4
6
8
7
9
10
[主要原料]碳酸钙(CaCO3),维生素D
(其他配料不含钙元素)
[功效成分]补钙
每片含钙(以Ca计)500 mg、
维生素D 1 001U
[食用方法]每日一次,每次1片
[规 格]2.5 g/片
(1)维生素D种类较多,其中维生素D2的化学式为C28H44O,试计算:
①维生素D2的相对分子质量为________。
②维生素D2中碳、氢、氧三种元素的质量比为__________。
(2)每片钙片中含碳酸钙的质量为______克。
题号
1
3
5
2
4
6
8
7
9
10
396
84∶11∶4
1.25
题号
1
3
5
2
4
6
8
7
9
10
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
(时间:40分钟 满分:60分)
一、选择题(本题包括15小题,每小题2分,共30分)
1.某方便面面饼的营养成分表如图所示,表中“钠”指的是( )
限时提能训练(二) 认识物质的构成
[A]单质 [B]分子 [C]元素 [D]原子
主要营养成分表
项目 面饼(每份115 g)
能量 2 318 kJ
蛋白质 10.0 g
油脂 23.6 g
碳水化合物 75 g
钠 993 mg
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
C [物质由元素组成,表中“钠”不是以单质、原子的形式存在的,而是以元素的形式存在,与具体形态无关,故选C。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
2.嫦娥六号月球取土,引领全球探月浪潮,2024年6月25日嫦娥六号顺利返回地球,带回的1 935.3 g月壤中含有大量安全无污染的核聚变原料He-3(如图所示)。下列关于He-3的说法正确的是( )
[A]He-3是一种新元素
[B]He-3原子中含有1个质子,2个电子
[C]He-3原子中含有3个质子,没有中子
[D]He-3原子中含有2个质子,1个中子,2个电子
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
D [He-3属于氦元素,不属于新元素,A错误;在原子中,质子数=核外电子数,He-3原子中含有2个质子,2个电子,B错误;He-3原子中含有2个质子,中子数为3-2=1,C错误;He-3原子中含有2个质子,1个中子,2个电子,D正确。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
3.就化学本身的特点来看,“见著知微”使我们更容易踏入化学学科的大门。下列物质是由分子构成的是( )
[A]氯化钠 [B]水
[C]氢氧化钠 [D]金刚石
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
B [氯化钠是由钠离子和氯离子构成的,水是由水分子构成的,氢氧化钠是由钠离子和氢氧根离子构成的,金刚石是由碳原子构成的,故B符合题意。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
4.下列有关分子、原子、离子、元素的说法中,正确的是( )
[A]原子都是由质子、中子、核外电子构成的
[B]同种元素的原子核内质子数和中子数一定相等
[C]氯化钾的结构与氯化钠相似,则氯化钾是由氯离子和钾离子构成的
[D]保持水的化学性质的最小粒子是氢原子和氧原子
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
C [原子不都是由质子、中子、核外电子构成的,氢原子的原子核中没有中子,A不正确;元素是具有相同质子数的一类原子的总称,同种元素的原子核内质子数一定相等,但中子数不一定相等,B不正确;氯化钾的结构与氯化钠相似,则氯化钾是由氯离子和钾离子构成的,C正确;水由水分子构成,则保持水的化学性质的最小粒子是水分子,D不正确。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
5.图中有关二氧化碳的说法正确的是( )
[A]① [B]② [C]③ [D]④
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
B [二氧化碳由碳元素和氧元素组成,或二氧化碳分子由碳原子和氧原子构成,①错误,②正确;一个二氧化碳分子由一个碳原子和两个氧原子构成,③错误;二氧化碳是由一种物质组成的,属于纯净物,④错误。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
6.如图是“多种多样的物质及其组成”。下列有关说法不正确的是( )
[A]分子由原子构成
[B]氨(NH3)是由氨元素组成的
[C]氯化钠由Na+和Cl-构成
[D]构成物质的粒子有分子、原子和离子
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
B [分子是由原子构成的,A项正确;氨(NH3)是由氮元素与氢元素组成的,不存在氨元素,B项错误;氯化钠是由Na+和Cl-构成的,C项正确;由图示可知,构成物质的粒子有分子、原子和离子,D项正确。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
D [水中氢元素显+1价,氧元素显-2价,A错误;磷酸钙由钙离子和磷酸根离子构成,钙离子属于阳离子,符号应为Ca2+,B错误;氧是8号元素,在原子中,原子序数=质子数=核外电子数,故氧
原子核外电子排布为2、6,故氧原子的结构示意图为 ,C错
误;由化学式可知,磷酸钙由Ca、P、O三种元素组成,D正确。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
8.下列化学符号中数字表示的意义正确的是( )
[A]CO2:“2”表示一个二氧化碳分子中含有两个氧原子
[B]2Fe:“2”表示两个铁元素
[C] “+2”表示铜离子带有两个单位正电荷
[D]O2-:“2”表示氧元素的化合价为负二价
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
A [标在化学式中元素右下角的数字表示一个分子中所含原子的数目,CO2中的“2”表示一个二氧化碳分子含有两个氧原子,A正确;标在元素符号前面的数字表示原子的个数,2Fe中的“2”表示2个铁原子,B错误;标在元素符号正上方的数字表示该元素化合价的数值, 中的“+2”表示铜元素的化合价为+2价,C错误;标在元素符号右上角的数字表示1个离子所带的电荷数,O2-中的“2”表示一个氧离子带有两个单位的负电荷,D错误。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
9.2024年全国民航工作会议提出,将推动国产大飞机C919走出国门。C919大型客机机身材料大量使用了第三代铝锂合金。如图为锂和铝两种元素在元素周期表中的信息及相关的离子结构图。以下说法正确的是( )
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
[A]m=2,n=8
[B]氧化锂的化学式为Li2O
[C]图b表示铝离子,离子符号为Al+3
[D]图中两种元素的本质区别是核内中子数不同
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
B [在元素周期表中,元素名称左上角的数字表示原子序数,原子序数=质子数,故m=3,在原子中,质子数=核外电子数,故铝原子的核外电子排布为2、8、3,铝离子是铝原子失去最外层3个电子后形成的,故n=8,A错误;锂原子最外层电子数为1,在化学反应中,容易失去最外层1个电子,即锂元素化合价为+1价,氧元素通常显-2价,故氧化锂的化学式为Li2O,B正确;图b表示铝离子,其由原子失去3个电子形成,即带三个单位的正电荷,离子符号为Al3+,C错误;元素是质子数相同的一类原子的总称,图中两种元素的本质区别是质子数不同,D错误。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
11.用数轴表示某些化学知识直观、简明、易记,下列数轴表示不正确的是( )
[A]地壳中元素含量由高到低:
[B]不同元素的核电荷数依次递减:
[C]含氮物质中氮元素的化合价由低到高:
[D]一个分子中所含的原子数由少到多:
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
B [地壳中元素含量由高到低的顺序是氧、硅、铝、铁、钙,A正确;钠、镁、铝、硅、磷的核电荷数依次递增,B错误;利用化合物中正负化合价代数和为零的原则,根据H为+1价、Na为+1价、O为-2价,K为+1价,可计算NH3中N为-3价、N2中N为0价、NaNO2中N为+3价、KNO3中 N为+5价,与数轴关系一致,C正确;一个氮气分子中含有2个原子,一个二氧化碳分子中含有3个原子,一个氨气分子中含有4个原子,一个甲烷分子中含有5个原子,与数轴关系一致,D正确。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
12.(2024·潍坊中考)戊二醛是一种广谱高效消毒剂,其分子结构如图所示(“—”“===”表示原子之间相互连接),下列说法正确的是( )
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
[A]戊二醛属于有机物,化学式为C5H8O2
[B]戊二醛中氧元素的质量分数最大
[C]戊二醛中碳、氢、氧三种元素的质量比为5∶8∶2
[D]保持戊二醛化学性质的最小粒子是碳原子、氢原子、氧原子
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
A [由题图可知,每个戊二醛分子由5个碳原子、8个氢原子、2个氧原子构成,化学式为C5H8O2,戊二醛是含有碳元素的化合物,属于有机物,A正确;戊二醛中碳、氢、氧三种元素的质量比为(12×5)∶(1×8)∶(16×2)=15∶2∶8,其中碳元素的质量分数最大,B、C错误;分子是保持物质化学性质的最小粒子,保持戊二醛化学性质的最小粒子为戊二醛分子,D错误。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
13.(2024·枣庄中考)下列物质中,前者属于氧化物,后者属于混合物的是( )
[A]熟石灰、海水
[B]冰水混合物、食盐水
[C]干冰、硫酸钠
[D]生铁、二氧化锰
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
B [熟石灰是氢氧化钙,属于碱;海水含有许多可溶性盐,属于混合物,A错误。冰水混合物只有水,水是由氢、氧元素组成的化合物,属于氧化物;食盐水含有氯化钠和水,属于混合物,B正确。干冰是固体二氧化碳,是由碳、氧元素组成的化合物,属于氧化物;硫酸钠是一种物质,属于纯净物,C错误。生铁是含碳的铁合金,属于混合物;二氧化锰是由锰、氧元素组成的化合物,属于氧化物,D错误。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
14.元素周期表是化学领域最重要的工具之一,对于研究和理解元素的性质至关重要。下图是元素周期表的一部分,请利用所学知识判断说法正确的是( )
[A]元素①的名称叫硅,属于非金属元素
[B]原子序数:②>①>③
[C]元素②的原子容易失去最外层电子
[D]元素②和元素③化学性质相似
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
C [由题图可知,元素①的原子序数是6,是碳元素,属于非金属元素,A项错误;根据元素周期表中,同一周期从左到右原子序数依次递增,则原子序数: ③>②>①,B项错误;由题图可知,元素②的原子序数是11,原子结构示意图为 ,最外层电子数为1,在化学反应中容易失去最外层电子,C项正确;元素②
最外层电子数是1,元素③ 最外层电子数为6,二者最外层电子数不同,化学性质不相似,D项错误。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
15.如图是五种粒子的结构示意图,下列说法正确的是( )
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
[A]若①结构的原子的相对原子质量为27,则该原子核内中子数为13
[B]①③⑤化学性质相似是因为它们原子的最外层电子数相同
[C]①②③④⑤均属于金属元素且都易失电子
[D]②结构的元素在元素周期表中的位置为第三周期
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
D [①结构中粒子的质子数为13,根据相对原子质量≈质子数+中子数,可得中子数=相对原子质量-质子数=27-13=14,A错误;①结构中质子数>核外电子数,属于阳离子,③和⑤结构中的质子数=核外电子数,属于原子,且③⑤结构中的最外层电子数相等,因此③⑤化学性质相似,与①性质不相同,B错误;①②③⑤结构对应的元素均为金属元素,④结构对应的元素为氯元素,属于非金属元素,C错误;②结构的元素是镁元素,在周期表中位于第三周期,D正确。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
二、填空与简答题(本题包括3小题,共18分)
16.(5分)(2024·枣庄中考)世界是物质的。从宏观角度看,物质是由元素组成的;从微观角度看,物质又是由分子、原子和离子等微观粒子构成的。
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
根据图示信息,回答下列问题:
(1)图1中铍原子的质子数为____,铍属于________(填“金属”或“非金属”)元素。
(2)图2中最外层达到相对稳定结构的微观粒子是________(填字母),与C属于同种元素的是________(填字母)。
(3)图2中B单质是由________(填“分子”或“原子”)构成的。
(4)图2中A和B两种元素组成化合物的化学式为________,其中A元素的化合价为________价。
4
金属
C
B
原子
Na2S
-2
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
解析:(1)图1中铍原子的原子序数(左上角数字)是4,根据原子序数=核电荷数=质子数=核外电子数,则铍原子的质子数是4;铍属于金属元素。
(2)最外层电子数为8(第一个电子层为2)属于相对稳定结构,则图2中最外层达到相对稳定结构的微观粒子是C。
元素的种类由质子数决定,质子数相同的一类原子属于同一种元素,B与C质子数(圆圈内数字)相同,则与C属于同种元素的是B。
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
(3)图2中B是钠,钠单质由原子构成。
(4)图2中A(硫)和B( 钠)两种元素组成化合物,钠元素显+1价,则化学式为Na2S,其中A(硫)元素的化合价为-2价。
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
17.(2分)2023年9月21日,天宫课堂第四课在梦天舱上进行授课。梦天舱载有世界上第一套由冷原子锶光钟等组成的空间冷原子钟,该钟是目前世界上最精确的钟。锶元素的原子序数为38,一个锶原子的质量为1.465×10-25 kg,一个碳-12原子的质量为1.993×10-26 kg。 请计算:(1)锶的核外电子数为________。
(2)锶原子的相对原子质量:____________________(写出计算式,不用求算)。
38
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
18.(11分)“宏观辨识与微观探析”是化学学科的核心素养之一。在宏观、微观和符号之间建立联系是化学学科的重要思维方式。
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
(1)图1是两个微粒的结构模型示意图,这两个微粒是否属于同种元素?______(填“是”或“否”),依据是_______________________若表示He-3原子,3为相对原子质量,则对应图1中的______(填“a”或“b”)。
(2)图2中①~④是四种物质的微观模型图。
由离子构成的是图________(填序号,下同),可以表示铁原子的是图________,表示单质的是________。
否
这两个微粒核内质子数不同
b
④
①
①②
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
(3)如图3是几个粒子的结构示意图:
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
①图a为某原子结构示意图,其中m的值为______,该原子的元素的化学性质与________(填字母)的化学性质相似;
②图b原子在化学反应中易________(填“得到”或“失去”)电子,形成________(用化学符号表示);
③上述粒子中,属于阳离子的是____________(用化学符号表示)。
16
b
得到
O2-
Mg2+、Al3+
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
解析:(1)决定元素种类的是质子数,这两个微粒核内质子数不同,所以不属于同种元素;He原子序数是2,核内质子数为2,He-3原子,3为相对原子质量,相对原子质量=质子数+中子数,中子数=1,故对应图1中的b。
(2)由图2可知①是原子直接构成的,②③是由分子构成的,④是由钠离子和氯离子构成的,故由离子构成的选④;铁是金属单质,由原子直接构成,故选①;①是原子直接构成的单质,②只含有一种分子为纯净物,分子中原子种类相同属于单质,③只含有一种分子为纯净物,分子中原子种类不相同属于化合物,④是由钠离子和氯离子构成的属于化合物,故表示单质的是①②。
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
(3)质子数=核外电子数,m=2+8+6=16;该原子的元素的化学性质与b的化学性质相似,因为它们的最外层电子数相同;图b其最外层电子数大于4,故该原子在化学反应中易得到电子;该元素为8号氧元素,最外层有6个电子,得到两个电子后形成带两个单位负电荷氧离子,符号为O2-;核内质子数大于核外电子数,为阳离子,故ce属于阳离子,c质子数是12,是镁离子,离子符号为Mg2+,e质子数是13,是铝离子,离子符号为Al3+。
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
三、实验与计算题(本题包括2小题,共12分)
19.(9分)(2023·威海中考)从原子论到分子学说
原子-分子论的创立,奠定了近代化学的基础,阅读下列材料回答问题:
材料一:1803年,道尔顿提出原子论,认为所有物质都是由原子构成的。单质由原子直接构成,同种原子相互排斥不能结合;化合物由“复杂原子”构成,“复杂原子”由不同原子按一定整数比例简单构成。
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
材料二:1811年,阿伏加德罗引入新的概念——分子,提出了分子学说。对于化合物而言,分子相当于道尔顿所谓的“复杂原子”;对于单质而言,同种原子可以结合成单质分子。
(1)完成下列表格。
物质 葡萄糖 氢气 二氧化硫 氦气
构成物质的微粒(写微粒符号) ________ _________ __________ _________
C6H12O6
H2
SO2
He
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
(2)上表微粒中符合道尔顿“复杂原子”的是 _______________(写化学式)。
(3)你同意材料一中加点部分的观点吗?________,请选用(1)表中的物质说明理由_______________________________________________
_____________________。
C6H12O6、SO2
不同意
氢气由氢分子构成,每个氢分子由两个相同的氢原子
构成
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
(4)1911年,英国科学家卢瑟福进行了著名的α粒子轰击金箔实验,根据实验,不能获得的结论是( )
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
A.金原子核带正电
B.金原子核外电子带负电
C.金原子核体积很小
D.金原子核的质量比α粒子大得多
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
(5)从原子论的创立到分子学说的提出,谈谈你对科学理论的发展有何感想_____________________________________________________
_______________________________________________。
科学理论的发展需要大胆创新或科学理论是不断传承和发展的(合理即可)
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
解析:(1)葡萄糖是由葡萄糖分子构成的,葡萄糖分子的符号为C6H12O6;氢气是由氢分子构成的,氢分子的符号为H2;二氧化硫是由二氧化硫分子构成的,二氧化硫分子的符号为SO2;氦气是一种稀有气体,是由氦原子构成的,氦原子的符号为He。
(2)由题干信息可知:道尔顿认为化合物由“复杂原子”构成,“复杂原子”由不同原子按一定整数比例简单构成,则上表微粒中符合道尔顿“复杂原子”的是C6H12O6、SO2。
(3)不同意材料一中加点部分的观点,因为氢气是由氢分子构成的,每个氢分子是由两个相同的氢原子构成。
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
(4)由图可知,带正电的α粒子遇到原子核后,方向发生了偏转,说明金原子核带正电,故A不符合题意;由该实验不能得出金原子核外电子带负电,故B符合题意;由图可知,绝大多数α粒子穿过金箔后仍沿原来的方向前进,只有少量α粒子的运转方向发生了偏转,说明金原子核体积很小,故C不符合题意;由图可知,有少数的α粒子被反弹了回来,说明遇到了质量很大的物质,故金原子核的质量比α粒子大得多,故D不符合题意。
(5)从原子论的创立到分子学说的提出,对科学理论的发展的感想有科学理论的发展需要大胆创新,科学理论是不断传承和发展的。
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
20.(3分)(2024·天津中考)蛋白质由甘氨酸(C2H5O2N)等多种氨基酸构成。计算:
(1)甘氨酸由_____种元素组成(写数值)。
(2)一个甘氨酸分子中含有_____个原子。
(3)75 g甘氨酸中含有氮元素的质量为_____g。
4
10
14
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
第二单元 认识物质的构成
枣庄考情分析
考点 考向 频次 分值 难度 常考题型
认识原子 原子的结构 2024年·T14(2)
2022年·T9(2) 2 * 选择题
原子与离子、分子 2024年·T14(1)
2021年·T10(3) 1
2
2 ** 选择题
填空题
考点 考向 频次 分值 难度 常考题型
认识元素 元素与元素符号 2021年·T2(A) 2
3 *
** 选择题
元素周期表 2024年·T14(1) 2 ** 选择题
认识单质与化合物 2024年·T14(3) 2 ** 选择题
考点 考向 频次 分值 难度 常考题型
物质组成的表示 化学式 2024年·T14(4)
2023年·T12(3) 2 * 选择题
化合价 2024年·T14(4)
2023年·T12(1)
2022年·T2 1 ** 填空题
物质组成的定量表示 计算物质中某元
素的质量分数 2022年·T9 2 * 选择题
单元体系构建
①原子核 ②中子 ③核内质子数 ④该层的电子数 ⑤最外层电子数一般小于4,易失电子,形成阳离子 ⑥最外层电子数一般大于4,易得电子,形成阴离子 ⑦最外层电子数为8(氦为2),既不易得电子,也不易失电子,是一种稳定结构 ⑧具有相同质子数的一类原子的总称 ⑨只由一种元素组成的纯净物 ⑩由两种或两种以上元素组成的纯净物 物质 水分子 氢元素 氧元素 氢原子 氧原子
1.[知识填充]分子和原子的区别是____________________________
________________,实验证明原子也可以再分,原子是由________和__________构成的。原子中各粒子间的关系:核电荷数=________= ____________。
深化研讨 任务达成
任务一 认识原子
在化学变化中,分子可以再分,
原子不能再分
原子核
核外电子
质子数
核外电子数
[应用体验]填写下列空白
图中a、b、c、d依次为________、________、________、________。
氧气分子
氧原子
核外电子
原子核
2.[问题思考]针对卢瑟福用带正电的α粒子轰击金箔的下列现象思考下列问题:
(1)绝大多数α粒子穿过金箔后仍沿原来方向前进说明_____________
_______________________。
(2)少数α粒子发生较大偏转说明________________。
(3)极少数α粒子偏转几乎达到180°说明________________________
_____________。
原子核很小,
原子核外有很大的空间
原子核带正电
原子核体积很小,但质量
却很大
3.[知识填充]相对原子质量 =________________________;相对原子质量≈________+________。
质子数
中子数
[应用体验]判断下列说法的正误
(1)相对原子质量就是原子质量的简称。 ( )
(2)碳原子的相对原子质量为12 g。 ( )
(3)两种原子的相对原子质量之比等于它们的质量之比。 ( )
(4)采用了相对原子质量后,就增大了原子的质量。 ( )
×
×
√
×
4.[知识填充]分子、原子、离子的关系
分子
离子
稀有气体
阳离子
阴离子
原子的结构
1.人类认识原子不同阶段的模型示意图如下,其中卢瑟福的著名的“α粒子轰击金箔”实验起到了关键作用。他们用一束带正电的、质量比电子大得多的高速运动的 α粒子轰击金箔时,发现:大多数α粒子能穿透金箔而不改变原来的运动方向,一小部分α粒子改变了原来的运动方向,有极少数α粒子被弹了回来。结合你所学的知识判断下列有关说法错误的是( )
A.汤姆孙发现了电子,推翻了道尔顿原子不可再分的认识
B.科学的发展道路是漫长而曲折的,探索永无止境
C.电子云模型形象地说明电子在原子核外作无规则的高速运动
D.“α粒子轰击金箔”实验证实了原子内的正电荷集中在居于原子中心的原子核上,相对于整个原子而言,原子核的质量和体积都很小
√
D [汤姆孙发现了电子,提出“葡萄干布丁”模型,推翻了道尔顿原子不可再分的认识,A正确;科学的发展道路是漫长而曲折的,探索永无止境,B正确;电子云模型形象地说明电子在原子核外作无规则的高速运动,C正确; “α粒子轰击金箔”实验证实了原子内的正电荷集中在居于原子中心的原子核上,相对于整个原子而言,原子核的质量占了原子质量的绝大部分,D错误。]
2.(2024·烟台中考)元素观、微粒观是重要的化学观念。下列有关说法错误的是( )
A.繁多复杂的物质世界是由种类有限的元素组成的
B.原子中的质子数和中子数一定相等
C.原子核体积很小,但集中了原子的主要质量
D.原子得失电子变成离子后,元素种类不变
√
B [物质是由元素组成的,虽然元素的种类是有限的,但由元素组成的物质种类是繁多的,A正确;同种元素的原子核内质子数和中子数不一定相等,例如碳-12、碳-13、碳-14的质子数相同,但中子数不同,则原子中质子数和中子数不一定相等,B错误;原子核体积相对于原子体积来说很小,原子的质量主要集中在原子核上,所以原子核的质量大约相当于原子的质量,C正确;元素种类由质子数决定,原子得失电子变成离子,其质子数不变,因此元素的种类不变,D正确。]
相对原子质量
√
4.碳-12原子的实际质量为 1.993×10-26 kg,氧原子的质量为2.657×10-26 kg,那么氧原子的相对原子质量是________(计算结果保留整数),那么由2个氧原子构成的氧气分子(O2)的相对分子质量是________。
16
32
5.(2024·云南中考)如图为金属钠与氯气反应生成氯化钠的示意图,下列说法错误的是( )
原子、离子和分子
A.每个氯离子带一个单位负电荷
B.钠原子在该反应中形成了阴离子
C.氯化钠是由钠离子和氯离子构成的
D.钠离子和氯离子的结构都相对稳定
√
B [氯离子是氯原子得到1个电子后形成的,故每个氯离子带一个单位的负电荷,A正确;在该反应中,钠原子失去电子形成阳离子,B错误;氯化钠是由金属元素和非金属元素组成的化合物,由钠离子和氯离子构成,C正确;钠离子和氯离子的最外层电子数均是8,均达到了相对稳定结构,D正确。]
6.分子、原子和离子都是构成物质的基本粒子。下列说法正确的是( )
A.分子由原子构成,分子比原子大
B.氯化钠是由钠离子和氯离子构成的
C.所有的原子中都含有质子、中子和电子
D.H2O2和H2O中都含有氢分子
√
B [分子由原子构成,同种物质对应的分子比原子大,不同种物质的分子和原子的质量、大小没有可比性,A错误;氯化钠是由钠离子和氯离子构成的,B正确;所有的原子中都含有质子和电子,不一定含有中子,例如普通氢原子中没有中子,C错误;H2O2和H2O分别是由H2O2分子、H2O分子构成,不含有氢分子,错误。]
1.认识原子结构中的几个易错点
(1)氢原子中没有中子。
(2)氦原子最外层电子数为2,但是稳定结构,与镁、钙(最外层电子数也为2)化学性质不同。
(3)质子数不一定等于中子数。
(4)决定原子化学性质的是其最外层电子数,即最外层电子数相同的化学性质相似。
2.判断离子所带电荷数的方法
判断离子所带电荷数可结合相应原子的原子结构示意图进行分析。一般来说,金属原子最外层电子数为几,其离子就带几个单位的正电荷;非金属原子得几个电子变为8电子稳定结构,其离子就带几个单位负电荷。
3.判断原子、阳离子、阴离子的方法
(1)阳离子:质子数>核外电子数。
(2)原子:质子数=核外电子数。
(3)阴离子:质子数<核外电子数。
4.相对原子质量不是原子的实际质量,它是一个比值,它与原子的实际质量成正比,即原子的实际质量越大,它的相对原子质量也就越大,反之,亦然。
1.[知识填充]
(1)元素是指具有相同________(即________)的一类_______的总称。元素可分为金属元素、____________和_____________三类。
(2)分布:地壳中含量最多的元素是____,其他含量前几位的元素是_____、_____、_____、_____。
任务二 认识元素
质子数
核电荷数
原子
非金属元素
稀有气体元素
O
Si
Al
Fe
Ca
(3)两个决定:决定元素种类的是__________,决定元素化学性质的是________________________________。
(4)元素符号的意义:①宏观:表示一种________;②微观:表示这种元素的__________;③由原子直接构成的物质,元素符号还可表示该物质。例如:H a.表示_________;b.表示一个_________。
质子数
原子的最外层电子数
元素
一个原子
氢元素
氢原子
(5)元素周期表中横行称为________,元素周期表中共有_____个,元素的周期数=原子的___________。元素周期表中“格”的含义有:
周期
七
电子层数
元素符号
元素名称
相对原子质量
原子序数
2.[应用体验]判断下列说法的正误
(1)地壳中含量最多的金属元素是铁。 ( )
(2)两种元素的根本区别在于相对原子质量不同。 ( )
(3)Fe2+和Fe3+ 核外电子数不同,但属于同种元素。 ( )
(4)水(H2O)中不含金属元素。 ( )
(5)镁的元素符号可表示为MG。 ( )
(6)2H表示两个氢元素。 ( )
×
×
√
√
×
×
3.[概念对比]
单质是__________组成的________;化合物是__________________组成的________;氧化物是指由__________组成的_________,其中一种元素是氧元素。
请将单质、化合物、氧化物填入下表①②③。
一种元素
纯净物
两种或两种以上元素
纯净物
两种元素
化合物
单质
化合物
氧化物
元素与元素符号
1.下列符号既可表示一种物质,又可表示一种元素,还可以表示一个原子的是( )
A.O B.2C C.Fe D.N2
√
C [O可表示氧元素,表示一个氧原子,但不能表示物质,氧气应表示为O2,A不符合题意;2C可表示2个碳原子,不是元素符号,B不符合题意;Fe属于金属元素,可表示铁元素,表示一个铁原子,还能表示铁这一物质,C符合题意;N2是氮气的化学式,不是元素符号,D不符合题意。]
2.(2024·陕西中考)下列生活中常见物质的成分只含金属元素的是
( )
A.小苏打:NaHCO3 B.纯金:Au
C.酒精:C2H5OH D.木炭:C
√
B [小苏打是碳酸氢钠的俗称,化学式为NaHCO3,含有氢、碳、氧、钠元素,其中碳、氢、氧元素属于非金属元素,钠元素属于金属元素,A不符合题意;纯金的化学式为Au,只含有金属元素,B符合题意;酒精的化学式为C2H5OH,含有碳、氢、氧三种非金属元素,C不符合题意;木炭的主要成分是碳,属于非金属元素,D不符合题意。]
3.5G通信技术是一大科技亮点,5G通信芯片由氮化镓材料制成。已知镓原子的结构示意图和镓元素在元素周期表中的信息如图所示,下列说法不正确的是( )
A.镓元素属于金属元素
B.镓原子的中子数为31
C.镓元素的相对原子质量为69.72
D.镓元素在化合物中的化合价通常显+3价
元素周期表
√
B [镓元素带有“钅”字旁,属于金属元素,A正确;在原子结构示意图中,圆圈内数字表示核内质子数,镓元素的质子数是31,而不是中子数为31,B错误;根据元素周期表中的信息图可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为69.72,C正确;由镓原子结构示意图可知,镓原子的最外层电子数是3,在反应过程中容易失去三个电子形成带三个正电荷的离子,则Ga通常为+3价,D正确。]
4.图1是几种元素在元素周期表中的部分信息,图2是几个微粒的结构示意图。下列说法不正确的是( )
A.图1中X名称为硫,元素符号为S,与氧元素化学性质相似
B.图1中X元素与磷、氯元素位于同周期
C.图2中表示镁原子的结构示意图是b
D.图2中属于同一种元素的是c与d
√
C [X元素为第16号元素,元素名称为硫,元素符号为S,硫和氧原子的最外层电子数均为6,化学性质相似,A正确;X元素与磷、氯元素的原子的核外电子层数都为3,位于同周期,B正确;图2中的 b中质子数为12,电子数为10,表示镁离子的结构示意图,C不正确;质子数相同,属于同一种元素,故图2中属于同一种元素的是c与d,D正确。]
5.(2024·福建中考)下列物质可制造用于治疗癌症等疾病的纳米酶,其中属于单质的是( )
A.金 B.氧化铁
C.氧化铈 D.四氧化三铁
认识单质与化合物
√
A [金是由金元素组成的纯净物,属于单质,A符合题意;氧化铁是由铁、氧元素组成的纯净物,氧化铈是由铈、氧元素组成的纯净物,四氧化三铁是由铁、氧元素组成的纯净物,均属于化合物,B、C、D不符合题意。]
6.(2024·眉山中考)下列各图中“●”和“○”分别表示不同元素的原子,其中表示化合物的是( )
A B
C D
√
B [该物质由三种分子混合而成,A属于混合物;该物质由同种分子构成,该分子由两种原子构成,B属于化合物;该物质由同种分子构成,该分子由同种原子构成,C属于单质;该物质由同种分子构成,该分子由同种原子构成,D属于单质。]
1.元素与原子的区别
元素只讲种类,不讲个数;原子既讲种类又讲个数。
2.元素周期表的应用
(1)元素的周期数=元素原子的电子层数。
(2)同一族(纵列)最外层电子数相等,化学性质相似。
(3)单元格的应用:可判断元素的类别,依据元素名称的偏旁确定该元素是金属元素还是非金属元素:一般带“钅”字旁的为金属元素(汞是唯一不带“钅”的金属元素);带“气”“氵”或“石”字旁的为非金属元素,稀有气体元素包括:氦、氖、氩、氪等元素。
[知识填充]
(1)概念:用________和______表示________________,叫作化学式。如过氧化氢的化学式为________,二氧化碳的化学式为________。
任务三 物质组成的表示
元素符号
数字
物质组成的式子
H2O2
CO2
(2)化学式代表的含义
氢元素
氧元素
过氧化氢
两个氢原子
两个氧原子
过氧化氢这种物质
过氧化氢分子
(3)化合价可确定不同元素原子化合时的________比。化合价的表示方法有以下三点:
①化合价的正、负和数目标在元素和原子团符号的_______方;
②符号(即正、负)在____,数目在_____;
③价数为“1”时,不能省略。
(4)化合价原则:在化合物中,各元素的正负化合价之和为_____。
个数
正上
前
后
零
化学式
1.(2024·宁夏中考)水是生命之源,在化学上可以用“H2O”表示,有关水的组成和构成的下列说法正确的是( )
A.水是由水分子构成的
B.水是由氢气和氧气组成的
C.水是由氢原子和氧原子构成的
D.水是由两个氢元素和一个氧元素组成的
√
A [水是由水分子构成的,A正确;水是纯净物,水中既不含氢气也不含氧气,B错误;在描述物质组成时,分子和原子要互相对应,如:水分子是由氢原子和氧原子构成的,是正确的,C表述方法错误;元素只讲种类,不讲个数,D错误。]
√
3.太原北齐壁画博物馆于2023年12月20日正式对外开放,展示了古墓中的千年华彩。下列壁画颜料所含主要物质中,元素化合价标注正确的是( )
化合价
A.白垩: B.赭石:
C.密陀僧: D.炭黑:
√
C [A.钙元素为+2价,氧元素为-2价,设碳元素化合价为a,(+2)+a+(-2)×3=0,a=+4,错误;B.氧元素为 -2价, 设铁元素化合价为b,2b+(-2)×3=0,b=+3,错误;C.氧元素为-2价,设铅元素化合价为c,c+(-2)=0,c=+2,正确;D.单质中元素化合价为0,错误。]
4.下列物质的化学式中,书写正确的是( )
A.碳酸钙 CaCO3 B.氯化铁 FeCl2
C.氧化钙 CaOH D.碳酸钠 NaCO3
√
A [碳酸钙中钙元素显+2价,碳酸根离子显-2价,其化学式为CaCO3,A正确;氯化铁中铁元素显+3价,氯元素显-1价,其化学式为FeCl3,B错误;氧化钙中钙元素显+2价,氧元素显-2价,其化学式为CaO,C错误;碳酸钠中钠元素显-1价,碳酸根离子显-2价,其化学式为Na2CO3,D错误。]
1.化学符号周围的数字
(1)前:写在元素符号、化学式、离子前面的数字仅表示其对应的原子、分子、离子的个数(数字可改变)。
(2)后:写在离子符号或原子团右上角的数字表示该离子或原子团的1个粒子所带的电荷数(数字不可改变)。注意:离子符号右上角先写数字再写正负号,数字为“1”时要省略。
(3)上:写在元素符号或原子团正上方的数字表示该元素或原子团的化合价。注意:正上方先写正负号再写数字,数字为“1”时不能省略。
(4)下:写在化学式右下角的数字表示一个分子中含有该原子或原子团的个数(数字不可改变)。
2.化合价的应用
(1)据化学式求化合价(“知式推价”)
依据:在化合物中,各元素的正负化合价之和为零。
(2)根据化合价书写化学式(“知价写式”)
方法:“十字交叉”法:先排序,后标价,再约简,后交叉。
1.[知识填充]
(1)化学式中各原子的_____________的总和,就是该物质的化学式量,对于由分子构成的物质,其化学式量也叫相对分子质量。如:H2SO4的相对分子质量=___________________________(列式子)。
(2)各元素的质量比=_____________×________之比。
(3)物质中某元素的质量分数=______________________×100%。
任务四 物质组成的定量表示
相对原子质量
1×2+32+16×4=98
相对原子质量
原子个数
×
×
×
计算相对分子质量
1.下列相对分子质量计算正确的是( )
A.NO2:相对分子质量=14×16×2=448
B.CuSO4·5H2O :相对分子质量=64+32+16×4+5+1×2+16×1
C.H2O2:相对分子质量=1×2+16×2=34克
D.Ca(OH)2:相对分子质量=40+(16+1)×2=74
√
D [NO2的相对分子质量=14+16×2=46,A错误;CuSO4·5H2O的相对分子质量=64+32+16×4+5×(1×2+16)=250,B错误;H2O2的相对分子质量=1×2+16×2=34,但相对分子质量的单位不是克,C错误;氢氧化钙的相对分子质量=40+(16+1)×2=74,D正确。]
2.(2024·乐山中考)将充满空气的气球放置在盛有空气的密闭容器中,气球沉入底部(如图甲)。若要使气球位置出现图乙中的变化,可以将密闭容器中的空气换成下列气体中的( )
A.氢气 B.甲烷
C.二氧化碳 D.一氧化碳
√
C [将充满空气的气球放置在盛有空气的密闭容器中,气球沉入底部,若要使气球位置出现图乙中的变化,可以将密闭容器中的空气换成密度比空气大的气体,一般在相同条件下,相对分子质量越大,其气体密度越大,空气平均相对分子质量为29,气体相对分子质量大于29的,气体密度就大于空气的密度,据此可知:氢气的相对分子质量为2、甲烷(CH4)的相对分子质量为16、二氧化碳的相对分子质量为44、一氧化碳的相对分子质量为28,C符合题意。]
3.(2024·山西中考)早在距今约六千年的半坡文化时期,陶制品上便出现了最早的彩绘。彩绘颜料种类多样,有红彩、黑彩和白彩(主要成分是硫酸钙等),硫酸钙(CaSO4)中,氧元素与钙元素的质量比为( )
A.5∶8 B.8∶5
C.5∶6 D.6∶5
计算组成物质的各元素的质量比
√
B [硫酸钙(CaSO4)中,氧元素与钙元素的质量比为(16×4)∶(40×1)=8∶5,故选B。]
4.景德镇被称为“瓷都”,得益于景德镇的高岭土[主要成分:Al2(Si2O5)(OH)x],它是制造陶瓷器的优良原料。经分析,其中铝、氧元素质量比为3∶8,则( )
A.x=1 B.x=2
C.x=3 D.x=4
√
5.我国科学家发现的千金藤素(C37H38N2O6)获得国家发明专利授权。以下关于千金藤素的说法不正确的是( )
A.千金藤素由碳、氢、氮、氧四种元素组成
B.千金藤素中碳、氢、氮、氧四种元素的质量比是37∶38∶2∶6
C.千金藤素分子是由碳原子、氢原子、氮原子和氧原子构成
D.千金藤素中碳元素的质量分数最大
计算物质中某元素的质量分数
√
B [由化学式可知,千金藤素由C、H、N、O四种元素组成,A正确;千金藤素中碳、氢、氮、氧四种元素的质量比是 (12×37)∶38∶(14×2)∶(16×6)=222∶19∶14∶48,B错误;千金藤素由千金藤素分子构成,千金藤素分子由碳原子、氢原子、氮原子和氧原子构成,C正确;千金藤素中碳、氢、氮、氧四种元素的质量比是222∶19∶14∶48,故碳元素的质量分数最大,D正确。]
6.“开门七件事,柴米油盐酱醋茶”。食醋中含有醋酸(CH3COOH)。计算:
(1)一个醋酸分子中含有____个原子;
(2)醋酸的相对分子质量为_____;
(3)醋酸中碳、氢元素的质量比为________(填最简比);
(4)醋酸中碳元素的质量分数为________。
8
60
6∶1
40%
7.(2024·长春中考)2024年4月,我国搭载了神舟十八号载人飞船的火箭发射成功。化学为航空航天领域的发展提供了强有力的支撑。
宇航员在太空中钙质流失严重,需要补钙。如图是某钙片标签的部分信息,下列说法正确的是( )
综合计算
碳酸钙D3片
【成分】碳酸钙(CaCO3)、维生素D3等。
【规格】每片含碳酸钙0.75 g。
【用法用量】口服,咀嚼后咽下。
成人:一次2片,一日1次,儿童酌量。
A.服用钙片可预防甲状腺肿大
B.碳酸钙由3种元素组成
C.碳酸钙的相对分子质量是100 g
D.按用量服用,成人每天从钙片中摄取钙元素的质量为0.3 g
√
8.中华文化博大精深,茶道、中医等处处蕴含着古代劳动人民的智慧。
(1)茶韵悠长,科学研究证实茶叶中含茶氨酸(化学式为C7H14N2O3)、锌、硒等多种对人体有益的成分。请计算:
①茶氨酸的相对分子质量为________。
②茶氨酸中氢、氮元素的质量比为________。
③________g茶氨酸中氮元素的质量为5.6 g。
174
1∶2
34.8
(2)黄芩是中药中的常见药,具有清热燥湿、消炎抗菌、消肿的功能。汉黄芩素(C6H12O5),是从黄芩中提取出来的,具有抗癌作用,28.4 g汉黄芩素中碳元素质量为________。
12.47 g
化学式的计算要根据相关的公式和概念进行,几种计算间的关系可用如图反映:
1.下列物质是由分子构成的是( )
A.氢氧化钾 B.铝
C.金刚石 D.甲烷
题号
1
3
5
2
4
6
8
7
9
10
分层评价 即时反馈
√
题号
1
3
5
2
4
6
8
7
9
10
D [大多数固态非金属单质、金属和稀有气体是由原子直接构成的,气态的非金属单质和由非金属元素组成的化合物是由分子构成的,一般含有金属元素和非金属元素的化合物是由离子构成的。根据上述分析可知:氢氧化钾是由钾离子和氢氧根离子构成的,铝是由铝原子构成的,金刚石是由碳原子构成的,A、B、C均不符合题意;甲烷是由甲烷分子构成的,D符合题意。]
2.2024年6月25日,嫦娥六号探测器返回地球,带回了月背土壤
1 935.3克。经检测月球矿物中含有丰富的氦-3,氦-3是可控核聚变的重要原料。如图是氦-3原子的构成示意图,下列说法正确的是
( )
A.含有2个中子
B.电子数和质子数相等
C.核电荷数为1
D.相对原子质量为4
题号
1
3
5
2
4
6
8
7
9
10
√
B [由题图中可看出:氦-3原子含有1个中子,A项不正确;氦-3原子中电子数和质子数都是2,相等,B项正确;核内质子数是2,所以核电荷数为2,C项不正确;相对原子质量≈质子数+中子数,即为3,D项不正确。]
题号
1
3
5
2
4
6
8
7
9
10
3.构成物质的微粒有分子、原子、离子等。下列物质由离子构成的是( )
题号
1
3
5
2
4
6
8
7
9
10
A.氧气 B.水
C.氯化钠 D.金刚石
√
C [氧气和水均由分子构成,A、B项不符合题意;氯化钠由钠离子和氯离子构成,C项符合题意;金刚石由碳原子构成,D项不符合题意。]
题号
1
3
5
2
4
6
8
7
9
10
4.镍元素可以维持生理结构、刺激生血、影响酶活性等作用,但是需要合理使用才可以防止产生不利影响。镍元素在元素周期表中的相关信息如图所示,下列关于该元素说法错误的是( )
A.图2中x=2
B.该元素位于元素周期表的第四周期
C.该元素的相对原子质量为58.69 g
D.该元素在化学反应中容易失去电子变
成阳离子
题号
1
3
5
2
4
6
8
7
9
10
√
C [原子中,核电荷数=核内质子数=核外电子数=原子序数,所以x=28-2-16-8=2,A正确;原子核外电子层数是几,所处周期就是几,镍原子核外电子层数是4,位于元素周期表的第四周期,B正确;镍元素的相对原子质量为58.69,C错误;镍原子最外层电子数是2,在反应中易失去电子,D正确。]
题号
1
3
5
2
4
6
8
7
9
10
5.“宏观—微观—符号”相结合是化学学科独有的思维方式。下列化学用语书写正确的是( )
A.2个氮原子—N2
B.氧化镁—MgO2
C.2个水分子—2H2O
D.氯离子—Cl-1
题号
1
3
5
2
4
6
8
7
9
10
√
C [2个氮原子表示为2N,A错误;氧化镁中镁元素显+2价,氧元素显-2价,根据化学式的书写规则可知,氧化镁的化学式为MgO,B错误;正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,所以2个水分子表示为2H2O,C正确;在表示该离子时,离子符号右上角先写数字再写正负号,带1个电荷时,1要省略,所以氯离子表示为Cl-,D错误。]
题号
1
3
5
2
4
6
8
7
9
10
6.如图是四种微粒的结构示意图。下列有关说法错误的是( )
题号
1
3
5
2
4
6
8
7
9
10
A.①③属于同种元素
B.②的微粒符号可表示为O2-
C.②③可形成化合物NaO
D.④中x的值为8
√
C [质子数决定元素种类,①③质子数相同都是11,属于同种元素,A正确;②的质子数为8,表示氧元素,核外电子数=2+8=10>8,表示阴离子,即为氧离子,故②微粒符号可表示为O2-,B正确;②质子数=8<核外电子数(2+8=10),表示带2个负电荷的氧离子,③质子数=11<核外电子数(2+8=10),表示带1个正电荷的钠离子,故可形成化合物Na2O,C错误;由于④中质子数=18=原子序数,是氩元素,属于稀有气体元素,则最外层电子数x的值为8,为稳定结构,D正确。]
题号
1
3
5
2
4
6
8
7
9
10
题号
1
3
5
2
4
6
8
7
9
10
√
B [由唾液酸的化学式为C11H19NO9可知,唾液酸由碳、氢、氮、氧四种元素组成,A正确;由唾液酸的化学式为C11H19NO9 可知,唾液酸由唾液酸分子构成,1个唾液酸分子由11+19+1+9=40个原子构成,B错误;由唾液酸的化学式为C11H19NO9可知,唾液酸中碳、氧元素的原子个数比为11∶9,C正确;由唾液酸的化学式为C11H19NO9可知,唾液酸中碳、氢、氮、氧四种元素的质量比为(12×11)∶(1×19)∶14∶(16×9)=132∶19∶14∶144,所以唾液酸中氧元素的质量分数最大,D正确。]
题号
1
3
5
2
4
6
8
7
9
10
8.下列各组物质,按单质、化合物、混合物顺序排列的是( )
A.固态氮、干冰、冰水共存物
B.稀有气体、氯化氢气体、液化石油气
C.液态氧、蒸馏水、透明的河水
D.天然气、煤、石油
题号
1
3
5
2
4
6
8
7
9
10
√
C [固态氮由氮元素一种物质组成,属于单质,干冰由碳和氧两种元素组成,属于化合物,冰水共存物由氢和氧两种元素组成,属于化合物,A错误;稀有气体中可能含有氦气、氖气等多种气体,属于混合物,氯化氢气体中含有氢和氯两种元素组成,属于化合物,液化石油气中含有氢气、一氧化碳等气体,属于混合物,B错误;液态氧由氧元素组成,属于单质,蒸馏水由氢和氧两种元素组成,属于化合物,透明的河水中含有水和溶进去的空气等物质属于混合物,C正确;天然气、煤、石油三大化石燃料都属于混合物,D错误。]
题号
1
3
5
2
4
6
8
7
9
10
9.俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形,如表为元素周期表的部分元素的相关信息,利用该表回答相关问题。
题号
1
3
5
2
4
6
8
7
9
10
题号
1
3
5
2
4
6
8
7
9
10
周期 ⅠA 0
1 1 H
1.008 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 2 He
4.003
2 3 Li
6.94 4 Be
9.012 5 B
10.81 6 C
12.01 7 N
14.01 8 O
16.00 9 F
19.00 10 Ne
20.18
3 11 Na
22.99 12 Mg
24.30 13 Al
26.98 14 Si
28.08 15 P
30.97 16 S
32.06 17 Cl
35.45 18 Ar
39.95
(1)第16号元素的原子在化学反应中易______(填“得到”或“失去”)电子,第11号元素和第16号元素形成的化合物的化学式是________。
(2)以下是A、B、C三种粒子的结构示意图,其中属于同种元素的是________(填字母,下同)。
题号
1
3
5
2
4
6
8
7
9
10
得到
Na2S
AC
(3)“芯片”是电子产品的核心部件,氮化镓是制造芯片的材料之一,如图是镓元素(Ga)的原子结构示意图及元素周期表的一部分。下列说法不正确的是________。
题号
1
3
5
2
4
6
8
7
9
10
B
A.镓属于金属元素,m=3
B.镓化学性质比较活泼,易形成阳离子Ga+3
C.镓元素的位置应该在Z处
D.镓的最外层电子数与Al相同
题号
1
3
5
2
4
6
8
7
9
10
(4)原子由质子、中子、电子等粒子构成,若以“ ”“ ”“ ”分别代表电子、中子、质子,如图为各微粒的结构示意图,其中属于同种元素的是________,带正电的是______。
题号
1
3
5
2
4
6
8
7
9
10
AD
C
解析:(1)最外层电子数大于4易得到电子,最外层电子数小于4易失去电子,第16号元素的原子最外层有6个电子,所以易得到2个电子;第11号元素为Na,钠最外层有1个电子,容易失去1个电子,化合价为+1价,Na和S形成的化合物的化学式为Na2S。
(2)质子数决定元素的种类,图中AC的质子数相同,故选:AC。
题号
1
3
5
2
4
6
8
7
9
10
(3)镓带“钅”字旁,属于金属元素,原子中,质子数=核外电子数,即31=2+8+18+m,解得m=3,A正确;镓原子最外层电子数是3,在化学反应中易失去3个电子而形成带3个单位正电荷的阳离子,镓化学性质比较活泼,易形成阳离子Ga3+,B错误;根据元素周期表中的表格可知,左上角的数字表示原子序数,原子中原子序数=核电荷数=质子数=核外电子数,由镓原子的结构示意图可知,其核内质子数为31,则该元素的原子序数为31,所以镓元素的位置应该在Z处,C正确;由元素周期律可知,同一主族元素的原子最外层电子数相同,镓的最外层电子数应与Al相同,D正确。
(4)由题图可知,AD质子数都为1,属于同种元素,C质子数为3,核外电子数2,属于阳离子带正电。
题号
1
3
5
2
4
6
8
7
9
10
10.如图为某厂生产的补钙片标签上的部分文字,请仔细阅读后回答下列问题:
题号
1
3
5
2
4
6
8
7
9
10
[主要原料]碳酸钙(CaCO3),维生素D
(其他配料不含钙元素)
[功效成分]补钙
每片含钙(以Ca计)500 mg、
维生素D 1 001U
[食用方法]每日一次,每次1片
[规 格]2.5 g/片
(1)维生素D种类较多,其中维生素D2的化学式为C28H44O,试计算:
①维生素D2的相对分子质量为________。
②维生素D2中碳、氢、氧三种元素的质量比为__________。
(2)每片钙片中含碳酸钙的质量为______克。
题号
1
3
5
2
4
6
8
7
9
10
396
84∶11∶4
1.25
题号
1
3
5
2
4
6
8
7
9
10
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
(时间:40分钟 满分:60分)
一、选择题(本题包括15小题,每小题2分,共30分)
1.某方便面面饼的营养成分表如图所示,表中“钠”指的是( )
限时提能训练(二) 认识物质的构成
[A]单质 [B]分子 [C]元素 [D]原子
主要营养成分表
项目 面饼(每份115 g)
能量 2 318 kJ
蛋白质 10.0 g
油脂 23.6 g
碳水化合物 75 g
钠 993 mg
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
C [物质由元素组成,表中“钠”不是以单质、原子的形式存在的,而是以元素的形式存在,与具体形态无关,故选C。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
2.嫦娥六号月球取土,引领全球探月浪潮,2024年6月25日嫦娥六号顺利返回地球,带回的1 935.3 g月壤中含有大量安全无污染的核聚变原料He-3(如图所示)。下列关于He-3的说法正确的是( )
[A]He-3是一种新元素
[B]He-3原子中含有1个质子,2个电子
[C]He-3原子中含有3个质子,没有中子
[D]He-3原子中含有2个质子,1个中子,2个电子
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
D [He-3属于氦元素,不属于新元素,A错误;在原子中,质子数=核外电子数,He-3原子中含有2个质子,2个电子,B错误;He-3原子中含有2个质子,中子数为3-2=1,C错误;He-3原子中含有2个质子,1个中子,2个电子,D正确。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
3.就化学本身的特点来看,“见著知微”使我们更容易踏入化学学科的大门。下列物质是由分子构成的是( )
[A]氯化钠 [B]水
[C]氢氧化钠 [D]金刚石
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
B [氯化钠是由钠离子和氯离子构成的,水是由水分子构成的,氢氧化钠是由钠离子和氢氧根离子构成的,金刚石是由碳原子构成的,故B符合题意。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
4.下列有关分子、原子、离子、元素的说法中,正确的是( )
[A]原子都是由质子、中子、核外电子构成的
[B]同种元素的原子核内质子数和中子数一定相等
[C]氯化钾的结构与氯化钠相似,则氯化钾是由氯离子和钾离子构成的
[D]保持水的化学性质的最小粒子是氢原子和氧原子
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
C [原子不都是由质子、中子、核外电子构成的,氢原子的原子核中没有中子,A不正确;元素是具有相同质子数的一类原子的总称,同种元素的原子核内质子数一定相等,但中子数不一定相等,B不正确;氯化钾的结构与氯化钠相似,则氯化钾是由氯离子和钾离子构成的,C正确;水由水分子构成,则保持水的化学性质的最小粒子是水分子,D不正确。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
5.图中有关二氧化碳的说法正确的是( )
[A]① [B]② [C]③ [D]④
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
B [二氧化碳由碳元素和氧元素组成,或二氧化碳分子由碳原子和氧原子构成,①错误,②正确;一个二氧化碳分子由一个碳原子和两个氧原子构成,③错误;二氧化碳是由一种物质组成的,属于纯净物,④错误。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
6.如图是“多种多样的物质及其组成”。下列有关说法不正确的是( )
[A]分子由原子构成
[B]氨(NH3)是由氨元素组成的
[C]氯化钠由Na+和Cl-构成
[D]构成物质的粒子有分子、原子和离子
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
B [分子是由原子构成的,A项正确;氨(NH3)是由氮元素与氢元素组成的,不存在氨元素,B项错误;氯化钠是由Na+和Cl-构成的,C项正确;由图示可知,构成物质的粒子有分子、原子和离子,D项正确。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
D [水中氢元素显+1价,氧元素显-2价,A错误;磷酸钙由钙离子和磷酸根离子构成,钙离子属于阳离子,符号应为Ca2+,B错误;氧是8号元素,在原子中,原子序数=质子数=核外电子数,故氧
原子核外电子排布为2、6,故氧原子的结构示意图为 ,C错
误;由化学式可知,磷酸钙由Ca、P、O三种元素组成,D正确。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
8.下列化学符号中数字表示的意义正确的是( )
[A]CO2:“2”表示一个二氧化碳分子中含有两个氧原子
[B]2Fe:“2”表示两个铁元素
[C] “+2”表示铜离子带有两个单位正电荷
[D]O2-:“2”表示氧元素的化合价为负二价
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
A [标在化学式中元素右下角的数字表示一个分子中所含原子的数目,CO2中的“2”表示一个二氧化碳分子含有两个氧原子,A正确;标在元素符号前面的数字表示原子的个数,2Fe中的“2”表示2个铁原子,B错误;标在元素符号正上方的数字表示该元素化合价的数值, 中的“+2”表示铜元素的化合价为+2价,C错误;标在元素符号右上角的数字表示1个离子所带的电荷数,O2-中的“2”表示一个氧离子带有两个单位的负电荷,D错误。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
9.2024年全国民航工作会议提出,将推动国产大飞机C919走出国门。C919大型客机机身材料大量使用了第三代铝锂合金。如图为锂和铝两种元素在元素周期表中的信息及相关的离子结构图。以下说法正确的是( )
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
[A]m=2,n=8
[B]氧化锂的化学式为Li2O
[C]图b表示铝离子,离子符号为Al+3
[D]图中两种元素的本质区别是核内中子数不同
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
B [在元素周期表中,元素名称左上角的数字表示原子序数,原子序数=质子数,故m=3,在原子中,质子数=核外电子数,故铝原子的核外电子排布为2、8、3,铝离子是铝原子失去最外层3个电子后形成的,故n=8,A错误;锂原子最外层电子数为1,在化学反应中,容易失去最外层1个电子,即锂元素化合价为+1价,氧元素通常显-2价,故氧化锂的化学式为Li2O,B正确;图b表示铝离子,其由原子失去3个电子形成,即带三个单位的正电荷,离子符号为Al3+,C错误;元素是质子数相同的一类原子的总称,图中两种元素的本质区别是质子数不同,D错误。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
11.用数轴表示某些化学知识直观、简明、易记,下列数轴表示不正确的是( )
[A]地壳中元素含量由高到低:
[B]不同元素的核电荷数依次递减:
[C]含氮物质中氮元素的化合价由低到高:
[D]一个分子中所含的原子数由少到多:
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
B [地壳中元素含量由高到低的顺序是氧、硅、铝、铁、钙,A正确;钠、镁、铝、硅、磷的核电荷数依次递增,B错误;利用化合物中正负化合价代数和为零的原则,根据H为+1价、Na为+1价、O为-2价,K为+1价,可计算NH3中N为-3价、N2中N为0价、NaNO2中N为+3价、KNO3中 N为+5价,与数轴关系一致,C正确;一个氮气分子中含有2个原子,一个二氧化碳分子中含有3个原子,一个氨气分子中含有4个原子,一个甲烷分子中含有5个原子,与数轴关系一致,D正确。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
12.(2024·潍坊中考)戊二醛是一种广谱高效消毒剂,其分子结构如图所示(“—”“===”表示原子之间相互连接),下列说法正确的是( )
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
[A]戊二醛属于有机物,化学式为C5H8O2
[B]戊二醛中氧元素的质量分数最大
[C]戊二醛中碳、氢、氧三种元素的质量比为5∶8∶2
[D]保持戊二醛化学性质的最小粒子是碳原子、氢原子、氧原子
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
A [由题图可知,每个戊二醛分子由5个碳原子、8个氢原子、2个氧原子构成,化学式为C5H8O2,戊二醛是含有碳元素的化合物,属于有机物,A正确;戊二醛中碳、氢、氧三种元素的质量比为(12×5)∶(1×8)∶(16×2)=15∶2∶8,其中碳元素的质量分数最大,B、C错误;分子是保持物质化学性质的最小粒子,保持戊二醛化学性质的最小粒子为戊二醛分子,D错误。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
13.(2024·枣庄中考)下列物质中,前者属于氧化物,后者属于混合物的是( )
[A]熟石灰、海水
[B]冰水混合物、食盐水
[C]干冰、硫酸钠
[D]生铁、二氧化锰
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
B [熟石灰是氢氧化钙,属于碱;海水含有许多可溶性盐,属于混合物,A错误。冰水混合物只有水,水是由氢、氧元素组成的化合物,属于氧化物;食盐水含有氯化钠和水,属于混合物,B正确。干冰是固体二氧化碳,是由碳、氧元素组成的化合物,属于氧化物;硫酸钠是一种物质,属于纯净物,C错误。生铁是含碳的铁合金,属于混合物;二氧化锰是由锰、氧元素组成的化合物,属于氧化物,D错误。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
14.元素周期表是化学领域最重要的工具之一,对于研究和理解元素的性质至关重要。下图是元素周期表的一部分,请利用所学知识判断说法正确的是( )
[A]元素①的名称叫硅,属于非金属元素
[B]原子序数:②>①>③
[C]元素②的原子容易失去最外层电子
[D]元素②和元素③化学性质相似
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
C [由题图可知,元素①的原子序数是6,是碳元素,属于非金属元素,A项错误;根据元素周期表中,同一周期从左到右原子序数依次递增,则原子序数: ③>②>①,B项错误;由题图可知,元素②的原子序数是11,原子结构示意图为 ,最外层电子数为1,在化学反应中容易失去最外层电子,C项正确;元素②
最外层电子数是1,元素③ 最外层电子数为6,二者最外层电子数不同,化学性质不相似,D项错误。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
15.如图是五种粒子的结构示意图,下列说法正确的是( )
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
[A]若①结构的原子的相对原子质量为27,则该原子核内中子数为13
[B]①③⑤化学性质相似是因为它们原子的最外层电子数相同
[C]①②③④⑤均属于金属元素且都易失电子
[D]②结构的元素在元素周期表中的位置为第三周期
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
D [①结构中粒子的质子数为13,根据相对原子质量≈质子数+中子数,可得中子数=相对原子质量-质子数=27-13=14,A错误;①结构中质子数>核外电子数,属于阳离子,③和⑤结构中的质子数=核外电子数,属于原子,且③⑤结构中的最外层电子数相等,因此③⑤化学性质相似,与①性质不相同,B错误;①②③⑤结构对应的元素均为金属元素,④结构对应的元素为氯元素,属于非金属元素,C错误;②结构的元素是镁元素,在周期表中位于第三周期,D正确。]
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
二、填空与简答题(本题包括3小题,共18分)
16.(5分)(2024·枣庄中考)世界是物质的。从宏观角度看,物质是由元素组成的;从微观角度看,物质又是由分子、原子和离子等微观粒子构成的。
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
根据图示信息,回答下列问题:
(1)图1中铍原子的质子数为____,铍属于________(填“金属”或“非金属”)元素。
(2)图2中最外层达到相对稳定结构的微观粒子是________(填字母),与C属于同种元素的是________(填字母)。
(3)图2中B单质是由________(填“分子”或“原子”)构成的。
(4)图2中A和B两种元素组成化合物的化学式为________,其中A元素的化合价为________价。
4
金属
C
B
原子
Na2S
-2
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
解析:(1)图1中铍原子的原子序数(左上角数字)是4,根据原子序数=核电荷数=质子数=核外电子数,则铍原子的质子数是4;铍属于金属元素。
(2)最外层电子数为8(第一个电子层为2)属于相对稳定结构,则图2中最外层达到相对稳定结构的微观粒子是C。
元素的种类由质子数决定,质子数相同的一类原子属于同一种元素,B与C质子数(圆圈内数字)相同,则与C属于同种元素的是B。
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
(3)图2中B是钠,钠单质由原子构成。
(4)图2中A(硫)和B( 钠)两种元素组成化合物,钠元素显+1价,则化学式为Na2S,其中A(硫)元素的化合价为-2价。
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
17.(2分)2023年9月21日,天宫课堂第四课在梦天舱上进行授课。梦天舱载有世界上第一套由冷原子锶光钟等组成的空间冷原子钟,该钟是目前世界上最精确的钟。锶元素的原子序数为38,一个锶原子的质量为1.465×10-25 kg,一个碳-12原子的质量为1.993×10-26 kg。 请计算:(1)锶的核外电子数为________。
(2)锶原子的相对原子质量:____________________(写出计算式,不用求算)。
38
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
18.(11分)“宏观辨识与微观探析”是化学学科的核心素养之一。在宏观、微观和符号之间建立联系是化学学科的重要思维方式。
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
(1)图1是两个微粒的结构模型示意图,这两个微粒是否属于同种元素?______(填“是”或“否”),依据是_______________________若表示He-3原子,3为相对原子质量,则对应图1中的______(填“a”或“b”)。
(2)图2中①~④是四种物质的微观模型图。
由离子构成的是图________(填序号,下同),可以表示铁原子的是图________,表示单质的是________。
否
这两个微粒核内质子数不同
b
④
①
①②
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
(3)如图3是几个粒子的结构示意图:
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
①图a为某原子结构示意图,其中m的值为______,该原子的元素的化学性质与________(填字母)的化学性质相似;
②图b原子在化学反应中易________(填“得到”或“失去”)电子,形成________(用化学符号表示);
③上述粒子中,属于阳离子的是____________(用化学符号表示)。
16
b
得到
O2-
Mg2+、Al3+
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
解析:(1)决定元素种类的是质子数,这两个微粒核内质子数不同,所以不属于同种元素;He原子序数是2,核内质子数为2,He-3原子,3为相对原子质量,相对原子质量=质子数+中子数,中子数=1,故对应图1中的b。
(2)由图2可知①是原子直接构成的,②③是由分子构成的,④是由钠离子和氯离子构成的,故由离子构成的选④;铁是金属单质,由原子直接构成,故选①;①是原子直接构成的单质,②只含有一种分子为纯净物,分子中原子种类相同属于单质,③只含有一种分子为纯净物,分子中原子种类不相同属于化合物,④是由钠离子和氯离子构成的属于化合物,故表示单质的是①②。
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
(3)质子数=核外电子数,m=2+8+6=16;该原子的元素的化学性质与b的化学性质相似,因为它们的最外层电子数相同;图b其最外层电子数大于4,故该原子在化学反应中易得到电子;该元素为8号氧元素,最外层有6个电子,得到两个电子后形成带两个单位负电荷氧离子,符号为O2-;核内质子数大于核外电子数,为阳离子,故ce属于阳离子,c质子数是12,是镁离子,离子符号为Mg2+,e质子数是13,是铝离子,离子符号为Al3+。
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
三、实验与计算题(本题包括2小题,共12分)
19.(9分)(2023·威海中考)从原子论到分子学说
原子-分子论的创立,奠定了近代化学的基础,阅读下列材料回答问题:
材料一:1803年,道尔顿提出原子论,认为所有物质都是由原子构成的。单质由原子直接构成,同种原子相互排斥不能结合;化合物由“复杂原子”构成,“复杂原子”由不同原子按一定整数比例简单构成。
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
材料二:1811年,阿伏加德罗引入新的概念——分子,提出了分子学说。对于化合物而言,分子相当于道尔顿所谓的“复杂原子”;对于单质而言,同种原子可以结合成单质分子。
(1)完成下列表格。
物质 葡萄糖 氢气 二氧化硫 氦气
构成物质的微粒(写微粒符号) ________ _________ __________ _________
C6H12O6
H2
SO2
He
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
(2)上表微粒中符合道尔顿“复杂原子”的是 _______________(写化学式)。
(3)你同意材料一中加点部分的观点吗?________,请选用(1)表中的物质说明理由_______________________________________________
_____________________。
C6H12O6、SO2
不同意
氢气由氢分子构成,每个氢分子由两个相同的氢原子
构成
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
(4)1911年,英国科学家卢瑟福进行了著名的α粒子轰击金箔实验,根据实验,不能获得的结论是( )
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
A.金原子核带正电
B.金原子核外电子带负电
C.金原子核体积很小
D.金原子核的质量比α粒子大得多
√
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
(5)从原子论的创立到分子学说的提出,谈谈你对科学理论的发展有何感想_____________________________________________________
_______________________________________________。
科学理论的发展需要大胆创新或科学理论是不断传承和发展的(合理即可)
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
解析:(1)葡萄糖是由葡萄糖分子构成的,葡萄糖分子的符号为C6H12O6;氢气是由氢分子构成的,氢分子的符号为H2;二氧化硫是由二氧化硫分子构成的,二氧化硫分子的符号为SO2;氦气是一种稀有气体,是由氦原子构成的,氦原子的符号为He。
(2)由题干信息可知:道尔顿认为化合物由“复杂原子”构成,“复杂原子”由不同原子按一定整数比例简单构成,则上表微粒中符合道尔顿“复杂原子”的是C6H12O6、SO2。
(3)不同意材料一中加点部分的观点,因为氢气是由氢分子构成的,每个氢分子是由两个相同的氢原子构成。
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
(4)由图可知,带正电的α粒子遇到原子核后,方向发生了偏转,说明金原子核带正电,故A不符合题意;由该实验不能得出金原子核外电子带负电,故B符合题意;由图可知,绝大多数α粒子穿过金箔后仍沿原来的方向前进,只有少量α粒子的运转方向发生了偏转,说明金原子核体积很小,故C不符合题意;由图可知,有少数的α粒子被反弹了回来,说明遇到了质量很大的物质,故金原子核的质量比α粒子大得多,故D不符合题意。
(5)从原子论的创立到分子学说的提出,对科学理论的发展的感想有科学理论的发展需要大胆创新,科学理论是不断传承和发展的。
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
20.(3分)(2024·天津中考)蛋白质由甘氨酸(C2H5O2N)等多种氨基酸构成。计算:
(1)甘氨酸由_____种元素组成(写数值)。
(2)一个甘氨酸分子中含有_____个原子。
(3)75 g甘氨酸中含有氮元素的质量为_____g。
4
10
14
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
14
15
16
17
18
19
20
同课章节目录
