溶质质量分数结合化学方程式的计算综合应用题高频考点 归纳练 2025年中考化学二轮复习备考
文档属性
| 名称 | 溶质质量分数结合化学方程式的计算综合应用题高频考点 归纳练 2025年中考化学二轮复习备考 |
|
|
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-18 00:00:00 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
溶质质量分数结合化学方程式的计算综合应用题高频考点
归纳练 2025年中考化学二轮复习备考
一、综合应用题
1.碳及碳的氧化物与我们的生活密切相关。
(1)金刚石和石墨是由碳元素组成的两种单质,它们化学性质相似,物理性质却有很大差异,原因是 。
(2)被誉为21世纪“黑金材料”的石墨烯,是从石墨中分离出的单层石墨片。石墨烯可用于新能源电池,利用的石墨烯的性质是 (填字母)。
A.硬度大 B.导电性 C.吸附性 D.可燃性
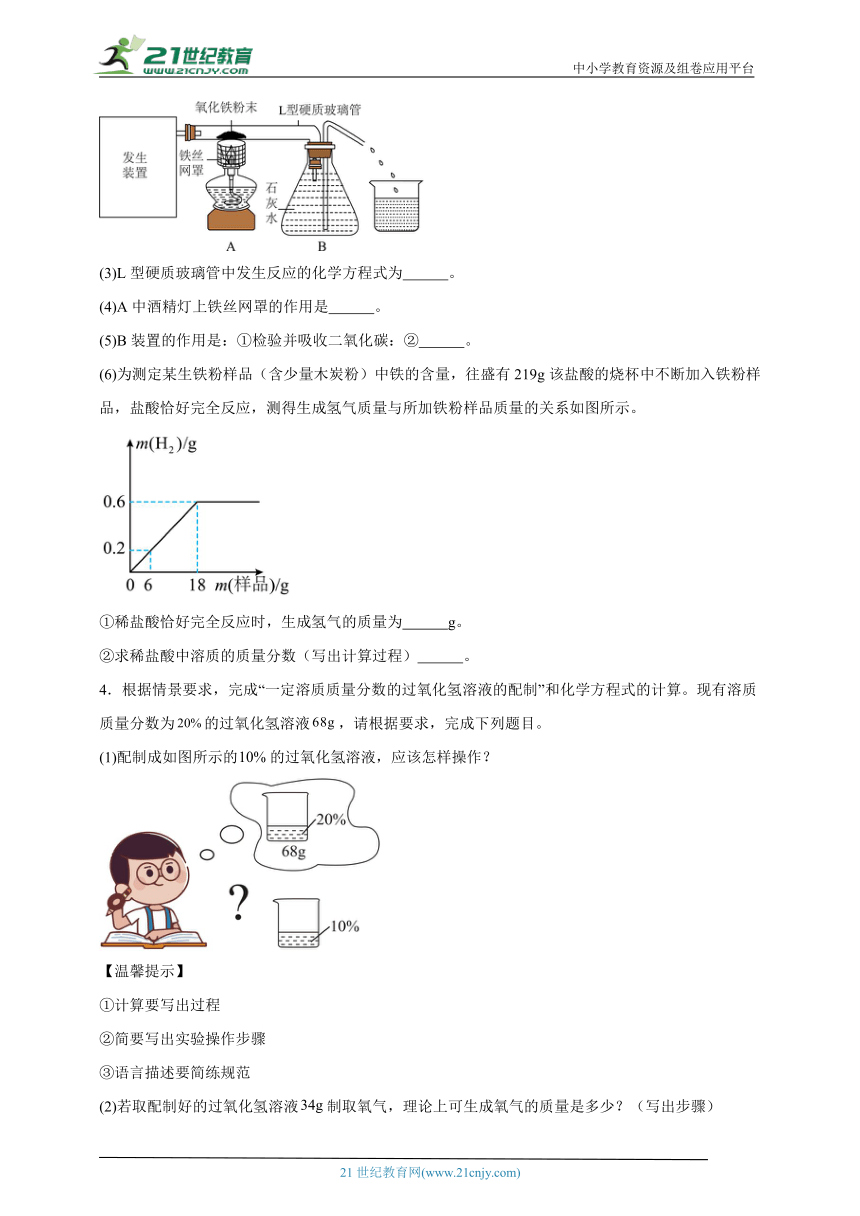
(3)如图为 CO 还原氧化铁的实验装置。
①装置A 中体现了CO的还原性,写出发生反应的化学方程式 。
②装置C 的作用是 ;
(4)某兴趣小组用如图所示装置制取CO2,并模拟自然界中 CO,的循环。
①实验室用石灰石和稀盐酸制取二氧化碳的化学方程式为 ,若要获得平稳的气流,应选择的发生装置为 (填“A”或“B”);
②将组装好的装置C置于阳光下一段时间,观察到有气泡产生,根据植物的光合作用可推断产生的气体为O2,装置C收集气体的方法利用了O2的 性质。
(5)过量排放二氧化碳会造成温室效应加剧,氢氧化钠溶液可用于吸收工业废气中的。若要处理含的工业废气(废气中的其他成分不参与反应),至少需要10%的氢氧化钠溶液的质量是多少
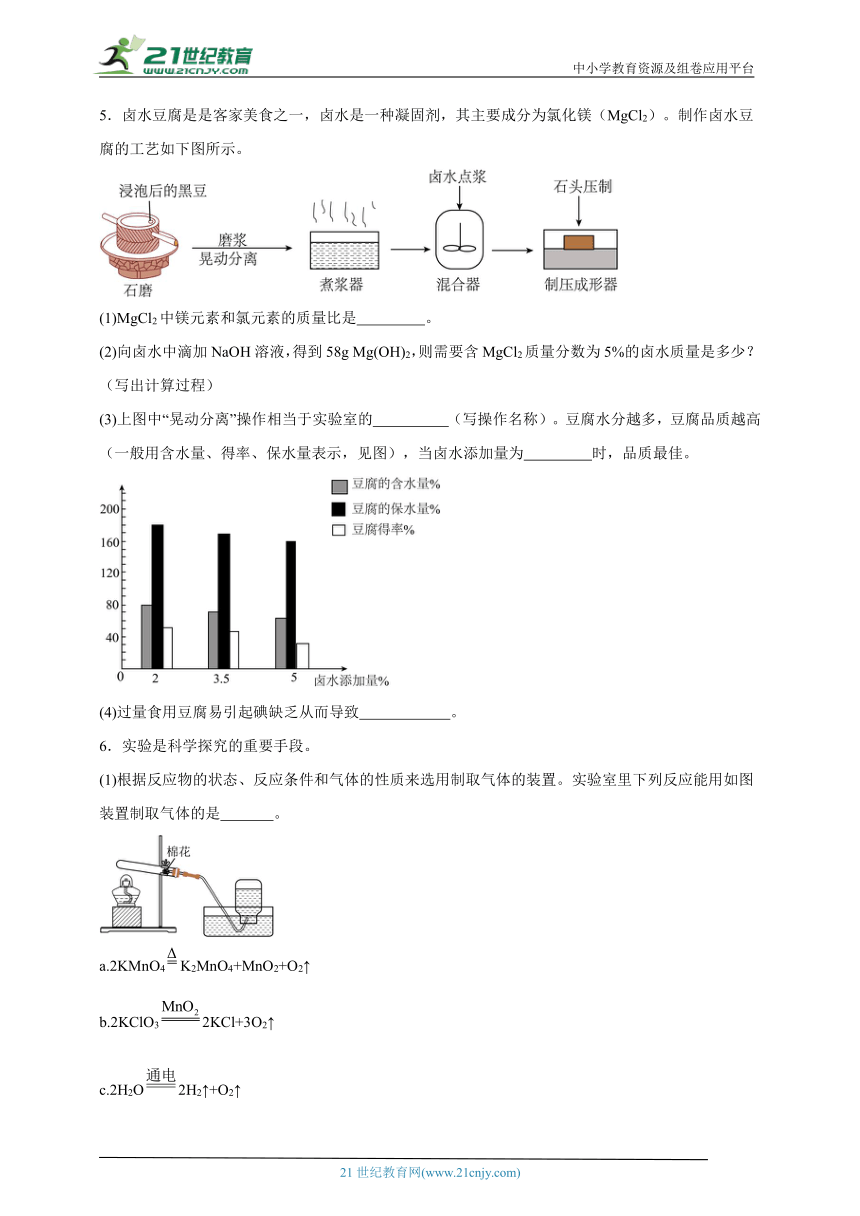
2.纳米铁粉具有易燃、无污染的特性,是一种极具实际应用价值和发展前景的新型燃料。制备纳米铁粉的其中一种流程如图1所示。
反应1:FeSO4+H2C2O4(草酸)FeC2O4↓(草酸亚铁)+H2SO4
(1)FeC2O4中碳元素的化合价为 。
(2)若制取2.88g的草酸亚铁,理论上需要10%的草酸溶液的质量是多少? (写出计算过程)
(3)将上述草酸亚铁置于玻璃管内,使其在700℃发生分解反应,生成纳米铁粉和一种气体。反应过程中需要往玻璃管内通入氮气,氮气的作用是 。管内固体质量随加热时间变化情况如图2所示,a的值为 。
3.钢铁的应用非常广泛,某化学小组围绕“铁的冶炼”开展主题学习。
I.古代炼铁工艺
《天工开物》中记载:“凡铁一炉载土(指铁矿石,下同)二千余斤,或用硬木柴,或用煤炭或用木炭,南北各从利便。扇炉风箱必用四人、六人带拽。土化成铁之后,从炉腰孔流出。”根据图文回答下列问题。
(1)常见的“土”有赤铁矿和 (答1种即可)。
(2)从燃烧的角度分析,“扇炉风箱”的作用是 。
Ⅱ.实验室模拟工业炼铁
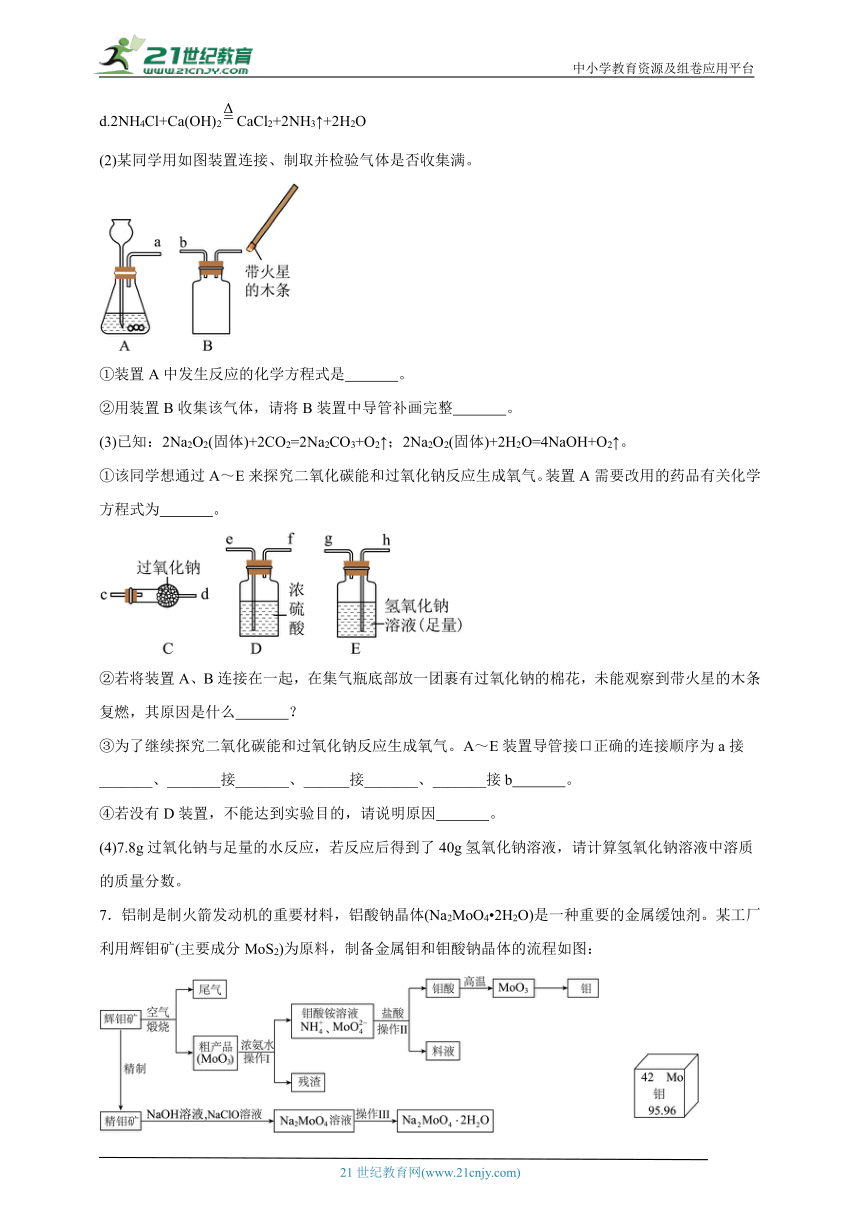
已知:草酸钠固体(化学式为)加热分解生成碳酸钠和一氧化碳,化学小组利用此反应制备一氧化碳,并用一氧化碳还原氧化铁。他们设计的实验装置如图:
(3)L型硬质玻璃管中发生反应的化学方程式为 。
(4)A中酒精灯上铁丝网罩的作用是 。
(5)B装置的作用是:①检验并吸收二氧化碳:② 。
(6)为测定某生铁粉样品(含少量木炭粉)中铁的含量,往盛有219g该盐酸的烧杯中不断加入铁粉样品,盐酸恰好完全反应,测得生成氢气质量与所加铁粉样品质量的关系如图所示。
①稀盐酸恰好完全反应时,生成氢气的质量为 g。
②求稀盐酸中溶质的质量分数(写出计算过程) 。
4.根据情景要求,完成“一定溶质质量分数的过氧化氢溶液的配制”和化学方程式的计算。现有溶质质量分数为的过氧化氢溶液,请根据要求,完成下列题目。
(1)配制成如图所示的的过氧化氢溶液,应该怎样操作?
【温馨提示】
①计算要写出过程
②简要写出实验操作步骤
③语言描述要简练规范
(2)若取配制好的过氧化氢溶液制取氧气,理论上可生成氧气的质量是多少?(写出步骤)
5.卤水豆腐是是客家美食之一,卤水是一种凝固剂,其主要成分为氯化镁(MgCl2)。制作卤水豆腐的工艺如下图所示。
(1)MgCl2中镁元素和氯元素的质量比是 。
(2)向卤水中滴加NaOH溶液,得到58g Mg(OH)2,则需要含MgCl2质量分数为5%的卤水质量是多少?(写出计算过程)
(3)上图中“晃动分离”操作相当于实验室的 (写操作名称)。豆腐水分越多,豆腐品质越高(一般用含水量、得率、保水量表示,见图),当卤水添加量为 时,品质最佳。
(4)过量食用豆腐易引起碘缺乏从而导致 。
6.实验是科学探究的重要手段。
(1)根据反应物的状态、反应条件和气体的性质来选用制取气体的装置。实验室里下列反应能用如图装置制取气体的是 。
a.2KMnO4K2MnO4+MnO2+O2↑
b.2KClO32KCl+3O2↑
c.2H2O2H2↑+O2↑
d.2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
(2)某同学用如图装置连接、制取并检验气体是否收集满。
①装置A中发生反应的化学方程式是 。
②用装置B收集该气体,请将B装置中导管补画完整 。
(3)已知:2Na2O2(固体)+2CO2=2Na2CO3+O2↑;2Na2O2(固体)+2H2O=4NaOH+O2↑。
①该同学想通过A~E来探究二氧化碳能和过氧化钠反应生成氧气。装置A需要改用的药品有关化学方程式为 。
②若将装置A、B连接在一起,在集气瓶底部放一团裹有过氧化钠的棉花,未能观察到带火星的木条复燃,其原因是什么 ?
③为了继续探究二氧化碳能和过氧化钠反应生成氧气。A~E装置导管接口正确的连接顺序为a接_______、_______接_______、______接_______、_______接b 。
④若没有D装置,不能达到实验目的,请说明原因 。
(4)7.8g过氧化钠与足量的水反应,若反应后得到了40g氢氧化钠溶液,请计算氢氧化钠溶液中溶质的质量分数。
7.铝制是制火箭发动机的重要材料,铝酸钠晶体(Na2MoO4 2H2O)是一种重要的金属缓蚀剂。某工厂利用辉钼矿(主要成分MoS2)为原料,制备金属钼和钼酸钠晶体的流程如图:
(1)煅烧过程中,空气从炉底进入,矿石经粉碎后从炉顶进入,这样处理的目的是 ,“煅烧”尾气为SO2,“煅烧”的化学方程式为 。
(2)操作Ⅰ的名称为 ,该操作所需的玻璃仪器有烧杯、 、玻璃棒,其中玻璃棒的作用为 ;操作Ⅰ得到的残渣需要进行洗涤的目的是 。
钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图1、图2。
(3)由图1可知要使碳素钢的缓蚀效果最佳,钼酸钠与月桂酰肌氨酸的浓度比应为 。
(4)从图2可见,碳素钢在两种酸中所受腐蚀差异较大,请从微观角度分析原因 。
(5)某温度下,钼酸根离子会形成BaMOO4沉淀,现取50gNa2MoO4溶液,向溶液中滴加BaCl2溶液,恰好完全反应后过滤,将滤渣经过一系列操作后得到纯净固体的质量为2.97g,求该溶液中Na2MoO4的质量分数(请写出计算过程)。(已知Na2MoO4、BaMoO4的相对分子质量分别为206、297)。
8.某化学兴趣小组欲探究实验室氧化铜和稀硫酸反应后某剩余废液的溶质成分,其实验步骤及对应实验现象如图一所示:
(1)由图一中的实验现象可推知,该剩余废液中的溶质组成为 (填化学式)。
(2)实验中加入NaOH溶液的溶质质量分数均为10%。在上述实验过程中,产生沉淀的质量与加入NaOH溶液的质量关系如图二所示。试回答:
①由图二可知,OA段反应过程没有沉淀生成,该过程对应图一中的步骤 (选填“a”、“b”、“c”之一)。
②当滴入10%的NaOH溶液160g时(至图中C点)。烧杯中溶液里一定大量存在的阴离子是 (写离子符号)。
③当滴入10%的NaOH溶液120g时(即图中B点),试通过计算,求生成沉淀的质量 (写出计算过程,计算结果精确到0.1)。
参考答案
1.(1)碳原子排列方式不同
(2)B
(3) 处理尾气
(4) A 不易溶于水
(5)解:设需要10%的氢氧化钠溶液的质量是x
x =40kg
答:至少需要10%的氢氧化钠溶液的质量是40kg。
(1)金刚石和石墨都是由碳原子直接构成的,金刚石中碳原子以空间网状结构排列,石墨中碳原子以层状结构排列,碳原子排列方式不同,所以物理性质不同;
(2)石墨烯是从石墨中分离出的单层石墨片,具有石墨的性质,石墨具有导电性,故选B;
(3)①一氧化碳和氧化铁高温下反应生成铁和二氧化碳,化学方程式为;
②尾气中含有一氧化碳,有毒,用点燃的酒精灯将一氧化碳点燃,转化为二氧化碳,故装置C 的作用是处理尾气;
(4)①实验室用石灰石和稀盐酸制取二氧化碳,石灰石的主要成分是碳酸钙,碳酸钙和盐酸反应生成氯化钙、水、二氧化碳,化学方程式为;反应物为固体和液体,不需要加热,若要获得平稳的气流,选择A为发生装置,A装置中用分液漏斗加入液体药品,可控制加入液体的速率,从而控制反应速率;
②装置C为排水集气法,说明氧气不易溶于水;
(5)过程见答案。
2.(1)+3
(2)设:理论上需要10%的草酸溶液的质量为x。
x=18g
答:理论上需要10%的草酸溶液的质量为18g。
(3) 防止生成的纳米铁粉在高温下与氧气反应被氧化,同时使生成的气体全部排出 1.12g
(1)在化合物中,铁元素通常显+2价,氧元素通常显 2价;设碳元素的化合价为x,根据化合物中各元素正负化合价代数和为零的原则,则有(+2)+2x+( 2)×4=0;
解得x=+3;
(2)见答案;
(3)纳米铁粉具有易燃性,氮气化学性质稳定,通入氮气可以排尽装置内的空气,防止生成的纳米铁粉在高温下与氧气反应被氧化,同时使生成的气体全部排出;
草酸亚铁置于玻璃管内,使其在700℃发生分解反应,生成纳米铁粉和一种气体,根据质量守恒定律可知,草酸亚铁中铁元素的质量=生成纳米铁粉中铁元素质量=a=
3.(1)磁铁矿(合理即可)
(2)提供充足的氧气
(3)
(4)集中火焰,提高温度
(5)收集未反应的一氧化碳,防止其污染空气
(6) 0.6 解:根据图像可知,加入样品18g时,恰好完全反应,设此时消耗的氯化氢的质量是x
故稀盐酸的溶质质量分数为
答:稀盐酸中溶质的质量分数为10%。
(1)常见的铁矿石除赤铁矿外,还有磁铁矿(主要成分Fe3O4)、菱铁矿(主要成分FeCO3)等 。
(2)燃烧需要氧气,“扇炉风箱” 能鼓入空气,提供充足的氧气,促进燃料充分燃烧,提高炉温。
(3)一氧化碳具有还原性,在高温条件下能还原氧化铁,生成铁和二氧化碳,化学方程式为。
(4)铁丝网球罩能使酒精灯火焰更集中,减少热量散失,从而提高加热温度,满足反应所需高温条件。
(5)一氧化碳难溶于水且不与氢氧化钙反应,B 装置中石灰水可检验并吸收反应生成的二氧化碳,同时能收集未反应的一氧化碳,避免其排放到空气中污染环境。
(6)①由图像可知,稀盐酸恰好完全反应时,生成氢气的质量为0.6g。
②铁与稀盐酸发生反应,根据图像,加入样品18g时,恰好完全反应,产生0.6g H2,据此计算,见答案。
4.(1)①计算:配制10%的过氧化氢溶液,设需要水的质量为x:68g×20%=(68g+x)×10%,x=68g,水的体积为:68g÷1g/mL=68mL;
②量取:用100mL量筒量取68mL水,倒入盛有溶质质量分数为20%的过氧化氢溶液的烧杯中;
③混匀:用玻璃棒搅拌,使其混合均匀;
④贮存:将配制好的过氧化氢溶液装入试剂瓶中,盖好瓶塞并贴上标签,放入指定地点。
(2)解:设理论上可生成氧气的质量为x。
答:理论上可生成氧气的质量为。
(1)有溶质质量分数为20%的过氧化氢溶液68g,配制10%的过氧化氢溶液,操作如下:
①计算:配制10%的过氧化氢溶液,设需要水的质量为x,68g×20%=(68g+x)×10%,x=68g,水的体积为:68g÷1g/mL=68mL;
②量取:用100mL量筒量取68mL水,倒入盛有溶质质量分数为20%的过氧化氢溶液的烧杯中;
③混匀:用玻璃棒搅拌,使其混合均匀;
④贮存:将配制好的过氧化氢溶液装入试剂瓶中,盖好瓶塞并贴上标签,放入指定地点。
(2)见答案。
5.(1)24:71
(2)解:设需要含MgCl2质量分数为5%的卤水质量为x 。
答:需要含MgCl2质量分数为5%的卤水质量为1900 g。
(3) 过滤 2%
(4)甲状腺肿大
(1)MgCl2中镁元素和氯元素的质量比是;
(2)卤水主要成分是氯化镁,向卤水中滴加氢氧化钠溶液,氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠,计算过程见答案;
(3)上图中“晃动分离”操作相当于实验室的过滤;
豆腐水分越多,豆腐品质越高,由图可知,当卤水添加量为2%时,豆腐的含水量最高,则其品质最佳;
(4)过量食用豆腐易引起碘缺乏从而导致甲状腺肿大。
6.(1)a
(2)
(3) CaCO3+2HCl=CaCl2+H2O+CO2↑ 二氧化碳不能燃烧也不支持燃烧 efcdhg 若没有D装置,则装置A中产生气体中含有的水蒸气也能使与过氧化钠产生氧气,对验证Na2O2与二氧化碳气体生成氧气造成干扰
(4)生成氢氧化钠的质量为
氢氧化钠溶液中溶质的质量分数为:
答:氢氧化钠溶液中溶质的质量分数为20%。
(1)由图可知,制取该气体的反应物为固体,且试管口需要塞一团棉花,该气体可用排水法收集;
a、该反应为固体加热型,试管口需塞一团棉花,防止固体粉末进入导管,生成的气体可用排水法收集,故选项符合题意;
b、该反应为固体加热型,试管口不需要塞一团棉花,故选项不符合题意;
c、该反应需要通电,故选项不符合题意;
d、该反应中生成的氨气易溶于水,不能用排水法收集,故选项不符合题意;
故选:a;
(2)①装置A为固液常温型发生装置,用装置A制取氧气,选用药品过氧化氢和二氧化锰,过氧化氢在二氧化锰的催化作用下生成水和氧气,发生反应的化学方程式为:;
②氧气的密度比空气大,用装置B收集氧气,应从长导管口进,短导管口出,则B装置为;
(3)①A装置中是制取二氧化碳,所以是大理石(或石灰石)的主要成分碳酸钙和稀盐酸反应生成氯化钙、水以及二氧化碳,反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑;
②若将装置A、B连接在一起,在集气瓶底部放一团裹有过氧化钠的棉花,未能观察到带火星的木条复燃,是因为二氧化碳不能燃烧也不支持燃烧;
③为了达到实验的目的,需要制备二氧化碳且除去杂质后让二氧化碳和过氧化钠反应,进而检验二氧化碳是否有剩余和检验是否生成了氧气,所以以上装置导管接口正确的连接顺序为a接e、f接c、d接h、g接b;
④若没有D装置,不能达到实验目的,是因为若没有D装置,则装置A中产生气体中含有的水蒸气也能使与过氧化钠产生氧气,对验证Na2O2与二氧化碳气体生成氧气造成干扰;
(4)解析见答案。
7.(1) 增大反应物间的接触面积,使反应更快、更充分
(2) 过滤 漏斗 引流 收集残渣表面的钼酸铵,提高产率
(3)1:1
(4)Cl-能加速钢锈蚀
(5)解:设该溶液中Na2MoO4的质量为x。
则该溶液中Na2MoO4的质量分数为
答:该溶液中Na2MoO4的质量分数为4.12%。
(1)煅烧过程中,空气从炉底进入,矿石经粉碎后从炉顶进入,这样处理的目的是增大反应物间的接触面积,使反应更快、更充分;
辉钼矿主要成分为MoS2,“煅烧”尾气为SO2,则“煅烧”过程中发生的反应是MoS2在空气中煅烧生成二氧化硫和MoO3,化学方程式为;
(2)分离固液的操作是过滤,则操作Ⅰ的名称为过滤;该操作所需的玻璃仪器有烧杯、漏斗、玻璃棒,其中玻璃棒的作用为引流;
操作Ⅰ得到的残渣需要进行洗涤的目的是收集残渣表面的钼酸铵,提高产率;
(3)由图1可知,钼酸钠与月桂酰肌氨酸的浓度均为时,碳素钢的腐蚀速率最小,即碳素钢的缓蚀效果最佳,则钼酸钠与月桂酰肌氨酸的浓度比应为;
(4)由图2可知,酸中氢离子浓度相同时,碳素钢的腐蚀速率稀盐酸>稀硫酸,碳素钢在两种酸中所受腐蚀差异较大,则从微观角度分析可能的原因是Cl-能加速钢锈蚀;
(5)计算过程见答案。
8.(1)、
(2) a 、 9.8g
解:设滴入10%的NaOH溶液120g时生成的氢氧化铜沉淀质量为x。
废液中硫酸铜所消耗的10%的氢氧化钠溶液质量为
答:滴入10%的NaOH溶液120g时生成的氢氧化铜沉淀质量为9.8g。
(1)氧化铜和稀硫酸反应生成硫酸铜和水,因此反应后剩余废液中一定含有,由图一可知,剩余废液中加入一定量氢氧化钠溶液,开始无明显现象,后产生沉淀,说明剩余废液中还含有,氢氧化钠先与发生中和反应生成硫酸钠和水,完全反应后氢氧化钠再与反应生成氢氧化铜沉淀和硫酸钠,故该剩余废液中的溶质组成为、;
(2)①由图二可知,OA段反应过程没有沉淀生成,该过程对应图一中的步骤a;
②当滴入10%的NaOH溶液160g时(至图中C点),该点表示氢氧化钠与硫酸铜恰好完全反应(B点)后继续滴加氢氧化钠溶液,则此时烧杯中溶液含有氢氧化钠、硫酸钠,故该溶液中一定大量存在的阴离子是、;
③计算过程见答案。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
溶质质量分数结合化学方程式的计算综合应用题高频考点
归纳练 2025年中考化学二轮复习备考
一、综合应用题
1.碳及碳的氧化物与我们的生活密切相关。
(1)金刚石和石墨是由碳元素组成的两种单质,它们化学性质相似,物理性质却有很大差异,原因是 。
(2)被誉为21世纪“黑金材料”的石墨烯,是从石墨中分离出的单层石墨片。石墨烯可用于新能源电池,利用的石墨烯的性质是 (填字母)。
A.硬度大 B.导电性 C.吸附性 D.可燃性
(3)如图为 CO 还原氧化铁的实验装置。
①装置A 中体现了CO的还原性,写出发生反应的化学方程式 。
②装置C 的作用是 ;
(4)某兴趣小组用如图所示装置制取CO2,并模拟自然界中 CO,的循环。
①实验室用石灰石和稀盐酸制取二氧化碳的化学方程式为 ,若要获得平稳的气流,应选择的发生装置为 (填“A”或“B”);
②将组装好的装置C置于阳光下一段时间,观察到有气泡产生,根据植物的光合作用可推断产生的气体为O2,装置C收集气体的方法利用了O2的 性质。
(5)过量排放二氧化碳会造成温室效应加剧,氢氧化钠溶液可用于吸收工业废气中的。若要处理含的工业废气(废气中的其他成分不参与反应),至少需要10%的氢氧化钠溶液的质量是多少
2.纳米铁粉具有易燃、无污染的特性,是一种极具实际应用价值和发展前景的新型燃料。制备纳米铁粉的其中一种流程如图1所示。
反应1:FeSO4+H2C2O4(草酸)FeC2O4↓(草酸亚铁)+H2SO4
(1)FeC2O4中碳元素的化合价为 。
(2)若制取2.88g的草酸亚铁,理论上需要10%的草酸溶液的质量是多少? (写出计算过程)
(3)将上述草酸亚铁置于玻璃管内,使其在700℃发生分解反应,生成纳米铁粉和一种气体。反应过程中需要往玻璃管内通入氮气,氮气的作用是 。管内固体质量随加热时间变化情况如图2所示,a的值为 。
3.钢铁的应用非常广泛,某化学小组围绕“铁的冶炼”开展主题学习。
I.古代炼铁工艺
《天工开物》中记载:“凡铁一炉载土(指铁矿石,下同)二千余斤,或用硬木柴,或用煤炭或用木炭,南北各从利便。扇炉风箱必用四人、六人带拽。土化成铁之后,从炉腰孔流出。”根据图文回答下列问题。
(1)常见的“土”有赤铁矿和 (答1种即可)。
(2)从燃烧的角度分析,“扇炉风箱”的作用是 。
Ⅱ.实验室模拟工业炼铁
已知:草酸钠固体(化学式为)加热分解生成碳酸钠和一氧化碳,化学小组利用此反应制备一氧化碳,并用一氧化碳还原氧化铁。他们设计的实验装置如图:
(3)L型硬质玻璃管中发生反应的化学方程式为 。
(4)A中酒精灯上铁丝网罩的作用是 。
(5)B装置的作用是:①检验并吸收二氧化碳:② 。
(6)为测定某生铁粉样品(含少量木炭粉)中铁的含量,往盛有219g该盐酸的烧杯中不断加入铁粉样品,盐酸恰好完全反应,测得生成氢气质量与所加铁粉样品质量的关系如图所示。
①稀盐酸恰好完全反应时,生成氢气的质量为 g。
②求稀盐酸中溶质的质量分数(写出计算过程) 。
4.根据情景要求,完成“一定溶质质量分数的过氧化氢溶液的配制”和化学方程式的计算。现有溶质质量分数为的过氧化氢溶液,请根据要求,完成下列题目。
(1)配制成如图所示的的过氧化氢溶液,应该怎样操作?
【温馨提示】
①计算要写出过程
②简要写出实验操作步骤
③语言描述要简练规范
(2)若取配制好的过氧化氢溶液制取氧气,理论上可生成氧气的质量是多少?(写出步骤)
5.卤水豆腐是是客家美食之一,卤水是一种凝固剂,其主要成分为氯化镁(MgCl2)。制作卤水豆腐的工艺如下图所示。
(1)MgCl2中镁元素和氯元素的质量比是 。
(2)向卤水中滴加NaOH溶液,得到58g Mg(OH)2,则需要含MgCl2质量分数为5%的卤水质量是多少?(写出计算过程)
(3)上图中“晃动分离”操作相当于实验室的 (写操作名称)。豆腐水分越多,豆腐品质越高(一般用含水量、得率、保水量表示,见图),当卤水添加量为 时,品质最佳。
(4)过量食用豆腐易引起碘缺乏从而导致 。
6.实验是科学探究的重要手段。
(1)根据反应物的状态、反应条件和气体的性质来选用制取气体的装置。实验室里下列反应能用如图装置制取气体的是 。
a.2KMnO4K2MnO4+MnO2+O2↑
b.2KClO32KCl+3O2↑
c.2H2O2H2↑+O2↑
d.2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
(2)某同学用如图装置连接、制取并检验气体是否收集满。
①装置A中发生反应的化学方程式是 。
②用装置B收集该气体,请将B装置中导管补画完整 。
(3)已知:2Na2O2(固体)+2CO2=2Na2CO3+O2↑;2Na2O2(固体)+2H2O=4NaOH+O2↑。
①该同学想通过A~E来探究二氧化碳能和过氧化钠反应生成氧气。装置A需要改用的药品有关化学方程式为 。
②若将装置A、B连接在一起,在集气瓶底部放一团裹有过氧化钠的棉花,未能观察到带火星的木条复燃,其原因是什么 ?
③为了继续探究二氧化碳能和过氧化钠反应生成氧气。A~E装置导管接口正确的连接顺序为a接_______、_______接_______、______接_______、_______接b 。
④若没有D装置,不能达到实验目的,请说明原因 。
(4)7.8g过氧化钠与足量的水反应,若反应后得到了40g氢氧化钠溶液,请计算氢氧化钠溶液中溶质的质量分数。
7.铝制是制火箭发动机的重要材料,铝酸钠晶体(Na2MoO4 2H2O)是一种重要的金属缓蚀剂。某工厂利用辉钼矿(主要成分MoS2)为原料,制备金属钼和钼酸钠晶体的流程如图:
(1)煅烧过程中,空气从炉底进入,矿石经粉碎后从炉顶进入,这样处理的目的是 ,“煅烧”尾气为SO2,“煅烧”的化学方程式为 。
(2)操作Ⅰ的名称为 ,该操作所需的玻璃仪器有烧杯、 、玻璃棒,其中玻璃棒的作用为 ;操作Ⅰ得到的残渣需要进行洗涤的目的是 。
钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图1、图2。
(3)由图1可知要使碳素钢的缓蚀效果最佳,钼酸钠与月桂酰肌氨酸的浓度比应为 。
(4)从图2可见,碳素钢在两种酸中所受腐蚀差异较大,请从微观角度分析原因 。
(5)某温度下,钼酸根离子会形成BaMOO4沉淀,现取50gNa2MoO4溶液,向溶液中滴加BaCl2溶液,恰好完全反应后过滤,将滤渣经过一系列操作后得到纯净固体的质量为2.97g,求该溶液中Na2MoO4的质量分数(请写出计算过程)。(已知Na2MoO4、BaMoO4的相对分子质量分别为206、297)。
8.某化学兴趣小组欲探究实验室氧化铜和稀硫酸反应后某剩余废液的溶质成分,其实验步骤及对应实验现象如图一所示:
(1)由图一中的实验现象可推知,该剩余废液中的溶质组成为 (填化学式)。
(2)实验中加入NaOH溶液的溶质质量分数均为10%。在上述实验过程中,产生沉淀的质量与加入NaOH溶液的质量关系如图二所示。试回答:
①由图二可知,OA段反应过程没有沉淀生成,该过程对应图一中的步骤 (选填“a”、“b”、“c”之一)。
②当滴入10%的NaOH溶液160g时(至图中C点)。烧杯中溶液里一定大量存在的阴离子是 (写离子符号)。
③当滴入10%的NaOH溶液120g时(即图中B点),试通过计算,求生成沉淀的质量 (写出计算过程,计算结果精确到0.1)。
参考答案
1.(1)碳原子排列方式不同
(2)B
(3) 处理尾气
(4) A 不易溶于水
(5)解:设需要10%的氢氧化钠溶液的质量是x
x =40kg
答:至少需要10%的氢氧化钠溶液的质量是40kg。
(1)金刚石和石墨都是由碳原子直接构成的,金刚石中碳原子以空间网状结构排列,石墨中碳原子以层状结构排列,碳原子排列方式不同,所以物理性质不同;
(2)石墨烯是从石墨中分离出的单层石墨片,具有石墨的性质,石墨具有导电性,故选B;
(3)①一氧化碳和氧化铁高温下反应生成铁和二氧化碳,化学方程式为;
②尾气中含有一氧化碳,有毒,用点燃的酒精灯将一氧化碳点燃,转化为二氧化碳,故装置C 的作用是处理尾气;
(4)①实验室用石灰石和稀盐酸制取二氧化碳,石灰石的主要成分是碳酸钙,碳酸钙和盐酸反应生成氯化钙、水、二氧化碳,化学方程式为;反应物为固体和液体,不需要加热,若要获得平稳的气流,选择A为发生装置,A装置中用分液漏斗加入液体药品,可控制加入液体的速率,从而控制反应速率;
②装置C为排水集气法,说明氧气不易溶于水;
(5)过程见答案。
2.(1)+3
(2)设:理论上需要10%的草酸溶液的质量为x。
x=18g
答:理论上需要10%的草酸溶液的质量为18g。
(3) 防止生成的纳米铁粉在高温下与氧气反应被氧化,同时使生成的气体全部排出 1.12g
(1)在化合物中,铁元素通常显+2价,氧元素通常显 2价;设碳元素的化合价为x,根据化合物中各元素正负化合价代数和为零的原则,则有(+2)+2x+( 2)×4=0;
解得x=+3;
(2)见答案;
(3)纳米铁粉具有易燃性,氮气化学性质稳定,通入氮气可以排尽装置内的空气,防止生成的纳米铁粉在高温下与氧气反应被氧化,同时使生成的气体全部排出;
草酸亚铁置于玻璃管内,使其在700℃发生分解反应,生成纳米铁粉和一种气体,根据质量守恒定律可知,草酸亚铁中铁元素的质量=生成纳米铁粉中铁元素质量=a=
3.(1)磁铁矿(合理即可)
(2)提供充足的氧气
(3)
(4)集中火焰,提高温度
(5)收集未反应的一氧化碳,防止其污染空气
(6) 0.6 解:根据图像可知,加入样品18g时,恰好完全反应,设此时消耗的氯化氢的质量是x
故稀盐酸的溶质质量分数为
答:稀盐酸中溶质的质量分数为10%。
(1)常见的铁矿石除赤铁矿外,还有磁铁矿(主要成分Fe3O4)、菱铁矿(主要成分FeCO3)等 。
(2)燃烧需要氧气,“扇炉风箱” 能鼓入空气,提供充足的氧气,促进燃料充分燃烧,提高炉温。
(3)一氧化碳具有还原性,在高温条件下能还原氧化铁,生成铁和二氧化碳,化学方程式为。
(4)铁丝网球罩能使酒精灯火焰更集中,减少热量散失,从而提高加热温度,满足反应所需高温条件。
(5)一氧化碳难溶于水且不与氢氧化钙反应,B 装置中石灰水可检验并吸收反应生成的二氧化碳,同时能收集未反应的一氧化碳,避免其排放到空气中污染环境。
(6)①由图像可知,稀盐酸恰好完全反应时,生成氢气的质量为0.6g。
②铁与稀盐酸发生反应,根据图像,加入样品18g时,恰好完全反应,产生0.6g H2,据此计算,见答案。
4.(1)①计算:配制10%的过氧化氢溶液,设需要水的质量为x:68g×20%=(68g+x)×10%,x=68g,水的体积为:68g÷1g/mL=68mL;
②量取:用100mL量筒量取68mL水,倒入盛有溶质质量分数为20%的过氧化氢溶液的烧杯中;
③混匀:用玻璃棒搅拌,使其混合均匀;
④贮存:将配制好的过氧化氢溶液装入试剂瓶中,盖好瓶塞并贴上标签,放入指定地点。
(2)解:设理论上可生成氧气的质量为x。
答:理论上可生成氧气的质量为。
(1)有溶质质量分数为20%的过氧化氢溶液68g,配制10%的过氧化氢溶液,操作如下:
①计算:配制10%的过氧化氢溶液,设需要水的质量为x,68g×20%=(68g+x)×10%,x=68g,水的体积为:68g÷1g/mL=68mL;
②量取:用100mL量筒量取68mL水,倒入盛有溶质质量分数为20%的过氧化氢溶液的烧杯中;
③混匀:用玻璃棒搅拌,使其混合均匀;
④贮存:将配制好的过氧化氢溶液装入试剂瓶中,盖好瓶塞并贴上标签,放入指定地点。
(2)见答案。
5.(1)24:71
(2)解:设需要含MgCl2质量分数为5%的卤水质量为x 。
答:需要含MgCl2质量分数为5%的卤水质量为1900 g。
(3) 过滤 2%
(4)甲状腺肿大
(1)MgCl2中镁元素和氯元素的质量比是;
(2)卤水主要成分是氯化镁,向卤水中滴加氢氧化钠溶液,氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠,计算过程见答案;
(3)上图中“晃动分离”操作相当于实验室的过滤;
豆腐水分越多,豆腐品质越高,由图可知,当卤水添加量为2%时,豆腐的含水量最高,则其品质最佳;
(4)过量食用豆腐易引起碘缺乏从而导致甲状腺肿大。
6.(1)a
(2)
(3) CaCO3+2HCl=CaCl2+H2O+CO2↑ 二氧化碳不能燃烧也不支持燃烧 efcdhg 若没有D装置,则装置A中产生气体中含有的水蒸气也能使与过氧化钠产生氧气,对验证Na2O2与二氧化碳气体生成氧气造成干扰
(4)生成氢氧化钠的质量为
氢氧化钠溶液中溶质的质量分数为:
答:氢氧化钠溶液中溶质的质量分数为20%。
(1)由图可知,制取该气体的反应物为固体,且试管口需要塞一团棉花,该气体可用排水法收集;
a、该反应为固体加热型,试管口需塞一团棉花,防止固体粉末进入导管,生成的气体可用排水法收集,故选项符合题意;
b、该反应为固体加热型,试管口不需要塞一团棉花,故选项不符合题意;
c、该反应需要通电,故选项不符合题意;
d、该反应中生成的氨气易溶于水,不能用排水法收集,故选项不符合题意;
故选:a;
(2)①装置A为固液常温型发生装置,用装置A制取氧气,选用药品过氧化氢和二氧化锰,过氧化氢在二氧化锰的催化作用下生成水和氧气,发生反应的化学方程式为:;
②氧气的密度比空气大,用装置B收集氧气,应从长导管口进,短导管口出,则B装置为;
(3)①A装置中是制取二氧化碳,所以是大理石(或石灰石)的主要成分碳酸钙和稀盐酸反应生成氯化钙、水以及二氧化碳,反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑;
②若将装置A、B连接在一起,在集气瓶底部放一团裹有过氧化钠的棉花,未能观察到带火星的木条复燃,是因为二氧化碳不能燃烧也不支持燃烧;
③为了达到实验的目的,需要制备二氧化碳且除去杂质后让二氧化碳和过氧化钠反应,进而检验二氧化碳是否有剩余和检验是否生成了氧气,所以以上装置导管接口正确的连接顺序为a接e、f接c、d接h、g接b;
④若没有D装置,不能达到实验目的,是因为若没有D装置,则装置A中产生气体中含有的水蒸气也能使与过氧化钠产生氧气,对验证Na2O2与二氧化碳气体生成氧气造成干扰;
(4)解析见答案。
7.(1) 增大反应物间的接触面积,使反应更快、更充分
(2) 过滤 漏斗 引流 收集残渣表面的钼酸铵,提高产率
(3)1:1
(4)Cl-能加速钢锈蚀
(5)解:设该溶液中Na2MoO4的质量为x。
则该溶液中Na2MoO4的质量分数为
答:该溶液中Na2MoO4的质量分数为4.12%。
(1)煅烧过程中,空气从炉底进入,矿石经粉碎后从炉顶进入,这样处理的目的是增大反应物间的接触面积,使反应更快、更充分;
辉钼矿主要成分为MoS2,“煅烧”尾气为SO2,则“煅烧”过程中发生的反应是MoS2在空气中煅烧生成二氧化硫和MoO3,化学方程式为;
(2)分离固液的操作是过滤,则操作Ⅰ的名称为过滤;该操作所需的玻璃仪器有烧杯、漏斗、玻璃棒,其中玻璃棒的作用为引流;
操作Ⅰ得到的残渣需要进行洗涤的目的是收集残渣表面的钼酸铵,提高产率;
(3)由图1可知,钼酸钠与月桂酰肌氨酸的浓度均为时,碳素钢的腐蚀速率最小,即碳素钢的缓蚀效果最佳,则钼酸钠与月桂酰肌氨酸的浓度比应为;
(4)由图2可知,酸中氢离子浓度相同时,碳素钢的腐蚀速率稀盐酸>稀硫酸,碳素钢在两种酸中所受腐蚀差异较大,则从微观角度分析可能的原因是Cl-能加速钢锈蚀;
(5)计算过程见答案。
8.(1)、
(2) a 、 9.8g
解:设滴入10%的NaOH溶液120g时生成的氢氧化铜沉淀质量为x。
废液中硫酸铜所消耗的10%的氢氧化钠溶液质量为
答:滴入10%的NaOH溶液120g时生成的氢氧化铜沉淀质量为9.8g。
(1)氧化铜和稀硫酸反应生成硫酸铜和水,因此反应后剩余废液中一定含有,由图一可知,剩余废液中加入一定量氢氧化钠溶液,开始无明显现象,后产生沉淀,说明剩余废液中还含有,氢氧化钠先与发生中和反应生成硫酸钠和水,完全反应后氢氧化钠再与反应生成氢氧化铜沉淀和硫酸钠,故该剩余废液中的溶质组成为、;
(2)①由图二可知,OA段反应过程没有沉淀生成,该过程对应图一中的步骤a;
②当滴入10%的NaOH溶液160g时(至图中C点),该点表示氢氧化钠与硫酸铜恰好完全反应(B点)后继续滴加氢氧化钠溶液,则此时烧杯中溶液含有氢氧化钠、硫酸钠,故该溶液中一定大量存在的阴离子是、;
③计算过程见答案。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
