专题1第1单元第1课时《物质及其反应的分类》课件 (共34张PPT)——高中化学 苏教版(2019)必修第一册
文档属性
| 名称 | 专题1第1单元第1课时《物质及其反应的分类》课件 (共34张PPT)——高中化学 苏教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 515.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-20 00:00:00 | ||
图片预览









文档简介
(共34张PPT)
专题1 物质的分类及计量
第一单元 物质及其反应的分类
1.学会从不同的角度对常见物质进行分类。掌握化学物质的分类方法。(重点)
2.理解单质、氧化物、酸、碱、盐等物质之间的转化关系。(重点)
3.了解化学反应的基本类型和特点。
学习目标
【学习目标】
图书馆里有成千上万的书籍,超市里有琳琅满目的商品,为什么我们能很快找到需要的书和商品呢?那是因为对书籍和商品进行了分类,否则,无疑是大海捞针。
思考:(1)分类是一种怎样的方法呢?
(2)物质分类对于化学家研究物质有何帮助呢?
新课导入
一、简单分类法及其应用
分类:把某些特征相似的事物归类到一起的方法。
【想一想】没有分类的世界的模样会怎样?
分类的目的和意义:能够提高人们工作、学习的效率,使人们更快更便捷地达到目的。
知识梳理
【提示】(1)根据通常的存在状态分类:
①气体:空气、氢气
②液体:乙醇、食盐水
③固体:硫酸铵、铜、碘、石墨
(2)根据导电性能分类:
①导体:食盐水、铜、石墨
②绝缘体:空气、乙醇、碘、氢气、硫酸铵
1.请尝试对下列化学物质进行分类,并与同学交流:
空气、乙醇、硫酸铵、铜、碘、氢气、石墨、食盐水
【想一想】
(3)根据所含物质的种类分类:
①混合物:空气、食盐水
②纯净物:乙醇、硫酸铵、铜、碘、氢气、石墨
(4)根据组成纯净物的元素种类分类:
①单质:铜、碘、氢气、石墨
②化合物:乙醇、硫酸铵
(5)将纯净物分为无机物和有机物:
①有机物:乙醇
②无机物:硫酸铵
2.请回顾初中化学学过哪些有关物质类别的概念
【提示】混合物、纯净物、单质、化合物、金属单质、非金属单质、稀有气体单质、酸、碱、盐、氧化物
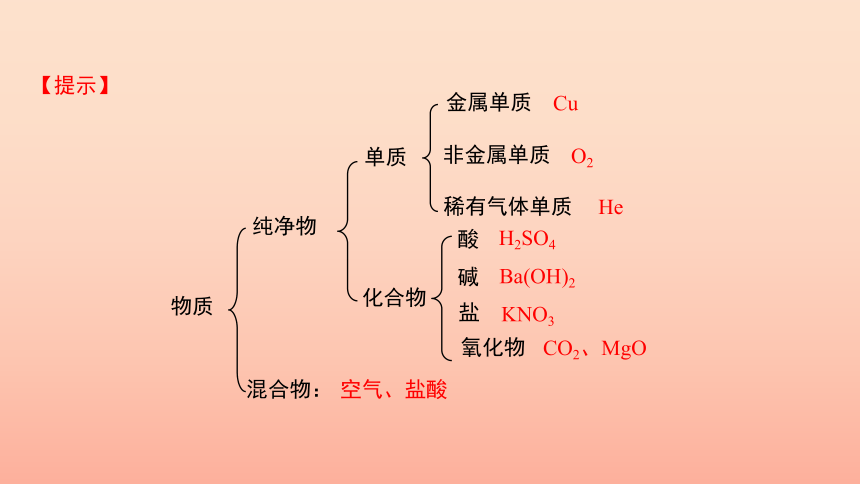
3.请大家用已有知识对上述概念进行分类,并用图示把这些概念的相互关系表示出来,并将下列物质写在其所属物质分类的后面:
O2、Cu、He、H2SO4、Ba(OH)2、KNO3、CO2、MgO、空气、盐酸。
物质
纯净物
金属单质
非金属单质
化合物
酸
碱
盐
氧化物
单质
混合物:
稀有气体单质
Cu
O2
He
H2SO4
Ba(OH)2
KNO3
CO2、MgO
空气、盐酸
【提示】
物质
纯净物
金属单质
非金属单质
化合物
酸
碱
盐
氧化物
单质
混合物
稀有气体单质
1. 树状分类法——对同类事物进行再分类的方法。
二、分类的方法
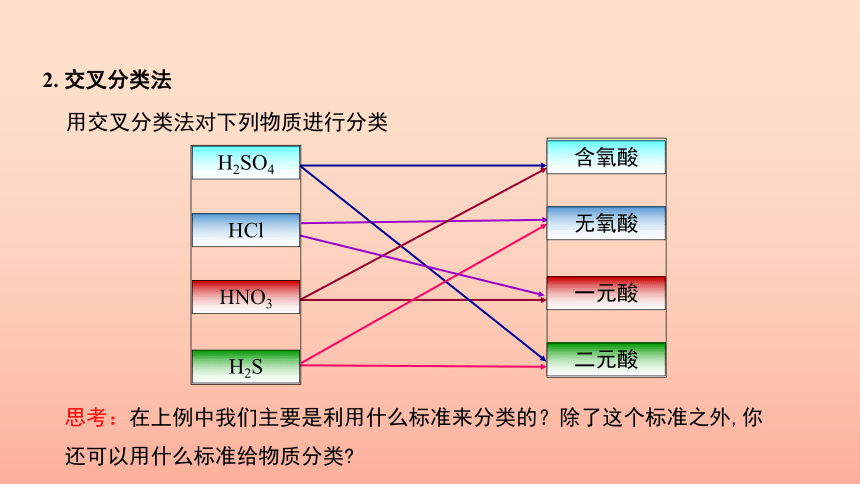
用交叉分类法对下列物质进行分类
思考:在上例中我们主要是利用什么标准来分类的?除了这个标准之外,你还可以用什么标准给物质分类
2. 交叉分类法
H2SO4
HCl
HNO3
H2S
含氧酸
无氧酸
一元酸
二元酸
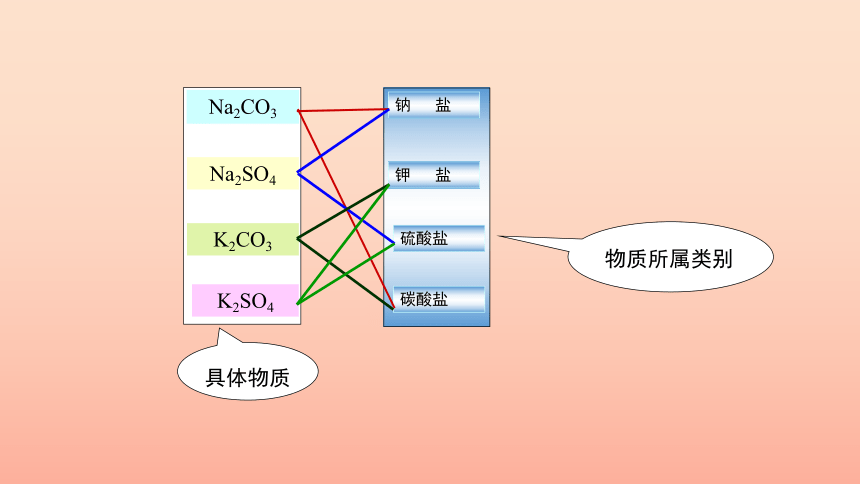
碳酸盐
硫酸盐
钾 盐
钠 盐
Na2CO3
Na2SO4
K2CO3
K2SO4
具体物质
物质所属类别
我们学习物质的分类是为了指导我们学习物质的性质,在初中的学习中我们已经学习过哪些类别物质的性质?它们分别具有什么样的性质?
酸
按是否含氧:含氧酸(H2SO4)、无氧酸(HCl)
按提供氢离子数目:一元酸、二元酸……
按强弱:强酸(H2SO4)、中强酸(H3PO4)、弱酸(H2CO3)
按挥发性:挥发性酸(HCl)、高沸点酸(H2SO4)
按溶解性:可溶性酸、难溶性酸
酸的分类
KOH、NaOH、Ba(OH)2、NH3·H2O
易溶碱:
可溶碱:
微溶碱:
难溶碱:
Ca(OH)2
Mg(OH)2、Zn(OH)2、Cu(OH)2 Fe(OH)3
碱
一元碱、二元碱、多元碱
按溶解性
按提供OH-的数目:
碱的分类
1. 按组成分为:
NaCl、FeS、MgCl2
NaNO3、CuSO4、CaCO3
某化某
某酸某
NaHCO3、Ca(HCO3)2
NaH2PO4
某酸氢某
某酸几氢某
Cu2(OH)2CO3、Mg(OH)Cl
碱式某酸(化)某
正 盐:
酸式盐:
碱式盐:
盐的分类
2. 按是否可溶于水:
可溶性盐:
难溶性盐:
KCl、Na2S、NH4HCO3、MgSO4
CaCO3、AgCl、BaSO4
3. 按阴、阳离子来分:
阳离子:
阴离子:
K+、Na+、 、Cu2+、Ca2+
、 、Cl-、 、
某盐
某酸盐
金属氧化物
非金属氧化物
酸性氧化物
碱性氧化物
Fe2O3
Al2O3
NO
Na2O
SO2
CO
氧
化
物
组成元素
性 质
氧化物的分类
下列是实验室常见的物质,它们能和哪些物质发生反应,写出反应的方程式,并总结反应的规律。
Fe、O2 、 C、CO2、CaO、NaOH溶液、H2SO4、CuSO4溶液、Na2CO3溶液
【思考与交流】
【提示】
(1)Fe
3Fe+2O2====Fe3O4
点燃
Fe+H2SO4====FeSO4+H2↑
Fe+CuSO4====FeSO4+Cu
C+O2====CO2
点燃
(2)C
C+2CuO====CO2↑+2Cu
高温
金属+酸→盐+H2↑
1. 单质
非金属单质
金属单质
金属+盐溶液→新的盐溶液+新的金属
金属+O2→氧化物
与氧气反应→氧化物
与金属氧化物反应→氧化物+金属
讨论小结:
(4)CaO
CaO+H2O====Ca(OH)2
CaO+2HCl====CaCl2+H2O
【提示】
(3)CO2
CO2+H2O====H2CO3
CO2+2NaOH====Na2CO3+H2O
CO2+ CaO====CaCO3
2. 氧化物
酸性
氧化物
酸性氧化物+H2O→含氧酸
酸性氧化物+碱→盐+H2O
酸性氧化物+碱性氧化物→含氧酸盐
碱性
氧化物
碱性氧化物(Na2O,CaO)+H2O→可溶性碱
碱性氧化物+酸→盐+水
碱性氧化物+酸性氧化物→含氧酸盐
讨论小结:
【提示】
(5)H2SO4
H2SO4 + CaO====CaSO4+H2O
H2SO4 + 2NaOH====Na2SO4+2H2O
H2SO4 + Na2CO3====Na2SO4+H2O+CO2↑
3. 酸
酸+指示剂
酸+碱性氧化物→盐+水
酸+碱→盐+水
酸+盐→新盐+新酸
某些含氧酸→水+酸性氧化物
讨论小结:
4. 碱
碱+指示剂
碱+酸性氧化物→盐+水
碱+酸→盐+水
碱+盐→新盐+新碱
难溶性碱→水+碱性氧化物
(6)NaOH
2NaOH+ H2SO4 ====Na2SO4+2H2O
2NaOH+CuSO4 ====Na2SO4+Cu(OH)2↓
2NaOH + CO2 ====Na2CO3+H2O
【提示】
讨论小结:
反应类型 实例
化合反应
分解反应
置换反应
复分解反应
A+B====AB
AB====A+B
AB+C====A+BC
AB+CD====AD+CB
H2SO4 +2NaOH====Na2SO4+2H2O
2H2+O2====2H2O
点燃
2KClO3====2KCl+3O2↑
MnO2
△
H2SO4 +Zn====ZnSO4 +H2↑
四种基本类型的化学反应
其他反应类型:
CH4+2O2====CO2+2H2O
点燃
根据反应前后元素的化合价是否变化:
(1)氧化还原反应:元素化合价__________的反应;
(2)非氧化还原反应:元素化合价___________的反应。
观察下列化学方程式中各元素化合价变化情况:
发生变化
不发生变化
CH4+2O2====CO2+2H2O
点燃
氧化还原反应和四大基本反应类型的关系
氧化还原反应
置换
反应
化合
反应
分解
反应
复分解
反应
【交流讨论】
(1)水溶液中发生复分解反应,至少要具备下列条件之一:
a. 生成沉淀(包括微溶物)
b. 生成挥发性物质(气体)
c. 生成水
(2)在水溶液中,一种金属与另一种可溶性金属的盐溶液
发生置换反应具备的条件是:
活动性较强的金属置换活动性较弱的金属
金属活动性顺序(常见元素)
K Ca Na Mg Al Zn Fe … Cu Hg Ag
两类反应发生的条件
1.分类的一般步骤:
2.分类的一般原则:
行之有效,简单易行
确定分类标准
选择分类方法
得出正确分类
3.物质的分类
4.物质的转化
课堂小结
1.在物质的分类中,前者包括后者的是( )
A.氧化物、酸性氧化物 B.含氧酸、酸
C.碱性氧化物、碱 D.酸式盐、盐
A
当堂检测
2.按照物质的树状分类和交叉分类,H2SO4属于( )
①酸 ②氢化物 ③氧化物 ④含氧酸
⑤一元酸 ⑥化合物 ⑦混合物
A.①④⑤ B.①④⑦
C.①⑥ D.①④⑥
D
课堂练习
3.比较归纳是化学学习常用的一种方法。对以下三种物质的转化关系,①C→CO2 ②CH4→CO2 ③CO→CO2,
比较归纳正确的是( )
A.三种转化关系中发生的反应都属于化合反应
B.三种转化关系中所有的生成物在常温下都是气体
C.三种物质都只能跟氧气反应转化为二氧化碳
D.三种物质都能在点燃条件下转化为二氧化碳
D
课堂练习
C
4. 下列属于氧化还原反应的是 ( )
A.2NaHCO3 ==== Na2CO3+H2O+CO2↑
B.Na2O+H2O ==== 2NaOH
C.2KI+Br2==== 2KBr+I2
D.MgO+2HCl==== MgCl2+H2O
△
课堂练习
5.下列物质可直接反应生成盐的是( )
①金属 ②碱性氧化物 ③碱
④非金属 ⑤酸性氧化物 ⑥酸
A.只有①②③ B.只有①④⑥
C.只有②⑤⑥ D.全部
D
课堂练习
专题1 物质的分类及计量
第一单元 物质及其反应的分类
1.学会从不同的角度对常见物质进行分类。掌握化学物质的分类方法。(重点)
2.理解单质、氧化物、酸、碱、盐等物质之间的转化关系。(重点)
3.了解化学反应的基本类型和特点。
学习目标
【学习目标】
图书馆里有成千上万的书籍,超市里有琳琅满目的商品,为什么我们能很快找到需要的书和商品呢?那是因为对书籍和商品进行了分类,否则,无疑是大海捞针。
思考:(1)分类是一种怎样的方法呢?
(2)物质分类对于化学家研究物质有何帮助呢?
新课导入
一、简单分类法及其应用
分类:把某些特征相似的事物归类到一起的方法。
【想一想】没有分类的世界的模样会怎样?
分类的目的和意义:能够提高人们工作、学习的效率,使人们更快更便捷地达到目的。
知识梳理
【提示】(1)根据通常的存在状态分类:
①气体:空气、氢气
②液体:乙醇、食盐水
③固体:硫酸铵、铜、碘、石墨
(2)根据导电性能分类:
①导体:食盐水、铜、石墨
②绝缘体:空气、乙醇、碘、氢气、硫酸铵
1.请尝试对下列化学物质进行分类,并与同学交流:
空气、乙醇、硫酸铵、铜、碘、氢气、石墨、食盐水
【想一想】
(3)根据所含物质的种类分类:
①混合物:空气、食盐水
②纯净物:乙醇、硫酸铵、铜、碘、氢气、石墨
(4)根据组成纯净物的元素种类分类:
①单质:铜、碘、氢气、石墨
②化合物:乙醇、硫酸铵
(5)将纯净物分为无机物和有机物:
①有机物:乙醇
②无机物:硫酸铵
2.请回顾初中化学学过哪些有关物质类别的概念
【提示】混合物、纯净物、单质、化合物、金属单质、非金属单质、稀有气体单质、酸、碱、盐、氧化物
3.请大家用已有知识对上述概念进行分类,并用图示把这些概念的相互关系表示出来,并将下列物质写在其所属物质分类的后面:
O2、Cu、He、H2SO4、Ba(OH)2、KNO3、CO2、MgO、空气、盐酸。
物质
纯净物
金属单质
非金属单质
化合物
酸
碱
盐
氧化物
单质
混合物:
稀有气体单质
Cu
O2
He
H2SO4
Ba(OH)2
KNO3
CO2、MgO
空气、盐酸
【提示】
物质
纯净物
金属单质
非金属单质
化合物
酸
碱
盐
氧化物
单质
混合物
稀有气体单质
1. 树状分类法——对同类事物进行再分类的方法。
二、分类的方法
用交叉分类法对下列物质进行分类
思考:在上例中我们主要是利用什么标准来分类的?除了这个标准之外,你还可以用什么标准给物质分类
2. 交叉分类法
H2SO4
HCl
HNO3
H2S
含氧酸
无氧酸
一元酸
二元酸
碳酸盐
硫酸盐
钾 盐
钠 盐
Na2CO3
Na2SO4
K2CO3
K2SO4
具体物质
物质所属类别
我们学习物质的分类是为了指导我们学习物质的性质,在初中的学习中我们已经学习过哪些类别物质的性质?它们分别具有什么样的性质?
酸
按是否含氧:含氧酸(H2SO4)、无氧酸(HCl)
按提供氢离子数目:一元酸、二元酸……
按强弱:强酸(H2SO4)、中强酸(H3PO4)、弱酸(H2CO3)
按挥发性:挥发性酸(HCl)、高沸点酸(H2SO4)
按溶解性:可溶性酸、难溶性酸
酸的分类
KOH、NaOH、Ba(OH)2、NH3·H2O
易溶碱:
可溶碱:
微溶碱:
难溶碱:
Ca(OH)2
Mg(OH)2、Zn(OH)2、Cu(OH)2 Fe(OH)3
碱
一元碱、二元碱、多元碱
按溶解性
按提供OH-的数目:
碱的分类
1. 按组成分为:
NaCl、FeS、MgCl2
NaNO3、CuSO4、CaCO3
某化某
某酸某
NaHCO3、Ca(HCO3)2
NaH2PO4
某酸氢某
某酸几氢某
Cu2(OH)2CO3、Mg(OH)Cl
碱式某酸(化)某
正 盐:
酸式盐:
碱式盐:
盐的分类
2. 按是否可溶于水:
可溶性盐:
难溶性盐:
KCl、Na2S、NH4HCO3、MgSO4
CaCO3、AgCl、BaSO4
3. 按阴、阳离子来分:
阳离子:
阴离子:
K+、Na+、 、Cu2+、Ca2+
、 、Cl-、 、
某盐
某酸盐
金属氧化物
非金属氧化物
酸性氧化物
碱性氧化物
Fe2O3
Al2O3
NO
Na2O
SO2
CO
氧
化
物
组成元素
性 质
氧化物的分类
下列是实验室常见的物质,它们能和哪些物质发生反应,写出反应的方程式,并总结反应的规律。
Fe、O2 、 C、CO2、CaO、NaOH溶液、H2SO4、CuSO4溶液、Na2CO3溶液
【思考与交流】
【提示】
(1)Fe
3Fe+2O2====Fe3O4
点燃
Fe+H2SO4====FeSO4+H2↑
Fe+CuSO4====FeSO4+Cu
C+O2====CO2
点燃
(2)C
C+2CuO====CO2↑+2Cu
高温
金属+酸→盐+H2↑
1. 单质
非金属单质
金属单质
金属+盐溶液→新的盐溶液+新的金属
金属+O2→氧化物
与氧气反应→氧化物
与金属氧化物反应→氧化物+金属
讨论小结:
(4)CaO
CaO+H2O====Ca(OH)2
CaO+2HCl====CaCl2+H2O
【提示】
(3)CO2
CO2+H2O====H2CO3
CO2+2NaOH====Na2CO3+H2O
CO2+ CaO====CaCO3
2. 氧化物
酸性
氧化物
酸性氧化物+H2O→含氧酸
酸性氧化物+碱→盐+H2O
酸性氧化物+碱性氧化物→含氧酸盐
碱性
氧化物
碱性氧化物(Na2O,CaO)+H2O→可溶性碱
碱性氧化物+酸→盐+水
碱性氧化物+酸性氧化物→含氧酸盐
讨论小结:
【提示】
(5)H2SO4
H2SO4 + CaO====CaSO4+H2O
H2SO4 + 2NaOH====Na2SO4+2H2O
H2SO4 + Na2CO3====Na2SO4+H2O+CO2↑
3. 酸
酸+指示剂
酸+碱性氧化物→盐+水
酸+碱→盐+水
酸+盐→新盐+新酸
某些含氧酸→水+酸性氧化物
讨论小结:
4. 碱
碱+指示剂
碱+酸性氧化物→盐+水
碱+酸→盐+水
碱+盐→新盐+新碱
难溶性碱→水+碱性氧化物
(6)NaOH
2NaOH+ H2SO4 ====Na2SO4+2H2O
2NaOH+CuSO4 ====Na2SO4+Cu(OH)2↓
2NaOH + CO2 ====Na2CO3+H2O
【提示】
讨论小结:
反应类型 实例
化合反应
分解反应
置换反应
复分解反应
A+B====AB
AB====A+B
AB+C====A+BC
AB+CD====AD+CB
H2SO4 +2NaOH====Na2SO4+2H2O
2H2+O2====2H2O
点燃
2KClO3====2KCl+3O2↑
MnO2
△
H2SO4 +Zn====ZnSO4 +H2↑
四种基本类型的化学反应
其他反应类型:
CH4+2O2====CO2+2H2O
点燃
根据反应前后元素的化合价是否变化:
(1)氧化还原反应:元素化合价__________的反应;
(2)非氧化还原反应:元素化合价___________的反应。
观察下列化学方程式中各元素化合价变化情况:
发生变化
不发生变化
CH4+2O2====CO2+2H2O
点燃
氧化还原反应和四大基本反应类型的关系
氧化还原反应
置换
反应
化合
反应
分解
反应
复分解
反应
【交流讨论】
(1)水溶液中发生复分解反应,至少要具备下列条件之一:
a. 生成沉淀(包括微溶物)
b. 生成挥发性物质(气体)
c. 生成水
(2)在水溶液中,一种金属与另一种可溶性金属的盐溶液
发生置换反应具备的条件是:
活动性较强的金属置换活动性较弱的金属
金属活动性顺序(常见元素)
K Ca Na Mg Al Zn Fe … Cu Hg Ag
两类反应发生的条件
1.分类的一般步骤:
2.分类的一般原则:
行之有效,简单易行
确定分类标准
选择分类方法
得出正确分类
3.物质的分类
4.物质的转化
课堂小结
1.在物质的分类中,前者包括后者的是( )
A.氧化物、酸性氧化物 B.含氧酸、酸
C.碱性氧化物、碱 D.酸式盐、盐
A
当堂检测
2.按照物质的树状分类和交叉分类,H2SO4属于( )
①酸 ②氢化物 ③氧化物 ④含氧酸
⑤一元酸 ⑥化合物 ⑦混合物
A.①④⑤ B.①④⑦
C.①⑥ D.①④⑥
D
课堂练习
3.比较归纳是化学学习常用的一种方法。对以下三种物质的转化关系,①C→CO2 ②CH4→CO2 ③CO→CO2,
比较归纳正确的是( )
A.三种转化关系中发生的反应都属于化合反应
B.三种转化关系中所有的生成物在常温下都是气体
C.三种物质都只能跟氧气反应转化为二氧化碳
D.三种物质都能在点燃条件下转化为二氧化碳
D
课堂练习
C
4. 下列属于氧化还原反应的是 ( )
A.2NaHCO3 ==== Na2CO3+H2O+CO2↑
B.Na2O+H2O ==== 2NaOH
C.2KI+Br2==== 2KBr+I2
D.MgO+2HCl==== MgCl2+H2O
△
课堂练习
5.下列物质可直接反应生成盐的是( )
①金属 ②碱性氧化物 ③碱
④非金属 ⑤酸性氧化物 ⑥酸
A.只有①②③ B.只有①④⑥
C.只有②⑤⑥ D.全部
D
课堂练习
