浙江省宁波市三锋教研联盟2024-2025学年高一下学期4月期中化学试卷(含答案)
文档属性
| 名称 | 浙江省宁波市三锋教研联盟2024-2025学年高一下学期4月期中化学试卷(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 269.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-19 00:00:00 | ||
图片预览




文档简介
绝密★考试结束前
2024学年第二学期宁波三锋教研联盟期中联考
高一年级化学学科试题
考生须知:
1. 本卷共8页满分100分,考试时间90分钟。
2. 答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相应数字。
3. 所有答案必须写在答题纸上,写在试卷上无效。
4. 考试结束后,只需上交答题纸。
可能用到的相对原子质量: H1 C12 N14 016 Mg 24 Si 28
选择题部分
一、选择题(本大题共25题,每小题2分,共50分。每小题列出的四个选项只有一个是符合题目 要求的,不选、多选、错选均不得分)
1.下列物质属于酸性氧化物的是
A. 一氧化氮 B.氧化铝 C.次氯酸 D.二氧化硅
2. 煤层气的主要成分是
A. 甲烷 B.一氧化碳 C.氢气 D.乙烯
3.下列仪器名称正确的是
A. 三脚架 B.钳 锅
4.下列有关化学用语表示正确的是
A.乙炔的结构简式: H-C 三C-H
C. 蒸发皿
B.氮气的结构式:
D.长颈漏斗
NEN
C.甲基的电子式: D.四氯化碳的空间填充模型:
5.下列反应中属于取代反应的是
A.2KI+Cl =2KCl+I
C.AgNO +HCl=AgCll+H O
D.CH =CH +Br — →CH BrCH Br
高一化学学科试题第1页(共8页)
(
6.下列反应属于非氧化还原反应,且能量变化符
合右图所示的反应是
A.氢氧化钠溶液与硫酸溶液反应
B.盐酸与镁条反应
C.
NH
Cl
晶体与
Ba
(
OH
) ·8H O
晶体混合
D.灼热的炭与二氧化碳反应
7.下列物质对应的化学式正确的是
A.
黄铁矿
FeS
B
.
石膏2
CaSO
·H O
C.
重晶石
BaSO
D.
金刚砂
SiO
8.下列说法正确的是
)
(
反应物
能量
变化
生成物
反应过程
能量
)
A.C H 与 C H 一定互为同系物 B.CH OCH 与 CH CH OH 互为同分异构体
c. Na 与 Mg 互为同位素 D.H 与 D 互为同素异形体
9.对于反应:3A(g)+B(g)=2C(g)+4D(g), 表示该反应速率最快的是
A.v(A)=0.6mol/(L·s) B.v(B)=0.4mol/(L·s)
C.v(C)=0.7mol/(L·s) D.vD)=2.0mol/(L·min)
10.关于实验室安全与操作,说法不正确的是
A. 易燃物如钠、钾、白磷等未用完放回原试剂瓶
B.制备银氨溶液:在洁净的试管中加入1mL2% 氨水,边振荡边逐滴加入2%AgNO 溶液,直到最 初产生的沉淀完全溶解
C. 制备氢氧化铁胶体:向沸水中逐滴加入5~6滴FeCl 饱和溶液,继续煮沸至液体呈红褐色
D.如不慎将碱沾到皮肤上,应立即用大量水冲洗,然后涂上1%的硼酸
11.下列说法正确的是
A.糖类是具有甜味的物质,都符合Cn(H O)m 的通式
B.工业上可利用油脂在酸性条件下的水解获得高级脂肪酸盐和甘油,进行肥皂生产
C. 蛋白质在重金属盐的作用下会变性,因此服用“钡餐”会引起中毒
D. 淀粉和纤维素都属于天然高分子化合物
12.化学在材料领域发挥着举足轻重的作用,下列说法正确的是
A.工业上常用硫与橡胶作用进行橡胶硫化以获得更好的强度、韧性和化学稳定性,该过程仅发生 物理变化
B. 聚乙烯绝缘性好,耐化学腐蚀,可作为食品包装袋,但含碳碳双键,易发生加成反应容易老化
C.“蛟龙”号载人潜水器的耐压球壳使用到钛合金材料,属于新型合金
D.利用高纯硅的半导体性能可以制成计算机芯片、太阳能电池以及光导纤维
13.下列方程式书写正确的是
A. 向氯化铝溶液中逐滴加入过量氨水的离子方程式: AI ++4NH ·H O=[AI(OH)] +4NH
B.碳酸氢钠电离方程式: NaHCO =Na++HCO
C. 铜与浓硝酸反应的离子方程式:8H*+2NO +3Cu=2NO↑+4H O+3Cu +
D.工业制备漂白粉的离子方程式:Cl +2OH=Cl+ClO+H O
14.N 和 H 在催化剂表面合成氨的微观历程示意图如下,已知N +3H =2NH 为放热反应,下列说法 正确的是
高一化学学科试题第2页(共8页)
A.使用催化剂可以大大减少该反应放出的热量
B.反应物断键吸收的能量低于生成物成键放出的能量
C.温度升高,正反应速率减慢、逆反应速率加快
D.反应过程伴随着极性键、非极性键的断裂和形成
15.化学能源利用与生产生活息息相关,下列说法正确的是
A.新能源包括太阳能、风能、地热能、海洋能和氢能等
B. 氢 气 是 非 常 有 前 途 的 新 型 能 源 , 可 以 通 过 寻 找 化 石 燃 料 , 利 用 燃 烧 放 热 使 水 分 解 产 生 更 多 氢 气
C.燃料电池具有清洁、安全、高效等特点,能将化学能完全转化为电能
D.发展燃煤脱硫技术能有效减少碳排放
16.某学生设计并制作了一个水果电池,结构如图所示。下列说法正确的是
A.该装置只实现了化学能转化为电能
B.铜片作正极,发生氧化反应
C.电池工作时,电子从锌片经柠檬流向铜片
D.电池工作结束后柠檬的酸性减弱
17.化学与生活、生产息息相关。下列做法与调控化学反应速率无关的是
A.用冰箱冷藏食物 B.制作糕点时添加少量碳酸氢铵
C.煅烧矿石时,向炉膛鼓风增强火势 D.将固体试剂溶于水配成溶液后进行实验
18.某课外小组利用数字化实验设备探究镁与不同浓度盐酸的反应速率。取两份0.01g 镁条分别与 1mol/L 和0.5mol/L 的盐酸反应,盐酸的体积均为2mL, 实验测得反应体系压强(p)随时间(t)的变化曲
线如图所示。下列说法不正确的是
(
I
120-
I
115-
110-
105-
400
600
t/s
0
200
p/kPa
)
A.曲线I 表示的是1mol/L 盐酸与镁反应
B.理论上经历足够长时间,两条曲线最终会重合
C.若其他条件不变,将盐酸换成同浓度的硫酸,获得的曲线相同
D.向实验中滴加少量硫酸铜,反应速率变快
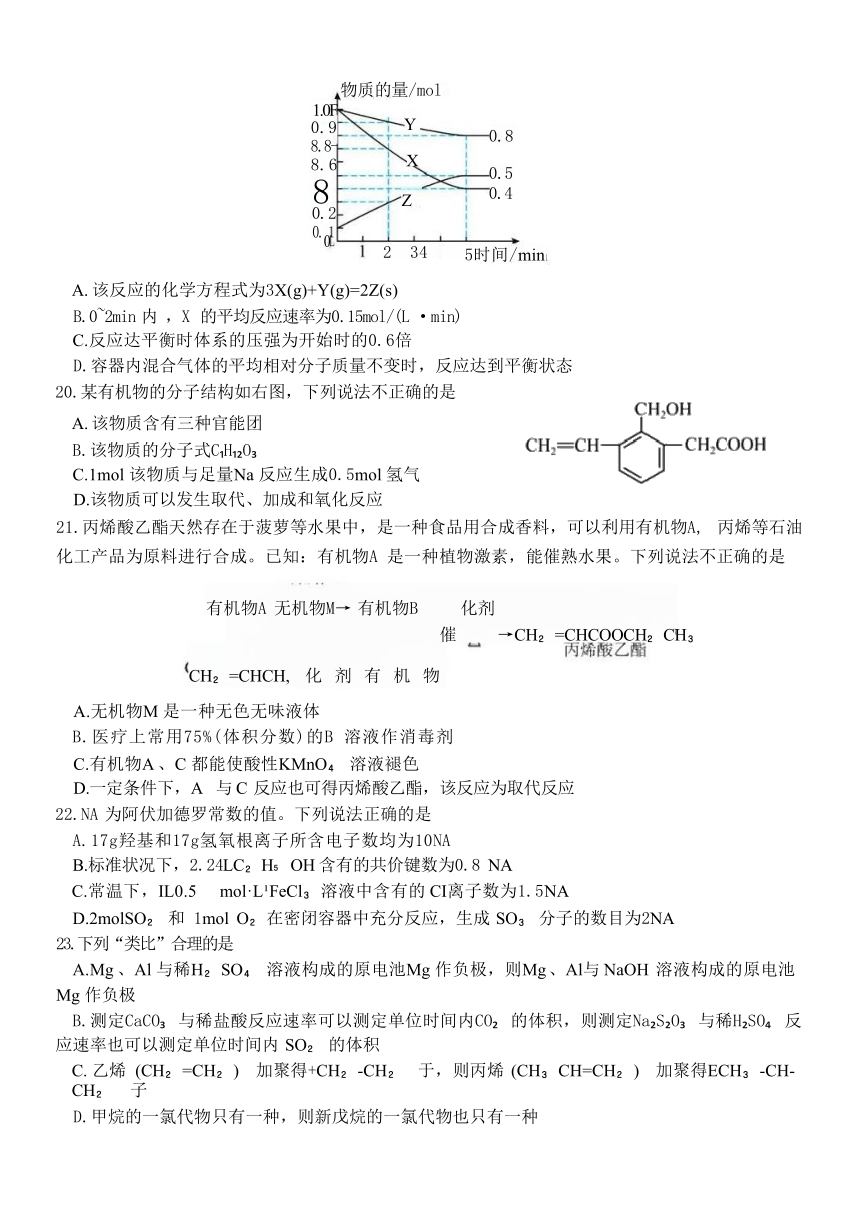
19.恒温下在2L 密闭容器中,通入一定量的气体X 和 Y 发生反应生成固体Z, 三种物质的物质的量 随 时 间 变 化 曲 线 如 图 。 下 列 说 法 不 正 确 的 是
高 一 化 学 学 科 试 题 第 3 页 ( 共 8 页 )
(
物质的量/mol
Y
X
8
2 34
5时间/
min
1.0F
0.9
8.8-
8.6
0.8
0.5
0.4
0.2
0.
0
Z
)
A. 该反应的化学方程式为3X(g)+Y(g)=2Z(s)
B.0~2min 内 ,X 的平均反应速率为0.15mol/(L ·min)
C.反应达平衡时体系的压强为开始时的0.6倍
D.容器内混合气体的平均相对分子质量不变时,反应达到平衡状态
20.某有机物的分子结构如右图,下列说法不正确的是
A. 该物质含有三种官能团
B.该物质的分子式C H O
C.1mol 该物质与足量Na 反应生成0.5mol 氢气
D.该物质可以发生取代、加成和氧化反应
21.丙烯酸乙酯天然存在于菠萝等水果中,是一种食品用合成香料,可以利用有机物A, 丙烯等石油 化工产品为原料进行合成。已知:有机物A 是一种植物激素,能催熟水果。下列说法不正确的是
有机物A 无机物M→ 有机物B 化剂
催 →CH =CHCOOCH CH
CH =CHCH, 化 剂 有 机 物
A.无机物M 是一种无色无味液体
B.医疗上常用75%(体积分数)的B 溶液作消毒剂
C.有机物A 、C 都能使酸性KMnO 溶液褪色
D.一定条件下,A 与 C 反应也可得丙烯酸乙酯,该反应为取代反应
22.NA 为阿伏加德罗常数的值。下列说法正确的是
A.17g羟基和17g氢氧根离子所含电子数均为10NA
B.标准状况下,2.24LC H OH 含有的共价键数为0.8 NA
C.常温下,IL0.5 mol·L FeCl 溶液中含有的 CI离子数为1.5NA
D.2molSO 和 1mol O 在密闭容器中充分反应,生成 SO 分子的数目为2NA
23.下列“类比”合理的是
A.Mg 、Al 与稀H SO 溶液构成的原电池Mg 作负极,则Mg 、Al与 NaOH 溶液构成的原电池Mg 作负极
B.测定CaCO 与稀盐酸反应速率可以测定单位时间内CO 的体积,则测定Na S O 与稀H SO 反 应速率也可以测定单位时间内 SO 的体积
C. 乙烯 (CH =CH ) 加聚得+CH -CH 于,则丙烯 (CH CH=CH ) 加聚得ECH -CH-CH 子
D.甲烷的一氯代物只有一种,则新戊烷的一氯代物也只有一种
高一化学学科试题第4页(共8页)
24.某课外兴趣小组利用硫代硫酸钠(Na S O3) 与稀硫酸反应,探究影响化学反应速率的因素(反应方 程式为Na S O +H SO =Na SO +SJ+SO ↑+H O), 设计了如表系列实验。下列说法不正确的是
实验序号 反应温度/℃ Na S O 稀硫酸 H O 反应停止所需时间
V/mL c/(mol ·L) V/mL c/(mol ·L ) V/mL
1 20 10.0 0.10 10.0 0.50 0 t
2 40 V 0.10 V 0.50 V t
3 20 V 0.10 4.0 0.50 V t
A.若用实验1和3探究稀硫酸浓度对反应速率的影响,则需V =10.0,V =6.0,tB.设计该实验的基本原理为变量控制,实验说明可以通过改变反应条件调控化学反应的速率
C. 若实验1不再产生沉淀的时间为5min, 则 v(H)=0.1mol-L ·min
D.将水更换为Na SO 溶液,对实验结果无影响
25.下列实验操作后,记录到相应现象,则能证明实验结论的是
选项 实验操作与现象 结论
A 将收集满甲烷和氯气混合气的试管倒扣在盛满水的水槽中,静置光照, 试管中液面上升 甲烷和氯气发生 了取代反应
B 将灼烧后表面变黑的螺旋状铜丝伸入约50℃的乙醇中,铜丝能保持红 热一段时间 乙醇催化氧化反 应是放热反应
C 取5mL0.1mol ·L 'FeCl 溶液于试管中,加入1mL0.1mol ·L KI溶液,充 分反应后滴入5滴15%KSCN溶液,溶液变血红色 KI与FeCl 的反 应有一定限度
D 大理石中加入盐酸后,将产生的气体通入硅酸钠水溶液中,硅酸钠溶 液变浑浊 碳酸的酸性强于 硅酸
非选择题部分
二 、非选择题(本大题共5小题,共50分)
26. (8分)请回答:
(1)写出乙酸甲酯的分子式
(2)写出H S 的电子式
(3)写出在一定条件下以氯乙烯为原料制备聚氯乙烯的化学方程式
(4)写出用覆铜板制作印刷电路板的离子方程式
27. (10分)乙二醇单乙酸酯可作为香料调香和定香的溶剂,应用于日用化妆品的生产中。其一种合成 路线图如下,其中A 的产量用来衡量一个国家石油化工发展水平, C 是生物的主要供能物质,A 、C 均可在一定条件下转化为B 。 回答下列问题:
高一化学学科试题第5页(共8页)
(1)A 的结构简式为 ,乙二醇单乙酸酯中所含官能团名称为
(2)D 与 E 生成乙二醇单乙酸酯的反应类型为 -0
(3)请写出C 转化为B 的化学方程式_
(4)下列说法正确的是 0
a.E 与 B 互为同系物
b.D 与 E 的反应需控制条件与反应物用量避免副产物生成
c.1mol 乙二醇单乙酸酯最多与1mol 钠反应生成11.2LH
28. (14分)氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及氨氧化制硝酸
高一化学学科试题第6页(共8页)
的流程示意图。
N 、H
合成塔
氨分离器
A
氧化炉
水
吸收塔
尾气处理装置
硝酸
(1)工业合成氨在合成塔中进行原理为: N (g)+3H (g)=2NH (g), 合成塔中每产生2mol NH , 放出92kJ 热量。已知断开1mol H-H 所需能量为436kJ 、断 开 1mol N=N 所需能量为946kJ, 则断开 1mol N-H 所需能量为 kJ。
(2)在氧化炉中NH 催化氧化生成NO, 反应为4NH (g)+5O (g)=4NO(g)+6H O(g) 。 某温度下, 在 2L 恒容密闭容器中充入4mol NH 和 5mol O 发生该反应, NH 的转化率随时间的变化关系如图。 (转化率:指已被转化的反应物的物质的量与其初始的物质的量之比)
①A 点的 v 正(NH )_ V逆(NH ) (填“>”“<”或“=”)
②0-5min内 O 的平均反应速率v(O )= mol/(L·min)
③下列措施能加快反应速率的是 _
A.升高温度
B. 将容器的体积减小一半
C.保持容器容积不变,充入 He 增大压强
D.不断将H O(g) 从体系中分离出来
④下列选项能说明上述反应已达到平衡的是
A.4v 正(NH )=5v 逆(O )
B. 单位时间内1mol N-H键断裂的同时有1mol H-O 键断裂 C.c(NH ):c(O ):c(NO):c(H O)=4:5:4:6
D. 容器内气体压强不再发生变化
(3)为避免硝酸生产尾气中的氮氧化物污染环境,可设计如图所示装置对NO 进行回收利用,装 置中ab 均为多孔石墨电极,质子交换膜只允许H* 通过。
(
用电器
NO →
a—
稀
HNO
质
子交换
膜
-O
b
稀HNO
)
①a 是 极 (填“正”或“负”),发生 反应 (填“氧化”或“还原”)
②写出正极的电极反应式
I.工业制备乙醇:
(1)工业上用乙烯与水在一定条件下反应制得乙醇,该反应的反应类型为 o
Ⅱ.酿制米酒:参照传统方法用糯米酿制米酒。
(2)用糯米酿得的米酒中,乙醇的浓度通常较低,为制得高度酒可采用的方法是 。(填 操作名称)
(3)某化学小组为检验糯米中淀粉水解的情况,进行如下图所示的实验,试管甲和试管丙均用 60~80℃的水浴加热5~6min, 试管乙不加热,待试管甲中的溶液冷却后再进行后续实验。
高一化学学科试题第7页(共8页)
(
住房
)2g淀粉和20mL20% 的稀硫酸
2g淀粉和 20mL水
甲 乙 丙
实验1:取少量甲中溶液,加入新制的氢氧化铜,加热,没有砖红色沉淀出现。
实验2:取少量乙中溶液,滴加几滴碘水,溶液变为蓝色,但取少量甲中溶液做此实验时,溶液 不变蓝色。
实验3:取少量丙中溶液加入NaOH 溶液调节至碱性,再滴加碘水,溶液颜色无明显变化。
①设计甲和乙是为了探究_ 对淀粉水解的影响。
②实验1失败的原因是_
③写出淀粉水解的化学方程式_ -0
④下列结论中合理的是 (填字母)。
a. 淀粉水解需要在催化剂和一定温度下进行
b.欲检验淀粉是否完全水解,最好在冷却后的水解液中加碘
c.实验3说明丙中淀粉已水解完全
Ⅲ.乙醇与乙酸的反应如图所示。
( 4 ) 试 管a 中发生反应的化学方程式: _ 。
(5)试管b 中应装有 溶液(填“饱和Na CO " 或“饱和NaOH'), 该溶液的作用是 a.①② b.②③ c.①③d.①②③
①吸收乙醇②中和乙酸③降低乙酸乙酯在水中的溶解度
30. (6分)盖尔达法是测定牛奶样品中蛋白质含量的一种常用方法,其原理是把牛奶中的氮元素完全 转化成氨。为测定某款牛奶的蛋白质含量,取60.0g 牛奶样品,经盖尔达法处理后,用
50.00mL1.00mol/L 硫酸将其完全吸收(其他物质不与硫酸反应),再加入19.00mL4.00mol/L 氢 氧 化钠溶液恰好生成硫酸钠和硫酸铵。请计算:(计算结果均保留3位有效数字)
( 1 ) 所 用NaOH 的物质的量为 mol。
(2)样品中蛋白质转化生成的氨的物质的量为 mol。
(3)若蛋白质中氮元素的质量分数为14.0%,则样品中蛋白质的质量分数为 0
高一化学学科试题第8页(共8页)
2024学年第二学期宁波三锋教研联盟期中联考 高一年级化学学科参考答案
选择题部分
1 2 3 4 5 6 7 8 9 10
D A C B B A C B B B
11 12 13 14 15 16 17 18 19 20
D C B B A D B C B C
21 22 23 24 25
D C D C B
非选择题部分
26. (8分,每空2分)
(1)C H O (2)
(4)2Fe ++Cu=2Fe ++Cu +
27. (10分,每空2分)(1)CH =CH 酯基、羟基 (2)酯化反应(取代反应)
(4)bd
28. (14分)(1)391(2分) (2)①>(2分) ②0.25 ( 2 分 ) ③AB(2 分 ) ④BD (2分)
(3)①负(1分) 氧化(1分) ②O +4e+4H =2H O(2 分)
29. (12分)(1)加成反应(1分) (2)蒸馏(1分)
(3)①温度(1分) ②没有加碱中和稀硫酸(1分)
③ 6(2分) ④ab(2 分)
(5)饱和Na CO (1 分) d(1分)
30. (6分,每空2分)(1)7.60×10 mol (2)2.40×10 mol (3)4.00% (未保留有效数字得1分)
2024学年第二学期宁波三锋教研联盟期中联考
高一年级化学学科试题
考生须知:
1. 本卷共8页满分100分,考试时间90分钟。
2. 答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相应数字。
3. 所有答案必须写在答题纸上,写在试卷上无效。
4. 考试结束后,只需上交答题纸。
可能用到的相对原子质量: H1 C12 N14 016 Mg 24 Si 28
选择题部分
一、选择题(本大题共25题,每小题2分,共50分。每小题列出的四个选项只有一个是符合题目 要求的,不选、多选、错选均不得分)
1.下列物质属于酸性氧化物的是
A. 一氧化氮 B.氧化铝 C.次氯酸 D.二氧化硅
2. 煤层气的主要成分是
A. 甲烷 B.一氧化碳 C.氢气 D.乙烯
3.下列仪器名称正确的是
A. 三脚架 B.钳 锅
4.下列有关化学用语表示正确的是
A.乙炔的结构简式: H-C 三C-H
C. 蒸发皿
B.氮气的结构式:
D.长颈漏斗
NEN
C.甲基的电子式: D.四氯化碳的空间填充模型:
5.下列反应中属于取代反应的是
A.2KI+Cl =2KCl+I
C.AgNO +HCl=AgCll+H O
D.CH =CH +Br — →CH BrCH Br
高一化学学科试题第1页(共8页)
(
6.下列反应属于非氧化还原反应,且能量变化符
合右图所示的反应是
A.氢氧化钠溶液与硫酸溶液反应
B.盐酸与镁条反应
C.
NH
Cl
晶体与
Ba
(
OH
) ·8H O
晶体混合
D.灼热的炭与二氧化碳反应
7.下列物质对应的化学式正确的是
A.
黄铁矿
FeS
B
.
石膏2
CaSO
·H O
C.
重晶石
BaSO
D.
金刚砂
SiO
8.下列说法正确的是
)
(
反应物
能量
变化
生成物
反应过程
能量
)
A.C H 与 C H 一定互为同系物 B.CH OCH 与 CH CH OH 互为同分异构体
c. Na 与 Mg 互为同位素 D.H 与 D 互为同素异形体
9.对于反应:3A(g)+B(g)=2C(g)+4D(g), 表示该反应速率最快的是
A.v(A)=0.6mol/(L·s) B.v(B)=0.4mol/(L·s)
C.v(C)=0.7mol/(L·s) D.vD)=2.0mol/(L·min)
10.关于实验室安全与操作,说法不正确的是
A. 易燃物如钠、钾、白磷等未用完放回原试剂瓶
B.制备银氨溶液:在洁净的试管中加入1mL2% 氨水,边振荡边逐滴加入2%AgNO 溶液,直到最 初产生的沉淀完全溶解
C. 制备氢氧化铁胶体:向沸水中逐滴加入5~6滴FeCl 饱和溶液,继续煮沸至液体呈红褐色
D.如不慎将碱沾到皮肤上,应立即用大量水冲洗,然后涂上1%的硼酸
11.下列说法正确的是
A.糖类是具有甜味的物质,都符合Cn(H O)m 的通式
B.工业上可利用油脂在酸性条件下的水解获得高级脂肪酸盐和甘油,进行肥皂生产
C. 蛋白质在重金属盐的作用下会变性,因此服用“钡餐”会引起中毒
D. 淀粉和纤维素都属于天然高分子化合物
12.化学在材料领域发挥着举足轻重的作用,下列说法正确的是
A.工业上常用硫与橡胶作用进行橡胶硫化以获得更好的强度、韧性和化学稳定性,该过程仅发生 物理变化
B. 聚乙烯绝缘性好,耐化学腐蚀,可作为食品包装袋,但含碳碳双键,易发生加成反应容易老化
C.“蛟龙”号载人潜水器的耐压球壳使用到钛合金材料,属于新型合金
D.利用高纯硅的半导体性能可以制成计算机芯片、太阳能电池以及光导纤维
13.下列方程式书写正确的是
A. 向氯化铝溶液中逐滴加入过量氨水的离子方程式: AI ++4NH ·H O=[AI(OH)] +4NH
B.碳酸氢钠电离方程式: NaHCO =Na++HCO
C. 铜与浓硝酸反应的离子方程式:8H*+2NO +3Cu=2NO↑+4H O+3Cu +
D.工业制备漂白粉的离子方程式:Cl +2OH=Cl+ClO+H O
14.N 和 H 在催化剂表面合成氨的微观历程示意图如下,已知N +3H =2NH 为放热反应,下列说法 正确的是
高一化学学科试题第2页(共8页)
A.使用催化剂可以大大减少该反应放出的热量
B.反应物断键吸收的能量低于生成物成键放出的能量
C.温度升高,正反应速率减慢、逆反应速率加快
D.反应过程伴随着极性键、非极性键的断裂和形成
15.化学能源利用与生产生活息息相关,下列说法正确的是
A.新能源包括太阳能、风能、地热能、海洋能和氢能等
B. 氢 气 是 非 常 有 前 途 的 新 型 能 源 , 可 以 通 过 寻 找 化 石 燃 料 , 利 用 燃 烧 放 热 使 水 分 解 产 生 更 多 氢 气
C.燃料电池具有清洁、安全、高效等特点,能将化学能完全转化为电能
D.发展燃煤脱硫技术能有效减少碳排放
16.某学生设计并制作了一个水果电池,结构如图所示。下列说法正确的是
A.该装置只实现了化学能转化为电能
B.铜片作正极,发生氧化反应
C.电池工作时,电子从锌片经柠檬流向铜片
D.电池工作结束后柠檬的酸性减弱
17.化学与生活、生产息息相关。下列做法与调控化学反应速率无关的是
A.用冰箱冷藏食物 B.制作糕点时添加少量碳酸氢铵
C.煅烧矿石时,向炉膛鼓风增强火势 D.将固体试剂溶于水配成溶液后进行实验
18.某课外小组利用数字化实验设备探究镁与不同浓度盐酸的反应速率。取两份0.01g 镁条分别与 1mol/L 和0.5mol/L 的盐酸反应,盐酸的体积均为2mL, 实验测得反应体系压强(p)随时间(t)的变化曲
线如图所示。下列说法不正确的是
(
I
120-
I
115-
110-
105-
400
600
t/s
0
200
p/kPa
)
A.曲线I 表示的是1mol/L 盐酸与镁反应
B.理论上经历足够长时间,两条曲线最终会重合
C.若其他条件不变,将盐酸换成同浓度的硫酸,获得的曲线相同
D.向实验中滴加少量硫酸铜,反应速率变快
19.恒温下在2L 密闭容器中,通入一定量的气体X 和 Y 发生反应生成固体Z, 三种物质的物质的量 随 时 间 变 化 曲 线 如 图 。 下 列 说 法 不 正 确 的 是
高 一 化 学 学 科 试 题 第 3 页 ( 共 8 页 )
(
物质的量/mol
Y
X
8
2 34
5时间/
min
1.0F
0.9
8.8-
8.6
0.8
0.5
0.4
0.2
0.
0
Z
)
A. 该反应的化学方程式为3X(g)+Y(g)=2Z(s)
B.0~2min 内 ,X 的平均反应速率为0.15mol/(L ·min)
C.反应达平衡时体系的压强为开始时的0.6倍
D.容器内混合气体的平均相对分子质量不变时,反应达到平衡状态
20.某有机物的分子结构如右图,下列说法不正确的是
A. 该物质含有三种官能团
B.该物质的分子式C H O
C.1mol 该物质与足量Na 反应生成0.5mol 氢气
D.该物质可以发生取代、加成和氧化反应
21.丙烯酸乙酯天然存在于菠萝等水果中,是一种食品用合成香料,可以利用有机物A, 丙烯等石油 化工产品为原料进行合成。已知:有机物A 是一种植物激素,能催熟水果。下列说法不正确的是
有机物A 无机物M→ 有机物B 化剂
催 →CH =CHCOOCH CH
CH =CHCH, 化 剂 有 机 物
A.无机物M 是一种无色无味液体
B.医疗上常用75%(体积分数)的B 溶液作消毒剂
C.有机物A 、C 都能使酸性KMnO 溶液褪色
D.一定条件下,A 与 C 反应也可得丙烯酸乙酯,该反应为取代反应
22.NA 为阿伏加德罗常数的值。下列说法正确的是
A.17g羟基和17g氢氧根离子所含电子数均为10NA
B.标准状况下,2.24LC H OH 含有的共价键数为0.8 NA
C.常温下,IL0.5 mol·L FeCl 溶液中含有的 CI离子数为1.5NA
D.2molSO 和 1mol O 在密闭容器中充分反应,生成 SO 分子的数目为2NA
23.下列“类比”合理的是
A.Mg 、Al 与稀H SO 溶液构成的原电池Mg 作负极,则Mg 、Al与 NaOH 溶液构成的原电池Mg 作负极
B.测定CaCO 与稀盐酸反应速率可以测定单位时间内CO 的体积,则测定Na S O 与稀H SO 反 应速率也可以测定单位时间内 SO 的体积
C. 乙烯 (CH =CH ) 加聚得+CH -CH 于,则丙烯 (CH CH=CH ) 加聚得ECH -CH-CH 子
D.甲烷的一氯代物只有一种,则新戊烷的一氯代物也只有一种
高一化学学科试题第4页(共8页)
24.某课外兴趣小组利用硫代硫酸钠(Na S O3) 与稀硫酸反应,探究影响化学反应速率的因素(反应方 程式为Na S O +H SO =Na SO +SJ+SO ↑+H O), 设计了如表系列实验。下列说法不正确的是
实验序号 反应温度/℃ Na S O 稀硫酸 H O 反应停止所需时间
V/mL c/(mol ·L) V/mL c/(mol ·L ) V/mL
1 20 10.0 0.10 10.0 0.50 0 t
2 40 V 0.10 V 0.50 V t
3 20 V 0.10 4.0 0.50 V t
A.若用实验1和3探究稀硫酸浓度对反应速率的影响,则需V =10.0,V =6.0,t
C. 若实验1不再产生沉淀的时间为5min, 则 v(H)=0.1mol-L ·min
D.将水更换为Na SO 溶液,对实验结果无影响
25.下列实验操作后,记录到相应现象,则能证明实验结论的是
选项 实验操作与现象 结论
A 将收集满甲烷和氯气混合气的试管倒扣在盛满水的水槽中,静置光照, 试管中液面上升 甲烷和氯气发生 了取代反应
B 将灼烧后表面变黑的螺旋状铜丝伸入约50℃的乙醇中,铜丝能保持红 热一段时间 乙醇催化氧化反 应是放热反应
C 取5mL0.1mol ·L 'FeCl 溶液于试管中,加入1mL0.1mol ·L KI溶液,充 分反应后滴入5滴15%KSCN溶液,溶液变血红色 KI与FeCl 的反 应有一定限度
D 大理石中加入盐酸后,将产生的气体通入硅酸钠水溶液中,硅酸钠溶 液变浑浊 碳酸的酸性强于 硅酸
非选择题部分
二 、非选择题(本大题共5小题,共50分)
26. (8分)请回答:
(1)写出乙酸甲酯的分子式
(2)写出H S 的电子式
(3)写出在一定条件下以氯乙烯为原料制备聚氯乙烯的化学方程式
(4)写出用覆铜板制作印刷电路板的离子方程式
27. (10分)乙二醇单乙酸酯可作为香料调香和定香的溶剂,应用于日用化妆品的生产中。其一种合成 路线图如下,其中A 的产量用来衡量一个国家石油化工发展水平, C 是生物的主要供能物质,A 、C 均可在一定条件下转化为B 。 回答下列问题:
高一化学学科试题第5页(共8页)
(1)A 的结构简式为 ,乙二醇单乙酸酯中所含官能团名称为
(2)D 与 E 生成乙二醇单乙酸酯的反应类型为 -0
(3)请写出C 转化为B 的化学方程式_
(4)下列说法正确的是 0
a.E 与 B 互为同系物
b.D 与 E 的反应需控制条件与反应物用量避免副产物生成
c.1mol 乙二醇单乙酸酯最多与1mol 钠反应生成11.2LH
28. (14分)氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及氨氧化制硝酸
高一化学学科试题第6页(共8页)
的流程示意图。
N 、H
合成塔
氨分离器
A
氧化炉
水
吸收塔
尾气处理装置
硝酸
(1)工业合成氨在合成塔中进行原理为: N (g)+3H (g)=2NH (g), 合成塔中每产生2mol NH , 放出92kJ 热量。已知断开1mol H-H 所需能量为436kJ 、断 开 1mol N=N 所需能量为946kJ, 则断开 1mol N-H 所需能量为 kJ。
(2)在氧化炉中NH 催化氧化生成NO, 反应为4NH (g)+5O (g)=4NO(g)+6H O(g) 。 某温度下, 在 2L 恒容密闭容器中充入4mol NH 和 5mol O 发生该反应, NH 的转化率随时间的变化关系如图。 (转化率:指已被转化的反应物的物质的量与其初始的物质的量之比)
①A 点的 v 正(NH )_ V逆(NH ) (填“>”“<”或“=”)
②0-5min内 O 的平均反应速率v(O )= mol/(L·min)
③下列措施能加快反应速率的是 _
A.升高温度
B. 将容器的体积减小一半
C.保持容器容积不变,充入 He 增大压强
D.不断将H O(g) 从体系中分离出来
④下列选项能说明上述反应已达到平衡的是
A.4v 正(NH )=5v 逆(O )
B. 单位时间内1mol N-H键断裂的同时有1mol H-O 键断裂 C.c(NH ):c(O ):c(NO):c(H O)=4:5:4:6
D. 容器内气体压强不再发生变化
(3)为避免硝酸生产尾气中的氮氧化物污染环境,可设计如图所示装置对NO 进行回收利用,装 置中ab 均为多孔石墨电极,质子交换膜只允许H* 通过。
(
用电器
NO →
a—
稀
HNO
质
子交换
膜
-O
b
稀HNO
)
①a 是 极 (填“正”或“负”),发生 反应 (填“氧化”或“还原”)
②写出正极的电极反应式
I.工业制备乙醇:
(1)工业上用乙烯与水在一定条件下反应制得乙醇,该反应的反应类型为 o
Ⅱ.酿制米酒:参照传统方法用糯米酿制米酒。
(2)用糯米酿得的米酒中,乙醇的浓度通常较低,为制得高度酒可采用的方法是 。(填 操作名称)
(3)某化学小组为检验糯米中淀粉水解的情况,进行如下图所示的实验,试管甲和试管丙均用 60~80℃的水浴加热5~6min, 试管乙不加热,待试管甲中的溶液冷却后再进行后续实验。
高一化学学科试题第7页(共8页)
(
住房
)2g淀粉和20mL20% 的稀硫酸
2g淀粉和 20mL水
甲 乙 丙
实验1:取少量甲中溶液,加入新制的氢氧化铜,加热,没有砖红色沉淀出现。
实验2:取少量乙中溶液,滴加几滴碘水,溶液变为蓝色,但取少量甲中溶液做此实验时,溶液 不变蓝色。
实验3:取少量丙中溶液加入NaOH 溶液调节至碱性,再滴加碘水,溶液颜色无明显变化。
①设计甲和乙是为了探究_ 对淀粉水解的影响。
②实验1失败的原因是_
③写出淀粉水解的化学方程式_ -0
④下列结论中合理的是 (填字母)。
a. 淀粉水解需要在催化剂和一定温度下进行
b.欲检验淀粉是否完全水解,最好在冷却后的水解液中加碘
c.实验3说明丙中淀粉已水解完全
Ⅲ.乙醇与乙酸的反应如图所示。
( 4 ) 试 管a 中发生反应的化学方程式: _ 。
(5)试管b 中应装有 溶液(填“饱和Na CO " 或“饱和NaOH'), 该溶液的作用是 a.①② b.②③ c.①③d.①②③
①吸收乙醇②中和乙酸③降低乙酸乙酯在水中的溶解度
30. (6分)盖尔达法是测定牛奶样品中蛋白质含量的一种常用方法,其原理是把牛奶中的氮元素完全 转化成氨。为测定某款牛奶的蛋白质含量,取60.0g 牛奶样品,经盖尔达法处理后,用
50.00mL1.00mol/L 硫酸将其完全吸收(其他物质不与硫酸反应),再加入19.00mL4.00mol/L 氢 氧 化钠溶液恰好生成硫酸钠和硫酸铵。请计算:(计算结果均保留3位有效数字)
( 1 ) 所 用NaOH 的物质的量为 mol。
(2)样品中蛋白质转化生成的氨的物质的量为 mol。
(3)若蛋白质中氮元素的质量分数为14.0%,则样品中蛋白质的质量分数为 0
高一化学学科试题第8页(共8页)
2024学年第二学期宁波三锋教研联盟期中联考 高一年级化学学科参考答案
选择题部分
1 2 3 4 5 6 7 8 9 10
D A C B B A C B B B
11 12 13 14 15 16 17 18 19 20
D C B B A D B C B C
21 22 23 24 25
D C D C B
非选择题部分
26. (8分,每空2分)
(1)C H O (2)
(4)2Fe ++Cu=2Fe ++Cu +
27. (10分,每空2分)(1)CH =CH 酯基、羟基 (2)酯化反应(取代反应)
(4)bd
28. (14分)(1)391(2分) (2)①>(2分) ②0.25 ( 2 分 ) ③AB(2 分 ) ④BD (2分)
(3)①负(1分) 氧化(1分) ②O +4e+4H =2H O(2 分)
29. (12分)(1)加成反应(1分) (2)蒸馏(1分)
(3)①温度(1分) ②没有加碱中和稀硫酸(1分)
③ 6(2分) ④ab(2 分)
(5)饱和Na CO (1 分) d(1分)
30. (6分,每空2分)(1)7.60×10 mol (2)2.40×10 mol (3)4.00% (未保留有效数字得1分)
同课章节目录
