1.1 原子结构与元素性质 课件 (共31张PPT) 鲁科版(2019) 化学 必修第二册
文档属性
| 名称 | 1.1 原子结构与元素性质 课件 (共31张PPT) 鲁科版(2019) 化学 必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-20 00:00:00 | ||
图片预览









文档简介
(共31张PPT)
第一节 原子结构与元素性质
课时1 原子核 核素
罗布泊原子弹爆炸成功
秦山核电站
安全发电 6000 亿千瓦时,相当于节约标准煤1.89 亿吨,减排二氧化碳5.8亿吨、二氧化硫约322万吨,相当于植树造林375个西湖景区
1.认识原子核的结构,了解构成原子微粒的基本性质,懂得质量数和 的含义,掌握构成原子的微粒间的相互关系;知道元素、核素、同位素的含义,并能比较它们的不同。
2.通过对构成原子的微粒间的关系和氢元素核素等问题的探究,培养分析、处理数据的能力,运用比较、归纳等方法对信息进行加工。
3.通过对人类探索原子结构的历史了解假说、模型等科学研究方法和科学研究历程,培养学生的科学态度和科学精神。
【核心素养发展目标】
原子内部结构是怎么被发现的?
原子结构的发现历程
原子内部结构是怎么样的?
19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。
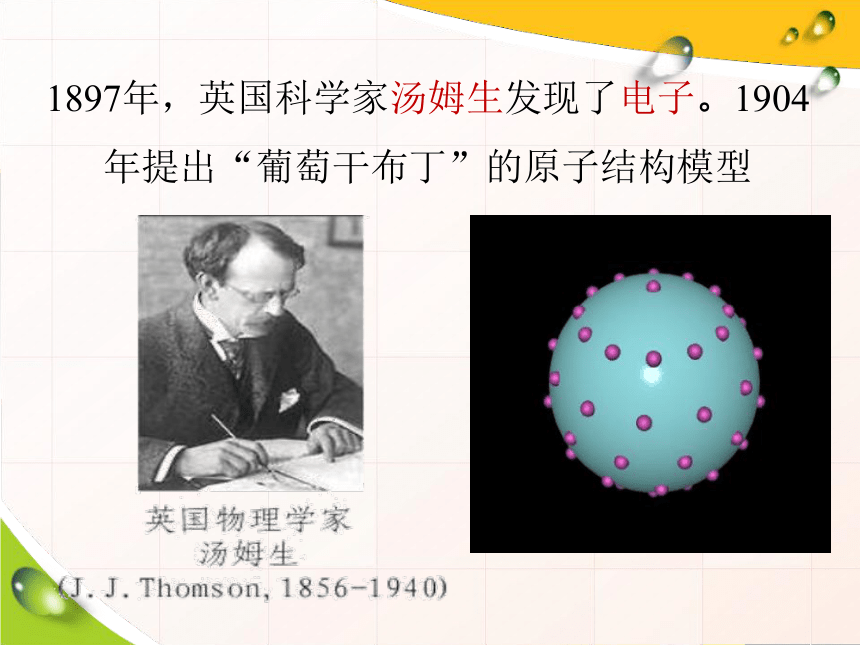
1897年,英国科学家汤姆生发现了电子。1904年提出“葡萄干布丁”的原子结构模型
1911年英国物理学家卢瑟福(汤姆生的学生)提出了核式原子结构模型
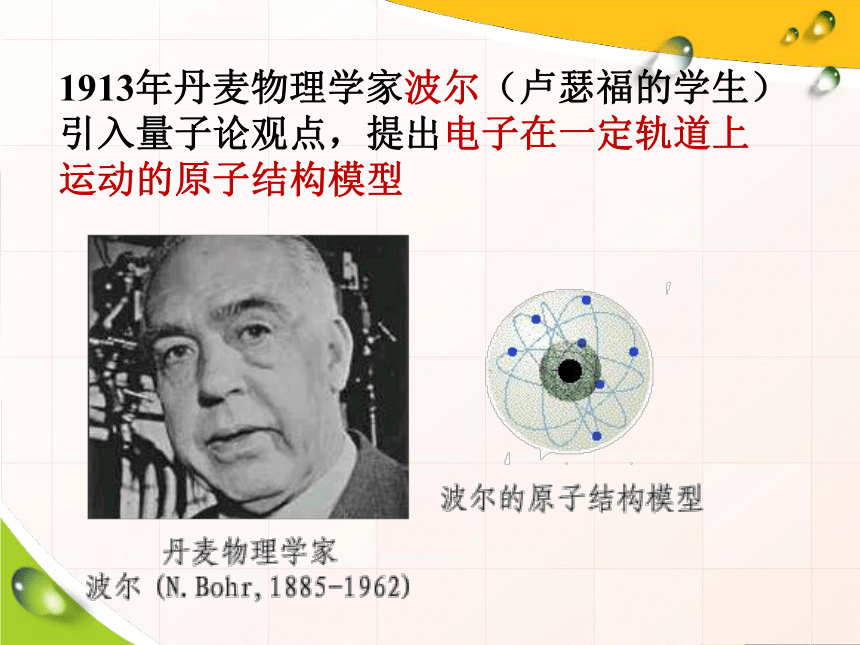
1913年丹麦物理学家波尔(卢瑟福的学生)引入量子论观点,提出电子在一定轨道上运动的原子结构模型
诺贝尔奖章
汤姆生1906
诺贝尔物理学奖
卢瑟福1908
诺贝尔化学奖
波尔1922
诺贝尔物理学奖
卢瑟福α粒子轰击金箔实验
1.实验结果?
为什么会有这样的结果?
2.实验结果表明原子结构是怎么样的?
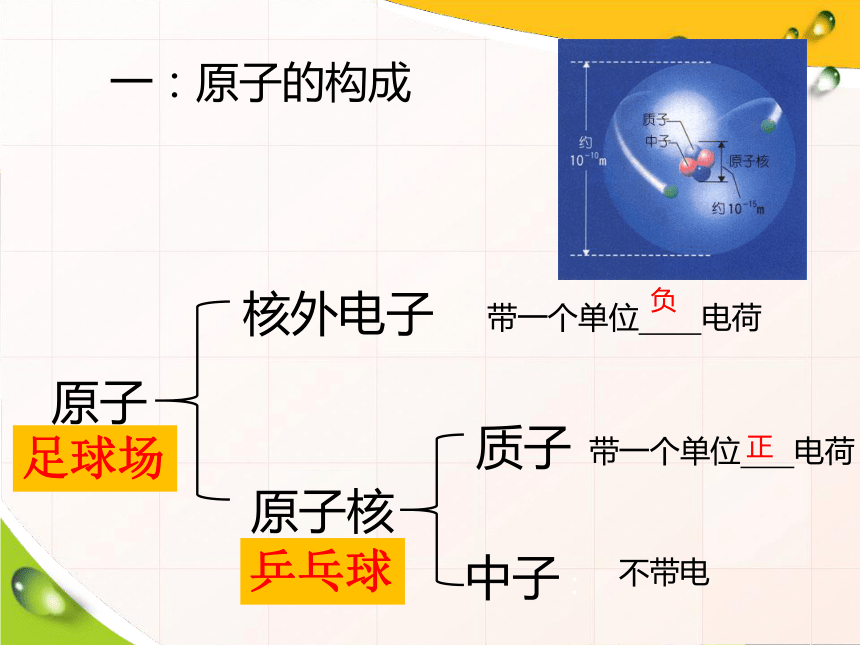
一:原子的构成
原子
原子核
核外电子
带一个单位 电荷
不带电
带一个单位 电荷
正
负
足球场
乒乓球
质子
中子:
小组合作探究 交流研讨
微粒 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.548×10-3 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
(1)质子数、核外电子数、核电荷数、原子序数之间存在怎样的关系?
(2)原子的质量主要有哪些微粒决定?
(3)原子的相对质量在数值上与原子核内的质子数和中子数有什么关系?
12C原子的质量的
1/12为1.66×10-27kg
1.在原子中,质子数、核电荷数、原子序数和核外电子数的关系:
微粒 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.548×10-3 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
电性关系: 电中性
核电荷数=质子数
=核外电子数=原子序数
原子:
原子序数=质子数=核电荷数=核外电子数
离子
阳离子:
Al3+
(原子失电子)
原子序数=质子数=核电荷数 核外电子数
>
核外电子数=质子数—电荷数
阴离子:
S2-
(原子得电子)
原子序数=质子数=核电荷数<核外电子数
核外电子数=质子数+电荷数
小组合作探究 交流研讨
2.原子的质量主要由哪些微粒决定?
微粒 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.548×10-3 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
质子数(Z)+中子数(N)=质量数(A)
原子( X )
原子核
核外电子
质子
中子
Z个
(A—Z)个
Z个
思考:是不是所有的原子均有质子、中子、电子构成?
注意:并非所有原子都是由质子、中子、电子构成,例 不含中子
H
1
1
3.原子组成表示方法
一般用符号 表示一个质量数为A、质子数为Z的原子
X
A
Z
X
A
Z
质量数 —
质子数 —
—元素符号
思考:
a
b
+
d
X
c+
-
a——质量数;
b——核电荷数/质子数
c——离子的价态;
d——化合价
针对性训练:
1 .已知 133Cs的核外电子数为55,质量数为133,则该原子的中子数为( )
A.23 B.55 C.78 D.133
[解析]133Cs的核外电子数为55,质量数为133,则该原子的中子数为133-55=78。
C
B
二:核素、同位素
比较氕、氘、氚的原子结构:
原子
质子数
中子数
质量数
名称
俗称
H(H)
1
1
1
1
0
0
氕
H(D)
2
1
1
1
2
氘
重氢
H(T)
3
1
1
2
3
氚
超重氢
二:核素、同位素
比较氕、氘、氚的原子结构:
原子
质子数
中子数
质量数
名称
俗称
H(H)
1
1
1
1
0
0
氕
H(D)
2
1
1
1
2
氘
重氢
H(T)
3
1
1
2
3
氚
超重氢
思考:
1.氕、氘、氚原子结构有何异同?
2.氕、氘、氚属于同一种元素吗?
质子数相同
属同种元素
中子数不同,质量数不同
不同种原子
二:核素、同位素
1.概念辨析
核素:具有相同数目的质子和相同数目中子的一类原子称为核素。
氢元素的三种核素
碳元素的三种核素
氧元素的三种核素
铀元素的三种核素
氯元素的两种核素
二:核素、同位素
1.概念辨析
核素:具有相同数目的质子和相同数目中子的一类原子称为核素。
元素:具有相同质子数的同一类原子的总称
同位素:质子数相同而中子数不同的同一元素
的不同核素,互为同位素。
特点:同种元素的各种同位素化学性质几乎完全
相同,物理性质有差异。
同位素
稳定同位素
放射性同位素
用途:
用作制造氢弹原料的是:
用作核反应堆燃料的是:
用作考古推断生物体的存在年代的是:
H、
2
1
H
3
1
U
235
92
C
14
6
O元素
三种核素
互为同位素
168O2
188O3
16O17O18O
同素异形体
二:核素、同位素
2.元素 、核素、 同位素之间的联系
元素
核素1
核素2
核素n
……
互为同位素
同素异形体:
同种元素
性质不同
单质
针对性训练:
3、下列互为同位素的是( )
A、O2和O3 B、235U 和238U
C、H2O 和 D2O D、CO 和CO2
4.法国里昂的科学家最近发现一种只由四个中子构成的
粒子,这种粒子称为“四中子”,也有人称之为“零号
元素”。下列有关“四中子”粒子的说法不正确的是
A.该粒子不显电性
B.该粒子质量数为4
C.与氢元素的质子数相同
D.该粒子质量数比T原子质量数大
B
C
课堂小结:
一:原子的结构
质子:
核外电子:
中子:
原子核
原子
结合核心素养发展目标
核电荷数=质子数
=核外电子数=原子序数
质子数(Z)+中子数(N)=质量数(A)
Z个
Z个
(A-Z)个
结合核心素养发展目标
课堂小结:
结合核心素养发展目标
二:元素 核素 同位素
元素 质子数 原子
核素 质子数 中子数 原子
同位素 质子数相同 中子数不同 核素
同素异形体 同种元素 性质不同 单质
元素
核素1
核素2
核素n
……
互为同位素
当堂检测:
在6Li、7Li、23Na、24Mg、14C、14N六种粒子中,
1.包含________种元素,
2.包含________种核素
3.其中互为同位素的是____ _
4.中子数相等的核素是__________
5
6
6Li、7Li
23Na、24Mg
归纳、总结、反刍:
你达到目标了吗?
结合核心素养发展目标快速整理落实
第一节 原子结构与元素性质
课时1 原子核 核素
罗布泊原子弹爆炸成功
秦山核电站
安全发电 6000 亿千瓦时,相当于节约标准煤1.89 亿吨,减排二氧化碳5.8亿吨、二氧化硫约322万吨,相当于植树造林375个西湖景区
1.认识原子核的结构,了解构成原子微粒的基本性质,懂得质量数和 的含义,掌握构成原子的微粒间的相互关系;知道元素、核素、同位素的含义,并能比较它们的不同。
2.通过对构成原子的微粒间的关系和氢元素核素等问题的探究,培养分析、处理数据的能力,运用比较、归纳等方法对信息进行加工。
3.通过对人类探索原子结构的历史了解假说、模型等科学研究方法和科学研究历程,培养学生的科学态度和科学精神。
【核心素养发展目标】
原子内部结构是怎么被发现的?
原子结构的发现历程
原子内部结构是怎么样的?
19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。
1897年,英国科学家汤姆生发现了电子。1904年提出“葡萄干布丁”的原子结构模型
1911年英国物理学家卢瑟福(汤姆生的学生)提出了核式原子结构模型
1913年丹麦物理学家波尔(卢瑟福的学生)引入量子论观点,提出电子在一定轨道上运动的原子结构模型
诺贝尔奖章
汤姆生1906
诺贝尔物理学奖
卢瑟福1908
诺贝尔化学奖
波尔1922
诺贝尔物理学奖
卢瑟福α粒子轰击金箔实验
1.实验结果?
为什么会有这样的结果?
2.实验结果表明原子结构是怎么样的?
一:原子的构成
原子
原子核
核外电子
带一个单位 电荷
不带电
带一个单位 电荷
正
负
足球场
乒乓球
质子
中子:
小组合作探究 交流研讨
微粒 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.548×10-3 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
(1)质子数、核外电子数、核电荷数、原子序数之间存在怎样的关系?
(2)原子的质量主要有哪些微粒决定?
(3)原子的相对质量在数值上与原子核内的质子数和中子数有什么关系?
12C原子的质量的
1/12为1.66×10-27kg
1.在原子中,质子数、核电荷数、原子序数和核外电子数的关系:
微粒 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.548×10-3 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
电性关系: 电中性
核电荷数=质子数
=核外电子数=原子序数
原子:
原子序数=质子数=核电荷数=核外电子数
离子
阳离子:
Al3+
(原子失电子)
原子序数=质子数=核电荷数 核外电子数
>
核外电子数=质子数—电荷数
阴离子:
S2-
(原子得电子)
原子序数=质子数=核电荷数<核外电子数
核外电子数=质子数+电荷数
小组合作探究 交流研讨
2.原子的质量主要由哪些微粒决定?
微粒 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.548×10-3 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
质子数(Z)+中子数(N)=质量数(A)
原子( X )
原子核
核外电子
质子
中子
Z个
(A—Z)个
Z个
思考:是不是所有的原子均有质子、中子、电子构成?
注意:并非所有原子都是由质子、中子、电子构成,例 不含中子
H
1
1
3.原子组成表示方法
一般用符号 表示一个质量数为A、质子数为Z的原子
X
A
Z
X
A
Z
质量数 —
质子数 —
—元素符号
思考:
a
b
+
d
X
c+
-
a——质量数;
b——核电荷数/质子数
c——离子的价态;
d——化合价
针对性训练:
1 .已知 133Cs的核外电子数为55,质量数为133,则该原子的中子数为( )
A.23 B.55 C.78 D.133
[解析]133Cs的核外电子数为55,质量数为133,则该原子的中子数为133-55=78。
C
B
二:核素、同位素
比较氕、氘、氚的原子结构:
原子
质子数
中子数
质量数
名称
俗称
H(H)
1
1
1
1
0
0
氕
H(D)
2
1
1
1
2
氘
重氢
H(T)
3
1
1
2
3
氚
超重氢
二:核素、同位素
比较氕、氘、氚的原子结构:
原子
质子数
中子数
质量数
名称
俗称
H(H)
1
1
1
1
0
0
氕
H(D)
2
1
1
1
2
氘
重氢
H(T)
3
1
1
2
3
氚
超重氢
思考:
1.氕、氘、氚原子结构有何异同?
2.氕、氘、氚属于同一种元素吗?
质子数相同
属同种元素
中子数不同,质量数不同
不同种原子
二:核素、同位素
1.概念辨析
核素:具有相同数目的质子和相同数目中子的一类原子称为核素。
氢元素的三种核素
碳元素的三种核素
氧元素的三种核素
铀元素的三种核素
氯元素的两种核素
二:核素、同位素
1.概念辨析
核素:具有相同数目的质子和相同数目中子的一类原子称为核素。
元素:具有相同质子数的同一类原子的总称
同位素:质子数相同而中子数不同的同一元素
的不同核素,互为同位素。
特点:同种元素的各种同位素化学性质几乎完全
相同,物理性质有差异。
同位素
稳定同位素
放射性同位素
用途:
用作制造氢弹原料的是:
用作核反应堆燃料的是:
用作考古推断生物体的存在年代的是:
H、
2
1
H
3
1
U
235
92
C
14
6
O元素
三种核素
互为同位素
168O2
188O3
16O17O18O
同素异形体
二:核素、同位素
2.元素 、核素、 同位素之间的联系
元素
核素1
核素2
核素n
……
互为同位素
同素异形体:
同种元素
性质不同
单质
针对性训练:
3、下列互为同位素的是( )
A、O2和O3 B、235U 和238U
C、H2O 和 D2O D、CO 和CO2
4.法国里昂的科学家最近发现一种只由四个中子构成的
粒子,这种粒子称为“四中子”,也有人称之为“零号
元素”。下列有关“四中子”粒子的说法不正确的是
A.该粒子不显电性
B.该粒子质量数为4
C.与氢元素的质子数相同
D.该粒子质量数比T原子质量数大
B
C
课堂小结:
一:原子的结构
质子:
核外电子:
中子:
原子核
原子
结合核心素养发展目标
核电荷数=质子数
=核外电子数=原子序数
质子数(Z)+中子数(N)=质量数(A)
Z个
Z个
(A-Z)个
结合核心素养发展目标
课堂小结:
结合核心素养发展目标
二:元素 核素 同位素
元素 质子数 原子
核素 质子数 中子数 原子
同位素 质子数相同 中子数不同 核素
同素异形体 同种元素 性质不同 单质
元素
核素1
核素2
核素n
……
互为同位素
当堂检测:
在6Li、7Li、23Na、24Mg、14C、14N六种粒子中,
1.包含________种元素,
2.包含________种核素
3.其中互为同位素的是____ _
4.中子数相等的核素是__________
5
6
6Li、7Li
23Na、24Mg
归纳、总结、反刍:
你达到目标了吗?
结合核心素养发展目标快速整理落实
