专题九 构成物质的微粒、元素(含答案)2025年中考一轮复习收官测试卷
文档属性
| 名称 | 专题九 构成物质的微粒、元素(含答案)2025年中考一轮复习收官测试卷 |  | |
| 格式 | docx | ||
| 文件大小 | 581.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-20 23:05:07 | ||
图片预览



文档简介
专题九 构成物质的微粒、元素——中考一轮复习收官测试卷
(试卷满分:60分;考试时间:60分钟)
一、选择题(本大题共10小题,每题2分,共20分)
1.下列对宏观事实的微观解释错误的是( )
A.电解水生成氢气和氧气——分子可以分成原子,原子也可重新组合成新的分子
B.氧气经压缩储存在钢瓶中——氧气分子体积变小
C.水的三态变化——分子自身能量、运动速率、分子间隔和排列方式的改变
D.水和双氧水化学性质不同——构成二者的分子不同
2.下列根据化学用语获得的信息正确的是( )
A.——铈的核电荷数为58
B.——表示氖原子的结构示意图
C.——两个铁离子
D.——“”表示铜离子带有两个单位正电荷
3.如图摘自元素周期表,据此判断下列叙述错误的是( )
A.C、N、O的原子序数依次递增
B.碳、氮、氧在元素周期表中属于同一族
C.氮原子的核外电子数为7
D.氧的相对原子质量为16.00
4.“推理”学习化学的一种重要方法。下列推断合理的是( )
A.离子是带电的微粒,所以带电的微粒均是离子
B.氧气、液氧都由氧分子构成,所以它们的化学性质相同
C.溶液具有均一性、稳定性,所以均一稳定的液体一定是溶液
D.同种元素原子核内质子数相同,所以质子数相同的微粒是同种元素
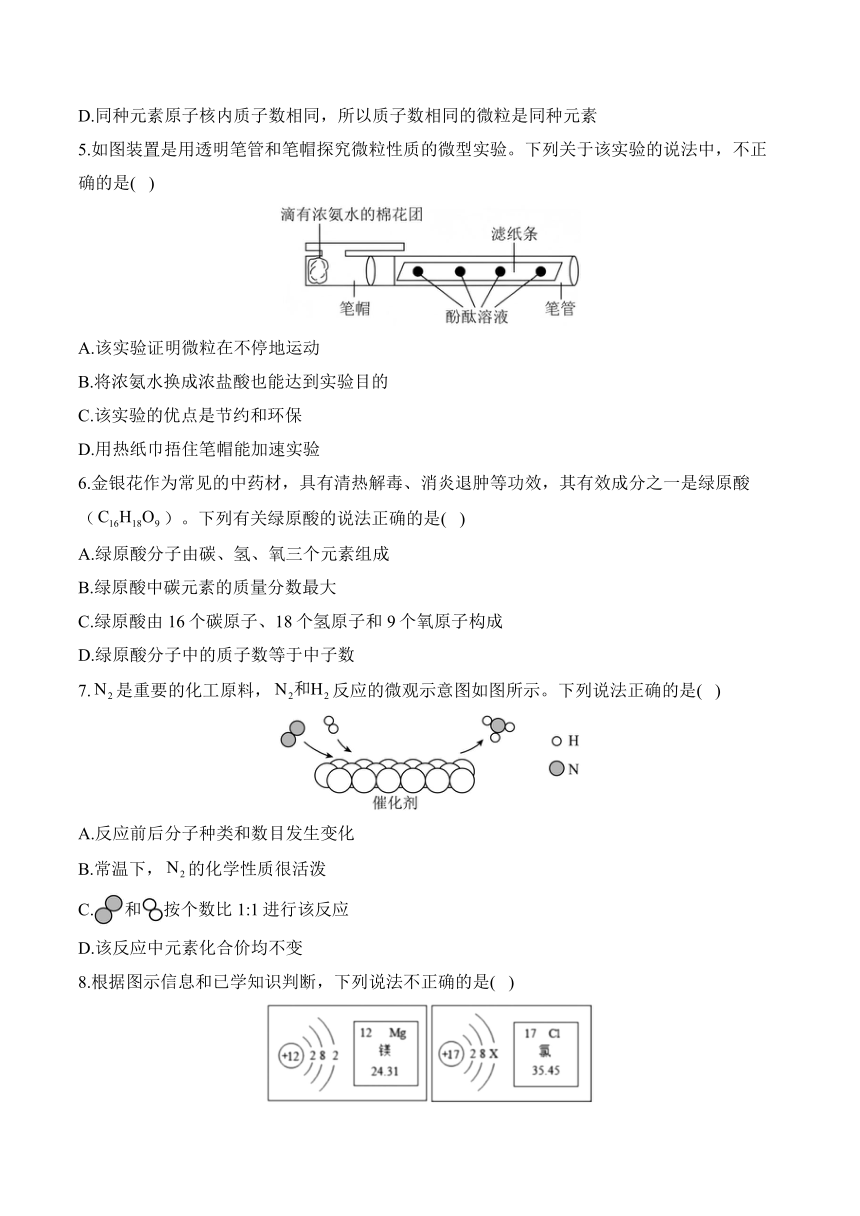
5.如图装置是用透明笔管和笔帽探究微粒性质的微型实验。下列关于该实验的说法中,不正确的是( )
A.该实验证明微粒在不停地运动
B.将浓氨水换成浓盐酸也能达到实验目的
C.该实验的优点是节约和环保
D.用热纸巾捂住笔帽能加速实验
6.金银花作为常见的中药材,具有清热解毒、消炎退肿等功效,其有效成分之一是绿原酸()。下列有关绿原酸的说法正确的是( )
A.绿原酸分子由碳、氢、氧三个元素组成
B.绿原酸中碳元素的质量分数最大
C.绿原酸由16个碳原子、18个氢原子和9个氧原子构成
D.绿原酸分子中的质子数等于中子数
7.是重要的化工原料,反应的微观示意图如图所示。下列说法正确的是( )
A.反应前后分子种类和数目发生变化
B.常温下,的化学性质很活泼
C.和按个数比1:1进行该反应
D.该反应中元素化合价均不变
8.根据图示信息和已学知识判断,下列说法不正确的是( )
A.镁原子和氦原子的化学性质相似
B.当X=8时,该微粒属于阴离子
C.在化学变化中,氯原子易得到电子
D.镁元素、氯元素都位于元素周期表的第三周期
9.推理是化学学习中常用的思维方法,下列推理正确的是( )
A.阳离子是带正电的粒子,则带正电的粒子一定是阳离子
B.纯净物只含一种物质,则只含一种物质的一定是纯净物
C.硫离子的最外层电子数为8,则最外层电子数为8的粒子一定是离子
D.化合物是由多种元素组成的,则由多种元素组成的物质一定是化合物
10.芯片蚀刻过程中,当物质与硅反应时生成的物质均为气体,在蚀刻物表面不留任何残留物。该反应微观示意图如图,下列说法正确的是 ( )
A.上述四种物质中有3种属于化合物 B.元素的化合价在反应前后没有变化
C.反应前后原子的种类不变 D.反应前后分子的种类不变
二、填空题(本题共9小题,每空1分,共40分)
11.结构决定性质,性质决定应用。微观探析是化学学习的特有方式。
(1)日本核废水中含有的氚是氢元素的一种原子,它具有放射性,相对原子质量为3,核内质子数为1,则其原子核内的中子数为____。
(2)锶原子的结构示意图如图甲所示。由图可知,锶属于____(填“金属”或“非金属”)元素,图乙表示的粒子中,与锶原子化学性质相似的有____(填序号)。
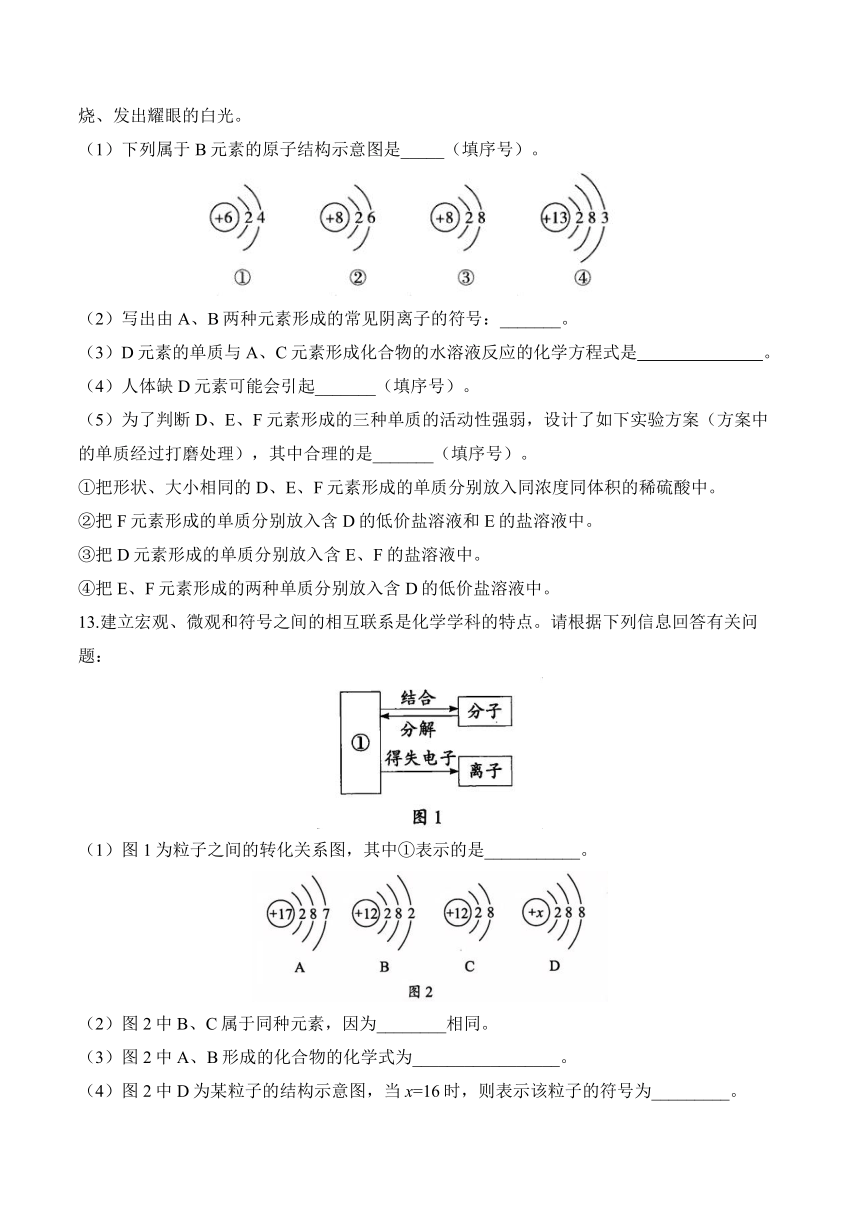
12.现有A、B、C、D、E、F六种元素。其中A元素原子的原子核中没有中子;B是地壳中含量最多的元素;C元素原子的核电荷数为17;D元素组成的单质是目前世界上年产量最高的金属;E是“司母戊鼎”中的一种金属元素,其单质呈紫红色;F元素形成的单质在空气中燃烧、发出耀眼的白光。
(1)下列属于B元素的原子结构示意图是_____(填序号)。
(2)写出由A、B两种元素形成的常见阴离子的符号:_______。
(3)D元素的单质与A、C元素形成化合物的水溶液反应的化学方程式是 。
(4)人体缺D元素可能会引起_______(填序号)。
(5)为了判断D、E、F元素形成的三种单质的活动性强弱,设计了如下实验方案(方案中的单质经过打磨处理),其中合理的是_______(填序号)。
①把形状、大小相同的D、E、F元素形成的单质分别放入同浓度同体积的稀硫酸中。
②把F元素形成的单质分别放入含D的低价盐溶液和E的盐溶液中。
③把D元素形成的单质分别放入含E、F的盐溶液中。
④把E、F元素形成的两种单质分别放入含D的低价盐溶液中。
13.建立宏观、微观和符号之间的相互联系是化学学科的特点。请根据下列信息回答有关问题:
(1)图1为粒子之间的转化关系图,其中①表示的是___________。
(2)图2中B、C属于同种元素,因为________相同。
(3)图2中A、B形成的化合物的化学式为_________________。
(4)图2中D为某粒子的结构示意图,当x=16时,则表示该粒子的符号为_________。
14.小维同学按如图所示的装置,进行实验:将浸有酚酞试液的棉花团绑在树形铁丝上制成“花树”,在玻璃片上放置盛有浓氨水的微型烧杯,罩上大烧杯:
(1)观察到的实验现象是: 。
(2)从实验现象得到的结论有:
①浓氨水具有_________性;② 。
(3)请写出一个能用分子运动的观点解释的词语或者诗句 。
15.化学实验也要“数字化”。利用氧气浓度传感器,进行下列实验。
(1)如上图所示,打开传感器开关,实验进行至170 s时绘制出下图中曲线AB段,接下来用手给塑料瓶外壁加热130 s左右,绘制出曲线BC段,对比曲线AB段和BC段,分析推理氧分子具有的特征是 。
(2)300 s时松开双手,停止加热。立即倒转使瓶口向下,绘制出曲线CD段。观察到氧气浓度比曲线AB段降低较快,分析推理氧气具有的物理性质是 。
16.在宏观、微观和符号之间建立联系是化学学科的重要思维方式。
回答下列问题:
(1)图1中,共有______种元素,①表示的微粒符号是______。
(2)图2中,X元素原子的核电荷数为12,它的元素符号是______。
(3)图2中,不能直接获取有关Na的信息是______(填选项)。
A.元素名称 B.元素的相对原子质量
C.原子序数 D.原子核内的中子数
(4)图1中⑤是镓元素(Ga)的原子结构示意图,它与图2中铝元素化学性质相似的原因是
。
蚀刻芯片的微观示意图如下,其中甲、丙、丁均为气体,该反应的化学方程式是
。
17.“见著知微,见微知著”是化学思维方法。根据下列粒子的结构示意图回答问题。
(1)上图A—F六种粒子共有_________种元素。
(2)与D化学性质相似的原子是_________(填字母)。
(3)若G粒子是带三个单位正电荷的微粒,G粒子的化学符号为_________。
若G粒子是带两个单位负电荷的微粒,G粒子的化学符号为_________。
18.元素周期表是学习和研究化学的重要工具。请回答下列问题:
(1)元素周期表中不同元素间最本质的区别是________(填字母)。
A.质子数不同 B.中子数不同 C.相对原子质量不同
(2)下图图1是元素周期表的部分内容,图2是这三种元素的原子结构示意图。
①硒元素的相对原子质量为_________,它属于_________(填“金属”,或“非金属”)元素。
②图2中硫原子的结构示意图是_________(填字母)。
③氧、硫、硒三种元素化学性质相似的原因是 。
④画出的结构示意图是_________。
19.建立“宏观—微观”之间的联系,是化学学习的重要方法。根据图示回答下列问题:
(1)硒元素被科学家称为“抗癌之王”,科学界研究发现血硒水平的高低与癌的发生息息相关。如图甲是硒元素的相关信息:硒元素属于_______(填“金属”或“非金属”)元素,相对原子质量是_____。
(2)如图乙,Na、Mg、Al三种元素位于元素周期表中第______周期,对于Na、Mg、Al三种元素来说,原子最外层电子数越多,原子半径反而越小,原子核对核外电子的引力越大,Na、Mg、Al三种原子失电子能力由强到弱的顺序是___________。
(3)二氧化碳和氢气在一定条件下转化为化工原料乙烯(),是我国科学研究的又一重大突破,其反应微观过程如图丙所示,用化学方程式表示为 。由图丙得到启示,请用微观的观点解释化学变化的实质: 。
答案以及解析
1.答案:B
解析:A、电解水生成氢气和氧气,是因为分子可以分成原子,原子再重新组合成新分子,故选项解释正确。B、氧气经压缩储存在钢瓶中,是因为分子间有间隔,气体受压后,分子间的间隔变小,故选项解释错误。C、水的三态变化,是因为分子自身能量、运动速率、分子间隔和排列方式的改变,故选项解释正确。D、水和双氧水化学性质不同,是因为构成二者的分子不同,故选项解释正确。故选:B。
2.答案:A
解析:A、元素周期表中的一格中,左上角的数字表示原子序数,原子序数=质子数,铈(Ce)的核电荷数为58,正确;B、原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,图中微粒的核外电子数=2+8=10,当该微粒是原子时,质子数=电子数=10,表示氖原子,当该微粒不是原子时,质子数≠电子数,不表示氖原子,错误;C、1个铁离子带3个单位的正电荷,1个亚铁离子带2个单位的正电荷,表示两个亚铁离子,而不是两个铁离子,错误;D、元素符号(或原子团)正上方的数字,表示在该化合物里该元素或原子团所显的化合价,表示铜元素的化合价为+2价,错误。故选A。
3.答案:B
解析:A、C、N、O的原子序数依次递增,A说法正确;B、碳、氮、氧在元素周期表中属于同一周期,B说法错误;C、在原子中,原子序数=核外电子数,故氮原子的核外电子数为7,C说法正确;D、氧的相对原子质量为16.00,D说法正确;故选:B。
4.答案:B解析:
5.答案:B
解析:A、酚酞溶液与滴有浓氨水的棉花糖没有接触,但酚酞溶液变红,说明分子在不断运动,该选项说法正确;B、浓盐酸呈酸性,不能使无色酚酞溶液变红,因此将浓氨水换成浓盐酸不能达到实验目的,该选项说法不正确;C、该实验为密闭装置,且使用的药品较少,则该实验的优点是节约和环保,该选项说法正确;D、分子是在不断运动的,温度越高,分子运动速率越快,因此热纸巾捂住笔帽能加速实验,该选项说法正确;故选:B。
6.答案:B
解析:元素只讲种类,不讲个数,绿原酸由碳、氢、氧三种元素组成,A错误;绿原酸中碳、氢、氧三种元素质量比为,则其中碳元素的质量分数最大,B正确;绿原酸是由绿原酸分子构成的,一个绿原酸分子是由16个碳原子、18个氢原子和9个氧原子构成的,C错误;分子是由原子构成的,原子中质子数不一定等于中子数,绿原酸分子是由碳、氢、氧三种原子构成的,其中氢原子中没有中子,则绿原酸分子中的质子数不等于中子数,D错误。
7.答案:A
8.答案:A
9.答案:B
10.答案:C
解析:A、四种物质中的氮气和硅均属于单质,与属于化合物,故A说法错误;B、在该反应前后,硅元素的化合价由零变成+4价,氮元素由+3价变成零,故B说法错误;C、由质量守恒定律可知,反应前后原子的种类不变,故C说法正确;D、由分子结构模型可知,反应前后分子的种类改变,故D说法错误。故选:C。
11.答案:(1)2
(2)金属;②④
解析:(1)相对原子质量≈质子数+中子数,故中子数=3-1=2。
(2)锶带“钅”,属于金属元素;化学性质与原子的最外层电子数密切相关,最外层电子数相同的原子,化学性质相似。由图甲可知,锶原子的最外层电子数为2,小于4,在化学反应中易失去电子形成阳离子;图乙表示的粒子中,最外层电子数与锶原子相同的有①②④,但是①只有一个电子层,为稀有气体原子,化学性质稳定,故与锶原子化学性质相似的有②④。
12.答案:(1)②
(2)
(3)
(4)贫血
(5)①③④
解析:(1)A、B、C、D、E、F六种元素,A元素原子的原子核中没有中子,所以A是氢元素;B是地壳中含量最多的元素,所以B是氧元素;C元素原子的核电荷数为17,所以C是氯元素;D元素组成的单质是目前世界上年产量最高的金属,所以D是铁元素;E是“司母戊鼎”中的一种金属元素,其单质呈紫红色,所以E是铜元素;F元素形成的单质在空气中燃烧、发出耀眼的白光,所以F是镁元素。经过验证,推导正确,所以B元素的原子。
(2)由A、B两种元素形成的常见阴离子结构示意图的符号是。
(3)D元素的单质与A、C元素形成化合物的水溶液的反应是铁和盐酸反应生成氯化亚铁和氢气,化学方程式为。
(4)人体缺铁元素可能会引起贫血。
(5)为了判断铁、铜、镁元素形成的三种单质的活动性强弱,①把形状、大小相同的D、E、F元素形成的单质分别放入同浓度同体积的稀硫酸中,依据能否发生反应以及气泡产生的速率,可以判断,故合理;②把F元素形成的单质分别放入含D的低价盐溶液和E的盐溶液中,都会反应,不能验证,故不合理;③把D元素形成的单质分别放入含E、F的盐溶液中,铁会置换出铜,不会置换出镁,可以验证,故合理;④把E、F元素形成的两种单质分别放入含D的低价盐溶液中,镁会置换出铁,铜不会置换出铁,可以验证,故合理。
13.答案:(1)原子
(2)质子数(或核电荷数)
(3)
(4)
14.答案:(1)棉花团变红色
(2)①挥发
②分子是不断运动的
(3)遥知不是雪,为有暗香来
解析:(1)观察到的实验现象是棉花团变红色,是因为氨分子是不断运动的,运动到酚酞溶液中时,与水结合生成氨水,氨水显碱性,能使酚酞变红色。
故答案为:棉花团变红色。
(2)①浓氨水具有挥发性。
故答案为:挥发。
②分子是不断运动的。
故答案为:分子是不断运动的。
(3)一个能用分子运动的观点解释的诗句是遥知不是雪,为有暗香来(远处的白色物质不是雪,是因为梅花散发出的花香味扑面而来,即能够说明分子是不断运动的)。
故答案为:遥知不是雪,为有暗香来。
15.答案:(1)温度升高,氧分子运动的速率加快
(2)氧气的密度比空气大
解析:(1)BC段曲线的下降程度远远大于AB段,说明在加热时,温度升高,氧分子运动的速率加快,逸出的速率快,瓶内氧气含量迅速减少。
(2)停止加热后,瓶子倒转,此时氧气浓度传感器位于上端而瓶口朝下,CD段氧气浓度降低速度大于AB段,说明此时的氧气分子主要集中在瓶口位置,即说明氧气的密度比空气大。
16.答案:(1)四或4;
(2)Mg
(3)D
(4)原子的最外层电子数相同
(5)
解析:(1)质子数决定元素的种类,图1中,共有四种质子数,共包含四种元素;①中质子数为17,核外电子数为18,表示氯离子,所以①表示的微粒符号是。故填:四或4;。
(2)X元素原子的核电荷数为12,表示镁元素,元素符号是Mg。故填:Mg。
(3)图2中,能直接获取有关Na的信息是原子序数、元素符号、元素名称、相对原子质量等,无法直接知道原子核内的中子数。故填:D。
(4)原子的最外层电子数决定元素的化学性质。镓元素、铝元素原子的最外层电子数相同,均为3。因此,二者化学性质相似。故填:原子的最外层电子数相同。
(5)据微观示意图可知,甲为,乙为Si,丙为,丁为。与Si在一定条件下反应生成和,反应的化学方程式为。故填:。
17.答案:(1)五
(2)DF
(3)
解析:(1)元素是具有相同核电荷数或质子数的一类原子的总称,元素的种类由质子数决定,故A—F六种粒子共有五种质子数,有五种元素;
(2)最外层电子数决定化学性质,原子最外层电子数相同,化学性质相似,故D、F的最外层电子数都是6,化学性质相似;A、E最外层电子数也相同,但A为氢元素,为非金属元素;E为钠元素,为金属元素;化学性质不同;B、C最外层电子数也相同,但B为原子,C为离子,化学性质不同;
(3)G粒子是带两个单位正电荷的微粒,质子数=2+8+2=12,为镁离子,符号为。
18.答案:(1)A
(2)①78.96;非金属
②B
③最外层电子数相同
④
解析:(1)决定元素种类的为质子数或核电荷数,则不同种元素的最本质区别为质子数或核电荷数不同,故选A。
(2)①元素周期表单元格中,最下方的数字表示相对原子质量,硒元素的相对原子质量为78.96;硒为“石”字旁,属于非金属元素。
②16号元素为硫元素,则硫原子的结构示意图为B。
③决定元素化学性质的为最外层电子数,氧、硫、硒三种原子最外层电子数相同,则它们的化学性质相似。
④氧为8号元素,则氧原子的核外电子数为8,是由氧原子得到2个电子形成的,则核外电子数为8+2=10,核外电子排布为2、8,结构示意图为:。
19.答案:(1)非金属;78.96
(2)三;Na>Mg>Al
(3);分子拆分成原子,原子重新组合成新的分子
解析:(1)硒是石字旁,属于非金属元素;根据硒元素在周期表中的信息,可知硒元素的相对原子质量是78.96。
(2)元素所在周期数与元素原子的核外电子层数相等,Na、Mg、Al三种元素原子的核外都有三个电子层,说明它们都位于第三周期;根据题给信息“原子最外层电子数越多,原子半径反而越小,原子核对核外电子的引力越大”,引力越大,则原子越不容易失去电子,三种原子的最外层电子数大小关系是Al>Mg>Na,则三种原子中,铝原子最不容易失去电子,其次是镁原子,失电子能力最强的是钠原子,故失电子能力由强到弱的顺序是Na>Mg>Al。
(3)根据微观示意图,可知该反应是二氧化碳和氢气在加热和催化剂作用下反应生成乙烯和水的过程,反应的化学方程式为。
(试卷满分:60分;考试时间:60分钟)
一、选择题(本大题共10小题,每题2分,共20分)
1.下列对宏观事实的微观解释错误的是( )
A.电解水生成氢气和氧气——分子可以分成原子,原子也可重新组合成新的分子
B.氧气经压缩储存在钢瓶中——氧气分子体积变小
C.水的三态变化——分子自身能量、运动速率、分子间隔和排列方式的改变
D.水和双氧水化学性质不同——构成二者的分子不同
2.下列根据化学用语获得的信息正确的是( )
A.——铈的核电荷数为58
B.——表示氖原子的结构示意图
C.——两个铁离子
D.——“”表示铜离子带有两个单位正电荷
3.如图摘自元素周期表,据此判断下列叙述错误的是( )
A.C、N、O的原子序数依次递增
B.碳、氮、氧在元素周期表中属于同一族
C.氮原子的核外电子数为7
D.氧的相对原子质量为16.00
4.“推理”学习化学的一种重要方法。下列推断合理的是( )
A.离子是带电的微粒,所以带电的微粒均是离子
B.氧气、液氧都由氧分子构成,所以它们的化学性质相同
C.溶液具有均一性、稳定性,所以均一稳定的液体一定是溶液
D.同种元素原子核内质子数相同,所以质子数相同的微粒是同种元素
5.如图装置是用透明笔管和笔帽探究微粒性质的微型实验。下列关于该实验的说法中,不正确的是( )
A.该实验证明微粒在不停地运动
B.将浓氨水换成浓盐酸也能达到实验目的
C.该实验的优点是节约和环保
D.用热纸巾捂住笔帽能加速实验
6.金银花作为常见的中药材,具有清热解毒、消炎退肿等功效,其有效成分之一是绿原酸()。下列有关绿原酸的说法正确的是( )
A.绿原酸分子由碳、氢、氧三个元素组成
B.绿原酸中碳元素的质量分数最大
C.绿原酸由16个碳原子、18个氢原子和9个氧原子构成
D.绿原酸分子中的质子数等于中子数
7.是重要的化工原料,反应的微观示意图如图所示。下列说法正确的是( )
A.反应前后分子种类和数目发生变化
B.常温下,的化学性质很活泼
C.和按个数比1:1进行该反应
D.该反应中元素化合价均不变
8.根据图示信息和已学知识判断,下列说法不正确的是( )
A.镁原子和氦原子的化学性质相似
B.当X=8时,该微粒属于阴离子
C.在化学变化中,氯原子易得到电子
D.镁元素、氯元素都位于元素周期表的第三周期
9.推理是化学学习中常用的思维方法,下列推理正确的是( )
A.阳离子是带正电的粒子,则带正电的粒子一定是阳离子
B.纯净物只含一种物质,则只含一种物质的一定是纯净物
C.硫离子的最外层电子数为8,则最外层电子数为8的粒子一定是离子
D.化合物是由多种元素组成的,则由多种元素组成的物质一定是化合物
10.芯片蚀刻过程中,当物质与硅反应时生成的物质均为气体,在蚀刻物表面不留任何残留物。该反应微观示意图如图,下列说法正确的是 ( )
A.上述四种物质中有3种属于化合物 B.元素的化合价在反应前后没有变化
C.反应前后原子的种类不变 D.反应前后分子的种类不变
二、填空题(本题共9小题,每空1分,共40分)
11.结构决定性质,性质决定应用。微观探析是化学学习的特有方式。
(1)日本核废水中含有的氚是氢元素的一种原子,它具有放射性,相对原子质量为3,核内质子数为1,则其原子核内的中子数为____。
(2)锶原子的结构示意图如图甲所示。由图可知,锶属于____(填“金属”或“非金属”)元素,图乙表示的粒子中,与锶原子化学性质相似的有____(填序号)。
12.现有A、B、C、D、E、F六种元素。其中A元素原子的原子核中没有中子;B是地壳中含量最多的元素;C元素原子的核电荷数为17;D元素组成的单质是目前世界上年产量最高的金属;E是“司母戊鼎”中的一种金属元素,其单质呈紫红色;F元素形成的单质在空气中燃烧、发出耀眼的白光。
(1)下列属于B元素的原子结构示意图是_____(填序号)。
(2)写出由A、B两种元素形成的常见阴离子的符号:_______。
(3)D元素的单质与A、C元素形成化合物的水溶液反应的化学方程式是 。
(4)人体缺D元素可能会引起_______(填序号)。
(5)为了判断D、E、F元素形成的三种单质的活动性强弱,设计了如下实验方案(方案中的单质经过打磨处理),其中合理的是_______(填序号)。
①把形状、大小相同的D、E、F元素形成的单质分别放入同浓度同体积的稀硫酸中。
②把F元素形成的单质分别放入含D的低价盐溶液和E的盐溶液中。
③把D元素形成的单质分别放入含E、F的盐溶液中。
④把E、F元素形成的两种单质分别放入含D的低价盐溶液中。
13.建立宏观、微观和符号之间的相互联系是化学学科的特点。请根据下列信息回答有关问题:
(1)图1为粒子之间的转化关系图,其中①表示的是___________。
(2)图2中B、C属于同种元素,因为________相同。
(3)图2中A、B形成的化合物的化学式为_________________。
(4)图2中D为某粒子的结构示意图,当x=16时,则表示该粒子的符号为_________。
14.小维同学按如图所示的装置,进行实验:将浸有酚酞试液的棉花团绑在树形铁丝上制成“花树”,在玻璃片上放置盛有浓氨水的微型烧杯,罩上大烧杯:
(1)观察到的实验现象是: 。
(2)从实验现象得到的结论有:
①浓氨水具有_________性;② 。
(3)请写出一个能用分子运动的观点解释的词语或者诗句 。
15.化学实验也要“数字化”。利用氧气浓度传感器,进行下列实验。
(1)如上图所示,打开传感器开关,实验进行至170 s时绘制出下图中曲线AB段,接下来用手给塑料瓶外壁加热130 s左右,绘制出曲线BC段,对比曲线AB段和BC段,分析推理氧分子具有的特征是 。
(2)300 s时松开双手,停止加热。立即倒转使瓶口向下,绘制出曲线CD段。观察到氧气浓度比曲线AB段降低较快,分析推理氧气具有的物理性质是 。
16.在宏观、微观和符号之间建立联系是化学学科的重要思维方式。
回答下列问题:
(1)图1中,共有______种元素,①表示的微粒符号是______。
(2)图2中,X元素原子的核电荷数为12,它的元素符号是______。
(3)图2中,不能直接获取有关Na的信息是______(填选项)。
A.元素名称 B.元素的相对原子质量
C.原子序数 D.原子核内的中子数
(4)图1中⑤是镓元素(Ga)的原子结构示意图,它与图2中铝元素化学性质相似的原因是
。
蚀刻芯片的微观示意图如下,其中甲、丙、丁均为气体,该反应的化学方程式是
。
17.“见著知微,见微知著”是化学思维方法。根据下列粒子的结构示意图回答问题。
(1)上图A—F六种粒子共有_________种元素。
(2)与D化学性质相似的原子是_________(填字母)。
(3)若G粒子是带三个单位正电荷的微粒,G粒子的化学符号为_________。
若G粒子是带两个单位负电荷的微粒,G粒子的化学符号为_________。
18.元素周期表是学习和研究化学的重要工具。请回答下列问题:
(1)元素周期表中不同元素间最本质的区别是________(填字母)。
A.质子数不同 B.中子数不同 C.相对原子质量不同
(2)下图图1是元素周期表的部分内容,图2是这三种元素的原子结构示意图。
①硒元素的相对原子质量为_________,它属于_________(填“金属”,或“非金属”)元素。
②图2中硫原子的结构示意图是_________(填字母)。
③氧、硫、硒三种元素化学性质相似的原因是 。
④画出的结构示意图是_________。
19.建立“宏观—微观”之间的联系,是化学学习的重要方法。根据图示回答下列问题:
(1)硒元素被科学家称为“抗癌之王”,科学界研究发现血硒水平的高低与癌的发生息息相关。如图甲是硒元素的相关信息:硒元素属于_______(填“金属”或“非金属”)元素,相对原子质量是_____。
(2)如图乙,Na、Mg、Al三种元素位于元素周期表中第______周期,对于Na、Mg、Al三种元素来说,原子最外层电子数越多,原子半径反而越小,原子核对核外电子的引力越大,Na、Mg、Al三种原子失电子能力由强到弱的顺序是___________。
(3)二氧化碳和氢气在一定条件下转化为化工原料乙烯(),是我国科学研究的又一重大突破,其反应微观过程如图丙所示,用化学方程式表示为 。由图丙得到启示,请用微观的观点解释化学变化的实质: 。
答案以及解析
1.答案:B
解析:A、电解水生成氢气和氧气,是因为分子可以分成原子,原子再重新组合成新分子,故选项解释正确。B、氧气经压缩储存在钢瓶中,是因为分子间有间隔,气体受压后,分子间的间隔变小,故选项解释错误。C、水的三态变化,是因为分子自身能量、运动速率、分子间隔和排列方式的改变,故选项解释正确。D、水和双氧水化学性质不同,是因为构成二者的分子不同,故选项解释正确。故选:B。
2.答案:A
解析:A、元素周期表中的一格中,左上角的数字表示原子序数,原子序数=质子数,铈(Ce)的核电荷数为58,正确;B、原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,图中微粒的核外电子数=2+8=10,当该微粒是原子时,质子数=电子数=10,表示氖原子,当该微粒不是原子时,质子数≠电子数,不表示氖原子,错误;C、1个铁离子带3个单位的正电荷,1个亚铁离子带2个单位的正电荷,表示两个亚铁离子,而不是两个铁离子,错误;D、元素符号(或原子团)正上方的数字,表示在该化合物里该元素或原子团所显的化合价,表示铜元素的化合价为+2价,错误。故选A。
3.答案:B
解析:A、C、N、O的原子序数依次递增,A说法正确;B、碳、氮、氧在元素周期表中属于同一周期,B说法错误;C、在原子中,原子序数=核外电子数,故氮原子的核外电子数为7,C说法正确;D、氧的相对原子质量为16.00,D说法正确;故选:B。
4.答案:B解析:
5.答案:B
解析:A、酚酞溶液与滴有浓氨水的棉花糖没有接触,但酚酞溶液变红,说明分子在不断运动,该选项说法正确;B、浓盐酸呈酸性,不能使无色酚酞溶液变红,因此将浓氨水换成浓盐酸不能达到实验目的,该选项说法不正确;C、该实验为密闭装置,且使用的药品较少,则该实验的优点是节约和环保,该选项说法正确;D、分子是在不断运动的,温度越高,分子运动速率越快,因此热纸巾捂住笔帽能加速实验,该选项说法正确;故选:B。
6.答案:B
解析:元素只讲种类,不讲个数,绿原酸由碳、氢、氧三种元素组成,A错误;绿原酸中碳、氢、氧三种元素质量比为,则其中碳元素的质量分数最大,B正确;绿原酸是由绿原酸分子构成的,一个绿原酸分子是由16个碳原子、18个氢原子和9个氧原子构成的,C错误;分子是由原子构成的,原子中质子数不一定等于中子数,绿原酸分子是由碳、氢、氧三种原子构成的,其中氢原子中没有中子,则绿原酸分子中的质子数不等于中子数,D错误。
7.答案:A
8.答案:A
9.答案:B
10.答案:C
解析:A、四种物质中的氮气和硅均属于单质,与属于化合物,故A说法错误;B、在该反应前后,硅元素的化合价由零变成+4价,氮元素由+3价变成零,故B说法错误;C、由质量守恒定律可知,反应前后原子的种类不变,故C说法正确;D、由分子结构模型可知,反应前后分子的种类改变,故D说法错误。故选:C。
11.答案:(1)2
(2)金属;②④
解析:(1)相对原子质量≈质子数+中子数,故中子数=3-1=2。
(2)锶带“钅”,属于金属元素;化学性质与原子的最外层电子数密切相关,最外层电子数相同的原子,化学性质相似。由图甲可知,锶原子的最外层电子数为2,小于4,在化学反应中易失去电子形成阳离子;图乙表示的粒子中,最外层电子数与锶原子相同的有①②④,但是①只有一个电子层,为稀有气体原子,化学性质稳定,故与锶原子化学性质相似的有②④。
12.答案:(1)②
(2)
(3)
(4)贫血
(5)①③④
解析:(1)A、B、C、D、E、F六种元素,A元素原子的原子核中没有中子,所以A是氢元素;B是地壳中含量最多的元素,所以B是氧元素;C元素原子的核电荷数为17,所以C是氯元素;D元素组成的单质是目前世界上年产量最高的金属,所以D是铁元素;E是“司母戊鼎”中的一种金属元素,其单质呈紫红色,所以E是铜元素;F元素形成的单质在空气中燃烧、发出耀眼的白光,所以F是镁元素。经过验证,推导正确,所以B元素的原子。
(2)由A、B两种元素形成的常见阴离子结构示意图的符号是。
(3)D元素的单质与A、C元素形成化合物的水溶液的反应是铁和盐酸反应生成氯化亚铁和氢气,化学方程式为。
(4)人体缺铁元素可能会引起贫血。
(5)为了判断铁、铜、镁元素形成的三种单质的活动性强弱,①把形状、大小相同的D、E、F元素形成的单质分别放入同浓度同体积的稀硫酸中,依据能否发生反应以及气泡产生的速率,可以判断,故合理;②把F元素形成的单质分别放入含D的低价盐溶液和E的盐溶液中,都会反应,不能验证,故不合理;③把D元素形成的单质分别放入含E、F的盐溶液中,铁会置换出铜,不会置换出镁,可以验证,故合理;④把E、F元素形成的两种单质分别放入含D的低价盐溶液中,镁会置换出铁,铜不会置换出铁,可以验证,故合理。
13.答案:(1)原子
(2)质子数(或核电荷数)
(3)
(4)
14.答案:(1)棉花团变红色
(2)①挥发
②分子是不断运动的
(3)遥知不是雪,为有暗香来
解析:(1)观察到的实验现象是棉花团变红色,是因为氨分子是不断运动的,运动到酚酞溶液中时,与水结合生成氨水,氨水显碱性,能使酚酞变红色。
故答案为:棉花团变红色。
(2)①浓氨水具有挥发性。
故答案为:挥发。
②分子是不断运动的。
故答案为:分子是不断运动的。
(3)一个能用分子运动的观点解释的诗句是遥知不是雪,为有暗香来(远处的白色物质不是雪,是因为梅花散发出的花香味扑面而来,即能够说明分子是不断运动的)。
故答案为:遥知不是雪,为有暗香来。
15.答案:(1)温度升高,氧分子运动的速率加快
(2)氧气的密度比空气大
解析:(1)BC段曲线的下降程度远远大于AB段,说明在加热时,温度升高,氧分子运动的速率加快,逸出的速率快,瓶内氧气含量迅速减少。
(2)停止加热后,瓶子倒转,此时氧气浓度传感器位于上端而瓶口朝下,CD段氧气浓度降低速度大于AB段,说明此时的氧气分子主要集中在瓶口位置,即说明氧气的密度比空气大。
16.答案:(1)四或4;
(2)Mg
(3)D
(4)原子的最外层电子数相同
(5)
解析:(1)质子数决定元素的种类,图1中,共有四种质子数,共包含四种元素;①中质子数为17,核外电子数为18,表示氯离子,所以①表示的微粒符号是。故填:四或4;。
(2)X元素原子的核电荷数为12,表示镁元素,元素符号是Mg。故填:Mg。
(3)图2中,能直接获取有关Na的信息是原子序数、元素符号、元素名称、相对原子质量等,无法直接知道原子核内的中子数。故填:D。
(4)原子的最外层电子数决定元素的化学性质。镓元素、铝元素原子的最外层电子数相同,均为3。因此,二者化学性质相似。故填:原子的最外层电子数相同。
(5)据微观示意图可知,甲为,乙为Si,丙为,丁为。与Si在一定条件下反应生成和,反应的化学方程式为。故填:。
17.答案:(1)五
(2)DF
(3)
解析:(1)元素是具有相同核电荷数或质子数的一类原子的总称,元素的种类由质子数决定,故A—F六种粒子共有五种质子数,有五种元素;
(2)最外层电子数决定化学性质,原子最外层电子数相同,化学性质相似,故D、F的最外层电子数都是6,化学性质相似;A、E最外层电子数也相同,但A为氢元素,为非金属元素;E为钠元素,为金属元素;化学性质不同;B、C最外层电子数也相同,但B为原子,C为离子,化学性质不同;
(3)G粒子是带两个单位正电荷的微粒,质子数=2+8+2=12,为镁离子,符号为。
18.答案:(1)A
(2)①78.96;非金属
②B
③最外层电子数相同
④
解析:(1)决定元素种类的为质子数或核电荷数,则不同种元素的最本质区别为质子数或核电荷数不同,故选A。
(2)①元素周期表单元格中,最下方的数字表示相对原子质量,硒元素的相对原子质量为78.96;硒为“石”字旁,属于非金属元素。
②16号元素为硫元素,则硫原子的结构示意图为B。
③决定元素化学性质的为最外层电子数,氧、硫、硒三种原子最外层电子数相同,则它们的化学性质相似。
④氧为8号元素,则氧原子的核外电子数为8,是由氧原子得到2个电子形成的,则核外电子数为8+2=10,核外电子排布为2、8,结构示意图为:。
19.答案:(1)非金属;78.96
(2)三;Na>Mg>Al
(3);分子拆分成原子,原子重新组合成新的分子
解析:(1)硒是石字旁,属于非金属元素;根据硒元素在周期表中的信息,可知硒元素的相对原子质量是78.96。
(2)元素所在周期数与元素原子的核外电子层数相等,Na、Mg、Al三种元素原子的核外都有三个电子层,说明它们都位于第三周期;根据题给信息“原子最外层电子数越多,原子半径反而越小,原子核对核外电子的引力越大”,引力越大,则原子越不容易失去电子,三种原子的最外层电子数大小关系是Al>Mg>Na,则三种原子中,铝原子最不容易失去电子,其次是镁原子,失电子能力最强的是钠原子,故失电子能力由强到弱的顺序是Na>Mg>Al。
(3)根据微观示意图,可知该反应是二氧化碳和氢气在加热和催化剂作用下反应生成乙烯和水的过程,反应的化学方程式为。
同课章节目录
