专题十二 质量守恒定律(含答案)2025年中考一轮复习收官测试卷
文档属性
| 名称 | 专题十二 质量守恒定律(含答案)2025年中考一轮复习收官测试卷 |  | |
| 格式 | docx | ||
| 文件大小 | 524.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-20 23:11:42 | ||
图片预览


文档简介
专题十二 质量守恒定律——中考一轮复习收官测试卷
(试卷满分:60分;考试时间:60分钟)
可能用到的相对原子质量:H-1 C-12 O-16 Fe-56
一、选择题(本大题共15小题,每题2分,共30分)
1.石灰氮(主要成分为)是一种固态肥料,与水反应的原理为,则X的化学式为( )
A. B. C. D.
2.根据化学方程式推断,M、N的相对分子质量相差( )
A.12 B.18 C.22 D.40
3.某物质1.6克在空气中充分燃烧共生成4.4克二氧化碳和3.6克水。则下列说法正确的是( )
①该物质中一定含有氧元素
②该物质中一定不含氧元素
③该物质中一定含有碳、氢元素
④该物质的一个分子中碳、氢原子的个数比为1:4
⑤该物质中氢元素的质量分数最大
A.①②③④⑤ B.②③④ C.③④⑤ D.②③
4.某化合物与9.6 g氧气在点燃的条件下恰好完全反应,生成8.8 g二氧化碳和5.4 g水,则该化合物的化学式为( )
A. B. C. D.
5.下列说法正确的是( )
A.氢气在氧气中燃烧时,参加反应的氢气和氧气的体积一定等于生成水的体积
B.某物质在氧气中燃烧后只生成二氧化碳和水,则该物质中一定含有碳、氢、氧元素
C.5 g硫和5 g氧气完全反应后,生成二氧化硫的质量为10 g
D.100 g水与100 g酒精混合后质量等于200 g,符合质量守恒定律
6.我国古代将炉甘石 、赤铜和木炭粉混合后加热到约,有如下反应发生:① ,② 。下列有关说法错误的是( )
A.X的化学式为 B.反应前后锌元素质量不变
C.②反应中ZnO发生了还原反应 D.②反应前后锌元素化合价升高
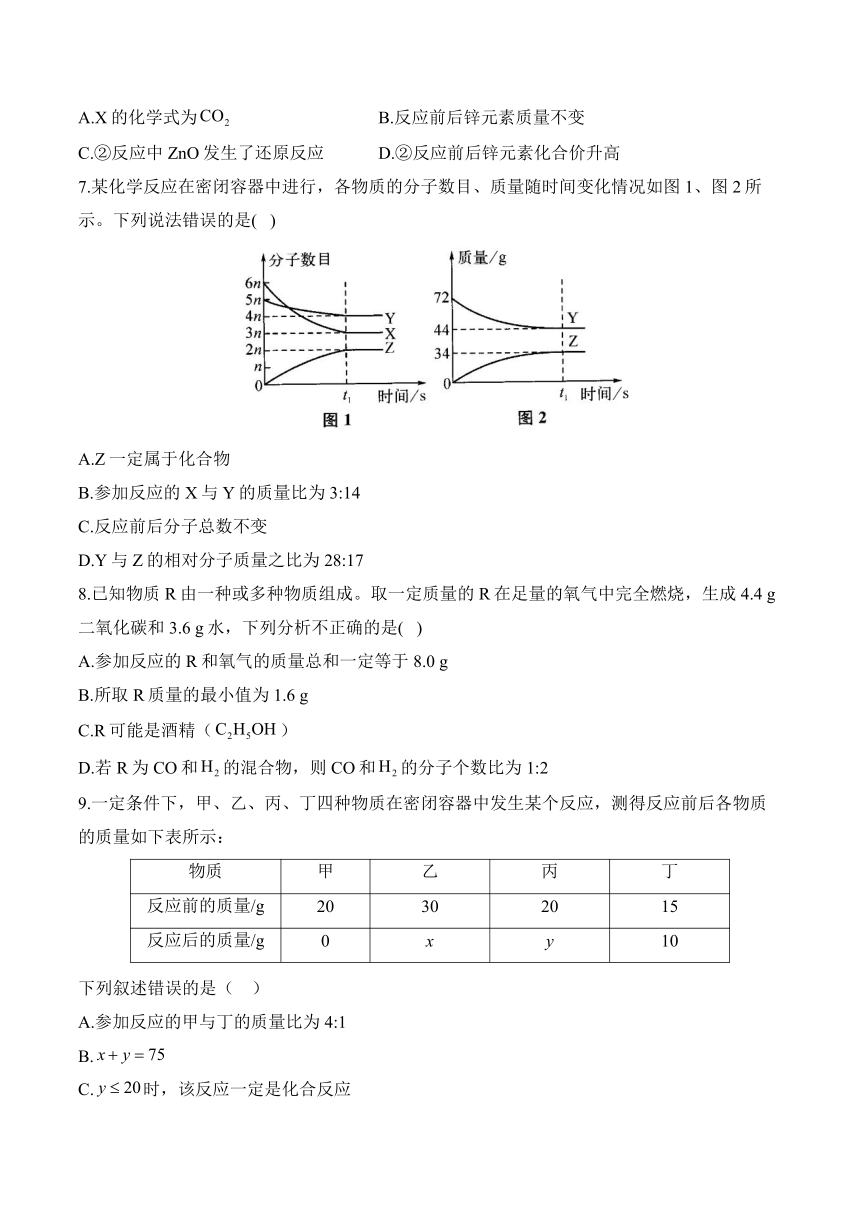
7.某化学反应在密闭容器中进行,各物质的分子数目、质量随时间变化情况如图1、图2所示。下列说法错误的是( )
A.Z一定属于化合物
B.参加反应的X与Y的质量比为3:14
C.反应前后分子总数不变
D.Y与Z的相对分子质量之比为28:17
8.已知物质R由一种或多种物质组成。取一定质量的R在足量的氧气中完全燃烧,生成4.4 g二氧化碳和3.6 g水,下列分析不正确的是( )
A.参加反应的R和氧气的质量总和一定等于8.0 g
B.所取R质量的最小值为1.6 g
C.R可能是酒精()
D.若R为CO和的混合物,则CO和的分子个数比为1:2
9.一定条件下,甲、乙、丙、丁四种物质在密闭容器中发生某个反应,测得反应前后各物质的质量如下表所示:
物质 甲 乙 丙 丁
反应前的质量/g 20 30 20 15
反应后的质量/g 0 x y 10
下列叙述错误的是( )
A.参加反应的甲与丁的质量比为4:1
B.
C.时,该反应一定是化合反应
D.x的取值范围:
10.将一定量的、和物质M置于密闭容器中,在特定条件下发生化学反应,反应前后各物质的质量分数如图所示。下列说法不正确的是( )
A.反应前后原子的数目不变
B.参加反应的和分子个数比为1:3
C.M可能是该反应的催化剂
D.反应后和质量分数之比为1:1
11.一定条件下,甲、乙、丙、丁四种物质在密闭容器中发生反应,测得反应前后各物质的质量如图所示,图中x、y分别表示乙和丙的质量。下列说法错误的是( )
A.反应后甲的质量分数是8%
B.x的取值范围:
C.时,生成物只有一种
D.参加反应的甲与丁的质量比为2:1
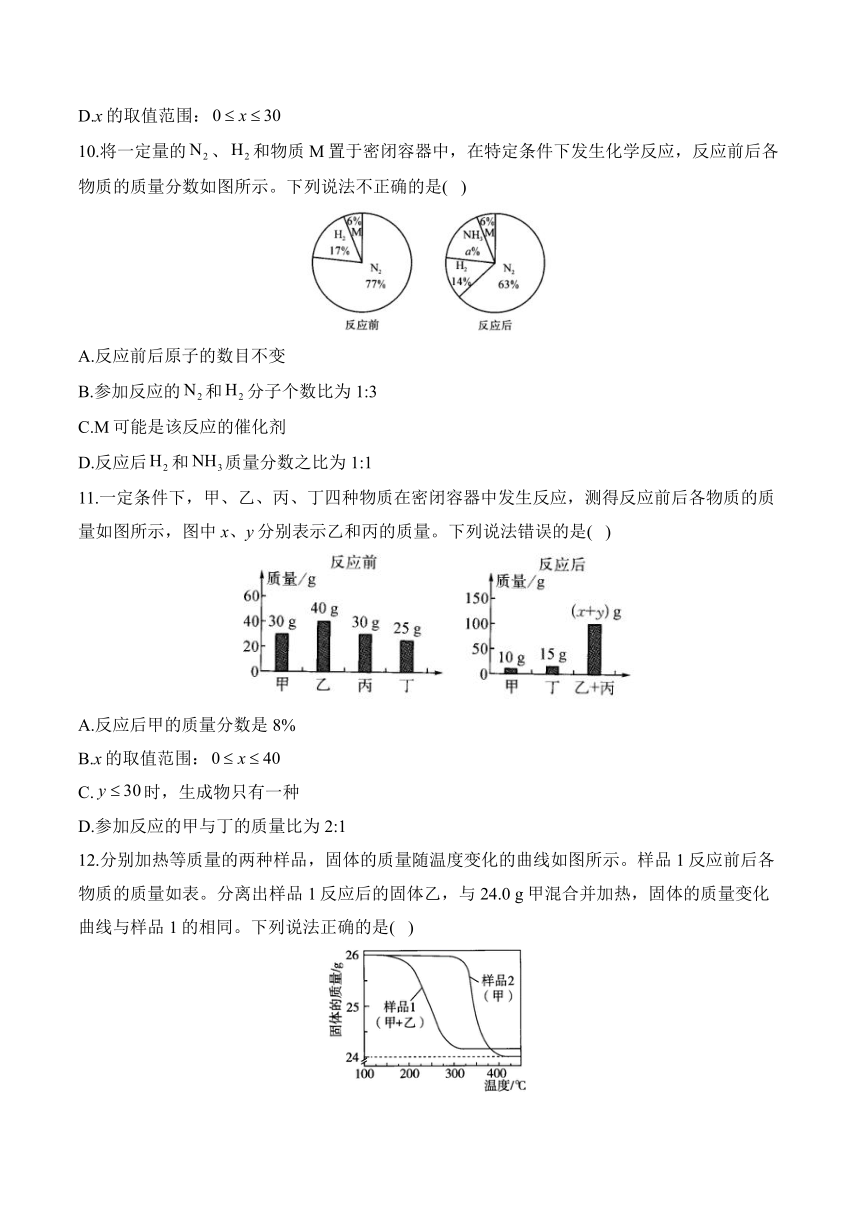
12.分别加热等质量的两种样品,固体的质量随温度变化的曲线如图所示。样品1反应前后各物质的质量如表。分离出样品1反应后的固体乙,与24.0 g甲混合并加热,固体的质量变化曲线与样品1的相同。下列说法正确的是( )
物质
反应前质量/g 24.0 2.0 0 0
反应后质量/g 0 2.0 x 1.9
A.该反应是化合反应 B.x=20.1
C.该条件下丙和丁均为气体 D.乙是催化剂
13.将0.72 g草酸亚铁()放在一个可称量的敞口容器中高温焙烧,500 ℃~600 ℃时,容器中的固体质量保持0.4 g不变。所得物质的化学式为( )
A.Fe B.FeO C. D.
14.下列现象能用质量守恒定律解释的是( )
A.蔗糖溶于水后总质量不变
B.浓硫酸敞口放置质量增加
C.饱和硝酸钾溶液升温,溶液质量不变
D.硫酸铜溶液和氢氧化钠溶液混合,溶液质量减小
15.某实验小组按图甲装置验证质量守恒定律,一段时间后,发现锥形瓶内部分固体变为红棕色。实验过程中瓶内物质或元素质量变化与图乙相符的是( )
A.铁粉的质量 B.氮气的质量 C.氧元素的质量 D.固态物质的质量
二、填空题(本题共4小题,每空1分,共19分)
16.质量守恒定律对科学发展具有重大意义。为验证质量守恒定律,某化学小组同学用下图所示实验装置进行了系列实验。
(1)甲同学用图1装置实验,此实验中气球的作用是____________________。
(2)乙同学用图2装置实验,发现天平的指针_______(填“偏左”、“偏右”或“不偏转”)。
(3)丙同学对乙同学的装置进行了改进(如图3),可能存在的隐患是____________。
(4)丁同学对乙同学的装置进行了改进(如图4),同组同学认为会产生误差,他的理由是
。
(5)戊同学对乙同学的装置进行了改进(如图5),发现反应前后总质量不变。请根据本小组的系列实验,从药品的选择、装置的设计等方面分析验证质量守恒定律时需要注意的相关事项 (至少写出3条)。
17.根据质量守恒定律,回答下列问题:
(1)在质量守恒定律的实验探究活动中,某小组同学将一根用砂纸打磨干净的长镁条和一个陶土网一起放在托盘天平上称量,记录所称的质量为。在陶土网上方将镁条点燃,观察反应现象,将镁条燃烧后的产物与陶土网一起放在托盘天平上称量,记录所称的质量为,发现,该反应__________质量守恒定律(填“遵循”或“不遵循”)。如果在燃着的镁条上方罩上玻璃罩,使生成物全部收集起来与陶土网一起放在托盘天平上称量,记录所称的质量为,则_________(填“大于”“小于”或“等于”),原因是 (请用化学方程式解释)。
(2)氧气面罩中常用过氧化钠吸收二氧化碳生成氧气和另一种物质,反应的化学方程式为,则X的化学式为_______。
(3)由质量守恒定律可知,化学反应前后,一定不变的是_______(填序号)。
①原子种类;②原子数目;③分子种类;④分子数目;⑤元素种类;⑥物质总质量
18.质量守恒定律的发现对化学的发展作出了巨大贡献。
(1)为验证质量守恒定律,小华设计图1装置进行实验。(已知:铁和稀盐酸反应生成氢气)
实验时,先将装有药品的装置放在天平上,添加砝码,移动游码至天平平衡
(图1),然后取下装置,用针筒向锥形瓶中注入少量稀盐酸,反应后再将装置放置于天平上,观察到 ,从而验证了质量守恒定律。若将锥形瓶改为烧杯,则不能验证质量守恒定律,原因是 。
(2)某反应的微观示意图如图2所示。
①X的化学式是_______。
②根据上述微观示意图,可得出化学反应遵循质量守恒定律的本质原因是 。
19.质量守恒定律对科学发展具有重大意义。
(1)由质量守恒定律可知,化学反应前后一定不变的是_______________(填序号)。
①原子种类②原子数目③分子种类
④分子数目⑤元素种类⑥物质种类
(2)下图是某反应的微观示意图(其中“”和“●”分别表示不同的原子)。
①反应后方框内应再填入_______________个微粒。
②请从微观的角度分析化学变化的实质是_______________。
(3)在一密闭容器内有4种物质A、B、C、D,它们在一定条件下发生化学反应。其中A、B、C的微观示意图和反应前后各物质的质量如下表所示。
物质 A B C D
微观示意图
反应前质量/g 100 1 1 46
反应后质量/g 4 89 55
①的值为_____。
②若D的相对分子质量为46,该反应的化学方程式是 。
实验题(本题共2小题,每空1分,共11分)
20.从定性到定量的角度研究化学,是物质属性的精细化表征的方法。
Ⅰ.从定性的角度研究:用如图实验装置探究汽油的元素组成(夹持仪器已略)。
实验中,要使汽油燃烧生成的气体能通过漏斗被吸入试管中,需要进行的操作是:
。
(2)观察到漏斗内壁出现水滴,试管中澄清石灰水变浑浊,由以上现象可推测出汽油中______(填“一定”或“可能”或“一定下”)含有氧元素。
Ⅱ.从定量的角度研究:设计了如图实验装置(天平略)验证质量守恒定律。
(3)上述三个实验装置中,能用于验证质量守恒定律的是 。
(4)写出A实验中的化学反应方程式: 。
(5)镁条在空气中完全燃烧生成氧化镁,若反应后称量发现固体的质量减轻,请分析产生这一现象的原因 。
21.以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格)。
【提出问题】
化学反应前后各物质的质量总和是否相等?
【猜想与假设】
猜想1:不相等;
猜想2:相等。
【实验探究】
(1)甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
甲组 乙组
实验方案(反应后略)
实验现象 有气泡产生,天平指针向右偏转 铁钉表面有红色物质析出,溶液颜色发生改变,天平指针没有偏转
结论 猜想1正确,反应的化学方程式: 。 猜想2正确
【反思评价】
(2)究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体逸出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在_________中进行。
【优化装置】
(3)同学们对甲组左盘中的反应装置进行了如下三种改进,你认为最佳装置是__________(填字母),从另外两种装置中任选一种指出其不足: 。
【得出结论】
(4)同学们利用改进后的最佳装置再次进行探究,均得出猜想2正确。进一步分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论: 的各物质的质量总和等于反应后生成的各物质的质量总和。
(5)解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒。
应用:某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质一定由 元素组成。
答案以及解析
1.答案:D
2.答案:C
解析:根据质量守恒定律,M与氢氧化钠的相对分子质量之和等于N与水的相对分子质量之和,故M、N的相对分子质量相差40-18=22。故选C。
3.答案:B
解析:1.6 g该物质在空气中充分燃烧,生成4.4 g二氧化碳和3.6 g水,根据质量守恒定律,反应前后元素的种类和质量均不变,故该物质中一定含有碳元素和氢元素。其中碳元素的质量等于生成的二氧化碳中碳元素的质量,氢元素的质量等于生成的水中氢元素的质量,故该物质中碳元素的质量为,氢元素的质量为。由于碳、氢元素的质量之和为1.2 g+0.4 g=1.6 g,与该物质的质量相等,因此该物质中只含有碳、氢元素,定不含氧元素,①错误,②③正确;该物质的一个分子中碳氢原子的个数比为是,④正确;该物质中碳元素与氢元素的质量比为1.2 g:0.4 g=3:1,则碳元素的质量分数最大,⑤错误。综上所述,B正确。
4.答案:B
解析:某化合物与9.6氧气在点燃的条件下恰好完全反应,生成8.8 g二氧化碳和5.4 g水,根据质量守恒定律,该化合物的质量为:;该化合物中碳元素质量:,氢元素质量:,氧元素质量:,化合物中含有碳元素、氢元素和氧元素;化合物中碳原子、氢原子、氧原子个数比:,化学式是。故选B。
5.答案:C
解析:质量守恒定律只适用于质量的守恒,不包括体积等其他方面的守恒,A错误;根据质量守恒定律,化学反应前后元素的种类不变,某物质在氧气中燃烧后只生成二氧化碳和水,则该物质中一定含有碳元素和氢元素,可能含有氧元素,B错误;硫与氧气在点燃的条件下反应生成二氧化硫,根据化学反应方程式可知,每32份质量的硫与32份质量的氧气完全反应,生成64份质量的二氧化硫,则5 g硫能与5 g氧气恰好完全反应生成10 g二氧化硫,C正确;质量守恒定律只适用于化学变化,不适用于物理变化,水与酒精混合的过程中没有新物质生成,属于物理变化,D错误。
6.答案:D
7.答案:C
解析:由图1可知,X和Y分子数减少,是反应物,Z分子数增多,是生成物,X减少6n-3n=3n,Y减少5n-4n=n,Z增加2n,即X、Y、Z的分子个数比为3:1:2,则该反应可表示为3X+Y2Z,Z一定属于化合物,反应前后分子总数改变;由图2可知,参加反应的Y的质量为72 g-44 g=28 g,生成Z的质量为34 g,由质量守恒定律可知,参加反应的X的质量为34 g-28 g=6 g,则参加反应的X与Y的质量比为6 g:28 g=3:14;设Y、Z的相对分子质量分别为m、n,由化学方程式可知,m:2n=28 g:34 g,则m:n=28:17。
8.答案:C
解析:根据质量守恒定律,反应前参加反应的R和氧气的质量总和为4.4 g+3.6 g=8 g;反应后g×44×100%=的二氧化碳中碳元素的质量为,水中氢元素的质量为,根据反应前后元素的种类和质量不变,故反应前R中的碳元素和氢元素分别为1.2 g和0.4 g,则R质量的最小值为1.2 g+0.4 g=1.6 g;R中C、H元素质量比为1.2 g:0.4 g=3:1,而酒精()中C、H元素质量比为(2×12):(6×1)=4:1;R中C、H原子个数比为,若R为CO和的混合物,则CO和的分子个数比为1:2。
9.答案:D
解析:由题给四种物质在反应前后的质量变化数据,结合质量守恒定律可知,甲、丁反应后质量减少,为反应物,参加反应的甲与丁的质量比为(20 g-0):(15 g-10 g)=20:5=4:1。x+y=20+30+20+15-10=75。若y<20,则丙为反应物;若y=20,则丙为催化剂或未参加反应,故该反应一定是化合反应。乙可能是生成物,可能是反应物,或为催化剂或未参加反应,故x的取值范围为。
10.答案:D
解析:化学反应前后各原子的种类、数目均不变;根据质量守恒定律,则a%=17%+77%-14%-63%=17%;据图可知,氢气的质量分数减少了3%,氨气的质量分数增加了17%,氮气的质量分数减少了14%,M的质量分数不变,说明该反应为氢气和氮气反应生成氨气,反应中氢气、氮气的质量比为3:14,设参加反应的氮气、氢气分子个数比为x:y,则28x:2y=14:3,解得x:y=1:3;反应前后M的质量分数不变,说明M可能是该反应的催化剂,也可能没有参与该反应;反应后氢气和氨气的质量分数比为14%:17%=14:17。
11.答案:B
解析:反应前后物质总质量保持不变,因此反应后甲的质量分数为;+30 g+40 g+30 g+25 g-10 g-15 g=100 g,x的取值范围:;y<30时,甲、丁、丙都是反应物,y=30时,丙是催化剂或未参与反应,所以生成物只有一种;参加反应的甲与丁的质量比为20 g:10 g=2:1。
12.答案:D
解析:A、B(×):由题表中信息可知,x=24.0+2.0-2.01.9=22.1,该反应中甲的质量减少,乙的质量不变,丙和丁的质量增大,符合“一变多”的特征,属于分解反应。C(×):由样品2的固体质量变化曲线可知,反应前后,固体质量减少约2g,则该条件下物质丙是固体,物质丁是气体。D(√):反应前后乙的质量不变;结合固体质量变化曲线图可知,没有加入乙时,甲分解所需的温度更高;且将乙再次与24.0 g甲混合加热时,固体质量变化曲线与样品1相同,说明乙的化学性质没有改变,则乙是该反应的催化剂。
13.答案:C
解析:0.72 g草酸亚铁中含铁元素的质量为,而反应后固体质量为0.4 g,不可能是铁单质,结合选项可知,应为铁的氧化物,铁元素和氧元素的质量比为0.28 g:(0.4 g-0.28 g)=7:3,设铁的氧化物的化学式为,则56x:16y=7:3,解得x:y=2:3,故所得物质的化学式为。
14.答案:D
解析:蔗糖溶于水后总质量不变,发生的是物理变化,不能用质量守恒定律解释,故A不符合题意;浓硫酸敞口放置质量增加,发生的是物理变化,不能用质量守恒定律解释,故B不符合题意;饱和硝酸钾溶液升温,溶液质量不变,发生的是物理变化,不能用质量守恒定律解释,故C不符合题意;硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,是化学变化,遵循质量守恒定律,故D符合题意。
15.答案:A
解析:锥形瓶内部分固体变为红棕色说明铁发生了锈蚀,铁的质量减小,但是铁还有剩余,故质量不会减小到0,A正确;氮气没有参与反应,质量不变,B错误;根据质量守恒定律,反应前后氧元素质量不变,C错误;铁与氧气和水反应生锈,在此过程中固态物质的质量会变大,D错误。
16.答案:(1)平衡气压、防止装置漏气(写出一点即给分)
(2)偏右
(3)锥形瓶内气压过大,使瓶塞被弹出
(4)反应产生气体,气球膨胀受到空气向上的浮力
(5)①选择没有气体参与的化学反应
②反应装置密闭
③防止气球变大,空气浮力对实验的影响
④反应装置产生的气体可以被吸收
⑤防止装置内压强太大导致装置爆炸
解析:(1)图1装置中气球的作用是平衡气压,可以防止瓶塞被冲出。
(2)乙同学用图2装置实验,该装置中碳酸钠粉末,会与稀盐酸反应生成二氧化碳,二氧化碳逸散到空气中,导致左盘上物质质量变小,会发现天平的指针偏右。
(3)丙同学对乙同学的装置进行了改进(如图3),图丙装置完全密封,与稀盐酸反应生成二氧化碳,会导致装置内气压增大,可能存在的隐患是锥形瓶内气压过大,使瓶塞被冲出。
(4)丁同学对乙同学的装置进行了改进(如图4),则与稀盐酸反应生成二氧化碳,会导致装置内气压增大,气球膨胀,从而产生浮力,导致实验误差,故填:反应产生气体,气球膨胀受到向上的浮力。
(5)根据本小组的系列实验,从药品的选择、装置的设计等方面分析验证质量守恒定律时需要注意的,相关事项有:选择没有气体参与的化学反应;反应装置密闭;防止气球变大,空气浮力对实验的影响;反应装置产生的气体可以被吸收;防止装置内压强太大导致装置爆炸(合理即可)。
17.答案:(1)遵循;小于;
(2)
(3)①②⑤⑥
18.答案:(1)天平继续保持平衡装置没有密闭,产生的氢气逸出了
(2)①;②化学反应前后,原子保持不变
19.答案:(1)①②⑤
(2)①2 ②反应物的原子重新组合生成新物质分子的过程
(3)0 ②
20.答案:(1)向右拉动注射器活塞
(2)可能
(3)A
(4)
(5)反应生成的一部分氧化镁以白烟的形式逸散到空气中
解析:(1)实验中,要使汽油燃烧生成的气体能通过漏斗被吸入试管中,需要进行的操作是向右拉动注射器活塞,试管中的压强减小,在外界大气压的作用下,汽油燃烧生成的气体可以通过漏斗被吸入试管中;
(2)观察到漏斗内壁出现水滴,说明有水生成,试管中澄清石灰水变白色浑浊(二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水),说明有二氧化碳生成,生成物水和二氧化碳中含有碳、氢、氧三种元素,根据质量守恒定律,反应前后元素种类不变,反应前氧气中只含有氧元素,则汽油中一定含有氢元素和碳元素,可能含有氧元素;
(3)A中铁和硫酸铜反应生成硫酸亚铁和铜,发生了化学变化,反应前后天平平衡,可用于验证质量守恒定律;B中稀盐酸和碳酸钠反应生成气化钠、二氧化碳和水,发生了化学变化,但是该装置敞口,该反应有气体生成,生成的气体会逸散到空气中,不能用于验证质量守恒定律;D中蒸馏水和酒精不反应,不能用于验证质量守恒定律;故选:A;
(4)A中铁和硫酸铜反应生成硫酸亚铁和铜,符号表达式为:;
B中稀盐酸和碳酸钠反应生成氯化钠、二氧化碳和水,发生了化学变化,但是该装置敞口,该反应有气体生成,生成的气体会逸散到空气中,左盘质量减小,则B中实验结束后天平指针偏右;
(5)镁条在空气中完全燃烧生成氧化镁,参加反应的镁和氧气的质量等于生成的氧化镁的质量,根据质量守恒定律,固体增加的质量即为参加反应的氧气的质量,则与的差值表示参加反应的氧气的质量。
21.答案:(1)
(2)密闭体系
(3)B;装置A实验中碳酸钠与盐酸反应生成二氧化碳,二氧化碳充满气球,使整个装置所受空气浮力增大,因此反应后天平会失去平衡(或装置C中无法控制反应速率,生成速率快,易使橡胶塞弹出,合理即可)
(4)参加化学反应
(5)铜、碳、氧、氢
解析:(1)碳酸钠与盐酸反应生成氯化钠、水和二氧化碳。根据质量守恒定律,参加反应的碳酸钠与氯化氢的质量和等于生成的氯化钠、水和二氧化碳的质量和,因二氧化碳气体逸出,故烧杯中反应后总质量比反应前总质量减小,观察到天平不平衡。反应的方程式为。
(2)通过讨论,同学们发现甲组中有气体逸出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在密闭体系中进行。
(3)装置A中碳酸钠与盐酸反应生成二氧化碳,二氧化碳充满气球,使整个装置所受空气浮力增大,因此反应后天平失去平衡。装置C中碳酸钠粉末与盐酸反应太快,橡胶塞易被弹出。
(4)参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
(5)因为化学反应前后元素的种类不变,氧化铜、二氧化碳和水共含有铜、碳、氧、氢四种元素,所以该反应物中也会含有这四种元素。
(试卷满分:60分;考试时间:60分钟)
可能用到的相对原子质量:H-1 C-12 O-16 Fe-56
一、选择题(本大题共15小题,每题2分,共30分)
1.石灰氮(主要成分为)是一种固态肥料,与水反应的原理为,则X的化学式为( )
A. B. C. D.
2.根据化学方程式推断,M、N的相对分子质量相差( )
A.12 B.18 C.22 D.40
3.某物质1.6克在空气中充分燃烧共生成4.4克二氧化碳和3.6克水。则下列说法正确的是( )
①该物质中一定含有氧元素
②该物质中一定不含氧元素
③该物质中一定含有碳、氢元素
④该物质的一个分子中碳、氢原子的个数比为1:4
⑤该物质中氢元素的质量分数最大
A.①②③④⑤ B.②③④ C.③④⑤ D.②③
4.某化合物与9.6 g氧气在点燃的条件下恰好完全反应,生成8.8 g二氧化碳和5.4 g水,则该化合物的化学式为( )
A. B. C. D.
5.下列说法正确的是( )
A.氢气在氧气中燃烧时,参加反应的氢气和氧气的体积一定等于生成水的体积
B.某物质在氧气中燃烧后只生成二氧化碳和水,则该物质中一定含有碳、氢、氧元素
C.5 g硫和5 g氧气完全反应后,生成二氧化硫的质量为10 g
D.100 g水与100 g酒精混合后质量等于200 g,符合质量守恒定律
6.我国古代将炉甘石 、赤铜和木炭粉混合后加热到约,有如下反应发生:① ,② 。下列有关说法错误的是( )
A.X的化学式为 B.反应前后锌元素质量不变
C.②反应中ZnO发生了还原反应 D.②反应前后锌元素化合价升高
7.某化学反应在密闭容器中进行,各物质的分子数目、质量随时间变化情况如图1、图2所示。下列说法错误的是( )
A.Z一定属于化合物
B.参加反应的X与Y的质量比为3:14
C.反应前后分子总数不变
D.Y与Z的相对分子质量之比为28:17
8.已知物质R由一种或多种物质组成。取一定质量的R在足量的氧气中完全燃烧,生成4.4 g二氧化碳和3.6 g水,下列分析不正确的是( )
A.参加反应的R和氧气的质量总和一定等于8.0 g
B.所取R质量的最小值为1.6 g
C.R可能是酒精()
D.若R为CO和的混合物,则CO和的分子个数比为1:2
9.一定条件下,甲、乙、丙、丁四种物质在密闭容器中发生某个反应,测得反应前后各物质的质量如下表所示:
物质 甲 乙 丙 丁
反应前的质量/g 20 30 20 15
反应后的质量/g 0 x y 10
下列叙述错误的是( )
A.参加反应的甲与丁的质量比为4:1
B.
C.时,该反应一定是化合反应
D.x的取值范围:
10.将一定量的、和物质M置于密闭容器中,在特定条件下发生化学反应,反应前后各物质的质量分数如图所示。下列说法不正确的是( )
A.反应前后原子的数目不变
B.参加反应的和分子个数比为1:3
C.M可能是该反应的催化剂
D.反应后和质量分数之比为1:1
11.一定条件下,甲、乙、丙、丁四种物质在密闭容器中发生反应,测得反应前后各物质的质量如图所示,图中x、y分别表示乙和丙的质量。下列说法错误的是( )
A.反应后甲的质量分数是8%
B.x的取值范围:
C.时,生成物只有一种
D.参加反应的甲与丁的质量比为2:1
12.分别加热等质量的两种样品,固体的质量随温度变化的曲线如图所示。样品1反应前后各物质的质量如表。分离出样品1反应后的固体乙,与24.0 g甲混合并加热,固体的质量变化曲线与样品1的相同。下列说法正确的是( )
物质
反应前质量/g 24.0 2.0 0 0
反应后质量/g 0 2.0 x 1.9
A.该反应是化合反应 B.x=20.1
C.该条件下丙和丁均为气体 D.乙是催化剂
13.将0.72 g草酸亚铁()放在一个可称量的敞口容器中高温焙烧,500 ℃~600 ℃时,容器中的固体质量保持0.4 g不变。所得物质的化学式为( )
A.Fe B.FeO C. D.
14.下列现象能用质量守恒定律解释的是( )
A.蔗糖溶于水后总质量不变
B.浓硫酸敞口放置质量增加
C.饱和硝酸钾溶液升温,溶液质量不变
D.硫酸铜溶液和氢氧化钠溶液混合,溶液质量减小
15.某实验小组按图甲装置验证质量守恒定律,一段时间后,发现锥形瓶内部分固体变为红棕色。实验过程中瓶内物质或元素质量变化与图乙相符的是( )
A.铁粉的质量 B.氮气的质量 C.氧元素的质量 D.固态物质的质量
二、填空题(本题共4小题,每空1分,共19分)
16.质量守恒定律对科学发展具有重大意义。为验证质量守恒定律,某化学小组同学用下图所示实验装置进行了系列实验。
(1)甲同学用图1装置实验,此实验中气球的作用是____________________。
(2)乙同学用图2装置实验,发现天平的指针_______(填“偏左”、“偏右”或“不偏转”)。
(3)丙同学对乙同学的装置进行了改进(如图3),可能存在的隐患是____________。
(4)丁同学对乙同学的装置进行了改进(如图4),同组同学认为会产生误差,他的理由是
。
(5)戊同学对乙同学的装置进行了改进(如图5),发现反应前后总质量不变。请根据本小组的系列实验,从药品的选择、装置的设计等方面分析验证质量守恒定律时需要注意的相关事项 (至少写出3条)。
17.根据质量守恒定律,回答下列问题:
(1)在质量守恒定律的实验探究活动中,某小组同学将一根用砂纸打磨干净的长镁条和一个陶土网一起放在托盘天平上称量,记录所称的质量为。在陶土网上方将镁条点燃,观察反应现象,将镁条燃烧后的产物与陶土网一起放在托盘天平上称量,记录所称的质量为,发现,该反应__________质量守恒定律(填“遵循”或“不遵循”)。如果在燃着的镁条上方罩上玻璃罩,使生成物全部收集起来与陶土网一起放在托盘天平上称量,记录所称的质量为,则_________(填“大于”“小于”或“等于”),原因是 (请用化学方程式解释)。
(2)氧气面罩中常用过氧化钠吸收二氧化碳生成氧气和另一种物质,反应的化学方程式为,则X的化学式为_______。
(3)由质量守恒定律可知,化学反应前后,一定不变的是_______(填序号)。
①原子种类;②原子数目;③分子种类;④分子数目;⑤元素种类;⑥物质总质量
18.质量守恒定律的发现对化学的发展作出了巨大贡献。
(1)为验证质量守恒定律,小华设计图1装置进行实验。(已知:铁和稀盐酸反应生成氢气)
实验时,先将装有药品的装置放在天平上,添加砝码,移动游码至天平平衡
(图1),然后取下装置,用针筒向锥形瓶中注入少量稀盐酸,反应后再将装置放置于天平上,观察到 ,从而验证了质量守恒定律。若将锥形瓶改为烧杯,则不能验证质量守恒定律,原因是 。
(2)某反应的微观示意图如图2所示。
①X的化学式是_______。
②根据上述微观示意图,可得出化学反应遵循质量守恒定律的本质原因是 。
19.质量守恒定律对科学发展具有重大意义。
(1)由质量守恒定律可知,化学反应前后一定不变的是_______________(填序号)。
①原子种类②原子数目③分子种类
④分子数目⑤元素种类⑥物质种类
(2)下图是某反应的微观示意图(其中“”和“●”分别表示不同的原子)。
①反应后方框内应再填入_______________个微粒。
②请从微观的角度分析化学变化的实质是_______________。
(3)在一密闭容器内有4种物质A、B、C、D,它们在一定条件下发生化学反应。其中A、B、C的微观示意图和反应前后各物质的质量如下表所示。
物质 A B C D
微观示意图
反应前质量/g 100 1 1 46
反应后质量/g 4 89 55
①的值为_____。
②若D的相对分子质量为46,该反应的化学方程式是 。
实验题(本题共2小题,每空1分,共11分)
20.从定性到定量的角度研究化学,是物质属性的精细化表征的方法。
Ⅰ.从定性的角度研究:用如图实验装置探究汽油的元素组成(夹持仪器已略)。
实验中,要使汽油燃烧生成的气体能通过漏斗被吸入试管中,需要进行的操作是:
。
(2)观察到漏斗内壁出现水滴,试管中澄清石灰水变浑浊,由以上现象可推测出汽油中______(填“一定”或“可能”或“一定下”)含有氧元素。
Ⅱ.从定量的角度研究:设计了如图实验装置(天平略)验证质量守恒定律。
(3)上述三个实验装置中,能用于验证质量守恒定律的是 。
(4)写出A实验中的化学反应方程式: 。
(5)镁条在空气中完全燃烧生成氧化镁,若反应后称量发现固体的质量减轻,请分析产生这一现象的原因 。
21.以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格)。
【提出问题】
化学反应前后各物质的质量总和是否相等?
【猜想与假设】
猜想1:不相等;
猜想2:相等。
【实验探究】
(1)甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
甲组 乙组
实验方案(反应后略)
实验现象 有气泡产生,天平指针向右偏转 铁钉表面有红色物质析出,溶液颜色发生改变,天平指针没有偏转
结论 猜想1正确,反应的化学方程式: 。 猜想2正确
【反思评价】
(2)究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体逸出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在_________中进行。
【优化装置】
(3)同学们对甲组左盘中的反应装置进行了如下三种改进,你认为最佳装置是__________(填字母),从另外两种装置中任选一种指出其不足: 。
【得出结论】
(4)同学们利用改进后的最佳装置再次进行探究,均得出猜想2正确。进一步分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论: 的各物质的质量总和等于反应后生成的各物质的质量总和。
(5)解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒。
应用:某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质一定由 元素组成。
答案以及解析
1.答案:D
2.答案:C
解析:根据质量守恒定律,M与氢氧化钠的相对分子质量之和等于N与水的相对分子质量之和,故M、N的相对分子质量相差40-18=22。故选C。
3.答案:B
解析:1.6 g该物质在空气中充分燃烧,生成4.4 g二氧化碳和3.6 g水,根据质量守恒定律,反应前后元素的种类和质量均不变,故该物质中一定含有碳元素和氢元素。其中碳元素的质量等于生成的二氧化碳中碳元素的质量,氢元素的质量等于生成的水中氢元素的质量,故该物质中碳元素的质量为,氢元素的质量为。由于碳、氢元素的质量之和为1.2 g+0.4 g=1.6 g,与该物质的质量相等,因此该物质中只含有碳、氢元素,定不含氧元素,①错误,②③正确;该物质的一个分子中碳氢原子的个数比为是,④正确;该物质中碳元素与氢元素的质量比为1.2 g:0.4 g=3:1,则碳元素的质量分数最大,⑤错误。综上所述,B正确。
4.答案:B
解析:某化合物与9.6氧气在点燃的条件下恰好完全反应,生成8.8 g二氧化碳和5.4 g水,根据质量守恒定律,该化合物的质量为:;该化合物中碳元素质量:,氢元素质量:,氧元素质量:,化合物中含有碳元素、氢元素和氧元素;化合物中碳原子、氢原子、氧原子个数比:,化学式是。故选B。
5.答案:C
解析:质量守恒定律只适用于质量的守恒,不包括体积等其他方面的守恒,A错误;根据质量守恒定律,化学反应前后元素的种类不变,某物质在氧气中燃烧后只生成二氧化碳和水,则该物质中一定含有碳元素和氢元素,可能含有氧元素,B错误;硫与氧气在点燃的条件下反应生成二氧化硫,根据化学反应方程式可知,每32份质量的硫与32份质量的氧气完全反应,生成64份质量的二氧化硫,则5 g硫能与5 g氧气恰好完全反应生成10 g二氧化硫,C正确;质量守恒定律只适用于化学变化,不适用于物理变化,水与酒精混合的过程中没有新物质生成,属于物理变化,D错误。
6.答案:D
7.答案:C
解析:由图1可知,X和Y分子数减少,是反应物,Z分子数增多,是生成物,X减少6n-3n=3n,Y减少5n-4n=n,Z增加2n,即X、Y、Z的分子个数比为3:1:2,则该反应可表示为3X+Y2Z,Z一定属于化合物,反应前后分子总数改变;由图2可知,参加反应的Y的质量为72 g-44 g=28 g,生成Z的质量为34 g,由质量守恒定律可知,参加反应的X的质量为34 g-28 g=6 g,则参加反应的X与Y的质量比为6 g:28 g=3:14;设Y、Z的相对分子质量分别为m、n,由化学方程式可知,m:2n=28 g:34 g,则m:n=28:17。
8.答案:C
解析:根据质量守恒定律,反应前参加反应的R和氧气的质量总和为4.4 g+3.6 g=8 g;反应后g×44×100%=的二氧化碳中碳元素的质量为,水中氢元素的质量为,根据反应前后元素的种类和质量不变,故反应前R中的碳元素和氢元素分别为1.2 g和0.4 g,则R质量的最小值为1.2 g+0.4 g=1.6 g;R中C、H元素质量比为1.2 g:0.4 g=3:1,而酒精()中C、H元素质量比为(2×12):(6×1)=4:1;R中C、H原子个数比为,若R为CO和的混合物,则CO和的分子个数比为1:2。
9.答案:D
解析:由题给四种物质在反应前后的质量变化数据,结合质量守恒定律可知,甲、丁反应后质量减少,为反应物,参加反应的甲与丁的质量比为(20 g-0):(15 g-10 g)=20:5=4:1。x+y=20+30+20+15-10=75。若y<20,则丙为反应物;若y=20,则丙为催化剂或未参加反应,故该反应一定是化合反应。乙可能是生成物,可能是反应物,或为催化剂或未参加反应,故x的取值范围为。
10.答案:D
解析:化学反应前后各原子的种类、数目均不变;根据质量守恒定律,则a%=17%+77%-14%-63%=17%;据图可知,氢气的质量分数减少了3%,氨气的质量分数增加了17%,氮气的质量分数减少了14%,M的质量分数不变,说明该反应为氢气和氮气反应生成氨气,反应中氢气、氮气的质量比为3:14,设参加反应的氮气、氢气分子个数比为x:y,则28x:2y=14:3,解得x:y=1:3;反应前后M的质量分数不变,说明M可能是该反应的催化剂,也可能没有参与该反应;反应后氢气和氨气的质量分数比为14%:17%=14:17。
11.答案:B
解析:反应前后物质总质量保持不变,因此反应后甲的质量分数为;+30 g+40 g+30 g+25 g-10 g-15 g=100 g,x的取值范围:;y<30时,甲、丁、丙都是反应物,y=30时,丙是催化剂或未参与反应,所以生成物只有一种;参加反应的甲与丁的质量比为20 g:10 g=2:1。
12.答案:D
解析:A、B(×):由题表中信息可知,x=24.0+2.0-2.01.9=22.1,该反应中甲的质量减少,乙的质量不变,丙和丁的质量增大,符合“一变多”的特征,属于分解反应。C(×):由样品2的固体质量变化曲线可知,反应前后,固体质量减少约2g,则该条件下物质丙是固体,物质丁是气体。D(√):反应前后乙的质量不变;结合固体质量变化曲线图可知,没有加入乙时,甲分解所需的温度更高;且将乙再次与24.0 g甲混合加热时,固体质量变化曲线与样品1相同,说明乙的化学性质没有改变,则乙是该反应的催化剂。
13.答案:C
解析:0.72 g草酸亚铁中含铁元素的质量为,而反应后固体质量为0.4 g,不可能是铁单质,结合选项可知,应为铁的氧化物,铁元素和氧元素的质量比为0.28 g:(0.4 g-0.28 g)=7:3,设铁的氧化物的化学式为,则56x:16y=7:3,解得x:y=2:3,故所得物质的化学式为。
14.答案:D
解析:蔗糖溶于水后总质量不变,发生的是物理变化,不能用质量守恒定律解释,故A不符合题意;浓硫酸敞口放置质量增加,发生的是物理变化,不能用质量守恒定律解释,故B不符合题意;饱和硝酸钾溶液升温,溶液质量不变,发生的是物理变化,不能用质量守恒定律解释,故C不符合题意;硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,是化学变化,遵循质量守恒定律,故D符合题意。
15.答案:A
解析:锥形瓶内部分固体变为红棕色说明铁发生了锈蚀,铁的质量减小,但是铁还有剩余,故质量不会减小到0,A正确;氮气没有参与反应,质量不变,B错误;根据质量守恒定律,反应前后氧元素质量不变,C错误;铁与氧气和水反应生锈,在此过程中固态物质的质量会变大,D错误。
16.答案:(1)平衡气压、防止装置漏气(写出一点即给分)
(2)偏右
(3)锥形瓶内气压过大,使瓶塞被弹出
(4)反应产生气体,气球膨胀受到空气向上的浮力
(5)①选择没有气体参与的化学反应
②反应装置密闭
③防止气球变大,空气浮力对实验的影响
④反应装置产生的气体可以被吸收
⑤防止装置内压强太大导致装置爆炸
解析:(1)图1装置中气球的作用是平衡气压,可以防止瓶塞被冲出。
(2)乙同学用图2装置实验,该装置中碳酸钠粉末,会与稀盐酸反应生成二氧化碳,二氧化碳逸散到空气中,导致左盘上物质质量变小,会发现天平的指针偏右。
(3)丙同学对乙同学的装置进行了改进(如图3),图丙装置完全密封,与稀盐酸反应生成二氧化碳,会导致装置内气压增大,可能存在的隐患是锥形瓶内气压过大,使瓶塞被冲出。
(4)丁同学对乙同学的装置进行了改进(如图4),则与稀盐酸反应生成二氧化碳,会导致装置内气压增大,气球膨胀,从而产生浮力,导致实验误差,故填:反应产生气体,气球膨胀受到向上的浮力。
(5)根据本小组的系列实验,从药品的选择、装置的设计等方面分析验证质量守恒定律时需要注意的,相关事项有:选择没有气体参与的化学反应;反应装置密闭;防止气球变大,空气浮力对实验的影响;反应装置产生的气体可以被吸收;防止装置内压强太大导致装置爆炸(合理即可)。
17.答案:(1)遵循;小于;
(2)
(3)①②⑤⑥
18.答案:(1)天平继续保持平衡装置没有密闭,产生的氢气逸出了
(2)①;②化学反应前后,原子保持不变
19.答案:(1)①②⑤
(2)①2 ②反应物的原子重新组合生成新物质分子的过程
(3)0 ②
20.答案:(1)向右拉动注射器活塞
(2)可能
(3)A
(4)
(5)反应生成的一部分氧化镁以白烟的形式逸散到空气中
解析:(1)实验中,要使汽油燃烧生成的气体能通过漏斗被吸入试管中,需要进行的操作是向右拉动注射器活塞,试管中的压强减小,在外界大气压的作用下,汽油燃烧生成的气体可以通过漏斗被吸入试管中;
(2)观察到漏斗内壁出现水滴,说明有水生成,试管中澄清石灰水变白色浑浊(二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水),说明有二氧化碳生成,生成物水和二氧化碳中含有碳、氢、氧三种元素,根据质量守恒定律,反应前后元素种类不变,反应前氧气中只含有氧元素,则汽油中一定含有氢元素和碳元素,可能含有氧元素;
(3)A中铁和硫酸铜反应生成硫酸亚铁和铜,发生了化学变化,反应前后天平平衡,可用于验证质量守恒定律;B中稀盐酸和碳酸钠反应生成气化钠、二氧化碳和水,发生了化学变化,但是该装置敞口,该反应有气体生成,生成的气体会逸散到空气中,不能用于验证质量守恒定律;D中蒸馏水和酒精不反应,不能用于验证质量守恒定律;故选:A;
(4)A中铁和硫酸铜反应生成硫酸亚铁和铜,符号表达式为:;
B中稀盐酸和碳酸钠反应生成氯化钠、二氧化碳和水,发生了化学变化,但是该装置敞口,该反应有气体生成,生成的气体会逸散到空气中,左盘质量减小,则B中实验结束后天平指针偏右;
(5)镁条在空气中完全燃烧生成氧化镁,参加反应的镁和氧气的质量等于生成的氧化镁的质量,根据质量守恒定律,固体增加的质量即为参加反应的氧气的质量,则与的差值表示参加反应的氧气的质量。
21.答案:(1)
(2)密闭体系
(3)B;装置A实验中碳酸钠与盐酸反应生成二氧化碳,二氧化碳充满气球,使整个装置所受空气浮力增大,因此反应后天平会失去平衡(或装置C中无法控制反应速率,生成速率快,易使橡胶塞弹出,合理即可)
(4)参加化学反应
(5)铜、碳、氧、氢
解析:(1)碳酸钠与盐酸反应生成氯化钠、水和二氧化碳。根据质量守恒定律,参加反应的碳酸钠与氯化氢的质量和等于生成的氯化钠、水和二氧化碳的质量和,因二氧化碳气体逸出,故烧杯中反应后总质量比反应前总质量减小,观察到天平不平衡。反应的方程式为。
(2)通过讨论,同学们发现甲组中有气体逸出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在密闭体系中进行。
(3)装置A中碳酸钠与盐酸反应生成二氧化碳,二氧化碳充满气球,使整个装置所受空气浮力增大,因此反应后天平失去平衡。装置C中碳酸钠粉末与盐酸反应太快,橡胶塞易被弹出。
(4)参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
(5)因为化学反应前后元素的种类不变,氧化铜、二氧化碳和水共含有铜、碳、氧、氢四种元素,所以该反应物中也会含有这四种元素。
同课章节目录
