专题十三 化学方程式(含答案)2025年中考一轮复习收官测试卷
文档属性
| 名称 | 专题十三 化学方程式(含答案)2025年中考一轮复习收官测试卷 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-20 23:20:41 | ||
图片预览


文档简介
专题十三 化学方程式——中考一轮复习收官测试卷
(试卷满分:60分;考试时间:60分钟)
可能用到的相对原子质量:H-1 Be-9 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32
Cl-35.5 Ca-40 Fe-56 Cu-64
一、选择题(本大题共15小题,每题2分,共30分)
1.下列关于,的说法不正确的是( )
A.表示一氧化氮和氧气在常温常压下反应生成二氧化氮
B.参加反应的的质量等于生成的的质量
C.参加反应的和的分子个数比为2:1
D.该反应属于化合反应
2.海洋资源的综合利用是解决人类社会资源短缺的重要途径之一、工业上电解饱和食盐水时发生如下反应:。关于这一反应,下列说法不正确的是( )
A.X的化学式是
B.氢氧化钠的相对分子质量为40g
C.生成氢气和氯气的质量比为2:71
D.反应生成的氢气是一种清洁的高能燃料
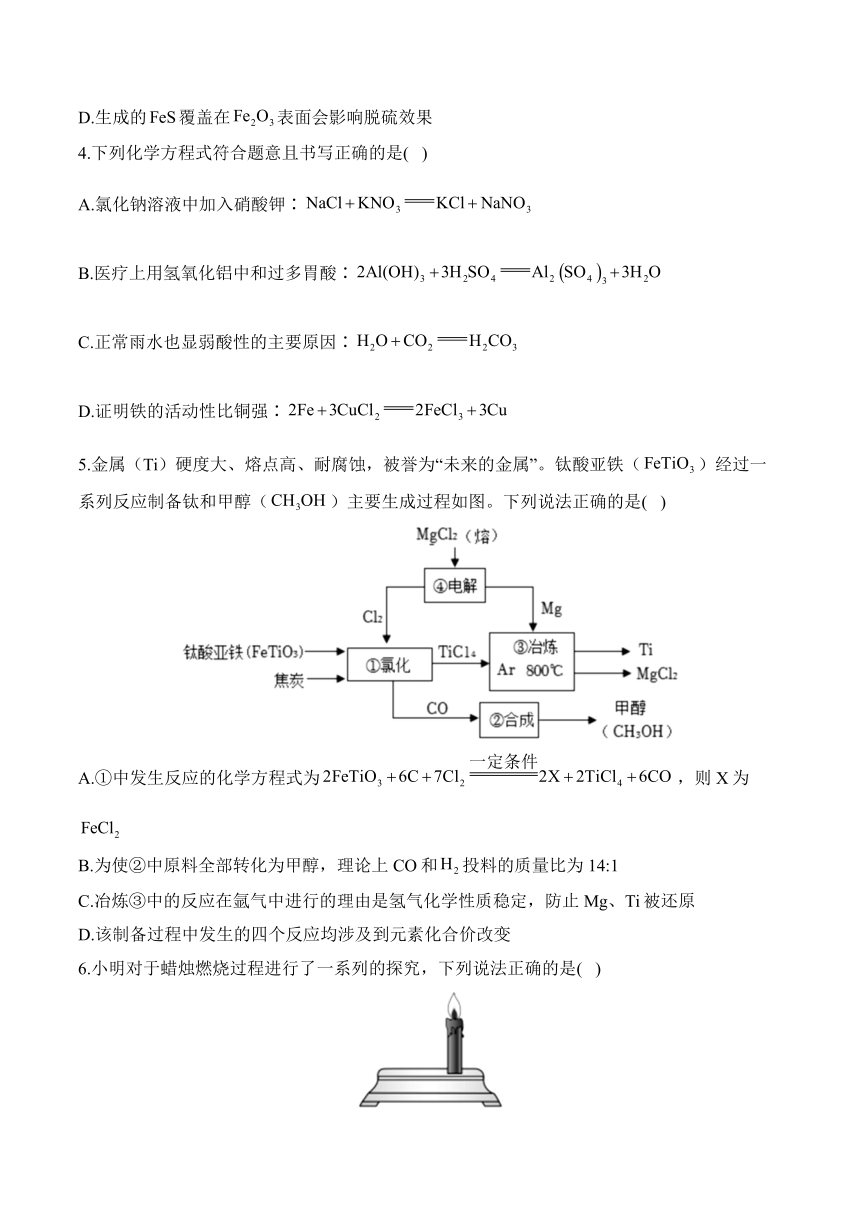
3.工业脱硫的一种原理如图所示。下列叙述正确的是( )
A.脱硫过程需及时补充
B.反应①中所有元素的化合价均发生改变
C.反应②的化学方程式为:
D.生成的覆盖在表面会影响脱硫效果
4.下列化学方程式符合题意且书写正确的是( )
A.氯化钠溶液中加入硝酸钾∶
B.医疗上用氢氧化铝中和过多胃酸∶
C.正常雨水也显弱酸性的主要原因∶
D.证明铁的活动性比铜强∶
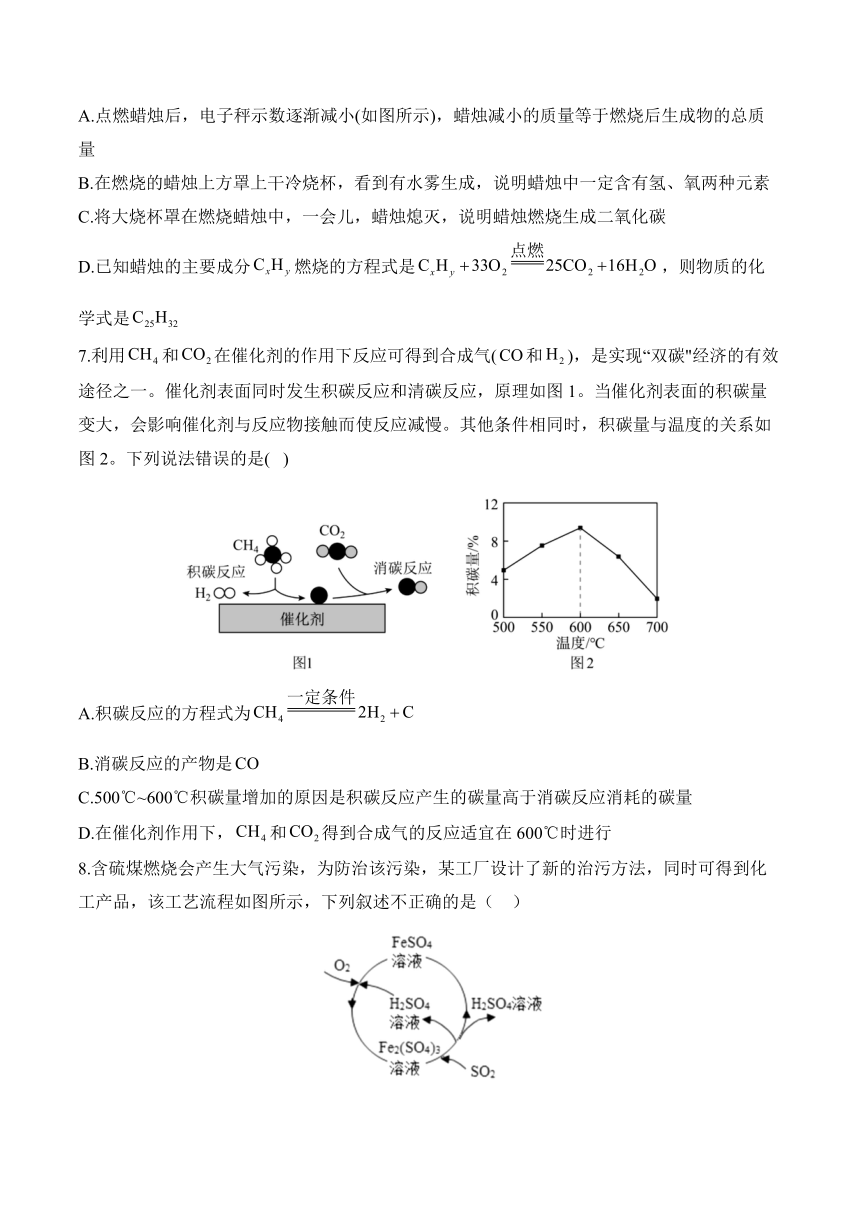
5.金属(Ti)硬度大、熔点高、耐腐蚀,被誉为“未来的金属”。钛酸亚铁()经过一系列反应制备钛和甲醇()主要生成过程如图。下列说法正确的是( )
A.①中发生反应的化学方程式为,则X为
B.为使②中原料全部转化为甲醇,理论上CO和投料的质量比为14:1
C.冶炼③中的反应在氩气中进行的理由是氢气化学性质稳定,防止Mg、Ti被还原
D.该制备过程中发生的四个反应均涉及到元素化合价改变
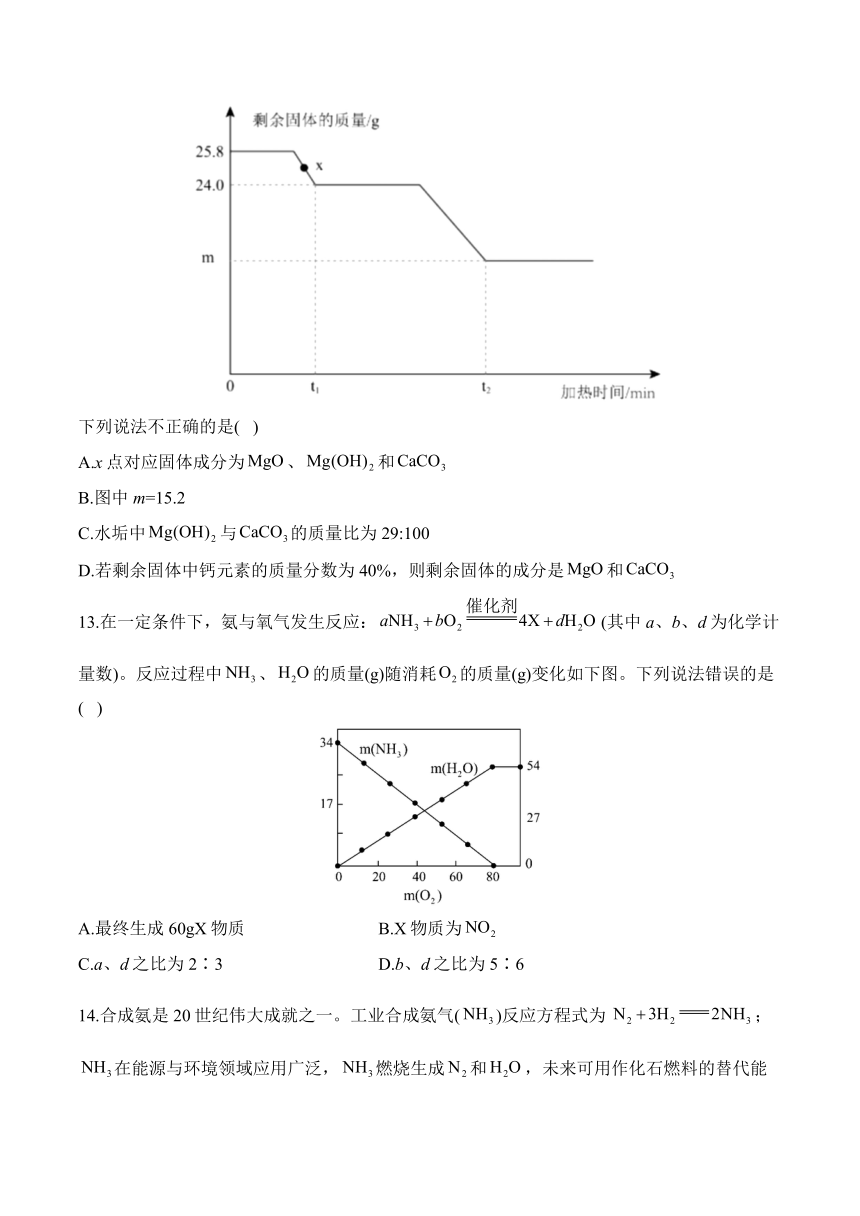
6.小明对于蜡烛燃烧过程进行了一系列的探究,下列说法正确的是( )
A.点燃蜡烛后,电子秤示数逐渐减小(如图所示),蜡烛减小的质量等于燃烧后生成物的总质量
B.在燃烧的蜡烛上方罩上干冷烧杯,看到有水雾生成,说明蜡烛中一定含有氢、氧两种元素
C.将大烧杯罩在燃烧蜡烛中,一会儿,蜡烛熄灭,说明蜡烛燃烧生成二氧化碳
D.已知蜡烛的主要成分燃烧的方程式是,则物质的化学式是
7.利用和在催化剂的作用下反应可得到合成气(和),是实现“双碳"经济的有效途径之一。催化剂表面同时发生积碳反应和清碳反应,原理如图1。当催化剂表面的积碳量变大,会影响催化剂与反应物接触而使反应减慢。其他条件相同时,积碳量与温度的关系如图2。下列说法错误的是( )
A.积碳反应的方程式为
B.消碳反应的产物是
C.500℃~600℃积碳量增加的原因是积碳反应产生的碳量高于消碳反应消耗的碳量
D.在催化剂作用下,和得到合成气的反应适宜在600℃时进行
8.含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )
A.该过程中化合价发生改变的元素为Fe、S、O
B.涉及的反应类型有化合反应和分解反应
C.图中涉及到的反应之一为
D.理论上,每消耗6.4t,需向体系中通入1.6t
9.镁与某金属的混合物共m g,在一定条件下与氧气充分反应,生成的氧化物共2m g。则该金属(括号内为生成的氧化物)可能是( )
A.Be(BeO) B.Cu(CuO) C.Al() D.Fe()
10.的燃烧反应在黑色固体M的作用下分两步进行,其原理如图所示。下列有关说法正确的是( )
A.物质M可能是
B.整个过程中只有氧元素的化合价发生改变
C.整体上,每消耗16g,需要提供32g
D.反应①中每消耗16g,需要消耗640gM
11.煅烧一段时间,冷却,称得剩余固体的质量为21.2 g,向剩余固体中加入足量的稀盐酸,充分反应,将所得溶液蒸干,得到33.3g ,下列说法不正确的是( )
A.m=30
B.剩余固体中、CaO的质量比为25:14
C.向剩余固体中加入稀盐酸时,会有气泡产生
D.煅烧前后的固体分别与足量稀盐酸反应,两者消耗HCl的质量相等
12.已知:,某水垢为、的混合物。某兴趣小组称取25.8g此水垢,加热,剩余固体的质量随加热时间的变化如图所示。
下列说法不正确的是( )
A.x点对应固体成分为、和
B.图中m=15.2
C.水垢中与的质量比为29:100
D.若剩余固体中钙元素的质量分数为40%,则剩余固体的成分是和
13.在一定条件下,氨与氧气发生反应:(其中a、b、d为化学计量数)。反应过程中、的质量(g)随消耗的质量(g)变化如下图。下列说法错误的是( )
A.最终生成60gX物质 B.X物质为
C.a、d之比为2∶3 D.b、d之比为5∶6
14.合成氨是20世纪伟大成就之一。工业合成氨气()反应方程式为 ;在能源与环境领域应用广泛,燃烧生成和,未来可用作化石燃料的替代能源;用合金催化氧化制,其反应的微观模型如图-1所示,反应过程中含氮生成物产率随反应温度的变化曲线如图-2所示。
下列说法正确的是( )
A.工业合成的反应类型为分解反应
B.燃烧的化学反应方程式为
C.制过程中,生产17kg,理论上需消耗2kg
D.作为燃料,比甲烷()更符合低碳理念
15.将20克和的混合气体通过足量灼热的粉末,充分反应后,气体的质量变为28克,则原混合气体中一氧化碳的质量分数为( )
A.30% B.50% C.40% D.70%
二、填空题(本题共3小题,每空1分,共15分)
16.阅读科普短文,回答下列问题。
甲醇()又称“木醇”,是一种易燃、有酒香味、无色透明的液体。
杭州亚运会开幕式主火炬采用了废碳再生的“绿色甲醇”作为燃料,具有安全高效、排放相对清洁的特点。甲醇可利用绿氢与从工业尾气中捕集的二氧化碳反应制得(如图一所示),实现了二氧化碳的减排和再生利用,也称为“零碳甲醇”。
工业上以将二氧化碳和氢气为原料制备甲醇,在一定条件下,该反应在有、无分子筛膜时甲醇的产率随温度变化的关系如图二所示。
(1)从碳排放的角度看,由化石能源(煤、石油、天然气)制得的氢气被称为“灰氢”,而如图一中制得的氢气被称为“绿氢”,原因是 。
(2)在一定条件下,以二氧化碳和氢气为原料制备甲醇,同时还生成了一种常见的液体物质,则反应的化学方程式为 。
(3)由图二可知,为提高甲醇的产率,合成甲醇应选择的最佳条件为 。
(4)开发和利用清洁高效的新能源,是21世纪人类面临的重要课题。请写出你知道的新能源__________。(写出一种即可)
17.生产生活中处处有化学,彰显化学魅力。
(1)成都市为了绿色大运,提倡将汽车改装,实现尾气无害化排放。其中尾气转化如图:
反应Ⅱ中的化学方程式为 ,两种生成物的质量比为 。
(2)“十四冬”主火炬塔圣火燃料是天然气。天然气是___________能源(填“可再生”或“不可再生”)。
(3)2024年3月25日,“海基二号”在珠江海域成功下水,凸显我国自主设计建造能力。
①“海基二号”用钢量相当于“鸟巢”。“百炼成钢”是炼钢的过程,其目的是 。
②造“海基二号”的钢管浸泡在海水中易被腐蚀,造成钢管腐蚀的物质有水、二氧化碳、
(填化学式)。
③生锈的钢管可以用盐酸除锈,但不能长时间浸泡的原因是 (用化学方程式表示)。
18.金属钛(Ti)是航空、军工电力等方面的必需材料,具有奇特的性能,被誉为“未来金属”,如图为以金红石(主要成分是)为原料制备金属钛的流程。
(1)金红石属于_________(选填“纯净物”或“混合物”)。
(2)电解槽中发生反应的化学方程式为 。
(3)氯化炉中会有尾气一氧化碳生成,写出一氧化碳的一种用途: 。
(4)还原炉中的反应条件是高温和氩气氛围,有关反应的化学方程式为。则X的化学式是_________,其中氩气的作用是 。
三、计算题(本题共3小题,每小题5分,共15分)
19.长期使用的热水锅炉会产生水垢。水垢主要成分是和。某兴趣小组为了测定水垢中的含量,将7.9g水垢粉碎放在烧杯中,然后向其中加入73g某浓度的稀盐酸,恰好反应(水垢中其他物质都不与稀盐酸反应),实验数据记录如下:
反应时间/min 0 1 2 3 4 5 6 7 8
烧杯内所盛物质的总质量/g 80.9 80.2 79.8 80.1 79.4 79.1 78.7 78.7 78.7
(1)表中有一数据是不合理的,该数据的测得时间是第________min;
(2)水垢中的质量分数。(列式计算,计算结果精确至0.1%,下同)
20.向100g溶液中滴加溶液,生成沉淀的质量与加入的溶液质量之间的关系如下图所示,请依据图中信息回答下列问题:
(1)该反应生成的沉淀的质量为_________g;
(2)求溶液中溶质的质量分数(根据化学方程式计算)。
21.现有一定质量的碳酸钠和氯化钠的固体混合物,其中含氯元素14.2g。向该混合物中加入138.1g一定溶质质量分数的稀盐酸,恰好完全反应,得到氯化钠溶液并生成4.4g气体。计算:
(1)原固体混合物中氯化钠的质量;
(2)反应后所得溶液中溶质的质量分数(结果保留至0.1%)。
答案以及解析
1.答案:B
解析:A、根据反应的化学方程式可知,该反应为一氧化氮和氧气在常温常压下反应生成二氧化氮,故A不符合题意;B、根据质量守恒定律,参加反应的的质量与参加反应的的质量之和等于生成的的质量,故B符合题意;C、根据反应的化学方程式可知,参加反应的和的分子个数比为2:1,故C不符合题意;D、该反应符合“多变一”的特点,属于化合反应,故D不符合题意。故选B。
2.答案:B
解析:A、反应前后原子的种类和个数不变,等号右边的个数分别为2、4、2、2,等号左边除2X外,的个数分别为2、0、2、0,则2X中含有4个氢原子和2个氧原子,则X的化学式为,该选项说法正确;B、相对分子质量的单位为“1”,而不是“g”,该选项说法不正确;C、结合方程式可知,生成氢气和氯气的质量比为(1×2):(35.5×2)=2:71,该选项说法正确;D、氢气燃烧只生成水,且热值高,是一种清洁的高能燃料,该选项说法正确。故选B。
3.答案:D
解析:A、脱硫过程反应消耗中间产物后该物质又反应生成,的量不变,其在流程中循环利用,因此不需要补充,故A说法错误;B、过程①是氧化铁和硫化氢反应生成硫化亚铁、硫和水,该反应中氢元素和氧元素的化合价不变,故B说法错误;C、反应②的化学方程式为:,故C说法错误;D、生成的段盖在表面会阻止反应的发生,影响脱硫效果,故D说法正确;故选:D。
4.答案:C
解析:A、氯化钠和硝酸钾不能反应,错误;B、胃液中含有的是盐酸不是硫酸,错误;C、正常雨水呈酸性是二氧化碳与水反应生成碳酸,正确;D、铁和氯化铜反应生成的是氯化亚铁不是氯化铜,错误;故选:C。
5.答案:D
解析:A、根据可知,反应前铁、钛、氧、碳、氯原子个数分别为2、2、6、6、14,反应后的生成物中铁、钛、氧、碳、氯原子个数分别为0、2、6、6、8,根据反应前后原子种类、数目不变,则,2X分子中含有2个铁原子和6个铁原子,则每个X分子由1个铁原子和3个氯原子构成,则物质X的化学式为,故选项说法错误。B、②中反应,即一氧化碳与氢气反应生成甲醇,反应的化学方程式为,为使原料全部转化为甲醇,理论上CO和投料的质量比为28:(2×2)=7:1,故选项说法错误。C、氩气的化学性质很不活泼,该反应在氩气(Ar)中进行的理由是防止Mg、Ti被氧化,故选项说法错误。D、①中有单质参加反应,生成了化合物,②中也有单质参加反应,生成了化合物,③中是置换反应,④中是熔融的氯化镁通电生成镁和氯气(两种单质),因此该制备过程中发生的四个反应均涉及到元素化合价改变,故选项说法正确。故选:D。
6.答案:D
7.答案:D
8.答案:B
9.答案:A
解析:假设m g金属全部是镁,则有:
生成氧化镁的质量为 ,生成的氧化物共,说明另一种金属与氧气反应生成氧化物的质量应该。通过计算,各生成对应氧化物的质量分别为,则。
10.答案:D
11.答案:B
解析:由质量守恒定律可知,碳酸钙中的钙元素全部转化到氯化钙中,则碳酸钙的质量为;剩余固体的质量为21.2 g,则生成的质量为30 g-21.2 g=8.8 g,设参加反应的碳酸钙的质量为x,生成氧化钙的质量为y,则有:
,
解得:x=20 g,y=11.2 g。
故剩余固体中、CaO的质量比为(30 g-20 g):11.2 g=25:28;由B可知,剩余固体为碳酸钙和氧化钙,加入稀盐酸,碳酸钙与稀盐酸反应生成了二氧化碳气体,会有气泡产生;根据质量守恒可知,氯化钙中的氯元素都来自盐酸,由于钙元素的质量都相等,因此两者消耗HCl的质量相等。
12.答案:D
解析:A、根据题意氢氧化镁加热分解生成氧化镁和水,碳酸钙高温分解生成氧化钙和二氧化碳,结合坐标图可知0-时刻是氢氧化镁加热分解生成氧化镁和水,-时刻是碳酸钙高温分解生成氧化钙和二氧化碳,所以x点部分氢氧化镁分解,碳酸钙未分解,即固体成分是、和,A正确,不符合题意;B、m点后固体质量不再减少,即水垢分解完全,0-时刻是氢氧化镁加热分解生成氧化镁和水,固体减少的质量=25.8g-24.0g=1.8g,即生成水的质量为1.8g,设氢氧化镁的质量为x,,,混合物中碳酸钙的质量=25.8g-5.8g=20.0g,设生成二氧化碳的质量为y,,,,反应完后剩余固体的质量=24g-8.8g=15.2g,B正确,不符合题意;C、根据上述分析水垢中与的质量比,C正确,不符合题意;D、根据质量守恒定律,化学反应前后元素质量不变,则剩余固体中钙元素的质量等于碳酸钙中钙元素的质量,钙元素质量=,若剩余固体中钙元素的质量分数为40%,则剩余固体的质量=,即氢氧化镁完全分解,碳酸钙部分分解,所以则剩余固体的成分是、和,D错误,不符合题意;故选D。
13.答案:B
解析:A、由图可知,参加反应的氨气的质量为34g,参加反应的氧气的质量为80g,生成水的质量为54g,由质量守恒定律可知,最终生成X物质的质量为34g+80g-54g=60g,选项正确;B、由A可知,反应中参加反应的氨气、氧气和生成的水的质量比=34g:80g:54g,则,,所以,,则反应的化学方程式为:,化学反应前后,各原子的数目保持不变,则X物质为,选项错误;C、由B可知,a、d之比=2:3,选项正确;D、由B可知,b、d之比=5:6,选项正确;故选B
14.答案:D
解析:A、工业合成氨气的反应为多种物质生成一种物质的反应,属于化合反应,该选项说法不正确;B、由图可知,氨气燃烧生成和,反应的化学方程式为:,该选项说法不正确;C、设理论上消耗氢气的质量为x,则,,解得x=3kg,该选项说法不正确;D、甲烷燃烧生成二氧化碳,则氨气比甲烷更符合低碳理念,该选项说法正确。故选D。
15.答案:D
解析:和混合气体通过足量灼热的氧化铜,与氧化铜发生反应生成铜和二氧化碳,而使气体质量增加;因此,利用充分反应后气体增加的量,根据反应的化学方程式可计算出参加反应的的质量;已知混合气体的总质量,进一步求得原混合气体中一氧化碳的质量分数。
设混合气体中的质量为x,
x=14g
则混合气体中一氧化碳的质量分数为:,
故选:D。
16.答案:(1)利用可再生能源发电,电解水制氢
(2)
(3)在有分子筛膜时,控温在210℃左右进行反应
(4)太阳能、风能、潮汐能等(合理即可)
解析:(1)图一中制得的氢气是利用可再生能源发电,电解水制得,制取过程中不产生碳排放,而由化石能源制得氢气时,化石能源含碳,制取过程会产生碳排放,所以图一中制得的氢气被称为“绿氢”;
(2)以二氧化碳和氢气为原料制备甲醇,同时生成一种常见液体物质,根据质量守恒定律,反应前后元素种类不变,可知该液体物质为水,二氧化碳和氢气在一定条件下反应生成甲醇和水,化学方程式为;
(3)由图二可知,有分子筛膜时甲醇产率高于无分子筛膜,且在210℃左右时,有分子筛膜的情况下甲醇产率最高。所以合成甲醇应选择的最佳条件为210℃、有分子筛膜;
(4)新能源是指在新技术基础上,可系统地开发利用的可再生能源或在地球尚未大规模利用的能源。常见的新能源有太阳能、风能、地热能、潮汐能等。
17.答案:(1);7:44
(2)不可再生
(3)除去生铁中多余的碳;;
解析:(1)由图知,反应Ⅱ是二氧化氮与一氧化碳在一定条件下反应生成氮气和二氧化碳,反应的化学方程式为:,故填:
由化学方程式知,两种生成氮气和二氧化碳的质量比为28:(44x4)=7:44,故填:7:44。
(2)天然气是不可再生能源,故填:不可再生。
(3)①炼钢的过程中,除去生铁中多余的碳,故填:除去生铁中多余的碳。②造“海基二号”的钢管浸泡在海水中易被腐蚀,造成钢管腐蚀的物质有水、二氧化碳、氯化钠,氯化钠化学式为,故填:。生锈的钢管可以用盐酸除锈,但不能长时间浸泡,因为铁与盐酸反应生成氯化亚铁和氢气,反应的化学方程式为:,故填:
。
18.答案:(1)混合物
(2)
(3)冶炼金属(合理即可)
(4);作保护气,防止镁、钛在高温的条件下被氧化
解析:(1)金红石的主要成分是,其中还含有其他物质,所以金红石属于混合物;故填:混合物;
(2)氯化镁在通电的条件下分解为镁和氯气,化学方程式为:;故填:;
(3)一氧化碳具有可燃性,所以可用作燃料;一氧化碳具有还原性,所以可用于冶炼金属;故填:冶炼金属(合理即可);
(4)由质量守恒定律可知,化学反应前后,原子的种类与数目不变。由化学方程式可知,反应前有:2个镁原子、1个钛原子和4个氯原子;反应后有:1个钛原子,所以2X中含有2个镁原子和4个氯原子,即X的化学式为;氩气是一种稀有气体,化学性质很稳定,该反应在(Ar)氛围中进行的理由是:氩气作保护气,防止镁、钛在高温的条件下被氧化。故填:;作保护气,防止镁、钛在高温的条件下被氧化。
19.答案:(1)3
(2)63.3%
解析:(1)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,生成的二氧化碳逸出,所以烧杯内所盛物质的总质量不断减少,而第三组是突然增大,所以第三组数据即第3min数据不合理;
(2)根据质量守恒定律,则生成二氧化碳的质量为80.9g-78.7g=2.2g,设水垢中碳酸钙的质量为x,与碳酸钙反应的盐酸中溶质的质量为y。
则水垢中碳酸钙的质量分数为:
答:水垢中的质量分数为63.3%。
20.答案:(1)4.9
(2)8%
解析:(1)由图中数据可知,生成质量为4.9g;
(2)解:设溶液中溶质的质量分数为x
x=8%
答:溶液中溶质的质量分数为8%。
21.答案:(1)23.4g
(2)20.9%
解析:(1)解:原固体混合物中氯化钠的质量为
答:原固体混合物中氯化钠的质量为23.4g。
(2)解:设参加反应的碳酸钠的质量为x,反应生成的氯化钠的质量为y。
x=10.6g
y=11.7g
所得溶液中溶质的质量分数为
答:所得溶液中溶质的质量分数为20.9%。
(试卷满分:60分;考试时间:60分钟)
可能用到的相对原子质量:H-1 Be-9 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32
Cl-35.5 Ca-40 Fe-56 Cu-64
一、选择题(本大题共15小题,每题2分,共30分)
1.下列关于,的说法不正确的是( )
A.表示一氧化氮和氧气在常温常压下反应生成二氧化氮
B.参加反应的的质量等于生成的的质量
C.参加反应的和的分子个数比为2:1
D.该反应属于化合反应
2.海洋资源的综合利用是解决人类社会资源短缺的重要途径之一、工业上电解饱和食盐水时发生如下反应:。关于这一反应,下列说法不正确的是( )
A.X的化学式是
B.氢氧化钠的相对分子质量为40g
C.生成氢气和氯气的质量比为2:71
D.反应生成的氢气是一种清洁的高能燃料
3.工业脱硫的一种原理如图所示。下列叙述正确的是( )
A.脱硫过程需及时补充
B.反应①中所有元素的化合价均发生改变
C.反应②的化学方程式为:
D.生成的覆盖在表面会影响脱硫效果
4.下列化学方程式符合题意且书写正确的是( )
A.氯化钠溶液中加入硝酸钾∶
B.医疗上用氢氧化铝中和过多胃酸∶
C.正常雨水也显弱酸性的主要原因∶
D.证明铁的活动性比铜强∶
5.金属(Ti)硬度大、熔点高、耐腐蚀,被誉为“未来的金属”。钛酸亚铁()经过一系列反应制备钛和甲醇()主要生成过程如图。下列说法正确的是( )
A.①中发生反应的化学方程式为,则X为
B.为使②中原料全部转化为甲醇,理论上CO和投料的质量比为14:1
C.冶炼③中的反应在氩气中进行的理由是氢气化学性质稳定,防止Mg、Ti被还原
D.该制备过程中发生的四个反应均涉及到元素化合价改变
6.小明对于蜡烛燃烧过程进行了一系列的探究,下列说法正确的是( )
A.点燃蜡烛后,电子秤示数逐渐减小(如图所示),蜡烛减小的质量等于燃烧后生成物的总质量
B.在燃烧的蜡烛上方罩上干冷烧杯,看到有水雾生成,说明蜡烛中一定含有氢、氧两种元素
C.将大烧杯罩在燃烧蜡烛中,一会儿,蜡烛熄灭,说明蜡烛燃烧生成二氧化碳
D.已知蜡烛的主要成分燃烧的方程式是,则物质的化学式是
7.利用和在催化剂的作用下反应可得到合成气(和),是实现“双碳"经济的有效途径之一。催化剂表面同时发生积碳反应和清碳反应,原理如图1。当催化剂表面的积碳量变大,会影响催化剂与反应物接触而使反应减慢。其他条件相同时,积碳量与温度的关系如图2。下列说法错误的是( )
A.积碳反应的方程式为
B.消碳反应的产物是
C.500℃~600℃积碳量增加的原因是积碳反应产生的碳量高于消碳反应消耗的碳量
D.在催化剂作用下,和得到合成气的反应适宜在600℃时进行
8.含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )
A.该过程中化合价发生改变的元素为Fe、S、O
B.涉及的反应类型有化合反应和分解反应
C.图中涉及到的反应之一为
D.理论上,每消耗6.4t,需向体系中通入1.6t
9.镁与某金属的混合物共m g,在一定条件下与氧气充分反应,生成的氧化物共2m g。则该金属(括号内为生成的氧化物)可能是( )
A.Be(BeO) B.Cu(CuO) C.Al() D.Fe()
10.的燃烧反应在黑色固体M的作用下分两步进行,其原理如图所示。下列有关说法正确的是( )
A.物质M可能是
B.整个过程中只有氧元素的化合价发生改变
C.整体上,每消耗16g,需要提供32g
D.反应①中每消耗16g,需要消耗640gM
11.煅烧一段时间,冷却,称得剩余固体的质量为21.2 g,向剩余固体中加入足量的稀盐酸,充分反应,将所得溶液蒸干,得到33.3g ,下列说法不正确的是( )
A.m=30
B.剩余固体中、CaO的质量比为25:14
C.向剩余固体中加入稀盐酸时,会有气泡产生
D.煅烧前后的固体分别与足量稀盐酸反应,两者消耗HCl的质量相等
12.已知:,某水垢为、的混合物。某兴趣小组称取25.8g此水垢,加热,剩余固体的质量随加热时间的变化如图所示。
下列说法不正确的是( )
A.x点对应固体成分为、和
B.图中m=15.2
C.水垢中与的质量比为29:100
D.若剩余固体中钙元素的质量分数为40%,则剩余固体的成分是和
13.在一定条件下,氨与氧气发生反应:(其中a、b、d为化学计量数)。反应过程中、的质量(g)随消耗的质量(g)变化如下图。下列说法错误的是( )
A.最终生成60gX物质 B.X物质为
C.a、d之比为2∶3 D.b、d之比为5∶6
14.合成氨是20世纪伟大成就之一。工业合成氨气()反应方程式为 ;在能源与环境领域应用广泛,燃烧生成和,未来可用作化石燃料的替代能源;用合金催化氧化制,其反应的微观模型如图-1所示,反应过程中含氮生成物产率随反应温度的变化曲线如图-2所示。
下列说法正确的是( )
A.工业合成的反应类型为分解反应
B.燃烧的化学反应方程式为
C.制过程中,生产17kg,理论上需消耗2kg
D.作为燃料,比甲烷()更符合低碳理念
15.将20克和的混合气体通过足量灼热的粉末,充分反应后,气体的质量变为28克,则原混合气体中一氧化碳的质量分数为( )
A.30% B.50% C.40% D.70%
二、填空题(本题共3小题,每空1分,共15分)
16.阅读科普短文,回答下列问题。
甲醇()又称“木醇”,是一种易燃、有酒香味、无色透明的液体。
杭州亚运会开幕式主火炬采用了废碳再生的“绿色甲醇”作为燃料,具有安全高效、排放相对清洁的特点。甲醇可利用绿氢与从工业尾气中捕集的二氧化碳反应制得(如图一所示),实现了二氧化碳的减排和再生利用,也称为“零碳甲醇”。
工业上以将二氧化碳和氢气为原料制备甲醇,在一定条件下,该反应在有、无分子筛膜时甲醇的产率随温度变化的关系如图二所示。
(1)从碳排放的角度看,由化石能源(煤、石油、天然气)制得的氢气被称为“灰氢”,而如图一中制得的氢气被称为“绿氢”,原因是 。
(2)在一定条件下,以二氧化碳和氢气为原料制备甲醇,同时还生成了一种常见的液体物质,则反应的化学方程式为 。
(3)由图二可知,为提高甲醇的产率,合成甲醇应选择的最佳条件为 。
(4)开发和利用清洁高效的新能源,是21世纪人类面临的重要课题。请写出你知道的新能源__________。(写出一种即可)
17.生产生活中处处有化学,彰显化学魅力。
(1)成都市为了绿色大运,提倡将汽车改装,实现尾气无害化排放。其中尾气转化如图:
反应Ⅱ中的化学方程式为 ,两种生成物的质量比为 。
(2)“十四冬”主火炬塔圣火燃料是天然气。天然气是___________能源(填“可再生”或“不可再生”)。
(3)2024年3月25日,“海基二号”在珠江海域成功下水,凸显我国自主设计建造能力。
①“海基二号”用钢量相当于“鸟巢”。“百炼成钢”是炼钢的过程,其目的是 。
②造“海基二号”的钢管浸泡在海水中易被腐蚀,造成钢管腐蚀的物质有水、二氧化碳、
(填化学式)。
③生锈的钢管可以用盐酸除锈,但不能长时间浸泡的原因是 (用化学方程式表示)。
18.金属钛(Ti)是航空、军工电力等方面的必需材料,具有奇特的性能,被誉为“未来金属”,如图为以金红石(主要成分是)为原料制备金属钛的流程。
(1)金红石属于_________(选填“纯净物”或“混合物”)。
(2)电解槽中发生反应的化学方程式为 。
(3)氯化炉中会有尾气一氧化碳生成,写出一氧化碳的一种用途: 。
(4)还原炉中的反应条件是高温和氩气氛围,有关反应的化学方程式为。则X的化学式是_________,其中氩气的作用是 。
三、计算题(本题共3小题,每小题5分,共15分)
19.长期使用的热水锅炉会产生水垢。水垢主要成分是和。某兴趣小组为了测定水垢中的含量,将7.9g水垢粉碎放在烧杯中,然后向其中加入73g某浓度的稀盐酸,恰好反应(水垢中其他物质都不与稀盐酸反应),实验数据记录如下:
反应时间/min 0 1 2 3 4 5 6 7 8
烧杯内所盛物质的总质量/g 80.9 80.2 79.8 80.1 79.4 79.1 78.7 78.7 78.7
(1)表中有一数据是不合理的,该数据的测得时间是第________min;
(2)水垢中的质量分数。(列式计算,计算结果精确至0.1%,下同)
20.向100g溶液中滴加溶液,生成沉淀的质量与加入的溶液质量之间的关系如下图所示,请依据图中信息回答下列问题:
(1)该反应生成的沉淀的质量为_________g;
(2)求溶液中溶质的质量分数(根据化学方程式计算)。
21.现有一定质量的碳酸钠和氯化钠的固体混合物,其中含氯元素14.2g。向该混合物中加入138.1g一定溶质质量分数的稀盐酸,恰好完全反应,得到氯化钠溶液并生成4.4g气体。计算:
(1)原固体混合物中氯化钠的质量;
(2)反应后所得溶液中溶质的质量分数(结果保留至0.1%)。
答案以及解析
1.答案:B
解析:A、根据反应的化学方程式可知,该反应为一氧化氮和氧气在常温常压下反应生成二氧化氮,故A不符合题意;B、根据质量守恒定律,参加反应的的质量与参加反应的的质量之和等于生成的的质量,故B符合题意;C、根据反应的化学方程式可知,参加反应的和的分子个数比为2:1,故C不符合题意;D、该反应符合“多变一”的特点,属于化合反应,故D不符合题意。故选B。
2.答案:B
解析:A、反应前后原子的种类和个数不变,等号右边的个数分别为2、4、2、2,等号左边除2X外,的个数分别为2、0、2、0,则2X中含有4个氢原子和2个氧原子,则X的化学式为,该选项说法正确;B、相对分子质量的单位为“1”,而不是“g”,该选项说法不正确;C、结合方程式可知,生成氢气和氯气的质量比为(1×2):(35.5×2)=2:71,该选项说法正确;D、氢气燃烧只生成水,且热值高,是一种清洁的高能燃料,该选项说法正确。故选B。
3.答案:D
解析:A、脱硫过程反应消耗中间产物后该物质又反应生成,的量不变,其在流程中循环利用,因此不需要补充,故A说法错误;B、过程①是氧化铁和硫化氢反应生成硫化亚铁、硫和水,该反应中氢元素和氧元素的化合价不变,故B说法错误;C、反应②的化学方程式为:,故C说法错误;D、生成的段盖在表面会阻止反应的发生,影响脱硫效果,故D说法正确;故选:D。
4.答案:C
解析:A、氯化钠和硝酸钾不能反应,错误;B、胃液中含有的是盐酸不是硫酸,错误;C、正常雨水呈酸性是二氧化碳与水反应生成碳酸,正确;D、铁和氯化铜反应生成的是氯化亚铁不是氯化铜,错误;故选:C。
5.答案:D
解析:A、根据可知,反应前铁、钛、氧、碳、氯原子个数分别为2、2、6、6、14,反应后的生成物中铁、钛、氧、碳、氯原子个数分别为0、2、6、6、8,根据反应前后原子种类、数目不变,则,2X分子中含有2个铁原子和6个铁原子,则每个X分子由1个铁原子和3个氯原子构成,则物质X的化学式为,故选项说法错误。B、②中反应,即一氧化碳与氢气反应生成甲醇,反应的化学方程式为,为使原料全部转化为甲醇,理论上CO和投料的质量比为28:(2×2)=7:1,故选项说法错误。C、氩气的化学性质很不活泼,该反应在氩气(Ar)中进行的理由是防止Mg、Ti被氧化,故选项说法错误。D、①中有单质参加反应,生成了化合物,②中也有单质参加反应,生成了化合物,③中是置换反应,④中是熔融的氯化镁通电生成镁和氯气(两种单质),因此该制备过程中发生的四个反应均涉及到元素化合价改变,故选项说法正确。故选:D。
6.答案:D
7.答案:D
8.答案:B
9.答案:A
解析:假设m g金属全部是镁,则有:
生成氧化镁的质量为 ,生成的氧化物共,说明另一种金属与氧气反应生成氧化物的质量应该。通过计算,各生成对应氧化物的质量分别为,则。
10.答案:D
11.答案:B
解析:由质量守恒定律可知,碳酸钙中的钙元素全部转化到氯化钙中,则碳酸钙的质量为;剩余固体的质量为21.2 g,则生成的质量为30 g-21.2 g=8.8 g,设参加反应的碳酸钙的质量为x,生成氧化钙的质量为y,则有:
,
解得:x=20 g,y=11.2 g。
故剩余固体中、CaO的质量比为(30 g-20 g):11.2 g=25:28;由B可知,剩余固体为碳酸钙和氧化钙,加入稀盐酸,碳酸钙与稀盐酸反应生成了二氧化碳气体,会有气泡产生;根据质量守恒可知,氯化钙中的氯元素都来自盐酸,由于钙元素的质量都相等,因此两者消耗HCl的质量相等。
12.答案:D
解析:A、根据题意氢氧化镁加热分解生成氧化镁和水,碳酸钙高温分解生成氧化钙和二氧化碳,结合坐标图可知0-时刻是氢氧化镁加热分解生成氧化镁和水,-时刻是碳酸钙高温分解生成氧化钙和二氧化碳,所以x点部分氢氧化镁分解,碳酸钙未分解,即固体成分是、和,A正确,不符合题意;B、m点后固体质量不再减少,即水垢分解完全,0-时刻是氢氧化镁加热分解生成氧化镁和水,固体减少的质量=25.8g-24.0g=1.8g,即生成水的质量为1.8g,设氢氧化镁的质量为x,,,混合物中碳酸钙的质量=25.8g-5.8g=20.0g,设生成二氧化碳的质量为y,,,,反应完后剩余固体的质量=24g-8.8g=15.2g,B正确,不符合题意;C、根据上述分析水垢中与的质量比,C正确,不符合题意;D、根据质量守恒定律,化学反应前后元素质量不变,则剩余固体中钙元素的质量等于碳酸钙中钙元素的质量,钙元素质量=,若剩余固体中钙元素的质量分数为40%,则剩余固体的质量=,即氢氧化镁完全分解,碳酸钙部分分解,所以则剩余固体的成分是、和,D错误,不符合题意;故选D。
13.答案:B
解析:A、由图可知,参加反应的氨气的质量为34g,参加反应的氧气的质量为80g,生成水的质量为54g,由质量守恒定律可知,最终生成X物质的质量为34g+80g-54g=60g,选项正确;B、由A可知,反应中参加反应的氨气、氧气和生成的水的质量比=34g:80g:54g,则,,所以,,则反应的化学方程式为:,化学反应前后,各原子的数目保持不变,则X物质为,选项错误;C、由B可知,a、d之比=2:3,选项正确;D、由B可知,b、d之比=5:6,选项正确;故选B
14.答案:D
解析:A、工业合成氨气的反应为多种物质生成一种物质的反应,属于化合反应,该选项说法不正确;B、由图可知,氨气燃烧生成和,反应的化学方程式为:,该选项说法不正确;C、设理论上消耗氢气的质量为x,则,,解得x=3kg,该选项说法不正确;D、甲烷燃烧生成二氧化碳,则氨气比甲烷更符合低碳理念,该选项说法正确。故选D。
15.答案:D
解析:和混合气体通过足量灼热的氧化铜,与氧化铜发生反应生成铜和二氧化碳,而使气体质量增加;因此,利用充分反应后气体增加的量,根据反应的化学方程式可计算出参加反应的的质量;已知混合气体的总质量,进一步求得原混合气体中一氧化碳的质量分数。
设混合气体中的质量为x,
x=14g
则混合气体中一氧化碳的质量分数为:,
故选:D。
16.答案:(1)利用可再生能源发电,电解水制氢
(2)
(3)在有分子筛膜时,控温在210℃左右进行反应
(4)太阳能、风能、潮汐能等(合理即可)
解析:(1)图一中制得的氢气是利用可再生能源发电,电解水制得,制取过程中不产生碳排放,而由化石能源制得氢气时,化石能源含碳,制取过程会产生碳排放,所以图一中制得的氢气被称为“绿氢”;
(2)以二氧化碳和氢气为原料制备甲醇,同时生成一种常见液体物质,根据质量守恒定律,反应前后元素种类不变,可知该液体物质为水,二氧化碳和氢气在一定条件下反应生成甲醇和水,化学方程式为;
(3)由图二可知,有分子筛膜时甲醇产率高于无分子筛膜,且在210℃左右时,有分子筛膜的情况下甲醇产率最高。所以合成甲醇应选择的最佳条件为210℃、有分子筛膜;
(4)新能源是指在新技术基础上,可系统地开发利用的可再生能源或在地球尚未大规模利用的能源。常见的新能源有太阳能、风能、地热能、潮汐能等。
17.答案:(1);7:44
(2)不可再生
(3)除去生铁中多余的碳;;
解析:(1)由图知,反应Ⅱ是二氧化氮与一氧化碳在一定条件下反应生成氮气和二氧化碳,反应的化学方程式为:,故填:
由化学方程式知,两种生成氮气和二氧化碳的质量比为28:(44x4)=7:44,故填:7:44。
(2)天然气是不可再生能源,故填:不可再生。
(3)①炼钢的过程中,除去生铁中多余的碳,故填:除去生铁中多余的碳。②造“海基二号”的钢管浸泡在海水中易被腐蚀,造成钢管腐蚀的物质有水、二氧化碳、氯化钠,氯化钠化学式为,故填:。生锈的钢管可以用盐酸除锈,但不能长时间浸泡,因为铁与盐酸反应生成氯化亚铁和氢气,反应的化学方程式为:,故填:
。
18.答案:(1)混合物
(2)
(3)冶炼金属(合理即可)
(4);作保护气,防止镁、钛在高温的条件下被氧化
解析:(1)金红石的主要成分是,其中还含有其他物质,所以金红石属于混合物;故填:混合物;
(2)氯化镁在通电的条件下分解为镁和氯气,化学方程式为:;故填:;
(3)一氧化碳具有可燃性,所以可用作燃料;一氧化碳具有还原性,所以可用于冶炼金属;故填:冶炼金属(合理即可);
(4)由质量守恒定律可知,化学反应前后,原子的种类与数目不变。由化学方程式可知,反应前有:2个镁原子、1个钛原子和4个氯原子;反应后有:1个钛原子,所以2X中含有2个镁原子和4个氯原子,即X的化学式为;氩气是一种稀有气体,化学性质很稳定,该反应在(Ar)氛围中进行的理由是:氩气作保护气,防止镁、钛在高温的条件下被氧化。故填:;作保护气,防止镁、钛在高温的条件下被氧化。
19.答案:(1)3
(2)63.3%
解析:(1)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,生成的二氧化碳逸出,所以烧杯内所盛物质的总质量不断减少,而第三组是突然增大,所以第三组数据即第3min数据不合理;
(2)根据质量守恒定律,则生成二氧化碳的质量为80.9g-78.7g=2.2g,设水垢中碳酸钙的质量为x,与碳酸钙反应的盐酸中溶质的质量为y。
则水垢中碳酸钙的质量分数为:
答:水垢中的质量分数为63.3%。
20.答案:(1)4.9
(2)8%
解析:(1)由图中数据可知,生成质量为4.9g;
(2)解:设溶液中溶质的质量分数为x
x=8%
答:溶液中溶质的质量分数为8%。
21.答案:(1)23.4g
(2)20.9%
解析:(1)解:原固体混合物中氯化钠的质量为
答:原固体混合物中氯化钠的质量为23.4g。
(2)解:设参加反应的碳酸钠的质量为x,反应生成的氯化钠的质量为y。
x=10.6g
y=11.7g
所得溶液中溶质的质量分数为
答:所得溶液中溶质的质量分数为20.9%。
同课章节目录
