专题五 金属与金属矿物(含答案)2025年中考一轮复习收官测试卷
文档属性
| 名称 | 专题五 金属与金属矿物(含答案)2025年中考一轮复习收官测试卷 |  | |
| 格式 | docx | ||
| 文件大小 | 610.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-20 23:21:24 | ||
图片预览



文档简介
专题五 金属与金属矿物——中考一轮复习收官测试卷
(试卷满分:60分;考试时间:60分钟)
可能用到的相对原子质量:Fe-56 Cu-64
一、选择题(本大题共10小题,每题2分,共20分)
1.人类文明进步与金属材料发展关系十分密切。下列有关金属材料的说法中,正确的是( )
A.金属在常温下都是固体
B.大多数金属元素在自然界中以单质的形式存在
C.金属材料包括金属和合金,生活中广泛使用的是合金
D.铝制品不易被锈蚀是因为铝不与氧气反应
2.《天工开物》被誉为“中国17世纪的工艺百科全书”,其中蕴含了大量的化学知识。下列理解错误的是( )
A.“煤饼烧石成灰”——石灰石经煅烧变成生石灰
B.“凡金性又柔,可屈折如枝柳”——金的硬度比较小
C.“火燃釜底,滚沸延及成盐”——加热蒸发溶剂析出食盐晶体
D.“烧铁器淬于胆矾水中,即成铜色也”——铁浸入铜盐溶液,表面生成红色铁锈
3.铝、铁、铜都是生活中常见的金属,下列有关叙述正确的是( )
A.铝比铁耐腐蚀,因为铝的化学性质比铁更稳定
B.三种金属都能与稀硫酸(或稀盐酸)反应
C.钢的含碳量比生铁高,因此应用更加广泛
D.黄铜比纯铜更适合用于制作耐磨齿轮
4.向盛有一定量氧化铁粉末的烧杯中不断加入稀盐酸,烧杯中相关量的变化与图像相符的是( )
A. B.C.D.
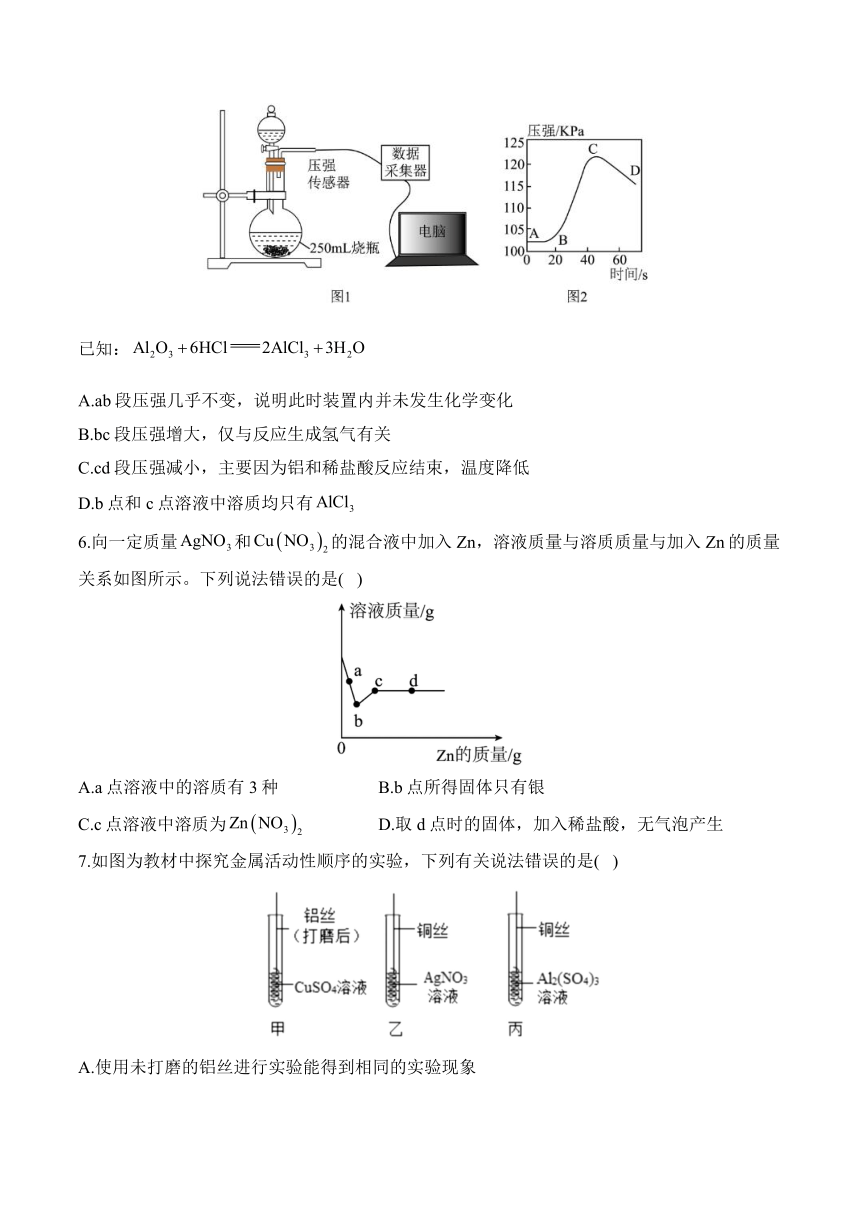
5.将未打磨的铝片和稀盐酸放入图-1所示的装置中(装置气密性良好),用压强传感器测定反应过程中烧瓶内的气体压强变化。结果如图-2所示。下列说法正确的是( )
已知:
A.ab段压强几乎不变,说明此时装置内并未发生化学变化
B.bc段压强增大,仅与反应生成氢气有关
C.cd段压强减小,主要因为铝和稀盐酸反应结束,温度降低
D.b点和c点溶液中溶质均只有
6.向一定质量和的混合液中加入Zn,溶液质量与溶质质量与加入Zn的质量关系如图所示。下列说法错误的是( )
A.a点溶液中的溶质有3种 B.b点所得固体只有银
C.c点溶液中溶质为 D.取d点时的固体,加入稀盐酸,无气泡产生
7.如图为教材中探究金属活动性顺序的实验,下列有关说法错误的是( )
A.使用未打磨的铝丝进行实验能得到相同的实验现象
B.省略丙实验也能比较、、三种金属的活动性
C.甲实验中溶液颜色逐渐变浅至无色
D.实验结束后,乙中溶液的质量减小
8.下列关于钢铁及其制品的说法,错误的是( )
A.含有某些金属和碳元素的铁合金,其性能比纯铁更优良
B.高炉中炼铁的主要反应可表示为
C.其他金属单质与铁一样,都能与盐酸反应得到氢气
D.家用菜刀经洗净擦干后可防止生锈
9.通过一氧化碳还原氧化铜可以得到铜,利用原位X射线粉末衍射仪来测定不同温度下反应后的固体物质成分,(不同晶态物质出现衍射峰的衍射角不同)实验结果如图所示。由图象信息可知,以下说法错误的是( )
A.加热到500℃以上,观察到有红色固体生成
B.200℃-300℃,发生的主要反应为
C.500℃以下得到的铜不纯净
D.化学反应控制条件很重要,同种反应物在不同条件下可能得到不同产物
10.将两张相同的铁丝网置于两个相同大小的锥形瓶中,分别倒入等体积的蒸馏水和食盐水,立即旋紧橡皮塞,将导管伸入滴有红墨水的水中。一段时间后,观察到烧杯中的导管内液面上升,且右侧导管内液面上升幅度较大,锥形瓶b中的铁丝网比a中的铁丝网锈蚀更严重。下列相关说法不正确的是( )
A.烧杯中的导管内液面上升是因为锥形瓶内气体被消耗
B.通过本实验说明食盐能加快铁锈蚀
C.仅通过本实验就能证明铁锈蚀需要与水接触
D.铁的锈蚀原理可用于测定空气中氧气的体积分数
二、填空题(本题共6小题,每空1分,共23分)
11.金属材料在人类文明的发展中起着重要作用,回答下列问题。
(1)唐代《太清丹经要诀》中记载了制取“彩色金”的方法:将雄黄()和锡粉(Sn)混合,“密固,入风炉吹之,……其色似金”。“彩色金”中______(填“含”或“不含”)金元素。
(2)北宋沈括在《梦溪笔谈》中提及“古人以剂钢为刃,柔铁为茎干,不尔则多断折”,其中剂钢就是铁的合金,相较于铁,剂钢的特点是___________(答一点)。
(3)明朝宋应星编写的《天工开物》中写道:“每红铜六斤,入倭铅四斤,先后入罐熔化,冷定取出,即成黄铜”,由此可知黄铜的熔点比“红铜”____________(填“高”或“低”)。
12.金属材料在生产、生活和化学实验中有着广泛的应用。
(1)金属镁是一种常用的实验用品。小明同学在实验室中取一段镁条,在空气中点燃,现象是 ,反应的化学方程式为 。
(2)实验室现有锌片和铜片,小明同学要验证锌、铜的金属活动性强弱,现提供下列试剂:①KCl溶液、②溶液、③稀盐酸,不能达到实验目的的是_____(填序号);所选试剂能达到实验目的,发生反应的化学方程式为 。
(3)银具有优良的导电性,被广泛用于电子制造业。工业上一般采用加热氧化银使其分解为银和氧气的方法制取银,该反应的化学方程式为 。
13.某火龙表演是国家级非物质文化遗产。其中的“打铁花”是先将生铁熔化成铁水,再用工具将铁水向空中用力抛出,形成“火树银花落,万点星辰开”的精彩场景。
(1)生铁的含碳量_______(填“<”“>”或“=”)钢的含碳量。工业上可用赤铁矿与CO在高温下反应来冶炼生铁,该反应主要利用了CO的_______(填字母)。
A.可燃性 B.还原性 C.密度比空气小
(2)铁花冷却后得到黑色固体,写出生成该固体的化学方程式: 。
(3)表演时可备细沙以防止火灾。细沙可阻止可燃物与______接触从而达到灭火的目的。
14.金属材料与生活和社会发展的关系非常密切。
(1)自行车的链条表面常涂油来防止生锈,此处应用的原理是什么?
(2)在、和的混合溶液中加入一定质量的锌粉,充分反应后过滤,向滤液中滴加稀盐酸,无明显现象。
①请写出一定发生了的反应的化学方程式 。
②向滤渣中滴加稀硫酸,有气泡产生,则固体中一定含有哪些物质_________?
15.金属材料对于改善人类生活,促进生产发展发挥着重要作用。
(1)家庭生活中常用铁锅炒菜,主要利用了铁的_______性。铁在空气中容易生锈,造成大量的资源浪费。某兴趣小组对铁生锈的原因进行了实验探究,能够说明铁生锈需要有水参与的实验现象是 。
(2)铝制品耐腐蚀是因其表面有致密的氧化铝薄膜,该反应的化学方程式为____________。
16.我国有着悠久的钢铁冶炼史,《天工开物》中记载的“炒钢法”如图1所示,该方法的生产过程可用图2表示。
资料:①潮泥灰的主要成分是石灰石;②铁的熔点是1535 ℃。根据图文回答下列问题。
(1)常见的铁矿石有赤铁矿和____________(写一种)。
(2)不断鼓入空气的目的是 。
(3)炼铁炉中生成铁的化学方程式为 。
(4)撒入潮泥灰的主要作用是 。不断翻炒液态生铁,是为了降低____元素的含量。
(5)钢的性能优良,如钢的熔点比纯铁的_________,易于加工。
三、实验题(本题共2小题,每空1分,共12分)
17.镉是镍镉电池的重要材料,工业上从铜镉渣(主要含有镉、锌、铜等单质)中分离回收镉的流程如图,回答下列问题。
【查阅资料】镉在其化合物中常显+2价。
(1)步骤①中加入过量稀盐酸的目的是 ,过滤后所得滤液中溶质成分为 。
(2)步骤②中发生反应的化学方程式为 (任写一个)。
(3)根据上述流程,请你推测Cu、Cd、Zn三种金属的活动性顺序为 ;除了上述流程外,下列试剂组还能验证Cu、Cd、Zn三种金属的活动性顺序的是____(填字母)。
A.Cu、Cd、溶液
B.Zn、Cd、溶液
C.Zn、Cu、溶液
18.某同学发现自己眼镜框中铜制部位表面有绿色的铜锈,他联想到探究铁生锈条件的实验,决定采用控制变量法探究铜生锈的原因,请你一起探究。
【提出问题】铜生锈的原因是什么?
【查阅资料】铜锈的主要成分是,俗称铜绿。
【猜想与假设】根据查阅的资料猜测:铜生锈是铜与空气中的氧气、水和二氧化碳共同作用的结果,理由是____________________。
【设计与实验】他仿照探究铁生锈条件的实验,设计并进行了如下所示的四个实验(说明:实验中用到的蒸馏水均已煮沸过且铜片已打磨干净)。
一、铜片不生锈
二、铜片不生锈
三、铜片生锈
四、铜片不生锈
在上述实验四中,控制的因素是 ,制取氧气的方法与加热高锰酸钾制取氧气的方法相比具有的优点是 (写一条)。铜生成铜绿的化学方程式为 。
【实验结论】他的猜想正确。
【反思与提高】
(1)生活中你会发现厨房中的铁锅与水接触的部分最容易生锈,切开的苹果不久后变成咖啡色,好像生了“锈”。这些物质“生锈”除了与水有关外,都与_________(填物质名称)有关。
(2)请你提出一条延长食品保质期的建议:__________________。
(3)要除去眼镜框表面的铜绿,应选用的药品是_________(写一种)。
四、计算题(本题共1小题,共5分)
19.《抱朴子内屏。黄白》记载了铜的冶炼方法:以曾青涂铁,铁赤色如铜。其“曾青”为硫酸铜溶液。
(1)此反应的实验现象为 。
(2)现有28g含为80%的铁粉,理论上可以炼出铜的质量是多少(写出计算过程)?
答案以及解析
1.答案:C
解析:A、常温下,不是所有金属都是固体,如常温下汞是液体,故A不正确;B、在自然界中只有少数的金属以单质形式存在,大部分都是以化合物形式存在的,故B不正确;C、金属材料包括金属和合金,因合金具有很多优点,如耐腐蚀、强度大等,所以日常使用的金属材料大多数是合金,故C正确;D、铝与氧气反应生成致密的氧化铝薄膜,阻止铝与氧气反应,所以铝制品不易被锈蚀,故D不正确;故选:C。
2.答案:D
解析:A、石灰石经煅烧变成生石灰,石灰石的主要成分是碳酸钙,高温下分解生成氧化钙和二氧化碳,故选项说法正确。B、凡金性又柔,可屈折如枝柳,说明金的硬度比较小,故选项说法正确。C、火燃釜底,滚沸延及成盐,指的是卤水滚沸逐渐结盐,即加热蒸发溶剂析出食盐晶体,故选项说法正确。D、烧铁器淬于胆矾水中,即成铜色也,铁浸入铜盐溶液,铁和硫酸铜反应生成硫酸亚铁和铜,故选项说法错误。故选:D。
3.答案:D
解析:A、铝比铁耐腐蚀,因为铝的表面有一层氧化物保护膜,故A选项说法错误;B、三种金属中铜不能与稀硫酸(或稀盐酸)反应,故B选项说法错误;C、钢的含碳量比生铁低,因此应用更加广泛,故C选项说法错误;D、黄铜比纯铜硬度大,更适合用于制作耐磨齿轮,故D选项说法正确。故选D。
4.答案:A
解析:氧化铁与稀盐酸反应产生氯化铁和水,加入稀盐酸后得到溶液,溶液中铁元素质量开始增加,当氧化铁反应完成后铁元素质量不变;氧化铁反应完后剩余固体质量为0;当稀盐酸与氧化铁反应完成后溶液质量增加的速率与加入稀盐酸速率相一致,比之前要慢;氧化铁与稀盐酸反应产生水,故溶剂质量增加,但当反应完全后,溶剂质量的增加速率应与加入稀盐酸速率一致,比之前要慢。
5.答案:C
6.答案:D
解析:A、a点时发生的是Zn与溶液反应生成硝酸锌溶液和银,硝酸银还没反应完,a点溶液中的溶质有硝酸银、硝酸锌、硝酸铜三种,故选项说法正确。B、b点锌和硝酸银恰好完全反应,则得到的固体为Ag,故选项说法正确。C、c点时,硝酸银和硝酸铜恰好完全反应,此时的溶质只有反应产物硝酸锌,故选项说法正确。D、d点时,加入的锌过量,此时固体为锌、铜和银,加入稀盐酸后,锌会和稀盐酸反应生成氢气,故选项说法错误。故选:D。
7.答案:A
8.答案:C
解析:在金属活动性顺序中,位于氢前面的金属才能置换出盐酸、稀硫酸中的氢。
9.答案:B
解析:A、加热到500℃以上,氧化铜完全转化成铜,观察到有红色固体生成,故选项正确。B、200℃-300℃,发生的主要反应为、,故选项不正确。C、500℃以下得到的铜不纯净,是因为生成物中含有铜和氧化亚铜,故选项正确。D、化学反应控制条件很重要,同种反应物在不同条件下可能得到不同产物,故选项正确。故选:B。
10.答案:C
11.答案:(1)不含
(2)硬度大(合理即可)
(3)低
12.答案:(1)剧烈燃烧,放出大量热,发出耀眼白光,生成白色固体;
(2)①;
(3)
解析:(1)镁条在空气中剧烈燃烧,放出大量热,发出耀眼白光,生成白色固体;该反应的化学方程式为:。
(2)金属活动性顺序为钾>锌>铁>氢>铜,所以KCl溶液不能与锌和铜反应,不能用于比较锌和铜的金属活动性强弱;锌能与溶液反应生成氯化锌和铁,即,但铜不能与溶液反应,说明锌的金属活动性比铜强;锌能与稀盐酸反应生成氯化锌和氢气,即,但铜不能与稀盐酸反应,说明锌的金属活动性比铜强。
(3)氧化银在加热条件下分解为银和氧气,该反应的化学方程式为。
13.答案:(1)>;B
(2)
(3)空气(或氧气)
14.答案:(1)隔绝氧气和水
(2);锌、铜、银或Zn、Cu、Ag
解析:(1)自行车的链条表面常涂油来防止生锈,原理是隔绝氧气和水;
(2)金属活动性:Al﹥Zn﹥Cu﹥Ag,锌不能与反应,锌先与硝酸银反应生成硝酸锌和银,当硝酸银反应完成后,锌与硝酸铜反应生成硝酸锌和铜;硝酸银与盐酸反应生成氯化银沉淀和硝酸,根据题干信息“向过滤后的溶液中滴加盐酸,无明显现象”,可知溶液中不含硝酸银;
①一定发生的反应是锌与硝酸银反应生成硝酸锌和银,反应的化学方程式: ;
②向滤纸上的固体中滴加稀硫酸,有气泡产生,则滤渣中含锌,说明锌过量,铜、银被完全置换出来,故固体中一定含有锌(Zn)、铜(Cu)、银(Ag)。
15.答案:(1)导热实验A中铁丝不生锈,实验C中铁丝生锈
(2)
解析:(1)家庭生活中常用铁锅炒菜,主要利用了铁的导热性。实验A中铁丝不与水接触,与氧气接触,不生锈;实验B中铁丝不与氧气接触,与水接触,不生锈:实验C中铁丝与氧气、水同时接触,生锈。能够说明铁生锈需要有水参与的实验现象是实验A中铁丝不生锈,实验C中铁丝生锈。
(2)铝具有很好的抗腐蚀性能,是因为铝在空气中与氧气反应,在其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化,反应的化学方程式为。
16.答案:(1)磁铁矿(合理即可)
(2)提高炉温
(3)(或)
(4)除杂(合理即可);碳
(5)低
解析:(1)常见的铁矿石有赤铁矿、磁铁矿和菱铁矿等。
(2)不断鼓入空气的目的是使碳与氧气充分反应,放出更多热量,提高炉温。
(3)高温条件下氧化铁和一氧化碳反应生成铁和二氧化碳;高温条件下四氧化三铁和一氧化碳反应生成铁和二氧化碳。
(4)撒入潮泥灰的主要作用是将铁矿石中的二氧化硅转化为炉渣而除去。生铁和钢的区别是含碳量不同,不断翻炒液态生铁,使生铁中碳与氧气接触反应生成二氧化碳,降低碳元素的含量,而得到钢。
(5)合金的熔点低于组成它的纯金属,钢的熔点比纯铁的低。
17.答案:(1)使金属镉、锌全部反应;氯化镉、氯化锌、氯化氢(或CdCl 、ZnCl 、HCl)
(2)(或)
(3)Zn>Cd>Cu;C
解析:(1)根据实验目的分析流程图信息,加入过量稀盐酸的目的是使铜镉渣中的金属镉、锌全部反应。镉与稀盐酸反应生成氯化镉和氢气,锌与稀盐酸反应生成氯化锌和氢气,铜不与稀盐酸反应,所加稀盐酸过量,因此所得滤液中溶质为氯化镉、氯化锌、氯化氢。
(2)向滤液中加入适量金属锌后得到氯化锌溶液和镉,可知步骤②中发生的反应为锌与稀盐酸反应生成氯化锌和氢气、锌与氯化镉反应生成氯化锌和镉,据此写出反应的化学方程式。
(3)根据前面的分析可知,三种金属活动性由强到弱依次为锌、镉、铜。将铜、镉分别放入硝酸锌溶液中,均不反应,可知三种金属中锌的金属活动性最强,无法进一步比较铜、镉的金属活动性强弱,A错误;将锌、镉分别放入硝酸铜溶液中,均反应,可知三种金属中铜的金属活动性最弱,无法进一步比较锌、镉的金属活动性强弱,B错误;将锌、铜分别放入硝酸镉溶液中,锌能反应、铜不反应,可知三种金属活动性由强到弱依次为锌、镉、铜,C正确。
18.答案:铜锈的主要成分是,其中含有Cu、O、H、C四种元素,化学反应前后物质的元素种类不变
【设计与实验】二氧化碳(或);装置简单(或节约能源等);
【反思与提高】(1)氧气
(2)隔绝氧气储存
(3)稀盐酸(或稀硫酸)
解析:【设计与实验】根据实验四分析可知氢氧化钠溶液吸收了空气中的二氧化碳,故铜只与水、氧气接触,不生锈;实验三有铜、水、二氧化碳、氧气,生锈,对比可知实验四控制的因素是二氧化碳(或);与用高锰酸钾制取氧气相比,用过氧化氢制氧气常温下即可进行,优,点是装置简单(或节约能源等);根据实验可知铜生锈是铜和水、二氧化碳、氧气发生了反应。
【反思与提高】
(1)铁的锈蚀是铁与水和氧气同时接触而发生的,故与氧气有关。
(2)食品变质是因为发生缓慢氧化导致的,故长久保存可采取隔绝氧气储存。
(3)铜绿是一种碱式碳酸盐,能与酸反应,故可以选用稀盐酸(或稀硫酸)除去。
19.答案:(1)铁表面有红色固体析出,溶液由蓝色逐渐变为浅绿色
(2)解:设理论上可以炼出铜的质量是x
x=25.6g
答:理论上可以炼出铜的质量是25.6g。
解析:(1)铁的活动性比铜强,铁与硫酸铜溶液反应生成硫酸亚铁和铜。铜是红色固体,硫酸铜溶液呈蓝色,硫酸亚铁溶液呈浅绿色,所以会看到铁表面有红色固体析出,溶液由蓝色逐渐变为浅绿色。
(2)铁与硫酸铜溶液反应生成硫酸亚铁和铜,化学方程式为,根据铁粉的质量可以计算出铜的质量,详见答案
(试卷满分:60分;考试时间:60分钟)
可能用到的相对原子质量:Fe-56 Cu-64
一、选择题(本大题共10小题,每题2分,共20分)
1.人类文明进步与金属材料发展关系十分密切。下列有关金属材料的说法中,正确的是( )
A.金属在常温下都是固体
B.大多数金属元素在自然界中以单质的形式存在
C.金属材料包括金属和合金,生活中广泛使用的是合金
D.铝制品不易被锈蚀是因为铝不与氧气反应
2.《天工开物》被誉为“中国17世纪的工艺百科全书”,其中蕴含了大量的化学知识。下列理解错误的是( )
A.“煤饼烧石成灰”——石灰石经煅烧变成生石灰
B.“凡金性又柔,可屈折如枝柳”——金的硬度比较小
C.“火燃釜底,滚沸延及成盐”——加热蒸发溶剂析出食盐晶体
D.“烧铁器淬于胆矾水中,即成铜色也”——铁浸入铜盐溶液,表面生成红色铁锈
3.铝、铁、铜都是生活中常见的金属,下列有关叙述正确的是( )
A.铝比铁耐腐蚀,因为铝的化学性质比铁更稳定
B.三种金属都能与稀硫酸(或稀盐酸)反应
C.钢的含碳量比生铁高,因此应用更加广泛
D.黄铜比纯铜更适合用于制作耐磨齿轮
4.向盛有一定量氧化铁粉末的烧杯中不断加入稀盐酸,烧杯中相关量的变化与图像相符的是( )
A. B.C.D.
5.将未打磨的铝片和稀盐酸放入图-1所示的装置中(装置气密性良好),用压强传感器测定反应过程中烧瓶内的气体压强变化。结果如图-2所示。下列说法正确的是( )
已知:
A.ab段压强几乎不变,说明此时装置内并未发生化学变化
B.bc段压强增大,仅与反应生成氢气有关
C.cd段压强减小,主要因为铝和稀盐酸反应结束,温度降低
D.b点和c点溶液中溶质均只有
6.向一定质量和的混合液中加入Zn,溶液质量与溶质质量与加入Zn的质量关系如图所示。下列说法错误的是( )
A.a点溶液中的溶质有3种 B.b点所得固体只有银
C.c点溶液中溶质为 D.取d点时的固体,加入稀盐酸,无气泡产生
7.如图为教材中探究金属活动性顺序的实验,下列有关说法错误的是( )
A.使用未打磨的铝丝进行实验能得到相同的实验现象
B.省略丙实验也能比较、、三种金属的活动性
C.甲实验中溶液颜色逐渐变浅至无色
D.实验结束后,乙中溶液的质量减小
8.下列关于钢铁及其制品的说法,错误的是( )
A.含有某些金属和碳元素的铁合金,其性能比纯铁更优良
B.高炉中炼铁的主要反应可表示为
C.其他金属单质与铁一样,都能与盐酸反应得到氢气
D.家用菜刀经洗净擦干后可防止生锈
9.通过一氧化碳还原氧化铜可以得到铜,利用原位X射线粉末衍射仪来测定不同温度下反应后的固体物质成分,(不同晶态物质出现衍射峰的衍射角不同)实验结果如图所示。由图象信息可知,以下说法错误的是( )
A.加热到500℃以上,观察到有红色固体生成
B.200℃-300℃,发生的主要反应为
C.500℃以下得到的铜不纯净
D.化学反应控制条件很重要,同种反应物在不同条件下可能得到不同产物
10.将两张相同的铁丝网置于两个相同大小的锥形瓶中,分别倒入等体积的蒸馏水和食盐水,立即旋紧橡皮塞,将导管伸入滴有红墨水的水中。一段时间后,观察到烧杯中的导管内液面上升,且右侧导管内液面上升幅度较大,锥形瓶b中的铁丝网比a中的铁丝网锈蚀更严重。下列相关说法不正确的是( )
A.烧杯中的导管内液面上升是因为锥形瓶内气体被消耗
B.通过本实验说明食盐能加快铁锈蚀
C.仅通过本实验就能证明铁锈蚀需要与水接触
D.铁的锈蚀原理可用于测定空气中氧气的体积分数
二、填空题(本题共6小题,每空1分,共23分)
11.金属材料在人类文明的发展中起着重要作用,回答下列问题。
(1)唐代《太清丹经要诀》中记载了制取“彩色金”的方法:将雄黄()和锡粉(Sn)混合,“密固,入风炉吹之,……其色似金”。“彩色金”中______(填“含”或“不含”)金元素。
(2)北宋沈括在《梦溪笔谈》中提及“古人以剂钢为刃,柔铁为茎干,不尔则多断折”,其中剂钢就是铁的合金,相较于铁,剂钢的特点是___________(答一点)。
(3)明朝宋应星编写的《天工开物》中写道:“每红铜六斤,入倭铅四斤,先后入罐熔化,冷定取出,即成黄铜”,由此可知黄铜的熔点比“红铜”____________(填“高”或“低”)。
12.金属材料在生产、生活和化学实验中有着广泛的应用。
(1)金属镁是一种常用的实验用品。小明同学在实验室中取一段镁条,在空气中点燃,现象是 ,反应的化学方程式为 。
(2)实验室现有锌片和铜片,小明同学要验证锌、铜的金属活动性强弱,现提供下列试剂:①KCl溶液、②溶液、③稀盐酸,不能达到实验目的的是_____(填序号);所选试剂能达到实验目的,发生反应的化学方程式为 。
(3)银具有优良的导电性,被广泛用于电子制造业。工业上一般采用加热氧化银使其分解为银和氧气的方法制取银,该反应的化学方程式为 。
13.某火龙表演是国家级非物质文化遗产。其中的“打铁花”是先将生铁熔化成铁水,再用工具将铁水向空中用力抛出,形成“火树银花落,万点星辰开”的精彩场景。
(1)生铁的含碳量_______(填“<”“>”或“=”)钢的含碳量。工业上可用赤铁矿与CO在高温下反应来冶炼生铁,该反应主要利用了CO的_______(填字母)。
A.可燃性 B.还原性 C.密度比空气小
(2)铁花冷却后得到黑色固体,写出生成该固体的化学方程式: 。
(3)表演时可备细沙以防止火灾。细沙可阻止可燃物与______接触从而达到灭火的目的。
14.金属材料与生活和社会发展的关系非常密切。
(1)自行车的链条表面常涂油来防止生锈,此处应用的原理是什么?
(2)在、和的混合溶液中加入一定质量的锌粉,充分反应后过滤,向滤液中滴加稀盐酸,无明显现象。
①请写出一定发生了的反应的化学方程式 。
②向滤渣中滴加稀硫酸,有气泡产生,则固体中一定含有哪些物质_________?
15.金属材料对于改善人类生活,促进生产发展发挥着重要作用。
(1)家庭生活中常用铁锅炒菜,主要利用了铁的_______性。铁在空气中容易生锈,造成大量的资源浪费。某兴趣小组对铁生锈的原因进行了实验探究,能够说明铁生锈需要有水参与的实验现象是 。
(2)铝制品耐腐蚀是因其表面有致密的氧化铝薄膜,该反应的化学方程式为____________。
16.我国有着悠久的钢铁冶炼史,《天工开物》中记载的“炒钢法”如图1所示,该方法的生产过程可用图2表示。
资料:①潮泥灰的主要成分是石灰石;②铁的熔点是1535 ℃。根据图文回答下列问题。
(1)常见的铁矿石有赤铁矿和____________(写一种)。
(2)不断鼓入空气的目的是 。
(3)炼铁炉中生成铁的化学方程式为 。
(4)撒入潮泥灰的主要作用是 。不断翻炒液态生铁,是为了降低____元素的含量。
(5)钢的性能优良,如钢的熔点比纯铁的_________,易于加工。
三、实验题(本题共2小题,每空1分,共12分)
17.镉是镍镉电池的重要材料,工业上从铜镉渣(主要含有镉、锌、铜等单质)中分离回收镉的流程如图,回答下列问题。
【查阅资料】镉在其化合物中常显+2价。
(1)步骤①中加入过量稀盐酸的目的是 ,过滤后所得滤液中溶质成分为 。
(2)步骤②中发生反应的化学方程式为 (任写一个)。
(3)根据上述流程,请你推测Cu、Cd、Zn三种金属的活动性顺序为 ;除了上述流程外,下列试剂组还能验证Cu、Cd、Zn三种金属的活动性顺序的是____(填字母)。
A.Cu、Cd、溶液
B.Zn、Cd、溶液
C.Zn、Cu、溶液
18.某同学发现自己眼镜框中铜制部位表面有绿色的铜锈,他联想到探究铁生锈条件的实验,决定采用控制变量法探究铜生锈的原因,请你一起探究。
【提出问题】铜生锈的原因是什么?
【查阅资料】铜锈的主要成分是,俗称铜绿。
【猜想与假设】根据查阅的资料猜测:铜生锈是铜与空气中的氧气、水和二氧化碳共同作用的结果,理由是____________________。
【设计与实验】他仿照探究铁生锈条件的实验,设计并进行了如下所示的四个实验(说明:实验中用到的蒸馏水均已煮沸过且铜片已打磨干净)。
一、铜片不生锈
二、铜片不生锈
三、铜片生锈
四、铜片不生锈
在上述实验四中,控制的因素是 ,制取氧气的方法与加热高锰酸钾制取氧气的方法相比具有的优点是 (写一条)。铜生成铜绿的化学方程式为 。
【实验结论】他的猜想正确。
【反思与提高】
(1)生活中你会发现厨房中的铁锅与水接触的部分最容易生锈,切开的苹果不久后变成咖啡色,好像生了“锈”。这些物质“生锈”除了与水有关外,都与_________(填物质名称)有关。
(2)请你提出一条延长食品保质期的建议:__________________。
(3)要除去眼镜框表面的铜绿,应选用的药品是_________(写一种)。
四、计算题(本题共1小题,共5分)
19.《抱朴子内屏。黄白》记载了铜的冶炼方法:以曾青涂铁,铁赤色如铜。其“曾青”为硫酸铜溶液。
(1)此反应的实验现象为 。
(2)现有28g含为80%的铁粉,理论上可以炼出铜的质量是多少(写出计算过程)?
答案以及解析
1.答案:C
解析:A、常温下,不是所有金属都是固体,如常温下汞是液体,故A不正确;B、在自然界中只有少数的金属以单质形式存在,大部分都是以化合物形式存在的,故B不正确;C、金属材料包括金属和合金,因合金具有很多优点,如耐腐蚀、强度大等,所以日常使用的金属材料大多数是合金,故C正确;D、铝与氧气反应生成致密的氧化铝薄膜,阻止铝与氧气反应,所以铝制品不易被锈蚀,故D不正确;故选:C。
2.答案:D
解析:A、石灰石经煅烧变成生石灰,石灰石的主要成分是碳酸钙,高温下分解生成氧化钙和二氧化碳,故选项说法正确。B、凡金性又柔,可屈折如枝柳,说明金的硬度比较小,故选项说法正确。C、火燃釜底,滚沸延及成盐,指的是卤水滚沸逐渐结盐,即加热蒸发溶剂析出食盐晶体,故选项说法正确。D、烧铁器淬于胆矾水中,即成铜色也,铁浸入铜盐溶液,铁和硫酸铜反应生成硫酸亚铁和铜,故选项说法错误。故选:D。
3.答案:D
解析:A、铝比铁耐腐蚀,因为铝的表面有一层氧化物保护膜,故A选项说法错误;B、三种金属中铜不能与稀硫酸(或稀盐酸)反应,故B选项说法错误;C、钢的含碳量比生铁低,因此应用更加广泛,故C选项说法错误;D、黄铜比纯铜硬度大,更适合用于制作耐磨齿轮,故D选项说法正确。故选D。
4.答案:A
解析:氧化铁与稀盐酸反应产生氯化铁和水,加入稀盐酸后得到溶液,溶液中铁元素质量开始增加,当氧化铁反应完成后铁元素质量不变;氧化铁反应完后剩余固体质量为0;当稀盐酸与氧化铁反应完成后溶液质量增加的速率与加入稀盐酸速率相一致,比之前要慢;氧化铁与稀盐酸反应产生水,故溶剂质量增加,但当反应完全后,溶剂质量的增加速率应与加入稀盐酸速率一致,比之前要慢。
5.答案:C
6.答案:D
解析:A、a点时发生的是Zn与溶液反应生成硝酸锌溶液和银,硝酸银还没反应完,a点溶液中的溶质有硝酸银、硝酸锌、硝酸铜三种,故选项说法正确。B、b点锌和硝酸银恰好完全反应,则得到的固体为Ag,故选项说法正确。C、c点时,硝酸银和硝酸铜恰好完全反应,此时的溶质只有反应产物硝酸锌,故选项说法正确。D、d点时,加入的锌过量,此时固体为锌、铜和银,加入稀盐酸后,锌会和稀盐酸反应生成氢气,故选项说法错误。故选:D。
7.答案:A
8.答案:C
解析:在金属活动性顺序中,位于氢前面的金属才能置换出盐酸、稀硫酸中的氢。
9.答案:B
解析:A、加热到500℃以上,氧化铜完全转化成铜,观察到有红色固体生成,故选项正确。B、200℃-300℃,发生的主要反应为、,故选项不正确。C、500℃以下得到的铜不纯净,是因为生成物中含有铜和氧化亚铜,故选项正确。D、化学反应控制条件很重要,同种反应物在不同条件下可能得到不同产物,故选项正确。故选:B。
10.答案:C
11.答案:(1)不含
(2)硬度大(合理即可)
(3)低
12.答案:(1)剧烈燃烧,放出大量热,发出耀眼白光,生成白色固体;
(2)①;
(3)
解析:(1)镁条在空气中剧烈燃烧,放出大量热,发出耀眼白光,生成白色固体;该反应的化学方程式为:。
(2)金属活动性顺序为钾>锌>铁>氢>铜,所以KCl溶液不能与锌和铜反应,不能用于比较锌和铜的金属活动性强弱;锌能与溶液反应生成氯化锌和铁,即,但铜不能与溶液反应,说明锌的金属活动性比铜强;锌能与稀盐酸反应生成氯化锌和氢气,即,但铜不能与稀盐酸反应,说明锌的金属活动性比铜强。
(3)氧化银在加热条件下分解为银和氧气,该反应的化学方程式为。
13.答案:(1)>;B
(2)
(3)空气(或氧气)
14.答案:(1)隔绝氧气和水
(2);锌、铜、银或Zn、Cu、Ag
解析:(1)自行车的链条表面常涂油来防止生锈,原理是隔绝氧气和水;
(2)金属活动性:Al﹥Zn﹥Cu﹥Ag,锌不能与反应,锌先与硝酸银反应生成硝酸锌和银,当硝酸银反应完成后,锌与硝酸铜反应生成硝酸锌和铜;硝酸银与盐酸反应生成氯化银沉淀和硝酸,根据题干信息“向过滤后的溶液中滴加盐酸,无明显现象”,可知溶液中不含硝酸银;
①一定发生的反应是锌与硝酸银反应生成硝酸锌和银,反应的化学方程式: ;
②向滤纸上的固体中滴加稀硫酸,有气泡产生,则滤渣中含锌,说明锌过量,铜、银被完全置换出来,故固体中一定含有锌(Zn)、铜(Cu)、银(Ag)。
15.答案:(1)导热实验A中铁丝不生锈,实验C中铁丝生锈
(2)
解析:(1)家庭生活中常用铁锅炒菜,主要利用了铁的导热性。实验A中铁丝不与水接触,与氧气接触,不生锈;实验B中铁丝不与氧气接触,与水接触,不生锈:实验C中铁丝与氧气、水同时接触,生锈。能够说明铁生锈需要有水参与的实验现象是实验A中铁丝不生锈,实验C中铁丝生锈。
(2)铝具有很好的抗腐蚀性能,是因为铝在空气中与氧气反应,在其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化,反应的化学方程式为。
16.答案:(1)磁铁矿(合理即可)
(2)提高炉温
(3)(或)
(4)除杂(合理即可);碳
(5)低
解析:(1)常见的铁矿石有赤铁矿、磁铁矿和菱铁矿等。
(2)不断鼓入空气的目的是使碳与氧气充分反应,放出更多热量,提高炉温。
(3)高温条件下氧化铁和一氧化碳反应生成铁和二氧化碳;高温条件下四氧化三铁和一氧化碳反应生成铁和二氧化碳。
(4)撒入潮泥灰的主要作用是将铁矿石中的二氧化硅转化为炉渣而除去。生铁和钢的区别是含碳量不同,不断翻炒液态生铁,使生铁中碳与氧气接触反应生成二氧化碳,降低碳元素的含量,而得到钢。
(5)合金的熔点低于组成它的纯金属,钢的熔点比纯铁的低。
17.答案:(1)使金属镉、锌全部反应;氯化镉、氯化锌、氯化氢(或CdCl 、ZnCl 、HCl)
(2)(或)
(3)Zn>Cd>Cu;C
解析:(1)根据实验目的分析流程图信息,加入过量稀盐酸的目的是使铜镉渣中的金属镉、锌全部反应。镉与稀盐酸反应生成氯化镉和氢气,锌与稀盐酸反应生成氯化锌和氢气,铜不与稀盐酸反应,所加稀盐酸过量,因此所得滤液中溶质为氯化镉、氯化锌、氯化氢。
(2)向滤液中加入适量金属锌后得到氯化锌溶液和镉,可知步骤②中发生的反应为锌与稀盐酸反应生成氯化锌和氢气、锌与氯化镉反应生成氯化锌和镉,据此写出反应的化学方程式。
(3)根据前面的分析可知,三种金属活动性由强到弱依次为锌、镉、铜。将铜、镉分别放入硝酸锌溶液中,均不反应,可知三种金属中锌的金属活动性最强,无法进一步比较铜、镉的金属活动性强弱,A错误;将锌、镉分别放入硝酸铜溶液中,均反应,可知三种金属中铜的金属活动性最弱,无法进一步比较锌、镉的金属活动性强弱,B错误;将锌、铜分别放入硝酸镉溶液中,锌能反应、铜不反应,可知三种金属活动性由强到弱依次为锌、镉、铜,C正确。
18.答案:铜锈的主要成分是,其中含有Cu、O、H、C四种元素,化学反应前后物质的元素种类不变
【设计与实验】二氧化碳(或);装置简单(或节约能源等);
【反思与提高】(1)氧气
(2)隔绝氧气储存
(3)稀盐酸(或稀硫酸)
解析:【设计与实验】根据实验四分析可知氢氧化钠溶液吸收了空气中的二氧化碳,故铜只与水、氧气接触,不生锈;实验三有铜、水、二氧化碳、氧气,生锈,对比可知实验四控制的因素是二氧化碳(或);与用高锰酸钾制取氧气相比,用过氧化氢制氧气常温下即可进行,优,点是装置简单(或节约能源等);根据实验可知铜生锈是铜和水、二氧化碳、氧气发生了反应。
【反思与提高】
(1)铁的锈蚀是铁与水和氧气同时接触而发生的,故与氧气有关。
(2)食品变质是因为发生缓慢氧化导致的,故长久保存可采取隔绝氧气储存。
(3)铜绿是一种碱式碳酸盐,能与酸反应,故可以选用稀盐酸(或稀硫酸)除去。
19.答案:(1)铁表面有红色固体析出,溶液由蓝色逐渐变为浅绿色
(2)解:设理论上可以炼出铜的质量是x
x=25.6g
答:理论上可以炼出铜的质量是25.6g。
解析:(1)铁的活动性比铜强,铁与硫酸铜溶液反应生成硫酸亚铁和铜。铜是红色固体,硫酸铜溶液呈蓝色,硫酸亚铁溶液呈浅绿色,所以会看到铁表面有红色固体析出,溶液由蓝色逐渐变为浅绿色。
(2)铁与硫酸铜溶液反应生成硫酸亚铁和铜,化学方程式为,根据铁粉的质量可以计算出铜的质量,详见答案
同课章节目录
