贵州省普通高中2024-2025学年高三下学期适应性测试化学试卷(含答案)
文档属性
| 名称 | 贵州省普通高中2024-2025学年高三下学期适应性测试化学试卷(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-20 00:00:00 | ||
图片预览




文档简介
贵州省普通高中2025届高三下学期学业水平选择性考试(4月)适应性测试 化学试题
一、单选题
1.贵州矿产丰富,对下列与矿产有关的物质说法错误的是
A.硫酸钡是弱电解质 B.氧化铝是两性氧化物
C.磷有多种同素异形体 D.煤中有多种含碳化合物
2.甲烷水合物是“可燃冰”的主要成分,其化学式可表示为。下列说法正确的是
A.H、C、O元素均位于元素周期表的p区
B.的电子式:
C.中碳原子的杂化轨道轮廓图:
D.和的VSEPR模型分别为V形和正四面体形
3.化学与生产生活息息相关。下列说法错误的是
A.淀粉-聚丙烯酸钠可用于抗旱保水
B.聚乙炔可作为集成电路板中的绝缘材料
C.硫酸锌可作为一种食品添加剂
D.高铁酸钠可用于饮用水消毒
4.使用下列实验材料能达到实验目的的是
选项 实验目的 实验材料
A 测定NaClO溶液的pH pH试纸
B 验证的氧化性 溴水
C 干燥 无水
D 制备胶体 饱和溶液、沸水
A.A B.B C.C D.D
5.设为阿伏加德罗常数的值。下列说法正确的是
A.2.8g乙烯与环丙烷的气体混合物中原子总数为0.6
B.标准状况下,11.2L 中含有的π键数目为0.5
C.5.6g Fe与足量的S反应转移电子数为0.3
D.常温下,1.0L 0.1的溶液中,数目为0.1
6.杜仲胶是我国特有的天然高分子资源。一种由杜仲胶合成环氧天然乳胶的方法如下:
下列说法错误的是
A.杜仲胶单体名称:2-甲基-1,3-丁二烯
B.环氧天然乳胶分子式:
C.分子极性:环氧天然乳胶<杜仲胶
D.分子结构修饰潜力:环氧天然乳胶>杜仲胶
7.下列实验室溶解固体的方法涉及的离子方程式错误的是
A.用KI溶液溶解:
B.用热浓NaOH溶液溶解试管中残留的S:
C.用稀硫酸与溶液溶解Cu:
D.用氨水溶解AgCl:
8.X、Y、Z、W为前四周期原子序数依次增大的元素。X原子核外有9种运动状态不同的电子,Y、Z为同主族元素且最高价氧化物对应的水化物均为强碱,W是原子核外未成对电子数最多的元素。下列说法正确的是
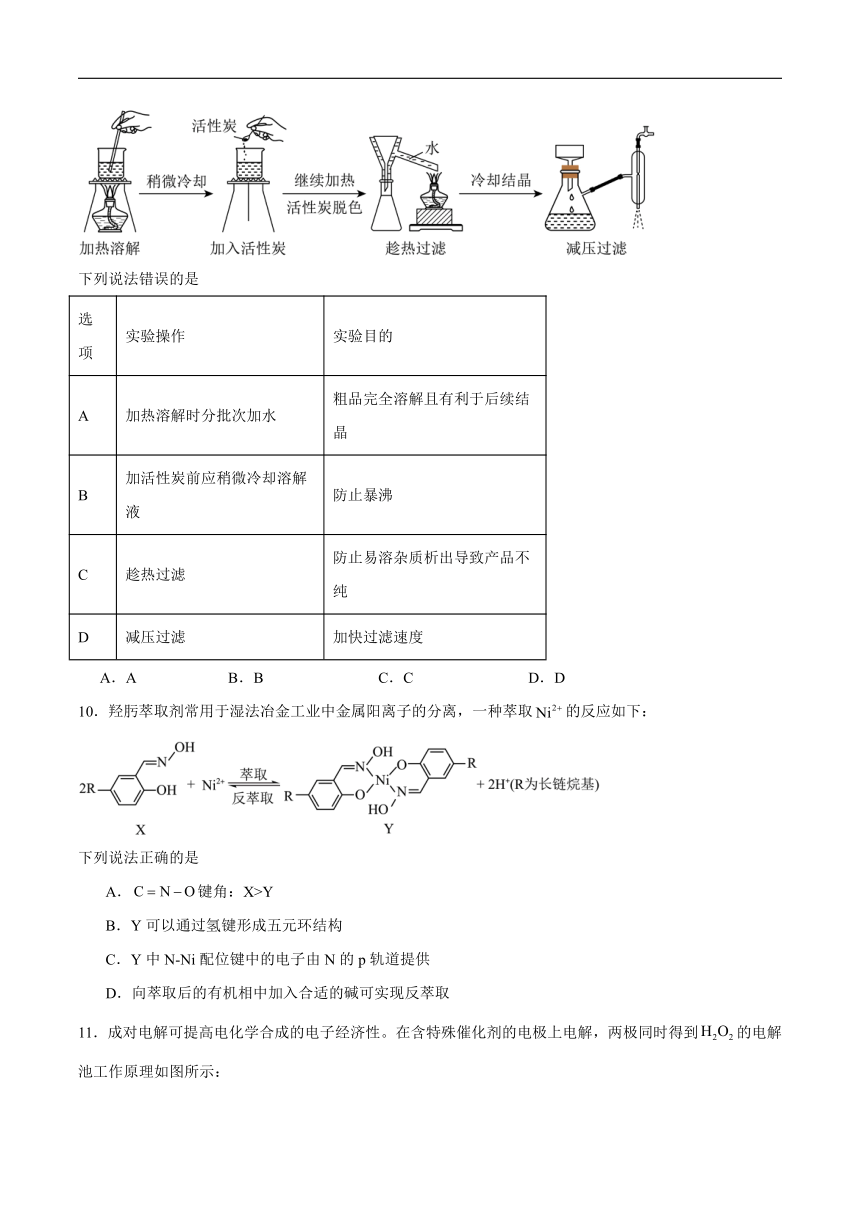
A.第一电离能:X>W>Z B.离子半径:XC.熔点:YX9.乙酰苯胺粗品重结晶主要步骤如下(夹持装置已省略):
下列说法错误的是
选项 实验操作 实验目的
A 加热溶解时分批次加水 粗品完全溶解且有利于后续结晶
B 加活性炭前应稍微冷却溶解液 防止暴沸
C 趁热过滤 防止易溶杂质析出导致产品不纯
D 减压过滤 加快过滤速度
A.A B.B C.C D.D
10.羟肟萃取剂常用于湿法冶金工业中金属阳离子的分离,一种萃取的反应如下:
下列说法正确的是
A.键角:X>Y
B.Y可以通过氢键形成五元环结构
C.Y中N-Ni配位键中的电子由N的p轨道提供
D.向萃取后的有机相中加入合适的碱可实现反萃取
11.成对电解可提高电化学合成的电子经济性。在含特殊催化剂的电极上电解,两极同时得到的电解池工作原理如图所示:
下列说法错误的是
A.阴极反应式:
B.电解过程中,从n区通过阳离子交换膜移向m区
C.电解过程中,当转移1mol电子时,理论上生成1mol
D.电解结束后,阳极区的小于1:7
12.湿法磷酸工艺中磷矿石[主要成分为、]酸浸、浓缩会产生含氟废气(HF、),废气中。一种回收氟的工艺如图所示:
已知:与HF、均能反应生成。
下列说法错误的是
A.“酸浸”前粉碎矿石可提高浸出效率
B.滤渣1的主要成分可以用于改良盐碱地(含)
C.与反应:
D.该工艺可以在陶瓷内衬的不锈钢装置中进行
13.镁锌合金具有特殊的性能,其晶胞结构如图,晶胞中的所有原子呈中心对称,其中原子1的分数坐标为,设为阿伏加德罗常数的值。
下列说法正确的是
A.该晶体类型为共价晶体
B.该晶体中Mg与Zn原子个数比为2:1
C.原子2的分数坐标为
D.该晶体的密度为
14.常温下,向20.00mL 0.1000的HCOOH溶液中逐滴滴入0.1000 NaOH溶液。溶液的pH及HCOOH、的pc随变化关系如图所示,pc表示HCOOH、浓度的负对数()。
下列说法错误的是
A.曲线III表示的变化情况
B.的数量级为
C.M点溶液中
D.N点溶液中
二、解答题
15.NOx(NO、NO2)是主要的大气污染物之一,现行环境空气中NOx含量测定方法如下:
I.采样:按下图(夹持装置已省略)连接仪器,进行操作a,装入药品,打开止气阀和采气泵,环境空气进入X中,NO2先转化为,进一步转化为偶氮染料;NO在Y中被氧化为NO2,在Z中被吸收转化。待X中吸收液变成粉红色后,同时关闭止气阀和采气泵,停止采样。
已知:①X、Z中盛装相同吸收液;
②CrO3易吸潮结块且易转化为Cr2O3。
(1)操作a为 。
(2)X、Z中多孔玻板上具有多个微孔结构,其作用是 。
(3)Y中发生反应的离子方程式为 。
(4)Y由内装CrO3的氧化管()改进而来,相对于CrO3氧化管,Y的优点有 。
II.NOx含量测定:将不同浓度的NaNO2标准溶液与足量吸收液反应生成偶氮染料,分别测定其吸光度(对特定波长光的吸收程度),绘制出吸光度与NaNO2标准溶液浓度的关系曲线如图。测定X、Z中吸收液的吸光度,与NaNO2标准溶液吸光度曲线对照得出的浓度,换算出NOx的含量。
(5)称取0.3750g NaNO2(已干燥恒重)配制成1000mL NaNO2标准溶液,下列实验仪器必须用到的是 (填名称)。
(6)以流量采样b小时,测得NOx的含量为,则所采集的环境空气中NOx的含量为 (用含a、b、m的代数式表示);若配制NaNO2标准溶液前NaNO2固体未经干燥恒重,将导致测定结果 (选填“偏大”或“偏小”)。
16.磷酸铁是新能源电池正极材料磷酸铁锂的前驱体。磷酸铁生产过程产生的硫酸铵废水中含有少量、、、等金属离子,对该废水进行资源化处理,得到硫酸铵镁[]与硫酸铵[]产品,其工艺流程如下:
已知:①25℃时,,,;
②摩尔质量:。
回答下列问题:
(1)基态Mn原子的价层电子排布式为 。
(2)25℃时,“中和沉淀”中控制pH=7.0,此时滤液1中为 ,该过程中pH不宜过高的原因是 。
(3)“沉淀除钙”中主要反应的化学方程式为 ,加入晶体的作用是 。
(4)“氧化”的目的是除去和,其中氧化的离子方程式为 ,氧化剂选用而不用的原因是 。
(5)测定产品纯度:取1.0000g 产品[含杂质]
配成100mL溶液,取20.00mL,用0.0100的EDTA标准溶液滴定,发生反应为,平行滴定3次,消耗标准溶液的平均体积为18.00mL,则产品的纯度为 %。
17.从烟气中捕集,与耦合反应生成CO和,有利于减少排放,减缓温室效应。反应方程式如下:
主反应: K
主要的副反应:I.
Ⅱ.
Ⅲ.
回答下列问题:
(1)计算 。为了抑制副反应Ⅱ的发生,主反应倾向于在 (选填“高温”或“低温”)下进行。
(2)主反应分别在Ni和NiMo合金催化剂上的反应历程如图所示,其中吸附在催化剂表面的中间物种加注*。
由图可知,相同条件下,为提高化学反应速率,使用 催化剂较好。在该催化剂上,反应历程的最大能垒(活化能)为 eV,决速步骤的反应方程式为 。
(3)在恒温、'时进料,在不同条件下达到平衡时的理论平衡转化率和如下表:
条件 平衡转化率(%)
i.只考虑主反应 80 80 1.00
ii.同时考虑主反应和副反应Ⅰ() 75 x y
iii.只考虑主反应在透氢膜反应器中进行 - 90 -
①在条件ⅰ时, (列出计算式)。
②与条件ⅰ相比,条件ⅱ中x 80%,y 1.00(选填“大于”“等于”或“小于”)。
③在条件ⅲ时,透氢膜反应器的工作原理如图所示。出口a和出口b中的物质的量的比值为 (保留小数点后2位)。
18.利希普坦IX()是一种抗心力衰竭药物,其合成路线之一如下(部分条件已省略):
回答下列问题:
(1)I中的官能团名称为 。
(2)I→Ⅲ的化学方程式为 。
(3)V的结构简式为 ,Ⅳ→Ⅵ中加入的作用是 。
(4)Ⅶ→Ⅸ中,产生了一种分子式为的副产物,其结构式为 (可简写为)。
(5)Ⅷ的同分异构体,同时满足下列条件的有 种(不考虑立体异构)。
①能直接发生银镜反应 ②含有苯环 ③卤素原子不与苯环直接相连
(6)Ⅲ→Ⅳ经过了以下反应历程:
M、P的结构简式分别为为 、为 ,P→Q的反应类型为 。
参考答案
1.A
2.C
3.B
4.D
5.A
6.C
7.B
8.A
9.C
10.B
11.D
12.D
13.C
14.B
15.(1)检查装置气密性
(2)增大气-液接触面积,提高吸收转化效率
(3)
(4)酸性KMnO4溶液较CrO3更稳定,气-液比气-固接触面积更大,氧化效率更高
(5)烧杯、1000mL容量瓶
(6) 偏大
16.(1)
(2) 防止、沉淀析出,减少的损耗
(3) 提供晶种或晶体诱导剂,促进晶体析出
(4) 用作氧化剂,会在产品中引入等杂质(用作氧化剂,不会引入杂质)
(5)77.32
17.(1) -172 高温
(2) NiMo(或NiMo合金) 1.58 [或]
(3) 大于 小于 0.65
18.(1)硝基、碳溴键(或溴原子)
(2)++HBr
(3) 消耗生成的HCl,促进反应进行
(4)
(5)4
(6) 消去或消除(反应)
一、单选题
1.贵州矿产丰富,对下列与矿产有关的物质说法错误的是
A.硫酸钡是弱电解质 B.氧化铝是两性氧化物
C.磷有多种同素异形体 D.煤中有多种含碳化合物
2.甲烷水合物是“可燃冰”的主要成分,其化学式可表示为。下列说法正确的是
A.H、C、O元素均位于元素周期表的p区
B.的电子式:
C.中碳原子的杂化轨道轮廓图:
D.和的VSEPR模型分别为V形和正四面体形
3.化学与生产生活息息相关。下列说法错误的是
A.淀粉-聚丙烯酸钠可用于抗旱保水
B.聚乙炔可作为集成电路板中的绝缘材料
C.硫酸锌可作为一种食品添加剂
D.高铁酸钠可用于饮用水消毒
4.使用下列实验材料能达到实验目的的是
选项 实验目的 实验材料
A 测定NaClO溶液的pH pH试纸
B 验证的氧化性 溴水
C 干燥 无水
D 制备胶体 饱和溶液、沸水
A.A B.B C.C D.D
5.设为阿伏加德罗常数的值。下列说法正确的是
A.2.8g乙烯与环丙烷的气体混合物中原子总数为0.6
B.标准状况下,11.2L 中含有的π键数目为0.5
C.5.6g Fe与足量的S反应转移电子数为0.3
D.常温下,1.0L 0.1的溶液中,数目为0.1
6.杜仲胶是我国特有的天然高分子资源。一种由杜仲胶合成环氧天然乳胶的方法如下:
下列说法错误的是
A.杜仲胶单体名称:2-甲基-1,3-丁二烯
B.环氧天然乳胶分子式:
C.分子极性:环氧天然乳胶<杜仲胶
D.分子结构修饰潜力:环氧天然乳胶>杜仲胶
7.下列实验室溶解固体的方法涉及的离子方程式错误的是
A.用KI溶液溶解:
B.用热浓NaOH溶液溶解试管中残留的S:
C.用稀硫酸与溶液溶解Cu:
D.用氨水溶解AgCl:
8.X、Y、Z、W为前四周期原子序数依次增大的元素。X原子核外有9种运动状态不同的电子,Y、Z为同主族元素且最高价氧化物对应的水化物均为强碱,W是原子核外未成对电子数最多的元素。下列说法正确的是
A.第一电离能:X>W>Z B.离子半径:X
下列说法错误的是
选项 实验操作 实验目的
A 加热溶解时分批次加水 粗品完全溶解且有利于后续结晶
B 加活性炭前应稍微冷却溶解液 防止暴沸
C 趁热过滤 防止易溶杂质析出导致产品不纯
D 减压过滤 加快过滤速度
A.A B.B C.C D.D
10.羟肟萃取剂常用于湿法冶金工业中金属阳离子的分离,一种萃取的反应如下:
下列说法正确的是
A.键角:X>Y
B.Y可以通过氢键形成五元环结构
C.Y中N-Ni配位键中的电子由N的p轨道提供
D.向萃取后的有机相中加入合适的碱可实现反萃取
11.成对电解可提高电化学合成的电子经济性。在含特殊催化剂的电极上电解,两极同时得到的电解池工作原理如图所示:
下列说法错误的是
A.阴极反应式:
B.电解过程中,从n区通过阳离子交换膜移向m区
C.电解过程中,当转移1mol电子时,理论上生成1mol
D.电解结束后,阳极区的小于1:7
12.湿法磷酸工艺中磷矿石[主要成分为、]酸浸、浓缩会产生含氟废气(HF、),废气中。一种回收氟的工艺如图所示:
已知:与HF、均能反应生成。
下列说法错误的是
A.“酸浸”前粉碎矿石可提高浸出效率
B.滤渣1的主要成分可以用于改良盐碱地(含)
C.与反应:
D.该工艺可以在陶瓷内衬的不锈钢装置中进行
13.镁锌合金具有特殊的性能,其晶胞结构如图,晶胞中的所有原子呈中心对称,其中原子1的分数坐标为,设为阿伏加德罗常数的值。
下列说法正确的是
A.该晶体类型为共价晶体
B.该晶体中Mg与Zn原子个数比为2:1
C.原子2的分数坐标为
D.该晶体的密度为
14.常温下,向20.00mL 0.1000的HCOOH溶液中逐滴滴入0.1000 NaOH溶液。溶液的pH及HCOOH、的pc随变化关系如图所示,pc表示HCOOH、浓度的负对数()。
下列说法错误的是
A.曲线III表示的变化情况
B.的数量级为
C.M点溶液中
D.N点溶液中
二、解答题
15.NOx(NO、NO2)是主要的大气污染物之一,现行环境空气中NOx含量测定方法如下:
I.采样:按下图(夹持装置已省略)连接仪器,进行操作a,装入药品,打开止气阀和采气泵,环境空气进入X中,NO2先转化为,进一步转化为偶氮染料;NO在Y中被氧化为NO2,在Z中被吸收转化。待X中吸收液变成粉红色后,同时关闭止气阀和采气泵,停止采样。
已知:①X、Z中盛装相同吸收液;
②CrO3易吸潮结块且易转化为Cr2O3。
(1)操作a为 。
(2)X、Z中多孔玻板上具有多个微孔结构,其作用是 。
(3)Y中发生反应的离子方程式为 。
(4)Y由内装CrO3的氧化管()改进而来,相对于CrO3氧化管,Y的优点有 。
II.NOx含量测定:将不同浓度的NaNO2标准溶液与足量吸收液反应生成偶氮染料,分别测定其吸光度(对特定波长光的吸收程度),绘制出吸光度与NaNO2标准溶液浓度的关系曲线如图。测定X、Z中吸收液的吸光度,与NaNO2标准溶液吸光度曲线对照得出的浓度,换算出NOx的含量。
(5)称取0.3750g NaNO2(已干燥恒重)配制成1000mL NaNO2标准溶液,下列实验仪器必须用到的是 (填名称)。
(6)以流量采样b小时,测得NOx的含量为,则所采集的环境空气中NOx的含量为 (用含a、b、m的代数式表示);若配制NaNO2标准溶液前NaNO2固体未经干燥恒重,将导致测定结果 (选填“偏大”或“偏小”)。
16.磷酸铁是新能源电池正极材料磷酸铁锂的前驱体。磷酸铁生产过程产生的硫酸铵废水中含有少量、、、等金属离子,对该废水进行资源化处理,得到硫酸铵镁[]与硫酸铵[]产品,其工艺流程如下:
已知:①25℃时,,,;
②摩尔质量:。
回答下列问题:
(1)基态Mn原子的价层电子排布式为 。
(2)25℃时,“中和沉淀”中控制pH=7.0,此时滤液1中为 ,该过程中pH不宜过高的原因是 。
(3)“沉淀除钙”中主要反应的化学方程式为 ,加入晶体的作用是 。
(4)“氧化”的目的是除去和,其中氧化的离子方程式为 ,氧化剂选用而不用的原因是 。
(5)测定产品纯度:取1.0000g 产品[含杂质]
配成100mL溶液,取20.00mL,用0.0100的EDTA标准溶液滴定,发生反应为,平行滴定3次,消耗标准溶液的平均体积为18.00mL,则产品的纯度为 %。
17.从烟气中捕集,与耦合反应生成CO和,有利于减少排放,减缓温室效应。反应方程式如下:
主反应: K
主要的副反应:I.
Ⅱ.
Ⅲ.
回答下列问题:
(1)计算 。为了抑制副反应Ⅱ的发生,主反应倾向于在 (选填“高温”或“低温”)下进行。
(2)主反应分别在Ni和NiMo合金催化剂上的反应历程如图所示,其中吸附在催化剂表面的中间物种加注*。
由图可知,相同条件下,为提高化学反应速率,使用 催化剂较好。在该催化剂上,反应历程的最大能垒(活化能)为 eV,决速步骤的反应方程式为 。
(3)在恒温、'时进料,在不同条件下达到平衡时的理论平衡转化率和如下表:
条件 平衡转化率(%)
i.只考虑主反应 80 80 1.00
ii.同时考虑主反应和副反应Ⅰ() 75 x y
iii.只考虑主反应在透氢膜反应器中进行 - 90 -
①在条件ⅰ时, (列出计算式)。
②与条件ⅰ相比,条件ⅱ中x 80%,y 1.00(选填“大于”“等于”或“小于”)。
③在条件ⅲ时,透氢膜反应器的工作原理如图所示。出口a和出口b中的物质的量的比值为 (保留小数点后2位)。
18.利希普坦IX()是一种抗心力衰竭药物,其合成路线之一如下(部分条件已省略):
回答下列问题:
(1)I中的官能团名称为 。
(2)I→Ⅲ的化学方程式为 。
(3)V的结构简式为 ,Ⅳ→Ⅵ中加入的作用是 。
(4)Ⅶ→Ⅸ中,产生了一种分子式为的副产物,其结构式为 (可简写为)。
(5)Ⅷ的同分异构体,同时满足下列条件的有 种(不考虑立体异构)。
①能直接发生银镜反应 ②含有苯环 ③卤素原子不与苯环直接相连
(6)Ⅲ→Ⅳ经过了以下反应历程:
M、P的结构简式分别为为 、为 ,P→Q的反应类型为 。
参考答案
1.A
2.C
3.B
4.D
5.A
6.C
7.B
8.A
9.C
10.B
11.D
12.D
13.C
14.B
15.(1)检查装置气密性
(2)增大气-液接触面积,提高吸收转化效率
(3)
(4)酸性KMnO4溶液较CrO3更稳定,气-液比气-固接触面积更大,氧化效率更高
(5)烧杯、1000mL容量瓶
(6) 偏大
16.(1)
(2) 防止、沉淀析出,减少的损耗
(3) 提供晶种或晶体诱导剂,促进晶体析出
(4) 用作氧化剂,会在产品中引入等杂质(用作氧化剂,不会引入杂质)
(5)77.32
17.(1) -172 高温
(2) NiMo(或NiMo合金) 1.58 [或]
(3) 大于 小于 0.65
18.(1)硝基、碳溴键(或溴原子)
(2)++HBr
(3) 消耗生成的HCl,促进反应进行
(4)
(5)4
(6) 消去或消除(反应)
同课章节目录
