苏教版高中化学5选择性必修3有机化学基础专题4生活中常用的有机物烃的含氧衍生物4.1.1生活中常用的有机化合物醇课件(共23张PPT)
文档属性
| 名称 | 苏教版高中化学5选择性必修3有机化学基础专题4生活中常用的有机物烃的含氧衍生物4.1.1生活中常用的有机化合物醇课件(共23张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-23 09:28:40 | ||
图片预览








文档简介
(共23张PPT)
第四章 生活中常用的有机物——烃的含氧衍生物
第一节 醇和酚
课时1
一、醇的结构及分类
般若汤
碧蚁
杜康
醇醪
钓诗钩
福水
桂浆
含春王
佳酿
这是什么的别名?
——酒
(乙醇)
1.能说出醇的结构特点并进行分类,列举甲醇、乙二醇、丙三醇等常见醇的应用;
2.能从分子组成和结构的角度解释醇类物质的主要物理性质及递变规律;
3.能从化学键和反应规律的角度进一步认识乙醇的化学性质,通过实验证实乙醇的消去反应和氧化反应,能写出相应的化学方程式。能基于化学键和官能团,建立结构预测性质系统分析模型。
学习目标
Q1:什么是醇?
醇:烃分子中 上的氢原子被 取代所形成的化合物。
官能团:(醇)羟基
CH3CHCH3
OH
C
H
2
O
H
CH3OH
CH3CH2OH
CH2=CHCH2OH
一、醇的结构及分类
饱和碳原子
羟基
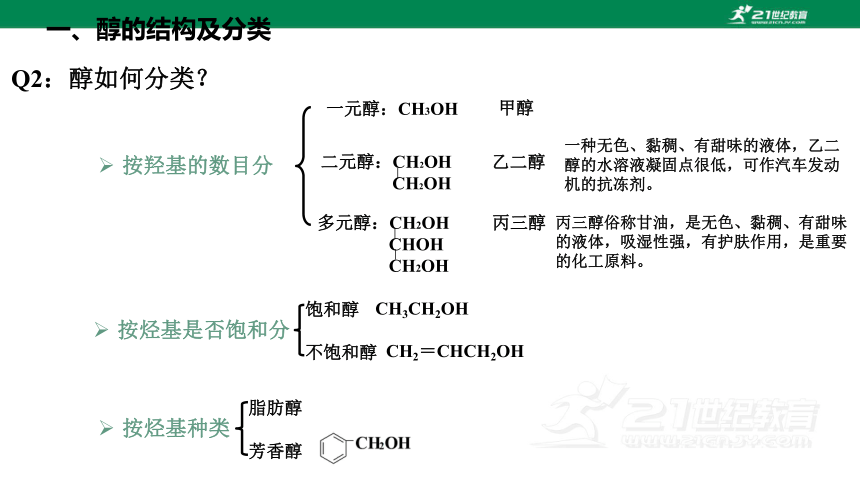
Q2:醇如何分类?
按羟基的数目分
按烃基种类
一元醇:CH3OH
甲醇
二元醇:CH2OH
CH2OH
乙二醇
多元醇:CH2OH
CHOH
CH2OH
丙三醇
脂肪醇
芳香醇
按烃基是否饱和分
饱和醇
不饱和醇
CH3CH2OH
CH2=CHCH2OH
一种无色、黏稠、有甜味的液体,乙二醇的水溶液凝固点很低,可作汽车发动机的抗冻剂。
丙三醇俗称甘油,是无色、黏稠、有甜味的液体,吸湿性强,有护肤作用,是重要的化工原料。
一、醇的结构及分类
二、醇的物理性质
Q3:醇有哪些物理性质?
Q3-1 分析醇的结构,推测醇在水中的溶解度
R-OH
小分子的醇均可与水以任意比互溶:醇与水形成了氢键;醇与水都是极性分子
随着碳原子数的增加,溶解度逐渐下降:碳原子数增加,疏水端增多
疏水端
亲水端
H H
O O
H H H
O
C2H5
二、醇的物理性质
Q3-2 观察下列表格,你能得到什么结论,为什么?
相对分子质量相近的醇和烷烃相比,醇的沸点高于烷烃:醇分子间存在氢键
碳原子数相同的醇,含羟基越多,沸点越高:形成分子间氢键数目多
三、醇的化学性质
一位著名的有机化学家曾说过,假如让一个有机化学家带上10种有机化合物到荒岛上独自工作,他的选择里一定会有醇。有了醇,他就能合成出各种各样的有机化合物。那么,在有机合成中醇为什么有如此重要的作用呢?
【质疑 联想】
三、醇的化学性质
Q4:醇有哪些化学性质?
Q4-1 结构决定性质,根据乙醇的结构,发生化学反应时哪些键易断裂,为什么?
⑤
①
③
H—C—C—O—H
H H
H H
②
④
①②易断键:氧原子吸引电子的能力比氢原子和碳原子强,使O—H、C—O 键的电子都向氧原子偏移,O—H、C—O键的极性较大,易断裂。
三、醇的化学性质
Q4-2-1 断①键会发生什么反应?
2CH3CH2O-H+2Na→2CH3CH2ONa+H2↑
乙醇钠
取代反应
Q4-2-2 钠和乙醇、钠与水反应比较,谁更剧烈?为什么?
钠与水反应更剧烈:乙醇中的氢不如钠活泼,乙醇分子中乙基是推电子基团,使O—H极性减弱。
H—O—H
CH3CH2O-H
三、醇的化学性质
【资料1】在实验室和工业中,常用醇和氢卤酸来制备卤代烷。
Q4-3-1: 以乙醇和溴化氢生成溴乙烷为例,思考乙醇的断键位置,尝试写出化学方程式。
C2H5Br+H2O
C2H5OH+HBr
断②键 取代反应
Q4-3-2: 在实验室中如何利用此反应制备溴乙烷?
三、醇的化学性质
【实验步骤】在试管Ⅰ中依次加入2 mL蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3 g溴化钠粉末,在试管Ⅱ注入蒸馏水,烧杯中注入自来水。加热试管Ⅰ至微沸状态数分钟后,冷却。
【实验现象】试管Ⅱ中有油状物质生成,溶液分层。
Q4-3-3:为什么实验中使用蒸馏水稀释浓硫酸,不能直接使用浓硫酸?
Q4-3-4:长导管、试管Ⅱ和烧杯中的水起到了什么作用?
冷凝作用,试管Ⅱ中的水还可以除去乙醇和HBr。
浓硫酸具有强氧化性,而HBr具有还原性,会发生副反应生成溴单质,而且还能使乙醇脱水。
三、醇的化学性质
Q4-5:思考乙醇的断键位置,尝试写出化学方程式。(浓硫酸为催化剂)
【资料2】16世纪,瑞士医生帕拉采尔苏斯的著作中讲述到:酒精与浓硫酸作用得到一种麻醉性液体,它正是乙醚。1540年,瑞士植物家柯德斯明确提出将乙醇与浓硫酸共同蒸馏以制取乙醚。
CH3CH2-O-CH2CH3
乙醚
分子间脱水:取代反应
CH3CH2-OH+H-O-CH2CH3
Q4-6-1:温度继续升高,会发生什么反应?
三、醇的化学性质
【实验步骤】组装装置,在圆底烧瓶中加入5mL乙醇和15mL浓硫酸,放入几片碎瓷片,加热,使混合溶液迅速升到170℃,观察实验现象。
【实验现象】酸性高锰酸钾溶液,溴的四氯化碳溶液均褪色
Q4-6-2: 根据实验现象推测生成何种产物?
Q4-6-3:思考乙醇的断键位置,尝试写出化学方程式。
乙烯
断②⑤键:β-H受羟基的影响,活性增大
-H
-H
分子内脱水 消去反应
Q4-6-4:发生消去反应,对于醇的结构有什么要求?
消去反应:在一定条件下,一个有机化合物分子内脱去一个或几个小分子生成不饱和化合物(含双键或三键)的反应。
醇含有β-H
三、醇的化学性质
【实验步骤】组装装置,在圆底烧瓶中加入5mL乙醇和15mL浓硫酸,放入几片碎瓷片,加热,使混合溶液迅速升到170℃,观察实验现象。
【实验现象】酸性高锰酸钾溶液褪色
Q4-6-5
碎瓷片的作用是是什么?
浓硫酸的作用是什么?
温度计的位置?
为何使液体温度迅速升到170℃?
混合溶液为先变黑?
为何要将溶液先通入氢氧化钠溶液中?
防止暴沸
催化剂和脱水剂
置于反应物的中央位置
在140℃时乙醇发生分子间脱水生成乙醚
因为浓硫酸的脱水性,使乙醇脱水炭化。
由于无水酒精和浓硫酸发生的氧化还原反应,反应制得的乙烯中往往混有H2O、CO2、SO2等气体。可将气体通入10%NaOH溶液洗气除杂。
三、醇的化学性质
Q4-7:乙醇还可以发生什么反应?
氧化反应
Q4-7-1:可以被哪些氧化剂氧化?断哪些键?
氧气,燃烧反应:
2CO2+3H2O
C2H5OH +3O2
点燃
氧气催化氧化:
全部
2CH3CH2OH + O2 2CH3CHO+2H2O
Cu或Ag
△
断①③键
Q4-7-2:醇类物质发生催化氧化结构上要满足什么?
存在α-H
三、醇的化学性质
与强氧化剂反应:
C2H5OH CH3COOH
K2Cr2O7(H+)
或KMnO4(H+)
应用体验
×
×
×
√
×
√
C
第四章 生活中常用的有机物——烃的含氧衍生物
第一节 醇和酚
课时1
一、醇的结构及分类
般若汤
碧蚁
杜康
醇醪
钓诗钩
福水
桂浆
含春王
佳酿
这是什么的别名?
——酒
(乙醇)
1.能说出醇的结构特点并进行分类,列举甲醇、乙二醇、丙三醇等常见醇的应用;
2.能从分子组成和结构的角度解释醇类物质的主要物理性质及递变规律;
3.能从化学键和反应规律的角度进一步认识乙醇的化学性质,通过实验证实乙醇的消去反应和氧化反应,能写出相应的化学方程式。能基于化学键和官能团,建立结构预测性质系统分析模型。
学习目标
Q1:什么是醇?
醇:烃分子中 上的氢原子被 取代所形成的化合物。
官能团:(醇)羟基
CH3CHCH3
OH
C
H
2
O
H
CH3OH
CH3CH2OH
CH2=CHCH2OH
一、醇的结构及分类
饱和碳原子
羟基
Q2:醇如何分类?
按羟基的数目分
按烃基种类
一元醇:CH3OH
甲醇
二元醇:CH2OH
CH2OH
乙二醇
多元醇:CH2OH
CHOH
CH2OH
丙三醇
脂肪醇
芳香醇
按烃基是否饱和分
饱和醇
不饱和醇
CH3CH2OH
CH2=CHCH2OH
一种无色、黏稠、有甜味的液体,乙二醇的水溶液凝固点很低,可作汽车发动机的抗冻剂。
丙三醇俗称甘油,是无色、黏稠、有甜味的液体,吸湿性强,有护肤作用,是重要的化工原料。
一、醇的结构及分类
二、醇的物理性质
Q3:醇有哪些物理性质?
Q3-1 分析醇的结构,推测醇在水中的溶解度
R-OH
小分子的醇均可与水以任意比互溶:醇与水形成了氢键;醇与水都是极性分子
随着碳原子数的增加,溶解度逐渐下降:碳原子数增加,疏水端增多
疏水端
亲水端
H H
O O
H H H
O
C2H5
二、醇的物理性质
Q3-2 观察下列表格,你能得到什么结论,为什么?
相对分子质量相近的醇和烷烃相比,醇的沸点高于烷烃:醇分子间存在氢键
碳原子数相同的醇,含羟基越多,沸点越高:形成分子间氢键数目多
三、醇的化学性质
一位著名的有机化学家曾说过,假如让一个有机化学家带上10种有机化合物到荒岛上独自工作,他的选择里一定会有醇。有了醇,他就能合成出各种各样的有机化合物。那么,在有机合成中醇为什么有如此重要的作用呢?
【质疑 联想】
三、醇的化学性质
Q4:醇有哪些化学性质?
Q4-1 结构决定性质,根据乙醇的结构,发生化学反应时哪些键易断裂,为什么?
⑤
①
③
H—C—C—O—H
H H
H H
②
④
①②易断键:氧原子吸引电子的能力比氢原子和碳原子强,使O—H、C—O 键的电子都向氧原子偏移,O—H、C—O键的极性较大,易断裂。
三、醇的化学性质
Q4-2-1 断①键会发生什么反应?
2CH3CH2O-H+2Na→2CH3CH2ONa+H2↑
乙醇钠
取代反应
Q4-2-2 钠和乙醇、钠与水反应比较,谁更剧烈?为什么?
钠与水反应更剧烈:乙醇中的氢不如钠活泼,乙醇分子中乙基是推电子基团,使O—H极性减弱。
H—O—H
CH3CH2O-H
三、醇的化学性质
【资料1】在实验室和工业中,常用醇和氢卤酸来制备卤代烷。
Q4-3-1: 以乙醇和溴化氢生成溴乙烷为例,思考乙醇的断键位置,尝试写出化学方程式。
C2H5Br+H2O
C2H5OH+HBr
断②键 取代反应
Q4-3-2: 在实验室中如何利用此反应制备溴乙烷?
三、醇的化学性质
【实验步骤】在试管Ⅰ中依次加入2 mL蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3 g溴化钠粉末,在试管Ⅱ注入蒸馏水,烧杯中注入自来水。加热试管Ⅰ至微沸状态数分钟后,冷却。
【实验现象】试管Ⅱ中有油状物质生成,溶液分层。
Q4-3-3:为什么实验中使用蒸馏水稀释浓硫酸,不能直接使用浓硫酸?
Q4-3-4:长导管、试管Ⅱ和烧杯中的水起到了什么作用?
冷凝作用,试管Ⅱ中的水还可以除去乙醇和HBr。
浓硫酸具有强氧化性,而HBr具有还原性,会发生副反应生成溴单质,而且还能使乙醇脱水。
三、醇的化学性质
Q4-5:思考乙醇的断键位置,尝试写出化学方程式。(浓硫酸为催化剂)
【资料2】16世纪,瑞士医生帕拉采尔苏斯的著作中讲述到:酒精与浓硫酸作用得到一种麻醉性液体,它正是乙醚。1540年,瑞士植物家柯德斯明确提出将乙醇与浓硫酸共同蒸馏以制取乙醚。
CH3CH2-O-CH2CH3
乙醚
分子间脱水:取代反应
CH3CH2-OH+H-O-CH2CH3
Q4-6-1:温度继续升高,会发生什么反应?
三、醇的化学性质
【实验步骤】组装装置,在圆底烧瓶中加入5mL乙醇和15mL浓硫酸,放入几片碎瓷片,加热,使混合溶液迅速升到170℃,观察实验现象。
【实验现象】酸性高锰酸钾溶液,溴的四氯化碳溶液均褪色
Q4-6-2: 根据实验现象推测生成何种产物?
Q4-6-3:思考乙醇的断键位置,尝试写出化学方程式。
乙烯
断②⑤键:β-H受羟基的影响,活性增大
-H
-H
分子内脱水 消去反应
Q4-6-4:发生消去反应,对于醇的结构有什么要求?
消去反应:在一定条件下,一个有机化合物分子内脱去一个或几个小分子生成不饱和化合物(含双键或三键)的反应。
醇含有β-H
三、醇的化学性质
【实验步骤】组装装置,在圆底烧瓶中加入5mL乙醇和15mL浓硫酸,放入几片碎瓷片,加热,使混合溶液迅速升到170℃,观察实验现象。
【实验现象】酸性高锰酸钾溶液褪色
Q4-6-5
碎瓷片的作用是是什么?
浓硫酸的作用是什么?
温度计的位置?
为何使液体温度迅速升到170℃?
混合溶液为先变黑?
为何要将溶液先通入氢氧化钠溶液中?
防止暴沸
催化剂和脱水剂
置于反应物的中央位置
在140℃时乙醇发生分子间脱水生成乙醚
因为浓硫酸的脱水性,使乙醇脱水炭化。
由于无水酒精和浓硫酸发生的氧化还原反应,反应制得的乙烯中往往混有H2O、CO2、SO2等气体。可将气体通入10%NaOH溶液洗气除杂。
三、醇的化学性质
Q4-7:乙醇还可以发生什么反应?
氧化反应
Q4-7-1:可以被哪些氧化剂氧化?断哪些键?
氧气,燃烧反应:
2CO2+3H2O
C2H5OH +3O2
点燃
氧气催化氧化:
全部
2CH3CH2OH + O2 2CH3CHO+2H2O
Cu或Ag
△
断①③键
Q4-7-2:醇类物质发生催化氧化结构上要满足什么?
存在α-H
三、醇的化学性质
与强氧化剂反应:
C2H5OH CH3COOH
K2Cr2O7(H+)
或KMnO4(H+)
应用体验
×
×
×
√
×
√
C
