苏教版高中化学5选择性必修3有机化学基础专题4生活中常用的有机物烃的含氧衍生物4.2羧酸的性质课件(共30张PPT)
文档属性
| 名称 | 苏教版高中化学5选择性必修3有机化学基础专题4生活中常用的有机物烃的含氧衍生物4.2羧酸的性质课件(共30张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-23 09:35:50 | ||
图片预览





文档简介
(共30张PPT)
4.2.2 羧酸的性质及应用
HO—C —COOH
CH2—COOH
CH2—COOH
柠檬酸
DL-苹果酸
山梨酸
1、定义:分子中烃基(或氢原子)与______ 相连的化合物。
官能团为_________。
2、通式:饱和一元羧酸的通式:
一、羧酸
羧基
CnH2n+1COOH(n≥1,n为整数)
CnH2nO2(n≥1,n为整数)
3、分类
羧酸
根据烃基类别
脂肪酸:乙酸
芳香酸:苯甲酸
根据羧基的数目
一元羧酸:甲酸
多元羧酸:对苯二甲酸、乙二酸
饱和羧酸:丙酸
不饱和羧酸:丙烯酸
根据烃基的饱和程度
根据烃基所含碳原子数
低级脂肪酸:含碳原子数较少的脂肪酸
高级脂肪酸:含碳原子数较多的脂肪酸
脂肪酸
常见的高级脂肪酸
饱和高级脂肪酸
不饱和高级脂肪酸
硬脂酸(C17H35COOH)
软脂酸(C15H31COOH)
油酸(C17H33COOH)
亚油酸(C17H31COOH)
碳原子数<10
碳原子数≥10
二、羧酸的物理性质
物理性质 规律 举例
溶解性
沸点
1、物理通性:
分子中碳原子数在4以下的羧酸能与水互溶
甲酸、乙酸、乙二酸
随着分子中碳原子数的增加,一元羧酸在水中的溶解度迅速变小,甚至不溶于水
高级脂肪酸不溶于水的蜡状固体
随着分子中碳原子数的增加,一元羧酸的沸点逐渐升高。
丙酸>乙酸>甲酸
乙酸:______液体,_____________气味
_______水,______挥发、温度低于16.6℃时呈冰状晶体, 无水乙酸俗称________。
2、乙酸的物理性质:
无色
有强烈刺激性
易溶于
易
冰醋酸
三、羧酸的化学性质
①
②
③
断①
RCOOH
RCOO-+H+
1.弱酸性
反应 现象与化学方程式
与酸碱指示剂作用
与碱反应(NaOH)
与碱性氧化物反应(CuO)
与活泼金属反应(Na)
与某些盐溶液(Na2CO3、NaHCO3)
羧酸的酸性比碳酸强
羧酸能使紫色石蕊溶液变红
RCOOH+NaOH→RCOONa+H2O
CuO+2RCOOH→(RCOO)2Cu+H2O
2RCOOH+2Na→2RCOONa+H2↑
2RCOOH+Na2CO3→2RCOONa+CO2↑+H2O
RCOOH+NaHCO3→RCOONa+CO2↑+H2O
三、羧酸的化学性质
1、随着分子中碳原子数的增加,羧酸的酸性逐渐减弱。高级脂肪酸不一定能使酸碱指示剂变色。
2、随着羧基数目的增加,羧酸的酸性逐渐增强。乙二酸>乙酸。
羧酸的酸性规律:
?问:下列常见物质酸性强弱比较:苯酚、甲酸、乙酸、乙二酸、碳酸、丙酸。
乙二酸>甲酸>乙酸>丙酸>碳酸>苯酚
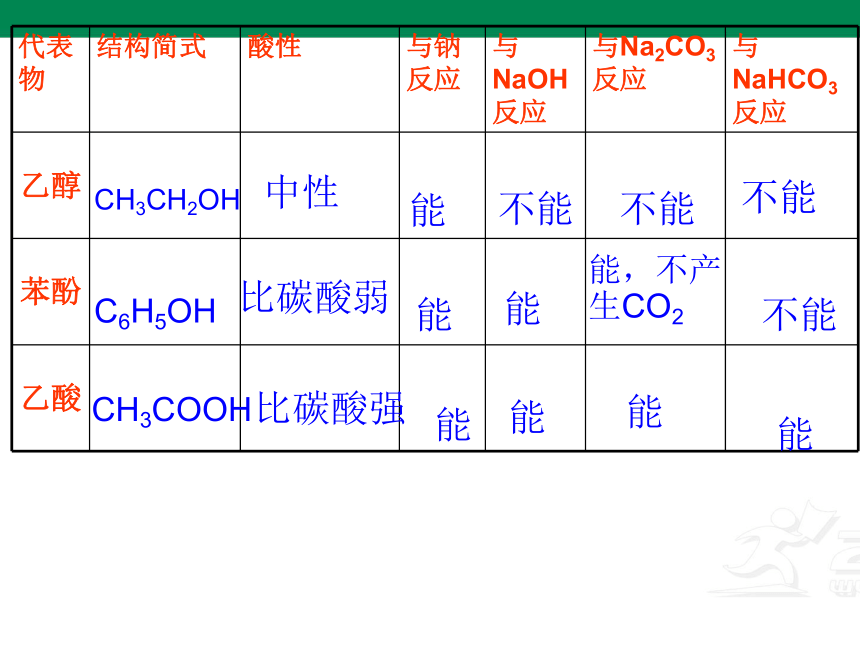
代表物 结构简式 酸性 与钠反应 与NaOH反应 与Na2CO3反应 与NaHCO3反应
乙醇
苯酚
乙酸
CH3CH2OH
中性
能
不能
不能
不能
C6H5OH
比碳酸弱
能
能
能,不产
生CO2
不能
CH3COOH
比碳酸强
能
能
能
能
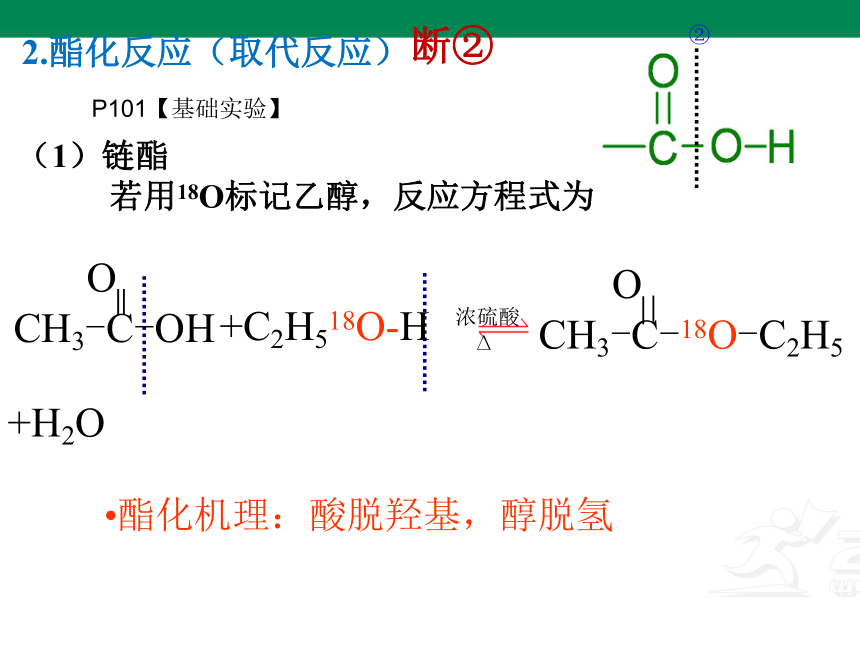
(1)链酯
若用18O标记乙醇,反应方程式为
2.酯化反应(取代反应)
酯化机理:酸脱羟基,醇脱氢
+C2H518O-H
浓硫酸
O
CH3-C-OH
+H2O
O
CH3-C-18O-C2H5
②
断②
P101【基础实验】
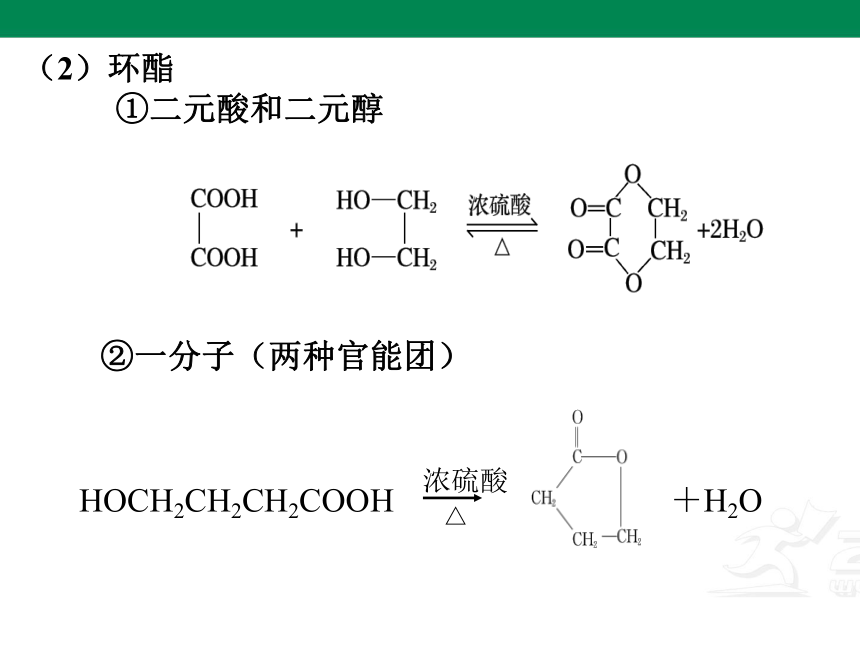
(2)环酯
①二元酸和二元醇
②一分子(两种官能团)
HOCH2CH2CH2COOH
浓硫酸
△
+H2O
③二分子
(3)缩聚反应
缩聚反应:有机化合物分子间脱去小分子获得高分子化合物的反应。
①二元醇与二元酸
(3)缩聚反应
乳酸分子
+(n-1)H2O
②羟基酸的缩聚(只有一种单体)
(3)缩聚反应
②羟基酸的缩聚(有两种单体)
nHO-CH2-COOH+nHO-CH2CH2-COOH →
[O-CH2-COOCH2CH2CO]n
H
OH
+(2n-1)H2O
RCOOH RCH2OH
LiAlH4
与醛和酮相比,羧基中的羧基较难与H2加成而被还原,只有强还原剂LiAlH4等才能将羧酸还原。
3.还原反应(加成反应)
③
断③
四、重要的羧酸
1、常见的羧酸
甲酸 苯甲酸 乙二酸
结构简式
俗名
颜色、状态
气味 —— ——
溶解性
用途
COOH
HOOC-COOH
HCOOH
蚁酸
安息香酸
草酸
无色液体
无色晶体
无色晶体
有刺激性气味
能与水、乙醇、甘油等互溶
微溶于水,易溶于乙醇
可溶于水和乙酸
用作还原剂,消毒剂,合成医药、农药和染料等原料
用于合成香料、药物等,它的钠盐用作食品防腐剂
化学分析中常用的还原剂,重要的的化工原料
2、甲酸的结构及化学性质
(1)甲酸的分子结构
分子式:
结构简式:
HCOOH
结构式:
C
O
H
H
O
官能团:
既具有羧酸的性质,又表现醛的性质
CH2O2
醛基 羧基
(2)甲酸的化学性质
①具有羧酸的性质
②具有醛的性质——氧化反应
a.银镜反应
b.与新制的氢氧化铜反应
c.使酸性高锰酸钾褪色
a.具有酸的通性
b.酯化反应
甲酸不能与H2发生加成反应?
3、乙二酸的化学性质
(1)乙二酸的电离:(具有酸的通性)
(2)与乙醇的酯化反应:
H2C2O4 H++HC2O4-
HC2O4- H++C2O42-
浓硫酸
COOH
COOH
+2CH3CH2OH
COOCH2CH3
COOCH2CH3
+2H2O
(3)特性(具有较强的还原性)
原因:乙二酸结构中两个羧基直接相连,相互影响使得乙二酸具有较强得还原性,能使酸性高锰酸钾褪色。
5 +2KMnO4+3H2SO4 K2SO4+2MnSO4+10CO2
+8H2O
COOH
COOH
五、酯的结构和性质
1、酯的概述:酯是酰基( )和烃氧基( )相连构成的一种羧酸的衍生物。酯是酸和醇酯化反应的产物。
C
R
O
O
R
C
O
O
2、官能团:
3、组成的结构:
C
O
R’
R
O
R代表烃基或氢原子
R’代表烃基
R、R’都是烃基时,可以相同,也可以不同
4、酯的命名:
酯的名称是根据生成酯的酸和醇来命名的。命名时,酸的名称写在前面,醇的名称写在后面,将其中的醇改成酯,称“某酸某酯”。
HCOOCH3
CH3COOCHCH3
CH3
CH3COOCH2CH2OOCCH3
甲酸甲酯
乙酸异丙酯(乙酸-2-丙酯)
二乙酸乙二酯
乙二酸乙二酯
乙二酸二乙酯
C-O-C2H5
C-O-C2H5
O
O
C-O-CH2
C-O-CH2
O
O
5、饱和一元羧酸与饱和一元醇形成的酯的分子通式CnH2nO2(n≥2)。
6、物理性质:
酯的密度一般比水_____,____溶于水,____溶于乙醇、乙醚等有机溶剂。低级酯是有____味的液体,_____挥发。
小
难
易
香
易
6、化学性质
(1)水解实验——P101【基础实验】
酸性水解
碱性水解
C
O
R’
R
O
RCOOR’+NaOH RCOONa+R’OH
RCOOR’+H2O RCOOH+R’OH
浓硫酸
(2)甲酸酯的结构和性质:
C
O
R’
H
O
甲酸酯是甲酸与醇发生的酯化反应的产物。
除了可以发生酯的水解,也能发生醛的氧化。能与新制氢氧化铜反应,能发生银镜反应等。所以能发生银镜反应的有醛、甲酸、甲酸酯等
醛基 酯基
六、加聚反应和缩聚反应的比较
加聚反应 缩聚反应
单体特征
单体种类
聚合方式
聚合物特征
产物
含不饱和键或环
一般含有两个官能团
含碳碳双键或碳碳三键
酚、醛、醇、羧酸、氨基酸等
通过不饱和键或开环加成
通过官能团缩合脱去小分子而连接
聚合物链节和单体具有相同的化学组成
聚合物链节和单体具有不同的化学组成
聚合物
聚合物和小分子
课堂作业
1、HCOOH与新制Cu(OH)2的反应
CH2COOH
CH2COOH
2、 与 CH3CH2OH的酯化反应
3、HOCH2CHCH2COOH生成环酯的反应
CH3
4、 + 的缩聚反应
COOH
COOH
CH2OH
CH2OH
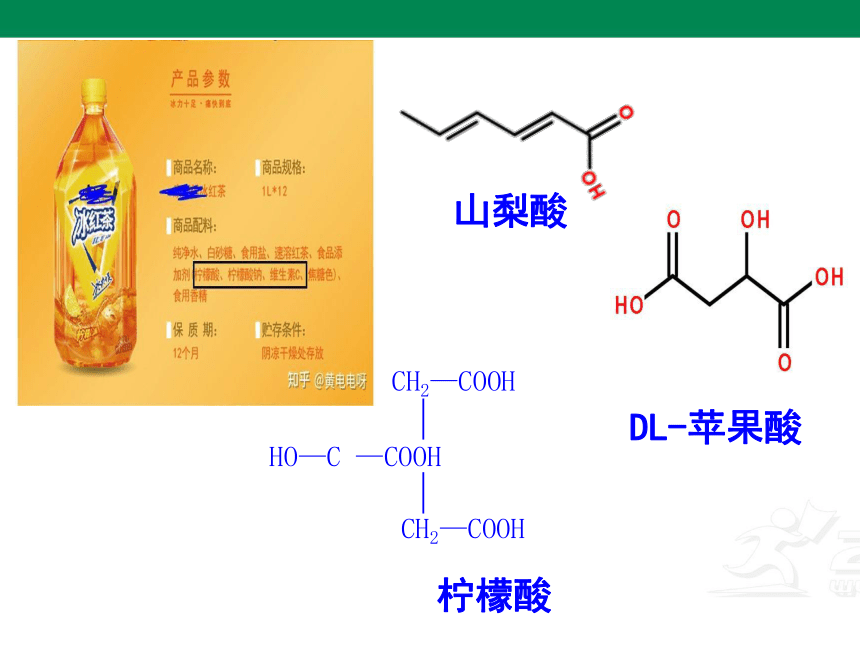
4.2.2 羧酸的性质及应用
HO—C —COOH
CH2—COOH
CH2—COOH
柠檬酸
DL-苹果酸
山梨酸
1、定义:分子中烃基(或氢原子)与______ 相连的化合物。
官能团为_________。
2、通式:饱和一元羧酸的通式:
一、羧酸
羧基
CnH2n+1COOH(n≥1,n为整数)
CnH2nO2(n≥1,n为整数)
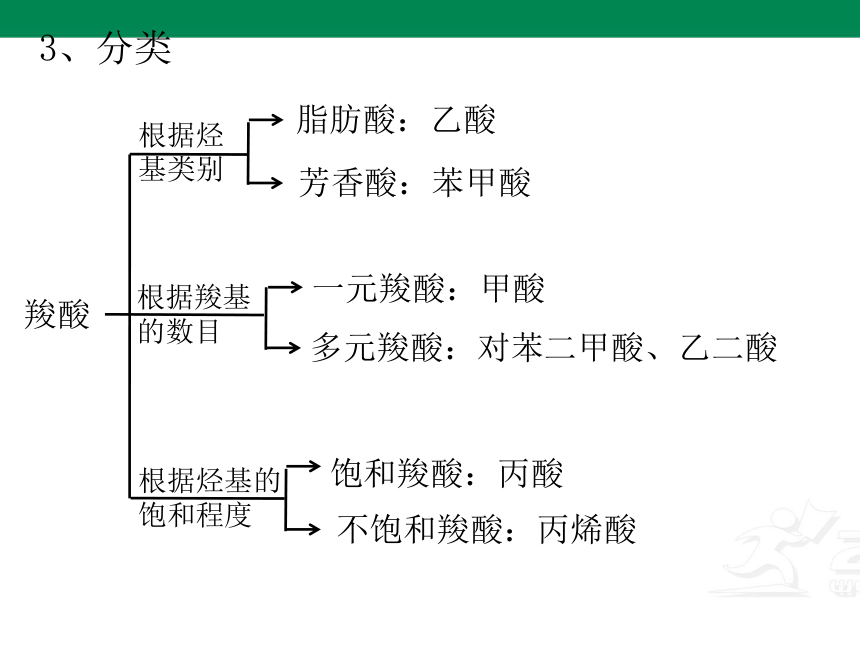
3、分类
羧酸
根据烃基类别
脂肪酸:乙酸
芳香酸:苯甲酸
根据羧基的数目
一元羧酸:甲酸
多元羧酸:对苯二甲酸、乙二酸
饱和羧酸:丙酸
不饱和羧酸:丙烯酸
根据烃基的饱和程度
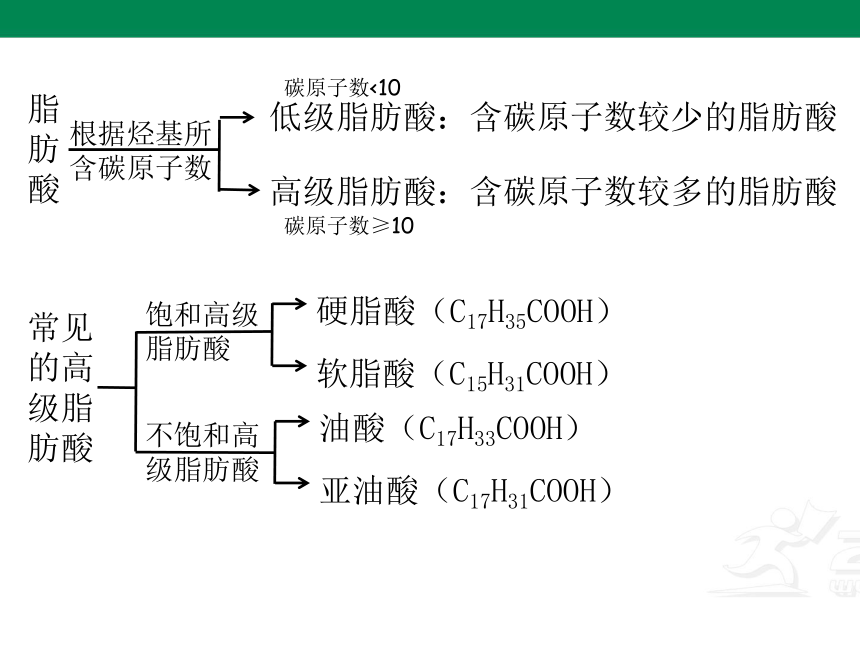
根据烃基所含碳原子数
低级脂肪酸:含碳原子数较少的脂肪酸
高级脂肪酸:含碳原子数较多的脂肪酸
脂肪酸
常见的高级脂肪酸
饱和高级脂肪酸
不饱和高级脂肪酸
硬脂酸(C17H35COOH)
软脂酸(C15H31COOH)
油酸(C17H33COOH)
亚油酸(C17H31COOH)
碳原子数<10
碳原子数≥10
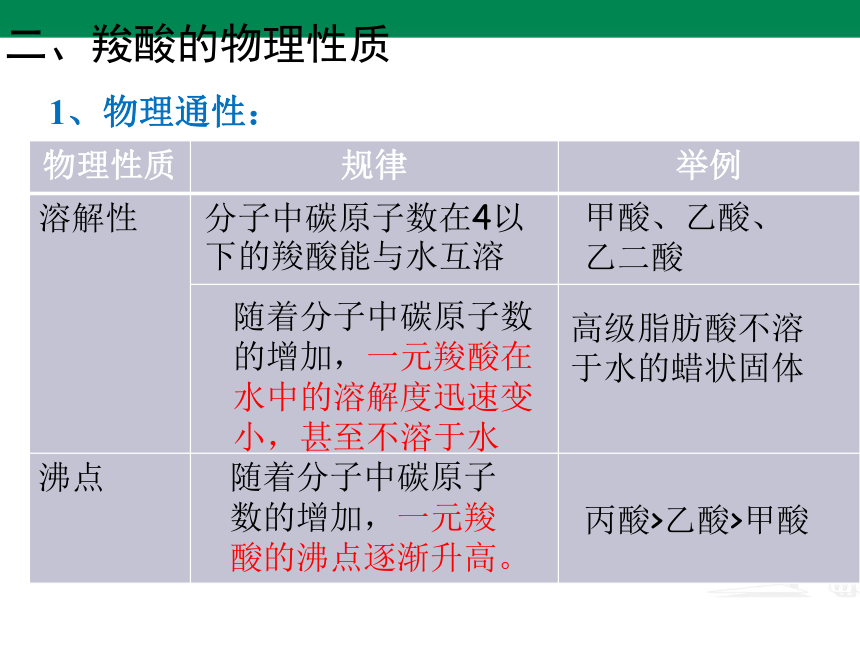
二、羧酸的物理性质
物理性质 规律 举例
溶解性
沸点
1、物理通性:
分子中碳原子数在4以下的羧酸能与水互溶
甲酸、乙酸、乙二酸
随着分子中碳原子数的增加,一元羧酸在水中的溶解度迅速变小,甚至不溶于水
高级脂肪酸不溶于水的蜡状固体
随着分子中碳原子数的增加,一元羧酸的沸点逐渐升高。
丙酸>乙酸>甲酸
乙酸:______液体,_____________气味
_______水,______挥发、温度低于16.6℃时呈冰状晶体, 无水乙酸俗称________。
2、乙酸的物理性质:
无色
有强烈刺激性
易溶于
易
冰醋酸
三、羧酸的化学性质
①
②
③
断①
RCOOH
RCOO-+H+
1.弱酸性
反应 现象与化学方程式
与酸碱指示剂作用
与碱反应(NaOH)
与碱性氧化物反应(CuO)
与活泼金属反应(Na)
与某些盐溶液(Na2CO3、NaHCO3)
羧酸的酸性比碳酸强
羧酸能使紫色石蕊溶液变红
RCOOH+NaOH→RCOONa+H2O
CuO+2RCOOH→(RCOO)2Cu+H2O
2RCOOH+2Na→2RCOONa+H2↑
2RCOOH+Na2CO3→2RCOONa+CO2↑+H2O
RCOOH+NaHCO3→RCOONa+CO2↑+H2O
三、羧酸的化学性质
1、随着分子中碳原子数的增加,羧酸的酸性逐渐减弱。高级脂肪酸不一定能使酸碱指示剂变色。
2、随着羧基数目的增加,羧酸的酸性逐渐增强。乙二酸>乙酸。
羧酸的酸性规律:
?问:下列常见物质酸性强弱比较:苯酚、甲酸、乙酸、乙二酸、碳酸、丙酸。
乙二酸>甲酸>乙酸>丙酸>碳酸>苯酚
代表物 结构简式 酸性 与钠反应 与NaOH反应 与Na2CO3反应 与NaHCO3反应
乙醇
苯酚
乙酸
CH3CH2OH
中性
能
不能
不能
不能
C6H5OH
比碳酸弱
能
能
能,不产
生CO2
不能
CH3COOH
比碳酸强
能
能
能
能
(1)链酯
若用18O标记乙醇,反应方程式为
2.酯化反应(取代反应)
酯化机理:酸脱羟基,醇脱氢
+C2H518O-H
浓硫酸
O
CH3-C-OH
+H2O
O
CH3-C-18O-C2H5
②
断②
P101【基础实验】
(2)环酯
①二元酸和二元醇
②一分子(两种官能团)
HOCH2CH2CH2COOH
浓硫酸
△
+H2O
③二分子
(3)缩聚反应
缩聚反应:有机化合物分子间脱去小分子获得高分子化合物的反应。
①二元醇与二元酸
(3)缩聚反应
乳酸分子
+(n-1)H2O
②羟基酸的缩聚(只有一种单体)
(3)缩聚反应
②羟基酸的缩聚(有两种单体)
nHO-CH2-COOH+nHO-CH2CH2-COOH →
[O-CH2-COOCH2CH2CO]n
H
OH
+(2n-1)H2O
RCOOH RCH2OH
LiAlH4
与醛和酮相比,羧基中的羧基较难与H2加成而被还原,只有强还原剂LiAlH4等才能将羧酸还原。
3.还原反应(加成反应)
③
断③
四、重要的羧酸
1、常见的羧酸
甲酸 苯甲酸 乙二酸
结构简式
俗名
颜色、状态
气味 —— ——
溶解性
用途
COOH
HOOC-COOH
HCOOH
蚁酸
安息香酸
草酸
无色液体
无色晶体
无色晶体
有刺激性气味
能与水、乙醇、甘油等互溶
微溶于水,易溶于乙醇
可溶于水和乙酸
用作还原剂,消毒剂,合成医药、农药和染料等原料
用于合成香料、药物等,它的钠盐用作食品防腐剂
化学分析中常用的还原剂,重要的的化工原料
2、甲酸的结构及化学性质
(1)甲酸的分子结构
分子式:
结构简式:
HCOOH
结构式:
C
O
H
H
O
官能团:
既具有羧酸的性质,又表现醛的性质
CH2O2
醛基 羧基
(2)甲酸的化学性质
①具有羧酸的性质
②具有醛的性质——氧化反应
a.银镜反应
b.与新制的氢氧化铜反应
c.使酸性高锰酸钾褪色
a.具有酸的通性
b.酯化反应
甲酸不能与H2发生加成反应?
3、乙二酸的化学性质
(1)乙二酸的电离:(具有酸的通性)
(2)与乙醇的酯化反应:
H2C2O4 H++HC2O4-
HC2O4- H++C2O42-
浓硫酸
COOH
COOH
+2CH3CH2OH
COOCH2CH3
COOCH2CH3
+2H2O
(3)特性(具有较强的还原性)
原因:乙二酸结构中两个羧基直接相连,相互影响使得乙二酸具有较强得还原性,能使酸性高锰酸钾褪色。
5 +2KMnO4+3H2SO4 K2SO4+2MnSO4+10CO2
+8H2O
COOH
COOH
五、酯的结构和性质
1、酯的概述:酯是酰基( )和烃氧基( )相连构成的一种羧酸的衍生物。酯是酸和醇酯化反应的产物。
C
R
O
O
R
C
O
O
2、官能团:
3、组成的结构:
C
O
R’
R
O
R代表烃基或氢原子
R’代表烃基
R、R’都是烃基时,可以相同,也可以不同
4、酯的命名:
酯的名称是根据生成酯的酸和醇来命名的。命名时,酸的名称写在前面,醇的名称写在后面,将其中的醇改成酯,称“某酸某酯”。
HCOOCH3
CH3COOCHCH3
CH3
CH3COOCH2CH2OOCCH3
甲酸甲酯
乙酸异丙酯(乙酸-2-丙酯)
二乙酸乙二酯
乙二酸乙二酯
乙二酸二乙酯
C-O-C2H5
C-O-C2H5
O
O
C-O-CH2
C-O-CH2
O
O
5、饱和一元羧酸与饱和一元醇形成的酯的分子通式CnH2nO2(n≥2)。
6、物理性质:
酯的密度一般比水_____,____溶于水,____溶于乙醇、乙醚等有机溶剂。低级酯是有____味的液体,_____挥发。
小
难
易
香
易
6、化学性质
(1)水解实验——P101【基础实验】
酸性水解
碱性水解
C
O
R’
R
O
RCOOR’+NaOH RCOONa+R’OH
RCOOR’+H2O RCOOH+R’OH
浓硫酸
(2)甲酸酯的结构和性质:
C
O
R’
H
O
甲酸酯是甲酸与醇发生的酯化反应的产物。
除了可以发生酯的水解,也能发生醛的氧化。能与新制氢氧化铜反应,能发生银镜反应等。所以能发生银镜反应的有醛、甲酸、甲酸酯等
醛基 酯基
六、加聚反应和缩聚反应的比较
加聚反应 缩聚反应
单体特征
单体种类
聚合方式
聚合物特征
产物
含不饱和键或环
一般含有两个官能团
含碳碳双键或碳碳三键
酚、醛、醇、羧酸、氨基酸等
通过不饱和键或开环加成
通过官能团缩合脱去小分子而连接
聚合物链节和单体具有相同的化学组成
聚合物链节和单体具有不同的化学组成
聚合物
聚合物和小分子
课堂作业
1、HCOOH与新制Cu(OH)2的反应
CH2COOH
CH2COOH
2、 与 CH3CH2OH的酯化反应
3、HOCH2CHCH2COOH生成环酯的反应
CH3
4、 + 的缩聚反应
COOH
COOH
CH2OH
CH2OH
