苏教版高中化学5选择性必修3有机化学基础专题5药物合成的重要原料卤代烃、胺、酰胺5.3有机合成设计课件
文档属性
| 名称 | 苏教版高中化学5选择性必修3有机化学基础专题5药物合成的重要原料卤代烃、胺、酰胺5.3有机合成设计课件 |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-23 09:37:47 | ||
图片预览






文档简介
(共35张PPT)
有机合成设计
专题5 药物合成的重要原料 卤代烃、胺、酰胺
第三单元 有机合成设计
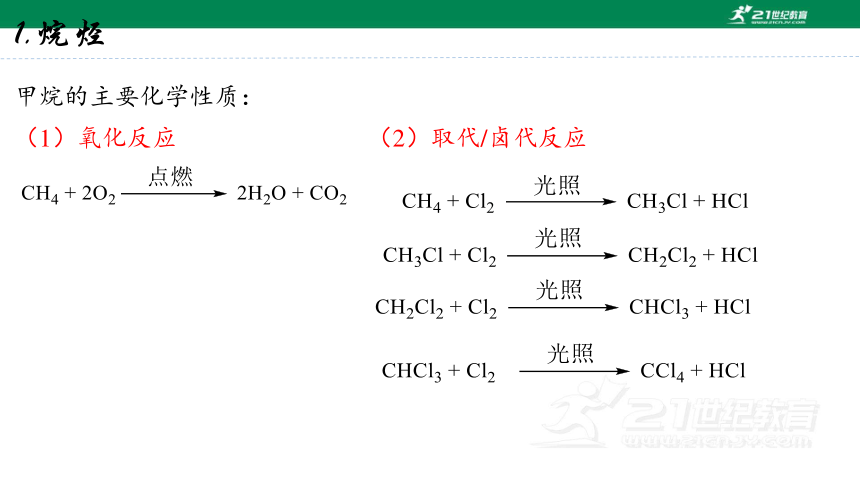
1.烷烃
烷烃的主要物理性质:
碳原子数≤4的烷烃和新戊烷是气态,其他的烷烃常温下呈液态或固态。
随着碳原子数的增加,烷烃的熔沸点升高,密度升高。碳原子数相同的烷烃,支链越多,熔沸点越低。
烷烃可溶于有机溶剂中,不易溶于水中。
甲烷是一种密度比空气小、常温下无色无味的气体。甲烷是最简单的有机物。甲烷作为常规天然气、可燃冰等的主要成分。
CH4 正四面体
1.烷烃
甲烷的主要化学性质:
(1)氧化反应
(2)取代/卤代反应
标况或常温下,简单的烯烃中,乙烯、丙烯、丁烯是气体,其他为液体或固体。
直链烯烃随着相对分子质量的增加,沸点升高。碳原子数相同的烯烃,支链越多,熔沸点越低。
与相应的烷烃相比,烯的沸点、水中溶解度都比烷烃略小些。
其密度一般比水小。
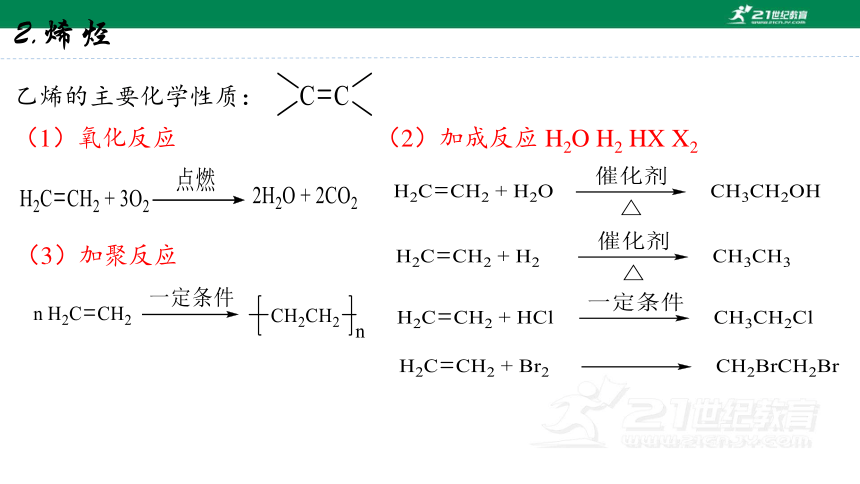
2.烯烃
烯烃的主要物理性质:
平面形
2.烯烃
乙烯的主要化学性质:
(1)氧化反应
(2)加成反应 H2O H2 HX X2
(3)加聚反应
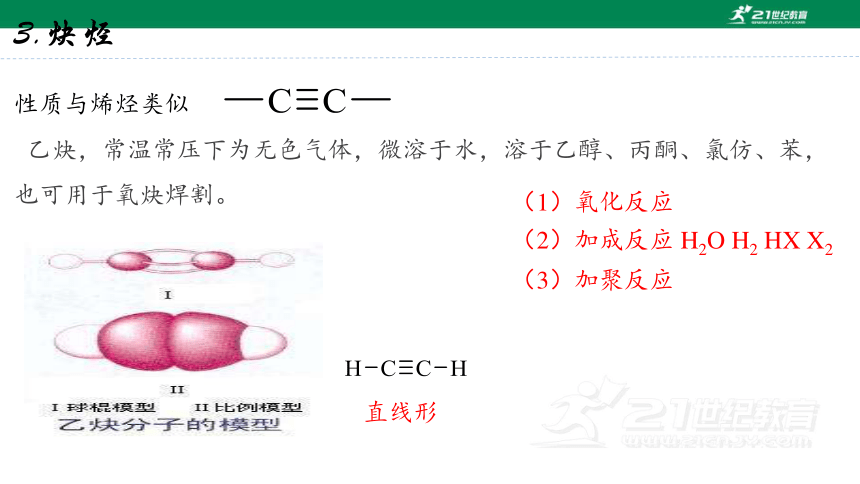
3.炔烃
性质与烯烃类似
乙炔,常温常压下为无色气体,微溶于水,溶于乙醇、丙酮、氯仿、苯,也可用于氧炔焊割。
(1)氧化反应
(2)加成反应 H2O H2 HX X2
(3)加聚反应
直线形
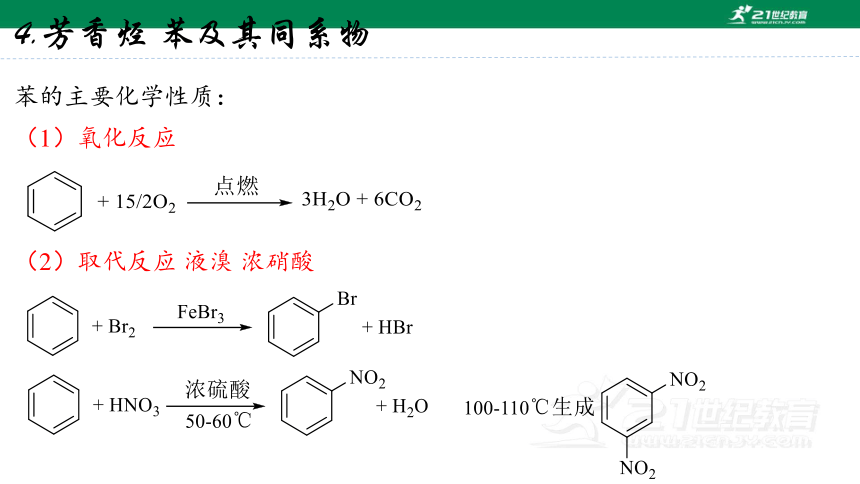
4.芳香烃 苯及其同系物
常温为易燃、易挥发、具有特殊芳香气味、无色液体。苯有剧毒,苯的密度比水小,苯难溶于水,是良好的有机溶剂。
苯的主要物理性质:
无碳碳双键或单双键交替的结构,12个原子共平面
苯的主要化学性质:
4.芳香烃 苯及其同系物
(1)氧化反应
(2)取代反应 液溴 浓硝酸
4.芳香烃 苯及其同系物
(3)加成反应
4.芳香烃 苯及其同系物
是一种无色、带特殊芳香味的易挥发液体,能与乙醇、乙醚、丙酮、氯仿、等混溶,不溶于水,密度比水小。
甲苯的主要物理性质:
5.卤代烃
卤代烃的主要物理性质:
常温下,大多数的卤代烃为液体,除了一氯甲烷、氯乙烷、氯乙烯等少数为气体外,其余多为液体或固体。
溴代烃、碘代烃及多卤代烃的密度比水大。
卤代烃难溶于水,但能溶于大多数有机溶剂,某些卤代烃本身就是很好的有机溶剂。
卤代烃的沸点随碳原子和卤素原子数目的增加而升高,且较相应的烷烃高。同一烃基的不同卤代烃的沸点随卤素原子的相对原子质量的增大而增大。
5.卤代烃
卤代烃的主要化学性质:
(1)消去反应
(2)取代反应
(3)加聚反应
6.醇
醇的主要物理性质:
一般来说,醇类化合物在常温常压下是液体。
低级醇能够与水混溶,尤其是含有三个以下碳原子的一元醇,可以和水以任意比例混合,如乙醇。高级醇随着碳链的增长,溶解度逐渐降低,高级醇在水中的溶解度降低,部分溶于水。
醇的熔沸点比含同数碳原子的烷烃、卤代烷高。这是因为醇分子间可以通过羟基形成氢键,增强了分子间的相互作用。一般来说, 随着碳链的增长,熔点也逐渐升高。
大多数醇具有特殊的气味和辛辣味道。
乙醇,俗称酒精,是常用的燃料、溶剂和消毒剂,在常温常压下是一种易挥发的无色透明液体,可以与水以任意比互溶,溶液具有酒香味,也可与多数有机溶剂混溶。分子间氢键的存在也使得乙醇的沸点高于相对分子质量相近的烷烃。
CH3CH2OH
6.醇
醇的主要化学性质:
(1)氧化反应
醇的催化氧化:断裂O-H键与α-C上的C-H键(2个H→醛,1个H→酮)
(2)取代反应
分子间脱水成醚
注意断键位置
酯化:酸失羟基,醇失氢
也可以与部分无机酸如HNO3在一定条件下反应
可以使酸性高锰酸钾溶液褪色
6.醇
(3)消去反应
分子内脱水:断裂C-O和β-C上C-H键
7.酚
苯酚的主要物理性质:
苯酚是是具有特殊气味的无色针状晶体,有毒,是生产某些树脂(酚醛树脂)的重要原料。熔点40.9℃,常温下微溶于水,易溶于有机溶剂,当温度高于65℃时,能跟水以任意比例互溶。苯酚暴露在空气中被氧气氧化呈粉红色。
常温下,苯酚能溶于水,静置后溶液分层,上层是溶有苯酚的水层,下层是溶有水的苯酚层。
最少有12个原子共平面,最多13个原子共平面
7.酚
苯酚的主要化学性质:
(1)取代反应 与Na NaOH Na2CO3
弱酸性:苯酚<碳酸<乙酸
注意取代基的位置
可使酸性高锰酸钾、溴水褪色
7.酚
(2)显色反应
向含有苯酚的溶液中加入三氯化铁溶液,溶液呈现紫色。
(3)缩聚反应 酚醛树脂的制备
取代的位置:邻位或对位
8.醛
醛的主要物理性质:
乙醛是无色、具有刺激性气味的液体,乙醛的密度比水小,沸点是20.8℃。乙醛易挥发,能与水、乙醇等互溶。
甲醛是一种无色气体,浓度较高时有强烈刺激性气味,能溶解于水,形成甲醛水溶液(35%-40%的甲醛水溶液——福尔马林。)
至少4原子共平面
8.醛
乙醛的主要化学性质:
(1)氧化反应
可使酸性高锰酸钾、溴水褪色(溴的四氯化碳溶液不褪色)
(2)银镜反应
(3)与新制Cu(OH)2反应
碱性条件下加热
8.醛
(3)缩聚反应 酚醛树脂的制备
(4)加成反应
书上:Ni、加热、加压
9.羧酸
乙酸在常温下是一种无色、有强烈刺激性气味的液体,纯的乙酸在低于熔点时会冻结成冰状晶体,因此无水乙酸也被称为冰醋酸。乙酸易溶于水和乙醇,其水溶液呈弱酸性。
乙酸的主要物理性质:
9.羧酸
(1)取代反应 与Na NaOH Na2CO3 NaHCO3
(2)缩聚反应
乙酸的主要化学性质:
10.酯
酯类都难溶于水,易溶于乙醇和乙醚等有机溶剂,密度一般比水小。
低分子量酯是无色、易挥发的芳香液体,高级饱和脂肪酸单酯常为无色无味的固体。
酯的主要物理性质:
乙酸乙酯是一种无色澄清液体,具有强烈的醚似的气味,微溶于水,但能溶于醇、酮、醚、氯仿等多数有机溶剂。
CH3COOCH2CH3
10.酯
酯的主要化学性质:
水解/取代反应:
回顾化学反应的分类——有机物的主要化学性质
1.取代反应:有机物中的原子或原子团被其他原子或原子团取代的反应。
2.加成反应:有机物中不饱和键两端原子与其他原子或原子团结合形成饱和或比较饱和有机物的反应。
3.消去反应:有机物脱去小分子形成不饱和键的反应。
4.加聚反应:含有不饱和键的化合物在一定条件下,单体间相互加成形成新高分子化合物的反应。
5.缩聚反应:有机化合物分子间脱去小分子形成高分子的反应。
6.氧化反应:加氧去氢
7.还原反应:加氢去氧
回顾化学反应的分类——有机物的主要化学性质
1.取代反应:(1)烷烃的卤代 (2)苯的溴代、硝化 (3)甲苯的硝化 (4)卤代烃的水解 (5)乙醇与Na、HX反应、分子间脱水反应 (6)酚与Na、NaOH、Na2CO3反应、溴代 (7)羧酸与Na、NaOH、Na2CO3、NaHCO3 (8)酯化反应 (9)酯的水解
2.加成反应:(1)与H2加成:烯烃、炔烃、芳香烃、酚、醛、酮 (2)与HX、X2、H2O加成
3.消去反应:(1)醇的分子内脱水 (2)卤代烃的消去
4.加聚反应:(1)含有不饱和碳碳键的有机物发生加聚
5.缩聚反应:(1)生成聚酯 (2)酚醛树脂的制备 (3)生成聚酰胺
6.氧化反应:(1)有机物和氧气的燃烧 (2)醇的催化氧化 (3)醛的氧化
(4)被酸性高锰酸钾氧化:烯烃、炔烃、α-C上有H的苯的同系物、醇、酚、醛
(5)醛的银镜反应、与新制Cu(OH)2反应
7.还原反应:(1)与H2加成 (2)-NO2还原为-NH2
不对称加成—马氏规则
回顾有机物之间的相互转化——官能团的引入与转化
有机物与无机试剂的特征反应
1.使酸性高锰酸钾溶液褪色:烯烃、炔烃、α-C上有H的苯的同系物、醇、酚、醛
2.使溴水褪色:烯烃、炔烃、酚、醛(不能使溴的四氯化碳褪色)
3.与Na反应:醇、酚、羧酸 与NaOH反应:卤代烃、酚、羧酸、酯、酰胺 与Na2CO3反应:酚、羧酸 与NaHCO3反应:羧酸
4.与新制Cu(OH)2反应:-CHO 醛、甲酸、甲酸某酯、甲酸盐、葡萄糖
5.与FeCl3显紫色:含有酚羟基的有机物
基团间的相互影响
基团对苯环的影响
苯环对基团的影响
苯环上有-CH3(烃基)、-OH、-NH2、-OR:取代基的邻位或对位
苯环上有-NO2、-CHO、-COOH、-CN、-COR:取代基的间位
基团对苯环的影响-取代的位置:
有机合成路线的设计
设计合成路线时,一般把反应物写在箭头的上方,把反应条件写在箭头的下方。
有机合成路线的设计
羟醛缩合反应:具有α-H的醛或酮,在稀NaOH溶液的催化下,α-H加成到羰基氧上,生成β-羟基醛或酮,然后受热脱水生成α,β-不饱和醛或酮。
习题训练
习题训练
习题训练
莫西赛利(化合物K)的合成路线:
以苯酚、乙烯和(CH3CO)2O为原料,无机试剂及有机催化剂任选合成
有机合成设计
专题5 药物合成的重要原料 卤代烃、胺、酰胺
第三单元 有机合成设计
1.烷烃
烷烃的主要物理性质:
碳原子数≤4的烷烃和新戊烷是气态,其他的烷烃常温下呈液态或固态。
随着碳原子数的增加,烷烃的熔沸点升高,密度升高。碳原子数相同的烷烃,支链越多,熔沸点越低。
烷烃可溶于有机溶剂中,不易溶于水中。
甲烷是一种密度比空气小、常温下无色无味的气体。甲烷是最简单的有机物。甲烷作为常规天然气、可燃冰等的主要成分。
CH4 正四面体
1.烷烃
甲烷的主要化学性质:
(1)氧化反应
(2)取代/卤代反应
标况或常温下,简单的烯烃中,乙烯、丙烯、丁烯是气体,其他为液体或固体。
直链烯烃随着相对分子质量的增加,沸点升高。碳原子数相同的烯烃,支链越多,熔沸点越低。
与相应的烷烃相比,烯的沸点、水中溶解度都比烷烃略小些。
其密度一般比水小。
2.烯烃
烯烃的主要物理性质:
平面形
2.烯烃
乙烯的主要化学性质:
(1)氧化反应
(2)加成反应 H2O H2 HX X2
(3)加聚反应
3.炔烃
性质与烯烃类似
乙炔,常温常压下为无色气体,微溶于水,溶于乙醇、丙酮、氯仿、苯,也可用于氧炔焊割。
(1)氧化反应
(2)加成反应 H2O H2 HX X2
(3)加聚反应
直线形
4.芳香烃 苯及其同系物
常温为易燃、易挥发、具有特殊芳香气味、无色液体。苯有剧毒,苯的密度比水小,苯难溶于水,是良好的有机溶剂。
苯的主要物理性质:
无碳碳双键或单双键交替的结构,12个原子共平面
苯的主要化学性质:
4.芳香烃 苯及其同系物
(1)氧化反应
(2)取代反应 液溴 浓硝酸
4.芳香烃 苯及其同系物
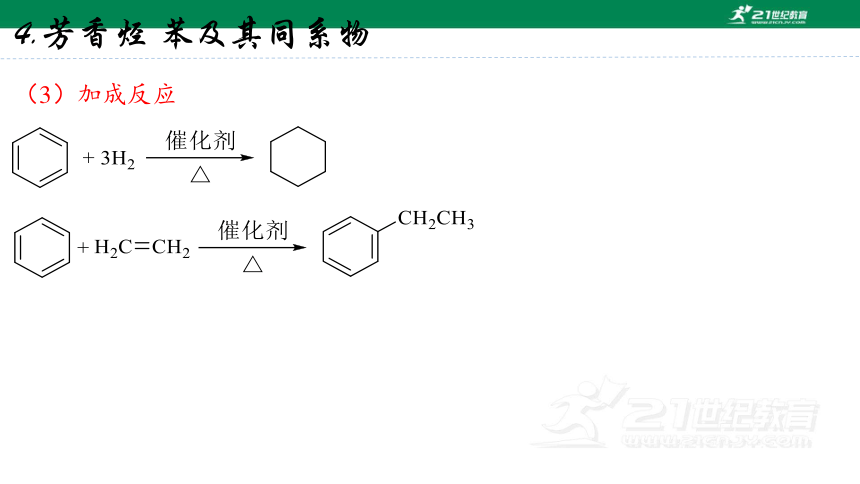
(3)加成反应
4.芳香烃 苯及其同系物
是一种无色、带特殊芳香味的易挥发液体,能与乙醇、乙醚、丙酮、氯仿、等混溶,不溶于水,密度比水小。
甲苯的主要物理性质:
5.卤代烃
卤代烃的主要物理性质:
常温下,大多数的卤代烃为液体,除了一氯甲烷、氯乙烷、氯乙烯等少数为气体外,其余多为液体或固体。
溴代烃、碘代烃及多卤代烃的密度比水大。
卤代烃难溶于水,但能溶于大多数有机溶剂,某些卤代烃本身就是很好的有机溶剂。
卤代烃的沸点随碳原子和卤素原子数目的增加而升高,且较相应的烷烃高。同一烃基的不同卤代烃的沸点随卤素原子的相对原子质量的增大而增大。
5.卤代烃
卤代烃的主要化学性质:
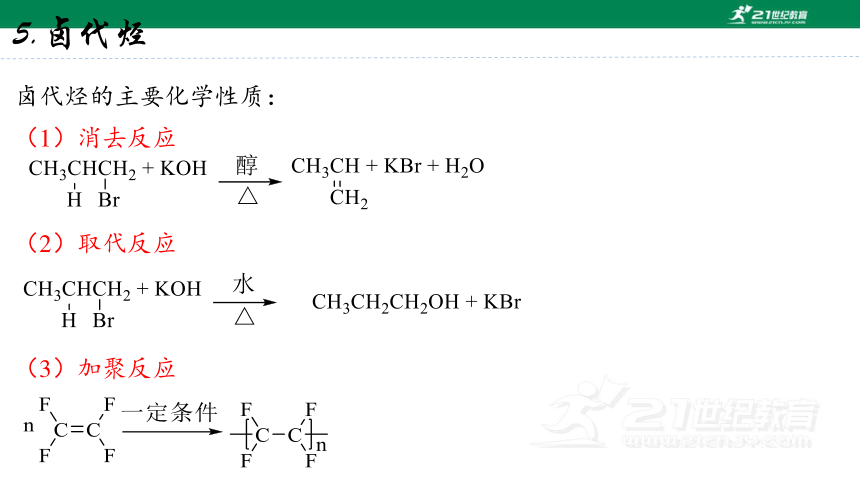
(1)消去反应
(2)取代反应
(3)加聚反应
6.醇
醇的主要物理性质:
一般来说,醇类化合物在常温常压下是液体。
低级醇能够与水混溶,尤其是含有三个以下碳原子的一元醇,可以和水以任意比例混合,如乙醇。高级醇随着碳链的增长,溶解度逐渐降低,高级醇在水中的溶解度降低,部分溶于水。
醇的熔沸点比含同数碳原子的烷烃、卤代烷高。这是因为醇分子间可以通过羟基形成氢键,增强了分子间的相互作用。一般来说, 随着碳链的增长,熔点也逐渐升高。
大多数醇具有特殊的气味和辛辣味道。
乙醇,俗称酒精,是常用的燃料、溶剂和消毒剂,在常温常压下是一种易挥发的无色透明液体,可以与水以任意比互溶,溶液具有酒香味,也可与多数有机溶剂混溶。分子间氢键的存在也使得乙醇的沸点高于相对分子质量相近的烷烃。
CH3CH2OH
6.醇
醇的主要化学性质:
(1)氧化反应
醇的催化氧化:断裂O-H键与α-C上的C-H键(2个H→醛,1个H→酮)
(2)取代反应
分子间脱水成醚
注意断键位置
酯化:酸失羟基,醇失氢
也可以与部分无机酸如HNO3在一定条件下反应
可以使酸性高锰酸钾溶液褪色
6.醇
(3)消去反应
分子内脱水:断裂C-O和β-C上C-H键
7.酚
苯酚的主要物理性质:
苯酚是是具有特殊气味的无色针状晶体,有毒,是生产某些树脂(酚醛树脂)的重要原料。熔点40.9℃,常温下微溶于水,易溶于有机溶剂,当温度高于65℃时,能跟水以任意比例互溶。苯酚暴露在空气中被氧气氧化呈粉红色。
常温下,苯酚能溶于水,静置后溶液分层,上层是溶有苯酚的水层,下层是溶有水的苯酚层。
最少有12个原子共平面,最多13个原子共平面
7.酚
苯酚的主要化学性质:
(1)取代反应 与Na NaOH Na2CO3
弱酸性:苯酚<碳酸<乙酸
注意取代基的位置
可使酸性高锰酸钾、溴水褪色
7.酚
(2)显色反应
向含有苯酚的溶液中加入三氯化铁溶液,溶液呈现紫色。
(3)缩聚反应 酚醛树脂的制备
取代的位置:邻位或对位
8.醛
醛的主要物理性质:
乙醛是无色、具有刺激性气味的液体,乙醛的密度比水小,沸点是20.8℃。乙醛易挥发,能与水、乙醇等互溶。
甲醛是一种无色气体,浓度较高时有强烈刺激性气味,能溶解于水,形成甲醛水溶液(35%-40%的甲醛水溶液——福尔马林。)
至少4原子共平面
8.醛
乙醛的主要化学性质:
(1)氧化反应
可使酸性高锰酸钾、溴水褪色(溴的四氯化碳溶液不褪色)
(2)银镜反应
(3)与新制Cu(OH)2反应
碱性条件下加热
8.醛
(3)缩聚反应 酚醛树脂的制备
(4)加成反应
书上:Ni、加热、加压
9.羧酸
乙酸在常温下是一种无色、有强烈刺激性气味的液体,纯的乙酸在低于熔点时会冻结成冰状晶体,因此无水乙酸也被称为冰醋酸。乙酸易溶于水和乙醇,其水溶液呈弱酸性。
乙酸的主要物理性质:
9.羧酸
(1)取代反应 与Na NaOH Na2CO3 NaHCO3
(2)缩聚反应
乙酸的主要化学性质:
10.酯
酯类都难溶于水,易溶于乙醇和乙醚等有机溶剂,密度一般比水小。
低分子量酯是无色、易挥发的芳香液体,高级饱和脂肪酸单酯常为无色无味的固体。
酯的主要物理性质:
乙酸乙酯是一种无色澄清液体,具有强烈的醚似的气味,微溶于水,但能溶于醇、酮、醚、氯仿等多数有机溶剂。
CH3COOCH2CH3
10.酯
酯的主要化学性质:
水解/取代反应:
回顾化学反应的分类——有机物的主要化学性质
1.取代反应:有机物中的原子或原子团被其他原子或原子团取代的反应。
2.加成反应:有机物中不饱和键两端原子与其他原子或原子团结合形成饱和或比较饱和有机物的反应。
3.消去反应:有机物脱去小分子形成不饱和键的反应。
4.加聚反应:含有不饱和键的化合物在一定条件下,单体间相互加成形成新高分子化合物的反应。
5.缩聚反应:有机化合物分子间脱去小分子形成高分子的反应。
6.氧化反应:加氧去氢
7.还原反应:加氢去氧
回顾化学反应的分类——有机物的主要化学性质
1.取代反应:(1)烷烃的卤代 (2)苯的溴代、硝化 (3)甲苯的硝化 (4)卤代烃的水解 (5)乙醇与Na、HX反应、分子间脱水反应 (6)酚与Na、NaOH、Na2CO3反应、溴代 (7)羧酸与Na、NaOH、Na2CO3、NaHCO3 (8)酯化反应 (9)酯的水解
2.加成反应:(1)与H2加成:烯烃、炔烃、芳香烃、酚、醛、酮 (2)与HX、X2、H2O加成
3.消去反应:(1)醇的分子内脱水 (2)卤代烃的消去
4.加聚反应:(1)含有不饱和碳碳键的有机物发生加聚
5.缩聚反应:(1)生成聚酯 (2)酚醛树脂的制备 (3)生成聚酰胺
6.氧化反应:(1)有机物和氧气的燃烧 (2)醇的催化氧化 (3)醛的氧化
(4)被酸性高锰酸钾氧化:烯烃、炔烃、α-C上有H的苯的同系物、醇、酚、醛
(5)醛的银镜反应、与新制Cu(OH)2反应
7.还原反应:(1)与H2加成 (2)-NO2还原为-NH2
不对称加成—马氏规则
回顾有机物之间的相互转化——官能团的引入与转化
有机物与无机试剂的特征反应
1.使酸性高锰酸钾溶液褪色:烯烃、炔烃、α-C上有H的苯的同系物、醇、酚、醛
2.使溴水褪色:烯烃、炔烃、酚、醛(不能使溴的四氯化碳褪色)
3.与Na反应:醇、酚、羧酸 与NaOH反应:卤代烃、酚、羧酸、酯、酰胺 与Na2CO3反应:酚、羧酸 与NaHCO3反应:羧酸
4.与新制Cu(OH)2反应:-CHO 醛、甲酸、甲酸某酯、甲酸盐、葡萄糖
5.与FeCl3显紫色:含有酚羟基的有机物
基团间的相互影响
基团对苯环的影响
苯环对基团的影响
苯环上有-CH3(烃基)、-OH、-NH2、-OR:取代基的邻位或对位
苯环上有-NO2、-CHO、-COOH、-CN、-COR:取代基的间位
基团对苯环的影响-取代的位置:
有机合成路线的设计
设计合成路线时,一般把反应物写在箭头的上方,把反应条件写在箭头的下方。
有机合成路线的设计
羟醛缩合反应:具有α-H的醛或酮,在稀NaOH溶液的催化下,α-H加成到羰基氧上,生成β-羟基醛或酮,然后受热脱水生成α,β-不饱和醛或酮。
习题训练
习题训练
习题训练
莫西赛利(化合物K)的合成路线:
以苯酚、乙烯和(CH3CO)2O为原料,无机试剂及有机催化剂任选合成
