苏教版高中化学5选择性必修3有机化学基础专题3有机物的结构与分类3.1.1脂肪烃的类别、烷烃的性质课件
文档属性
| 名称 | 苏教版高中化学5选择性必修3有机化学基础专题3有机物的结构与分类3.1.1脂肪烃的类别、烷烃的性质课件 |

|
|
| 格式 | ppt | ||
| 文件大小 | 7.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-23 09:38:45 | ||
图片预览






文档简介
(共60张PPT)
3.1.2
专
题
3
一、烃的类别及脂肪烃的物理性质
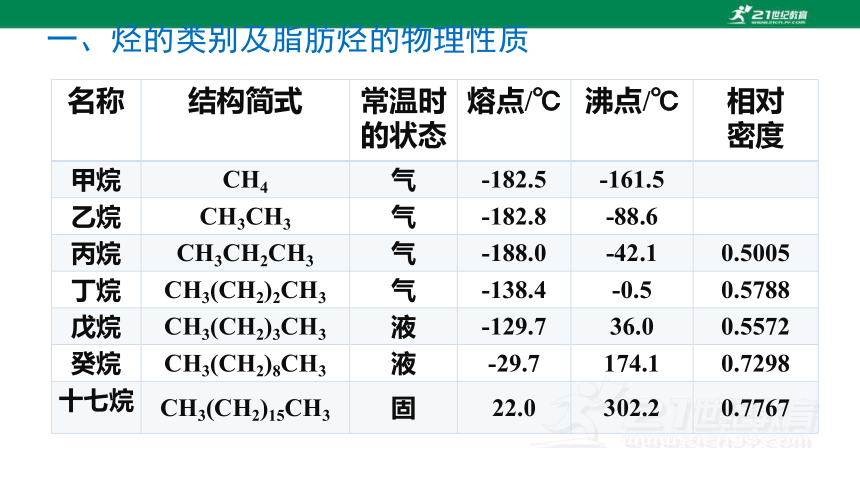
甲烷是最简单的有机物;
也是结构最简单的烷烃;
也是含碳量最小(含氢量最大)的烃 。
名称 结构简式 常温时的状态 熔点/℃ 沸点/℃ 相对
密度
甲烷 CH4 气 -182.5 -161.5
乙烷 CH3CH3 气 -182.8 -88.6
丙烷 CH3CH2CH3 气 -188.0 -42.1 0.5005
丁烷 CH3(CH2)2CH3 气 -138.4 -0.5 0.5788
戊烷 CH3(CH2)3CH3 液 -129.7 36.0 0.5572
癸烷 CH3(CH2)8CH3 液 -29.7 174.1 0.7298
十七烷 CH3(CH2)15CH3 固 22.0 302.2 0.7767
一、烃的类别及脂肪烃的物理性质
一、烃的类别及脂肪烃的物理性质
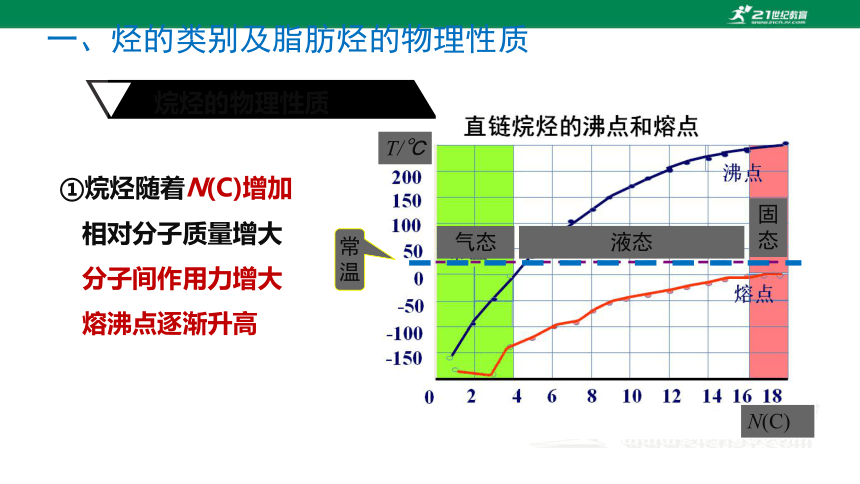
①烷烃随着N(C)增加
相对分子质量增大
分子间作用力增大
熔沸点逐渐升高
气态
常温
液态
固态
N(C)
T/℃
烷烃的物理性质
一、烃的类别及脂肪烃的物理性质
烷烃的物理性质
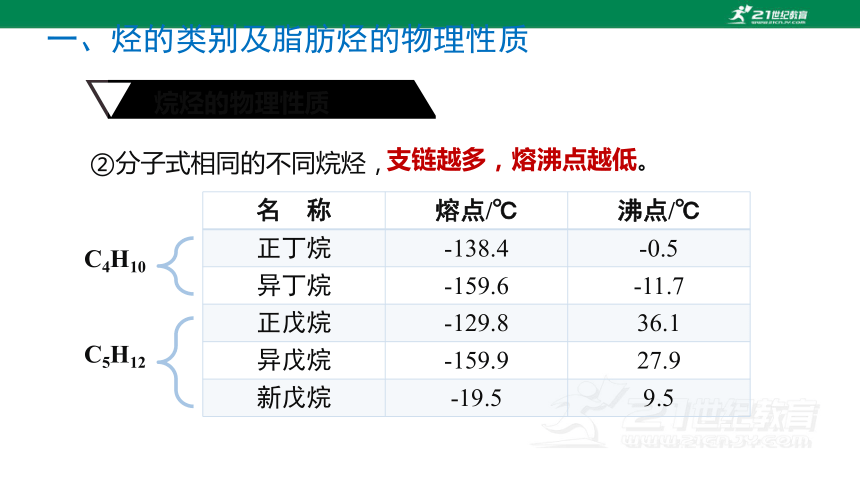
②分子式相同的不同烷烃,
名 称 熔点/℃ 沸点/℃
正丁烷 -138.4 -0.5
异丁烷 -159.6 -11.7
正戊烷 -129.8 36.1
异戊烷 -159.9 27.9
新戊烷 -19.5 9.5
C4H10
C5H12
支链越多,熔沸点越低。
一、烃的类别及脂肪烃的物理性质
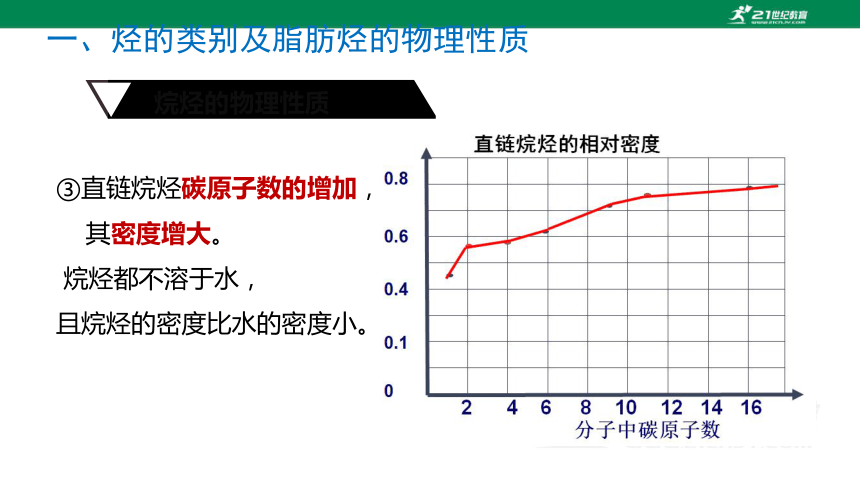
③直链烷烃碳原子数的增加,
其密度增大。
烷烃都不溶于水,
且烷烃的密度比水的密度小。
烷烃的物理性质
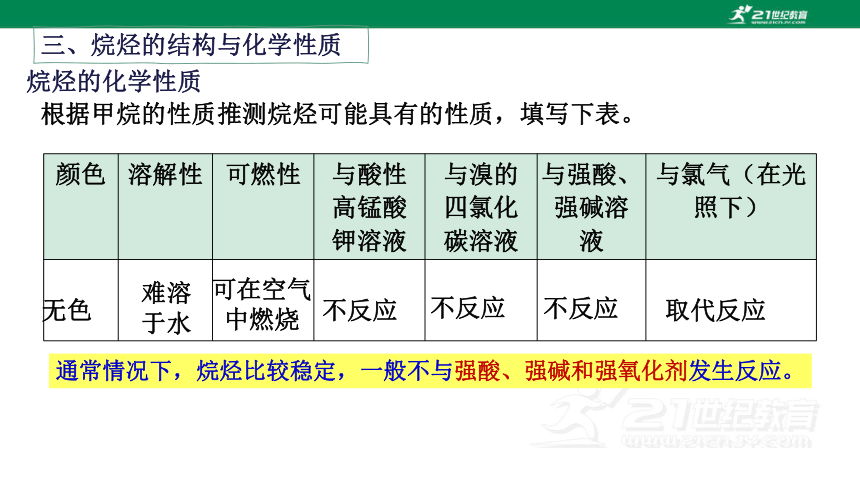
根据甲烷的性质推测烷烃可能具有的性质,填写下表。
颜色 溶解性 可燃性 与酸性高锰酸钾溶液 与溴的四氯化碳溶液 与强酸、强碱溶液 与氯气(在光照下)
无色
难溶
于水
可在空气中燃烧
不反应
取代反应
不反应
不反应
通常情况下,烷烃比较稳定,一般不与强酸、强碱和强氧化剂发生反应。
三、烷烃的结构与化学性质
烷烃的化学性质
(1).燃烧反应
甲烷与氧气反应(可燃性)
CH4+2O2 CO2+2H2O
点燃
注意:有机反应用“→”,不用“=”
现象:安静燃烧,火焰明亮,呈淡蓝色,
产生使澄清石灰水变浑浊的气体,放热。
【练一练】试写出C8H18的燃烧方程式
烷烃燃烧的递变规律:
含碳量少,则火焰为淡蓝色;
含碳量多,则火焰为黄色,且伴有黑烟。
二、烷烃的化学性质
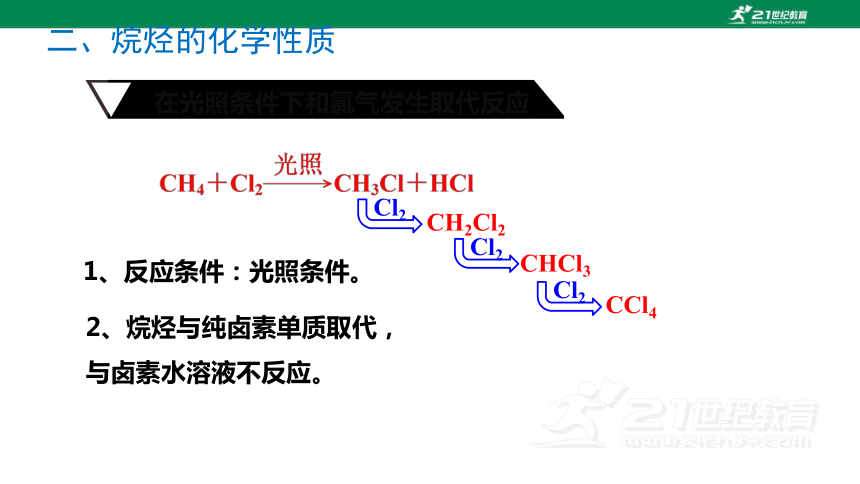
在光照条件下和氯气发生取代反应
CH2Cl2
CHCl3
Cl2
Cl2
Cl2
CCl4
2、烷烃与纯卤素单质取代,与卤素水溶液不反应。
1、反应条件:光照条件。
(2).取代反应
注:①甲烷的四种氯代物:CH3Cl、CH2Cl2、CHCl3、CCl4均难溶于水。 CHCl3和CCl4是工业上重要的溶剂
②CH4与Cl2的反应是逐步进行的,书写化学方程式时应分步书写。
③每取代1 mol氢原子,消耗1 mol Cl2,生成1 mol HCl
CH4 + Cl2 CH3Cl + HCl
光
CH3Cl + Cl2 CH2Cl2 + HCl
光
CH2Cl2 + Cl2 CHCl3 + HCl
光
CHCl3 + Cl2 CCl4 + HCl
光
一氯甲烷(无色气体)
二氯甲烷(难溶于水的无色液体)
三氯甲烷又叫氯仿 (有机溶剂)
四氯化碳(有机溶剂、灭火剂)
CH4与Cl2发生取代反应时,每有1 mol H被取代,则消耗1 mol Cl2,同时生成1 mol HCl,即n(Cl2)=n(H)=n(HCl)。
1 mol CH4与Cl2发生取代反应,最多消耗4 mol Cl2。
甲烷取代反应中的数量关系
二、烷烃的化学性质
二、烷烃的化学性质
思考:
如何判断烷烃与卤素单质反应生成一取代产物的种类?
烷烃分子中有几种不同化学环境的氢原子,就有几种一取代产物。
H
1
2
3
C
H
—
—
C
—
H
—
H
—
C
H
—
—
H
—
—
H
H
—
丙烷的一氯代物有两种同分异构体
二、烷烃的化学性质
燃烧通式:
CxHy + O2 xCO2 + H2O
2
y
4
y
( x+
)
烃的燃烧规律
点燃
在空气中能燃烧
二、烷烃的化学性质
100g烃 乙烷 乙烯 乙炔
碳元素的
质量分数 0.80 0.86 0.92
完全燃烧
放出热量 5200kJ 5040kJ 5000kJ
根据下表思考,人们倾向于选择哪种烃作为燃料呢?
质量相同的烃,碳元素的质量分数越低,完全燃烧时放出的热量越多。
二、烷烃的化学性质
烷烃的种类很多,人们倾向于选择哪种烷烃作为燃料呢?
烷烃 甲烷 丙烷 戊烷 庚烷
碳、氢原子个数比 1:4 3:8 5:12 7:16
碳元素的
质量分数 75% 81.8% 83.3% 84%
人们倾向于选用烷烃中相对分子质量小的烷烃作为燃料。
天然气主要成分是甲烷
一、烯烃的结构
1.官能团:
2.链状单烯烃通式:
碳碳双键
随碳原子数增多,碳原子质量分数 ,氢原子质量分数 。
不变
不变
单烯烃与同碳原子数的环烷烃是同分异构体
3.烯烃的结构:
能
sp3和sp2
同系物
三、烯烃的物理性质
颜色 气味 状态 溶解度 密度
稍有气味
无色
气体
难溶于水
比空气略小
用排水法收集乙烯
1.随着分子中碳原子数的增多,烯烃同系物的物理性质呈现规律性变化,即熔沸点逐渐升高,密度逐渐增大。
2.常温下:当C1-C4时呈气态; C5-C16时呈液态; C17以上时呈固态。
3.所有烯烃均难溶于水,密度均小于1。
4.分子式相同的烃,支链越多,熔沸点越低。
三、烯烃的物理性质
1.加成反应:
(与H2、Br2、HX、H2O等)
有机物分子中未饱和的碳原子跟其它原子或原子团直接结合生成别的物质的反应。
①加成原理:
②加成通式:
C=C
+X—Y →
C—C
X Y
加成:断一加二,
只上不下。
取代:上一下一,
有进有出
四、烯烃的化学性质
与H2、Br2、HX、H2O等
CH2=CH2+Br2 CH2BrCH2Br
使溴水/溴的四氯化碳褪色褪色
CH=CH2 + HCl CH3CH2Cl
一定条件
烯烃与卤化氢的加成也常用于制备卤代烃
CH=CH2 + H2 O CH3CH2OH
催化剂
△
乙烯与水的反应也称为乙烯的水化,是工业制乙醇的方法之一
CH3-CH=CH2 + H2 CH3CH2CH3
催化剂
四、烯烃的化学性质
烯烃的不对称加成反应
当不对称烯烃与含氢化合物(HBr、H2O等)加成时,H原子主要加到连有较多H原子的C原子上(马氏规则)
【提问】试写出CH2=CH-CH3与HBr的反应。
CH2=CH-CH3
CH2-CH-CH3
| |
H Br
CH2-CH-CH3
| |
Br H
主要产物
+ HBr
(2)多烯烃的加成反应
分子中含有多个双键的烃称为多烯烃。多烯烃发生加成反应可能出现多种加成产物。
1.概念:
2.通式:
3.分类(基于双键的相对位置):
一、二烯烃的结构
分子中含有两个碳碳双键的烯烃
累积二烯烃:双键连在同一C原子上。
共轭二烯烃:两双键被一个单键隔开。
孤立二烯烃:双键被多个单键隔开。
4.最简单的共轭二烯烃:
1,3-丁二烯
是一个平面型分子
1.共轭二烯烃的加成反应:
2.共轭二烯烃和1molBr2加成反应:
二、二烯烃的加成反应
CH2=CH—CH=CH2 + 2Br2 (足量)→
CH2 — CH—CH — CH2
Br Br Br Br
CH2=CH—CH=CH2 + 2Br2 →
CH2-CH-CH=CH2
| |
Br Br
1,2加成
CH2-CH=CH-CH2
| |
Br Br
1,4加成
3,4-二溴-1-丁烯
1,4-二溴-2-丁烯
1,3-丁二烯的1,2-加成和1,4-加成是竞争反应,到底哪一种加成产物占优势取决于反应条件。
已知共轭二烯烃(两个碳碳双键间有一个碳碳单键)与烯或炔可发生反应生成六元环状化合物,如1,3-丁二烯与乙烯反应可表示为:
则异戊二烯( )与丙烯反应,生成的产物的结构简式可能是
(2)氧化反应
①烯烃易燃烧,燃烧时火焰明亮并伴有____,单烯烃燃烧通式为_____________________________。
②烯烃可被酸性高锰酸钾溶液氧化,故烯烃可使酸性高锰酸钾溶液____。
黑烟
褪色
四、烯烃的化学性质
3.氧化反应:
②与酸性高锰酸钾溶液反应
现象:
酸性高锰酸钾溶液褪色
反应方程式:
5C2H4+ 12KMnO4 + 18H2SO4= 12MnSO4+10CO2+28H2O+6K2SO4
应用:
鉴别乙烯(与烷烃比)
【思考】能不能仅用酸性高锰酸钾除去乙烷中的乙烯?
不能,会产生CO2,应在后面通入氢氧化钠溶液去除CO2。
烯烃与酸性高锰酸钾溶液反应的产物
CH2=
CO2
KMnO4
H+
KMnO4
H+
C=O
R1
R2
C=
R1
R2
酮
R—CH=
R—COOH
KMnO4
H+
羧酸
二氢成CO2
一氢成羧基
无氢成羰基
【练一练】试写出CH2=CHCH2C=CHCH2CH3与酸性高锰酸钾溶液反应的产物?
R—CH=CH2
KMnO4
H+
R—COOH+CO2
一、炔烃的结构
1.官能团:
2.链状单炔烃通式:
碳碳三键
单炔烃与同碳原子数的二烯烃是同分异构体
3.烯烃的结构(以乙炔为例)
—C 三 C—
直线型
sp杂化
3个
2个
2.加成反应(与反应物的量有关,可分步表示)
①催化加氢
②使溴水褪色
CH≡CH+Br2 CH=CH
Br
Br
CH=CH+Br2 CH—CH
Br
Br
Br
Br
Br
Br
1 , 2 —二溴乙烯
1 , 1 , 2 , 2 —四溴乙烷
CH≡CH+H2
催化剂
△
CH2=CH2
(少量氢气)
(足量氢气)
催化剂
△
CH≡CH+2H2
CH3CH3
三、炔烃的化学性质
三、炔烃的化学性质
2.加成反应:
CH≡CH+Br2(不足) →CHBr=CHBr;
CH≡CH+2Br2(过量)→ CHBr2—CHBr2
△
CH≡CH+H2O CH3CHO(工业制乙醛)
CH=CH
H OH
不稳定转化
有机中注意两个双键不能相邻,碳碳双键上不能连羟基,同一个碳上不连两个羟基,因为都不稳定。
乙炔在HgSO4和稀硫酸的的催化下,可以与水发生加成反应。
①可燃性
O2
2CO2+2H2O
C2H4+ 3
甲烷
乙烯
乙炔
火焰明亮,并伴有浓烟
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,点燃前要验纯!
含碳量不同导致燃烧现象
有所不同,可用于三者鉴别
1.乙炔的氧化反应
②使酸性KMnO4溶液褪色
2KMnO4+ 3H2SO4+ C2H2→2MnSO4+ K2SO4+2CO2↑+ 4H2O
有机化合物的含碳量越高,火焰越明亮,黑烟越浓。
三、炔烃的化学性质
CaC2+2H2O Ca(OH)2+C2H2↑(剧烈)
原料:
原理:
为得到平稳乙炔气流常用饱和NaCl水溶液代替水
电石(CaC2 )、水
二、乙炔的实验室制法
乙炔的实验室制法及性质
实验内容 实验现象
(1)将饱和氯化钠溶液滴入盛有电石的烧瓶中
(2)将纯净的乙炔通入盛有酸性高锰酸钾溶液的试管中
(3)将纯净的乙炔通入盛有溴的四氯化碳溶液的试管中
反应剧烈,放热,有气体产生
酸性高锰酸钾溶液褪色
溴的四氯化碳溶液褪色
1.乙炔的实验室制法
乙炔的实验室制法及性质
精讲:
(1) 制取乙炔时能否使用启普发生器?
①使用饱和食盐水 ②控制饱和食盐水的滴加速度
(3) 在乙炔的性质实验之前为什么要除去硫化氢,
是如何除去呢?
放出的大量热量,操作不当会使启普发生器炸裂。
(2)电石与水反应非常剧烈,为了获得平稳的乙炔气流,需要采取哪些措施?
硫化氢有还原性会干扰实验,使用硫酸铜溶液除去
(4)在点燃乙炔之前需要进行的实验操作是什么?
收集一试管乙炔,验纯
1.乙炔的实验室制法
乙炔的实验室制法及性质
精讲:
导气管口附近塞入少量棉的作用是什么?
用试管作反应容器制取乙炔时,由于CaC2和水反应剧烈并产生泡沫,为防止产生的泡沫涌入导气管,应在导气管附近塞入少量棉花。
制取乙炔不能用启普发生器或具有启普发生器原理的实验装置,原因是什么?
①碳化钙吸水性强,与水反应剧烈,不能随用、随停。
②反应过程中放出大量的热,易使启普发生器炸裂。
③生成的Ca(OH)2呈糊状易堵塞球形漏斗。
装置的作用
装置①
反应装置,作用:产生乙炔。
装置②
除杂装置,作用:除去杂质H2S、PH3。
装置③
检验装置,作用:检验乙炔是否产生。
装置④
反应装置,作用:乙炔与溴的四氯化碳溶液反应。
装置⑤
尾气处理装置,作用:去除未反应的乙炔。
烷烃、烯烃、炔烃结构和性质的比较
烃 烷烃 烯烃 炔烃
通式 CnH2n+2
(n≥1) CnH2n
(n≥2) CnH2n-2
(n≥2)
代表物 CH4 CH2===CH2 CH≡CH
结构特点 全部为单键;饱和链烃;正四面体结构 含碳碳双键;不饱和链烃;平面形分子,键角120° 含碳碳三键;不饱和链烃;直线形分子,键角180°
烃 烷烃 烯烃 炔烃
化学性质 取代反应 在光照条件下发生卤代反应 — —
加成反应 — 能与H2、X2、HX、H2O、HCN等发生加成反应
氧化反应 燃烧火焰较明亮 燃烧火焰明亮,伴有黑烟 燃烧火焰很明亮,伴有浓烈的黑烟
不与酸性KMnO4溶液反应 能使酸性KMnO4溶液褪色
加聚反应 不能发生 能发生
鉴别 不能使溴水或酸性KMnO4溶液褪色 能使溴水或酸性 KMnO4 溶液褪色
03
加聚反应
PART THREE
一、加聚反应的概念
加聚反应:
相对分子质量小的化合物相互加成聚合成相对分子质量大的聚合物
单体:聚合成高分子化合物的小分子化合物,如CH2=CH2;
链节:高分子化合物中的最小重复单元,如 — CH2 — CH2 —;
聚合度:高分子化合物中的链节数,如聚乙烯中的n。
链节中含多个碳原子的单体的判断方法-一边赶法
去掉[ ]和n,将链节中的一个键从左向右折叠,单变双,双变单,遇到碳超过4价,则断开。
―→
―→CH2==CF2和CF2==CF—CF3。
二、加聚产物单体的判断方法
,单体为________________;
,单体为___________________;
CH3CH==CHCH3
二、加聚产物单体的判断方法
如 ,单体为____________和_____________。
如 ,单体为 。
CH2==CH2
CH3CH==CH2
二、加聚产物单体的判断方法
①乙烯型加聚反应
nR1-CH=CH-R2
一定条件
CH CH
[
]
n
R1 R2
非氢基团写上下方,主链双键变单键
【练一练】试写出丙烯、2-甲基丙烯的加聚反应?
nCH2=CH-CH3
一定条件
CH2 CH
[
]
n
CH3
nCH2=C-CH3
一定条件
CH2 C
[
]
n
CH3
CH3
CH3
二、加聚反应的类型
注意:聚合物均是混合物。
②混合型加聚反应
二、加聚反应的类型
[ CH2-CH2-CH2-CH=CH-CH2 ] n
nCH2=CH2 + nCH2=CH-CH3
[ CH2-CH2-CH2-CH ] n
催化剂
CH3
|
或 [ CH2-CH2-CH-CH2 ] n
CH3
|
nCH2=CH2 + nCH2=CH-CH=CH2
催化剂
二、炔烃的化学性质
3.加聚反应:
nCH CH
CH=CH
n
加温、加压
催化剂
还可以三分子聚合
3CH CH
加温、加压
催化剂
聚乙炔
导电塑料
常用于烃类鉴别与检验的试剂和现象
(1)用酸性高锰酸钾溶液鉴别
不褪色——
褪色——
烷烃、环烷烃、苯
烯烃、二烯烃、炔烃、苯的同系物等
(2)用溴水鉴别
褪色
加成反应——
烯烃、炔烃等不饱和烃
萃取——
苯及其同系物、液态烷烃、液态环烷烃
不褪色——
气态烷烃、气态环烷烃
三、乙炔的用途
①加成反应:制塑料,合成纤维。
②乙炔水化法制乙醛。
③氧炔焰:切割或焊接金属。
02
石油的炼制
PART TWO
一、石油的成分
1.石油的成分:
脂肪烃的来源有石油、天然气和煤等。
主要是由 、 和 组成组成的混合物,其中还含有少量不属于烃的物质。
气态烃
固态烃
液态烃
2.石油的炼制:
分馏、裂化、裂解等。
二、石油的分馏
1. 分馏原理:
根据沸点不同,通过加热汽化,然后冷凝,把石油分成不同沸点范围内的产物。
常压分馏:主要产品有石油气、汽油、煤油、轻柴油等。
减压分馏:主要产品有重柴油、润滑油、石蜡、燃料油等。
2. 分类:
常压分馏
塔内越往上温度越低,
蒸出的馏分沸点越低。
注意:
各馏分均为混合物。
减压分馏
三、石油的裂化
1. 裂化原理:
使具有 在高温下发生反应生成 的方法。
催化裂化和热裂化
2. 分类:
较长碳链的烃
短链烃
3. 目的:
提高轻质油的产量。
(轻质油:低沸点的汽油,. 一般泛指沸点范围约50~350℃的烃类混合物)
4. 举例:
C16H34
催化剂
加热、 加压
C8H18
辛烷
+ C8H16
辛烯
裂化汽油中含有不饱和烃
四、石油的裂解
1. 裂解原理:
与裂化原理相同,由 生产气态烯烃,又称深度裂化。
轻质油
2. 目的:
获得乙烯、丙烯等气态短链烃,为石油化工提供原料。
3. 举例:
C4H8
2C2H4
催化剂
加热、 加压
C8H18
C4H10 + C4H8
催化剂
加热、 加压
C4H10
C2H4 + C2H6
催化剂
加热、 加压
分馏 ①原理:利用原油中各组分 的不同进行分离
②产物:获得汽油、煤油、柴油等含碳原子少的轻质油(直馏汽油)
裂化 ①原理:将含碳原子数较多、沸点较高的烃 为碳原子数较少、 沸点较低的烃的过程。
如C16H34 C8H18+C8H16
②产物: 。
裂解 ①原理:裂解就是 ,得到碳原子数更小的烃类。
C8H18 C4H10+C4H8
C4H10 CH4+C3H6
C4H10 C2H6+C2H4
②产物: 。
沸点
断裂
碳原子数较少、沸点较低的烃
深度裂化
短链不饱和烃,如乙烯
石油的炼制工艺
3.1.2
专
题
3
一、烃的类别及脂肪烃的物理性质
甲烷是最简单的有机物;
也是结构最简单的烷烃;
也是含碳量最小(含氢量最大)的烃 。
名称 结构简式 常温时的状态 熔点/℃ 沸点/℃ 相对
密度
甲烷 CH4 气 -182.5 -161.5
乙烷 CH3CH3 气 -182.8 -88.6
丙烷 CH3CH2CH3 气 -188.0 -42.1 0.5005
丁烷 CH3(CH2)2CH3 气 -138.4 -0.5 0.5788
戊烷 CH3(CH2)3CH3 液 -129.7 36.0 0.5572
癸烷 CH3(CH2)8CH3 液 -29.7 174.1 0.7298
十七烷 CH3(CH2)15CH3 固 22.0 302.2 0.7767
一、烃的类别及脂肪烃的物理性质
一、烃的类别及脂肪烃的物理性质
①烷烃随着N(C)增加
相对分子质量增大
分子间作用力增大
熔沸点逐渐升高
气态
常温
液态
固态
N(C)
T/℃
烷烃的物理性质
一、烃的类别及脂肪烃的物理性质
烷烃的物理性质
②分子式相同的不同烷烃,
名 称 熔点/℃ 沸点/℃
正丁烷 -138.4 -0.5
异丁烷 -159.6 -11.7
正戊烷 -129.8 36.1
异戊烷 -159.9 27.9
新戊烷 -19.5 9.5
C4H10
C5H12
支链越多,熔沸点越低。
一、烃的类别及脂肪烃的物理性质
③直链烷烃碳原子数的增加,
其密度增大。
烷烃都不溶于水,
且烷烃的密度比水的密度小。
烷烃的物理性质
根据甲烷的性质推测烷烃可能具有的性质,填写下表。
颜色 溶解性 可燃性 与酸性高锰酸钾溶液 与溴的四氯化碳溶液 与强酸、强碱溶液 与氯气(在光照下)
无色
难溶
于水
可在空气中燃烧
不反应
取代反应
不反应
不反应
通常情况下,烷烃比较稳定,一般不与强酸、强碱和强氧化剂发生反应。
三、烷烃的结构与化学性质
烷烃的化学性质
(1).燃烧反应
甲烷与氧气反应(可燃性)
CH4+2O2 CO2+2H2O
点燃
注意:有机反应用“→”,不用“=”
现象:安静燃烧,火焰明亮,呈淡蓝色,
产生使澄清石灰水变浑浊的气体,放热。
【练一练】试写出C8H18的燃烧方程式
烷烃燃烧的递变规律:
含碳量少,则火焰为淡蓝色;
含碳量多,则火焰为黄色,且伴有黑烟。
二、烷烃的化学性质
在光照条件下和氯气发生取代反应
CH2Cl2
CHCl3
Cl2
Cl2
Cl2
CCl4
2、烷烃与纯卤素单质取代,与卤素水溶液不反应。
1、反应条件:光照条件。
(2).取代反应
注:①甲烷的四种氯代物:CH3Cl、CH2Cl2、CHCl3、CCl4均难溶于水。 CHCl3和CCl4是工业上重要的溶剂
②CH4与Cl2的反应是逐步进行的,书写化学方程式时应分步书写。
③每取代1 mol氢原子,消耗1 mol Cl2,生成1 mol HCl
CH4 + Cl2 CH3Cl + HCl
光
CH3Cl + Cl2 CH2Cl2 + HCl
光
CH2Cl2 + Cl2 CHCl3 + HCl
光
CHCl3 + Cl2 CCl4 + HCl
光
一氯甲烷(无色气体)
二氯甲烷(难溶于水的无色液体)
三氯甲烷又叫氯仿 (有机溶剂)
四氯化碳(有机溶剂、灭火剂)
CH4与Cl2发生取代反应时,每有1 mol H被取代,则消耗1 mol Cl2,同时生成1 mol HCl,即n(Cl2)=n(H)=n(HCl)。
1 mol CH4与Cl2发生取代反应,最多消耗4 mol Cl2。
甲烷取代反应中的数量关系
二、烷烃的化学性质
二、烷烃的化学性质
思考:
如何判断烷烃与卤素单质反应生成一取代产物的种类?
烷烃分子中有几种不同化学环境的氢原子,就有几种一取代产物。
H
1
2
3
C
H
—
—
C
—
H
—
H
—
C
H
—
—
H
—
—
H
H
—
丙烷的一氯代物有两种同分异构体
二、烷烃的化学性质
燃烧通式:
CxHy + O2 xCO2 + H2O
2
y
4
y
( x+
)
烃的燃烧规律
点燃
在空气中能燃烧
二、烷烃的化学性质
100g烃 乙烷 乙烯 乙炔
碳元素的
质量分数 0.80 0.86 0.92
完全燃烧
放出热量 5200kJ 5040kJ 5000kJ
根据下表思考,人们倾向于选择哪种烃作为燃料呢?
质量相同的烃,碳元素的质量分数越低,完全燃烧时放出的热量越多。
二、烷烃的化学性质
烷烃的种类很多,人们倾向于选择哪种烷烃作为燃料呢?
烷烃 甲烷 丙烷 戊烷 庚烷
碳、氢原子个数比 1:4 3:8 5:12 7:16
碳元素的
质量分数 75% 81.8% 83.3% 84%
人们倾向于选用烷烃中相对分子质量小的烷烃作为燃料。
天然气主要成分是甲烷
一、烯烃的结构
1.官能团:
2.链状单烯烃通式:
碳碳双键
随碳原子数增多,碳原子质量分数 ,氢原子质量分数 。
不变
不变
单烯烃与同碳原子数的环烷烃是同分异构体
3.烯烃的结构:
能
sp3和sp2
同系物
三、烯烃的物理性质
颜色 气味 状态 溶解度 密度
稍有气味
无色
气体
难溶于水
比空气略小
用排水法收集乙烯
1.随着分子中碳原子数的增多,烯烃同系物的物理性质呈现规律性变化,即熔沸点逐渐升高,密度逐渐增大。
2.常温下:当C1-C4时呈气态; C5-C16时呈液态; C17以上时呈固态。
3.所有烯烃均难溶于水,密度均小于1。
4.分子式相同的烃,支链越多,熔沸点越低。
三、烯烃的物理性质
1.加成反应:
(与H2、Br2、HX、H2O等)
有机物分子中未饱和的碳原子跟其它原子或原子团直接结合生成别的物质的反应。
①加成原理:
②加成通式:
C=C
+X—Y →
C—C
X Y
加成:断一加二,
只上不下。
取代:上一下一,
有进有出
四、烯烃的化学性质
与H2、Br2、HX、H2O等
CH2=CH2+Br2 CH2BrCH2Br
使溴水/溴的四氯化碳褪色褪色
CH=CH2 + HCl CH3CH2Cl
一定条件
烯烃与卤化氢的加成也常用于制备卤代烃
CH=CH2 + H2 O CH3CH2OH
催化剂
△
乙烯与水的反应也称为乙烯的水化,是工业制乙醇的方法之一
CH3-CH=CH2 + H2 CH3CH2CH3
催化剂
四、烯烃的化学性质
烯烃的不对称加成反应
当不对称烯烃与含氢化合物(HBr、H2O等)加成时,H原子主要加到连有较多H原子的C原子上(马氏规则)
【提问】试写出CH2=CH-CH3与HBr的反应。
CH2=CH-CH3
CH2-CH-CH3
| |
H Br
CH2-CH-CH3
| |
Br H
主要产物
+ HBr
(2)多烯烃的加成反应
分子中含有多个双键的烃称为多烯烃。多烯烃发生加成反应可能出现多种加成产物。
1.概念:
2.通式:
3.分类(基于双键的相对位置):
一、二烯烃的结构
分子中含有两个碳碳双键的烯烃
累积二烯烃:双键连在同一C原子上。
共轭二烯烃:两双键被一个单键隔开。
孤立二烯烃:双键被多个单键隔开。
4.最简单的共轭二烯烃:
1,3-丁二烯
是一个平面型分子
1.共轭二烯烃的加成反应:
2.共轭二烯烃和1molBr2加成反应:
二、二烯烃的加成反应
CH2=CH—CH=CH2 + 2Br2 (足量)→
CH2 — CH—CH — CH2
Br Br Br Br
CH2=CH—CH=CH2 + 2Br2 →
CH2-CH-CH=CH2
| |
Br Br
1,2加成
CH2-CH=CH-CH2
| |
Br Br
1,4加成
3,4-二溴-1-丁烯
1,4-二溴-2-丁烯
1,3-丁二烯的1,2-加成和1,4-加成是竞争反应,到底哪一种加成产物占优势取决于反应条件。
已知共轭二烯烃(两个碳碳双键间有一个碳碳单键)与烯或炔可发生反应生成六元环状化合物,如1,3-丁二烯与乙烯反应可表示为:
则异戊二烯( )与丙烯反应,生成的产物的结构简式可能是
(2)氧化反应
①烯烃易燃烧,燃烧时火焰明亮并伴有____,单烯烃燃烧通式为_____________________________。
②烯烃可被酸性高锰酸钾溶液氧化,故烯烃可使酸性高锰酸钾溶液____。
黑烟
褪色
四、烯烃的化学性质
3.氧化反应:
②与酸性高锰酸钾溶液反应
现象:
酸性高锰酸钾溶液褪色
反应方程式:
5C2H4+ 12KMnO4 + 18H2SO4= 12MnSO4+10CO2+28H2O+6K2SO4
应用:
鉴别乙烯(与烷烃比)
【思考】能不能仅用酸性高锰酸钾除去乙烷中的乙烯?
不能,会产生CO2,应在后面通入氢氧化钠溶液去除CO2。
烯烃与酸性高锰酸钾溶液反应的产物
CH2=
CO2
KMnO4
H+
KMnO4
H+
C=O
R1
R2
C=
R1
R2
酮
R—CH=
R—COOH
KMnO4
H+
羧酸
二氢成CO2
一氢成羧基
无氢成羰基
【练一练】试写出CH2=CHCH2C=CHCH2CH3与酸性高锰酸钾溶液反应的产物?
R—CH=CH2
KMnO4
H+
R—COOH+CO2
一、炔烃的结构
1.官能团:
2.链状单炔烃通式:
碳碳三键
单炔烃与同碳原子数的二烯烃是同分异构体
3.烯烃的结构(以乙炔为例)
—C 三 C—
直线型
sp杂化
3个
2个
2.加成反应(与反应物的量有关,可分步表示)
①催化加氢
②使溴水褪色
CH≡CH+Br2 CH=CH
Br
Br
CH=CH+Br2 CH—CH
Br
Br
Br
Br
Br
Br
1 , 2 —二溴乙烯
1 , 1 , 2 , 2 —四溴乙烷
CH≡CH+H2
催化剂
△
CH2=CH2
(少量氢气)
(足量氢气)
催化剂
△
CH≡CH+2H2
CH3CH3
三、炔烃的化学性质
三、炔烃的化学性质
2.加成反应:
CH≡CH+Br2(不足) →CHBr=CHBr;
CH≡CH+2Br2(过量)→ CHBr2—CHBr2
△
CH≡CH+H2O CH3CHO(工业制乙醛)
CH=CH
H OH
不稳定转化
有机中注意两个双键不能相邻,碳碳双键上不能连羟基,同一个碳上不连两个羟基,因为都不稳定。
乙炔在HgSO4和稀硫酸的的催化下,可以与水发生加成反应。
①可燃性
O2
2CO2+2H2O
C2H4+ 3
甲烷
乙烯
乙炔
火焰明亮,并伴有浓烟
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,点燃前要验纯!
含碳量不同导致燃烧现象
有所不同,可用于三者鉴别
1.乙炔的氧化反应
②使酸性KMnO4溶液褪色
2KMnO4+ 3H2SO4+ C2H2→2MnSO4+ K2SO4+2CO2↑+ 4H2O
有机化合物的含碳量越高,火焰越明亮,黑烟越浓。
三、炔烃的化学性质
CaC2+2H2O Ca(OH)2+C2H2↑(剧烈)
原料:
原理:
为得到平稳乙炔气流常用饱和NaCl水溶液代替水
电石(CaC2 )、水
二、乙炔的实验室制法
乙炔的实验室制法及性质
实验内容 实验现象
(1)将饱和氯化钠溶液滴入盛有电石的烧瓶中
(2)将纯净的乙炔通入盛有酸性高锰酸钾溶液的试管中
(3)将纯净的乙炔通入盛有溴的四氯化碳溶液的试管中
反应剧烈,放热,有气体产生
酸性高锰酸钾溶液褪色
溴的四氯化碳溶液褪色
1.乙炔的实验室制法
乙炔的实验室制法及性质
精讲:
(1) 制取乙炔时能否使用启普发生器?
①使用饱和食盐水 ②控制饱和食盐水的滴加速度
(3) 在乙炔的性质实验之前为什么要除去硫化氢,
是如何除去呢?
放出的大量热量,操作不当会使启普发生器炸裂。
(2)电石与水反应非常剧烈,为了获得平稳的乙炔气流,需要采取哪些措施?
硫化氢有还原性会干扰实验,使用硫酸铜溶液除去
(4)在点燃乙炔之前需要进行的实验操作是什么?
收集一试管乙炔,验纯
1.乙炔的实验室制法
乙炔的实验室制法及性质
精讲:
导气管口附近塞入少量棉的作用是什么?
用试管作反应容器制取乙炔时,由于CaC2和水反应剧烈并产生泡沫,为防止产生的泡沫涌入导气管,应在导气管附近塞入少量棉花。
制取乙炔不能用启普发生器或具有启普发生器原理的实验装置,原因是什么?
①碳化钙吸水性强,与水反应剧烈,不能随用、随停。
②反应过程中放出大量的热,易使启普发生器炸裂。
③生成的Ca(OH)2呈糊状易堵塞球形漏斗。
装置的作用
装置①
反应装置,作用:产生乙炔。
装置②
除杂装置,作用:除去杂质H2S、PH3。
装置③
检验装置,作用:检验乙炔是否产生。
装置④
反应装置,作用:乙炔与溴的四氯化碳溶液反应。
装置⑤
尾气处理装置,作用:去除未反应的乙炔。
烷烃、烯烃、炔烃结构和性质的比较
烃 烷烃 烯烃 炔烃
通式 CnH2n+2
(n≥1) CnH2n
(n≥2) CnH2n-2
(n≥2)
代表物 CH4 CH2===CH2 CH≡CH
结构特点 全部为单键;饱和链烃;正四面体结构 含碳碳双键;不饱和链烃;平面形分子,键角120° 含碳碳三键;不饱和链烃;直线形分子,键角180°
烃 烷烃 烯烃 炔烃
化学性质 取代反应 在光照条件下发生卤代反应 — —
加成反应 — 能与H2、X2、HX、H2O、HCN等发生加成反应
氧化反应 燃烧火焰较明亮 燃烧火焰明亮,伴有黑烟 燃烧火焰很明亮,伴有浓烈的黑烟
不与酸性KMnO4溶液反应 能使酸性KMnO4溶液褪色
加聚反应 不能发生 能发生
鉴别 不能使溴水或酸性KMnO4溶液褪色 能使溴水或酸性 KMnO4 溶液褪色
03
加聚反应
PART THREE
一、加聚反应的概念
加聚反应:
相对分子质量小的化合物相互加成聚合成相对分子质量大的聚合物
单体:聚合成高分子化合物的小分子化合物,如CH2=CH2;
链节:高分子化合物中的最小重复单元,如 — CH2 — CH2 —;
聚合度:高分子化合物中的链节数,如聚乙烯中的n。
链节中含多个碳原子的单体的判断方法-一边赶法
去掉[ ]和n,将链节中的一个键从左向右折叠,单变双,双变单,遇到碳超过4价,则断开。
―→
―→CH2==CF2和CF2==CF—CF3。
二、加聚产物单体的判断方法
,单体为________________;
,单体为___________________;
CH3CH==CHCH3
二、加聚产物单体的判断方法
如 ,单体为____________和_____________。
如 ,单体为 。
CH2==CH2
CH3CH==CH2
二、加聚产物单体的判断方法
①乙烯型加聚反应
nR1-CH=CH-R2
一定条件
CH CH
[
]
n
R1 R2
非氢基团写上下方,主链双键变单键
【练一练】试写出丙烯、2-甲基丙烯的加聚反应?
nCH2=CH-CH3
一定条件
CH2 CH
[
]
n
CH3
nCH2=C-CH3
一定条件
CH2 C
[
]
n
CH3
CH3
CH3
二、加聚反应的类型
注意:聚合物均是混合物。
②混合型加聚反应
二、加聚反应的类型
[ CH2-CH2-CH2-CH=CH-CH2 ] n
nCH2=CH2 + nCH2=CH-CH3
[ CH2-CH2-CH2-CH ] n
催化剂
CH3
|
或 [ CH2-CH2-CH-CH2 ] n
CH3
|
nCH2=CH2 + nCH2=CH-CH=CH2
催化剂
二、炔烃的化学性质
3.加聚反应:
nCH CH
CH=CH
n
加温、加压
催化剂
还可以三分子聚合
3CH CH
加温、加压
催化剂
聚乙炔
导电塑料
常用于烃类鉴别与检验的试剂和现象
(1)用酸性高锰酸钾溶液鉴别
不褪色——
褪色——
烷烃、环烷烃、苯
烯烃、二烯烃、炔烃、苯的同系物等
(2)用溴水鉴别
褪色
加成反应——
烯烃、炔烃等不饱和烃
萃取——
苯及其同系物、液态烷烃、液态环烷烃
不褪色——
气态烷烃、气态环烷烃
三、乙炔的用途
①加成反应:制塑料,合成纤维。
②乙炔水化法制乙醛。
③氧炔焰:切割或焊接金属。
02
石油的炼制
PART TWO
一、石油的成分
1.石油的成分:
脂肪烃的来源有石油、天然气和煤等。
主要是由 、 和 组成组成的混合物,其中还含有少量不属于烃的物质。
气态烃
固态烃
液态烃
2.石油的炼制:
分馏、裂化、裂解等。
二、石油的分馏
1. 分馏原理:
根据沸点不同,通过加热汽化,然后冷凝,把石油分成不同沸点范围内的产物。
常压分馏:主要产品有石油气、汽油、煤油、轻柴油等。
减压分馏:主要产品有重柴油、润滑油、石蜡、燃料油等。
2. 分类:
常压分馏
塔内越往上温度越低,
蒸出的馏分沸点越低。
注意:
各馏分均为混合物。
减压分馏
三、石油的裂化
1. 裂化原理:
使具有 在高温下发生反应生成 的方法。
催化裂化和热裂化
2. 分类:
较长碳链的烃
短链烃
3. 目的:
提高轻质油的产量。
(轻质油:低沸点的汽油,. 一般泛指沸点范围约50~350℃的烃类混合物)
4. 举例:
C16H34
催化剂
加热、 加压
C8H18
辛烷
+ C8H16
辛烯
裂化汽油中含有不饱和烃
四、石油的裂解
1. 裂解原理:
与裂化原理相同,由 生产气态烯烃,又称深度裂化。
轻质油
2. 目的:
获得乙烯、丙烯等气态短链烃,为石油化工提供原料。
3. 举例:
C4H8
2C2H4
催化剂
加热、 加压
C8H18
C4H10 + C4H8
催化剂
加热、 加压
C4H10
C2H4 + C2H6
催化剂
加热、 加压
分馏 ①原理:利用原油中各组分 的不同进行分离
②产物:获得汽油、煤油、柴油等含碳原子少的轻质油(直馏汽油)
裂化 ①原理:将含碳原子数较多、沸点较高的烃 为碳原子数较少、 沸点较低的烃的过程。
如C16H34 C8H18+C8H16
②产物: 。
裂解 ①原理:裂解就是 ,得到碳原子数更小的烃类。
C8H18 C4H10+C4H8
C4H10 CH4+C3H6
C4H10 C2H6+C2H4
②产物: 。
沸点
断裂
碳原子数较少、沸点较低的烃
深度裂化
短链不饱和烃,如乙烯
石油的炼制工艺
