苏教版高中化学必修第一册专题2研究物质的基本方法2.2溶液组成的定量研究课件(共35张PPT)
文档属性
| 名称 | 苏教版高中化学必修第一册专题2研究物质的基本方法2.2溶液组成的定量研究课件(共35张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 850.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-23 09:43:34 | ||
图片预览











文档简介
(共35张PPT)
(2)标准状况下,3.36 L HCl溶于水,得到100 mL盐酸溶液,所得盐酸溶液的溶质的物质的量浓度是多少?若把所得盐酸溶液稀释至500 mL,则所得溶液的物质的量浓度是多少?
(3)根据标签内容,求盐酸溶液中溶质的质量分数。
(3)假设盐酸的体积为1 L,溶液的质量=ρV=1.179 g·cm-3×1 000 cm3=1 179 g,n(HCl)=cV=12 mol·L-1×1 L=12 mol,m(HCl)=nM=12 mol×36.5 g·mol-1=438 g,溶质的质量分数w=438 g÷1 179 g×100%≈37.15%。
[答案] (1)c(HCl)=5 mol·L-1;c(H+)=5 mol·L-1
(2)1.5 mol·L-1 0.3 mol·L-1 (3)37.15%
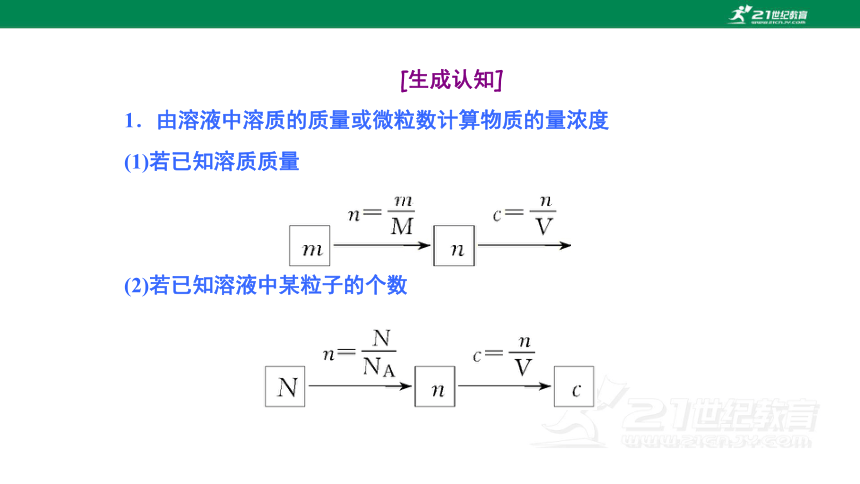
[生成认知]
1.由溶液中溶质的质量或微粒数计算物质的量浓度
(1)若已知溶质质量
(2)若已知溶液中某粒子的个数
2.由标准状况下气体的体积计算物质的量浓度
(1)若已知溶液的体积
3.溶液的稀释与混合
(1)稀释时
溶质质量不变:m1w1=m2w2;
溶质的物质的量不变
c(浓)·V(浓)=c(稀)·V(稀)。
(2)混合时
c(混)·V(混)=c1V1+c2V2。
[跟踪训练]
1.下列溶液中物质的量浓度为1 mol·L-1的是 ( )
A.将40 g NaOH溶解在1 L水中
B.将22.4 L HCl气体溶于水配成1 L溶液
C.将1 L 10 mol·L-1浓盐酸加入9 L水中
D.将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250 mL
2.下列说法中正确的是 ( )
A.将322 g Na2SO4·10H2O溶于1 L水中,所得溶液的物质的量浓度为1 mol·L-1
B.将1 L 2 mol·L-1 H2SO4溶液加水稀释到2 L,所得溶液的物质的量浓度为1 mol·L-1
C.将1 L 18.4 mol·L-1的H2SO4溶液加入到1 L水中,所得溶液的物质的量浓度为9.2 mol·L-1
D.将336 mL HCl气体溶于水,配成300 mL溶液,所得溶液的物质的量浓度为0.05 mol·L-1
解析:A项错在溶剂体积为1 L;C项溶液浓度大于9.2 mol·L-1;D项,未指明气体所处状况。
答案:B
2.定容时仰视或俯视刻度线产生的误差图解
(1)仰视刻度线(图1)。由于操作时是以刻度线为基准加水,刻度线低于液面,故加水量偏多,导致溶液体积偏大,浓度偏小。
(2)俯视刻度线(图2)。与仰视刻度线恰好相反,刻度线高于液面,使得加水量偏少,浓度偏大。
[跟踪训练]
1.配制一定物质的量浓度的某溶液,下列情况会使配制结果偏低的是
( )
A.未冷却即转移、定容 B.未洗烧杯及玻璃棒
C.定容时俯视刻度线观察液面 D.容量瓶中原有少量蒸馏水
解析:A项,未冷却即转移,最后导致溶液体积偏小,浓度偏高;B项,未洗涤导致溶质减少,浓度偏低;C项,俯视刻度线,导致V偏小,浓度偏大;D项没有影响。
答案:B
2.常温下,用密度为1.84 g·cm-3、溶质的质量分数为98%的硫酸,配制200 mL 2.3 mol·L-1的稀硫酸。
(1)所配制的稀硫酸中,H+的物质的量浓度为______mol·L-1。
(2)需用浓硫酸的体积为______mL。
(3)若所配制的稀硫酸浓度偏小,则下列可能的原因分析中正确的是______。
A.配制前,容量瓶中有少量蒸馏水
B.量取浓硫酸时,仰视液体的凹液面
C.未冷却,立即转移至容量瓶定容
D.定容时,仰视溶液的凹液面
[应用体验]
1.下列配制的溶液浓度偏高的是 ( )
A.配制盐酸用量筒量取浓盐酸时俯视刻度线
B.配制盐酸定容时,仰视容量瓶刻度线
C.称量4 g NaOH配制1 000 mL 0.1 mol·L-1 NaOH溶液时,砝码错放左盘
D.NaOH溶解后未经冷却即注入容量瓶并定容至刻度线
解析:A项,用量筒量取浓盐酸时俯视刻度线,将会使量得盐酸的体积小于计算值,导致浓度偏低;B项,定容时仰视容量瓶刻度线,将会导致加水量增多,使溶液浓度偏小;C项,由于所称NaOH固体的质量为整数,不需移动游码,故称得固体NaOH的质量是准确的,不会影响到配制溶液的浓度;D项,因热胀冷缩,会使容量瓶中的溶液在冷却后液面低于刻度线,导致所配溶液浓度偏高。
答案:D
2.用容量瓶配制一定物质的量浓度的NaCl溶液的实验中,会使所配溶液浓度偏高的是 ( )
A.定容时加水加多了,用滴管吸出溶液至刻度线
B.定容时仰视刻度线
C.没有洗涤溶解NaCl固体的烧杯和玻璃棒
D.称量NaCl固体时砝码上有杂质
解析:A项,用滴管吸出溶液使n(NaCl)减小,浓度偏低;B项,定容时仰视刻度线,溶液的体积偏大,浓度偏低;C项,未洗涤烧杯、玻璃棒,n(NaCl)减小,浓度偏低;D项,砝码上有杂质使本身质量偏大,称量NaCl的质量偏大,浓度偏高。
答案:D
A.标签上的离子的浓度是物质的量浓度
B.该品牌饮用矿物质水中c(Mg2+)最大值为2×10-4 mol·L-1
C.取少量待测液加入稀盐酸酸化,再滴入硝酸银,出现白色沉淀,说明有氯离子
D.一瓶该品牌饮用矿物质水中SO的物质的量不超过1×10-5 mol
2.在无土栽培时,需用0.5 mol·L-1 NH4Cl、0.16 mol·L-1 KCl、0.24 mol·L-1 K2SO4配制而成的营养液。若用KCl、NH4Cl和(NH4)2SO4三种固体来配制1 L营养液,则需此三种固体物质的量分别为 ( )
A.0.4 mol、0.5 mol、0.12 mol
B.0.66 mol、0.5 mol、0.24 mol
C.0.64 mol、0.5 mol、0.24 mol
D.0.64 mol、0.02 mol、0.24 mol
3. (选自鲁科版新教材P29)106 g Na2CO3溶于1 L水中所得溶液与1 mol Na2CO3溶于水稀释成1 L的溶液相比,Na2CO3的物质的量浓度是否相等?为什么?
答案:不相等。106 g碳酸钠溶于1 L水时,所得溶液的体积大于1 L。所得溶液的物质的量浓度小于1 mol·L-1,所以1 mol 碳酸钠溶于水稀释成1 L的溶液,其物质的量浓度为1 mol·L-1。
(2)标准状况下,3.36 L HCl溶于水,得到100 mL盐酸溶液,所得盐酸溶液的溶质的物质的量浓度是多少?若把所得盐酸溶液稀释至500 mL,则所得溶液的物质的量浓度是多少?
(3)根据标签内容,求盐酸溶液中溶质的质量分数。
(3)假设盐酸的体积为1 L,溶液的质量=ρV=1.179 g·cm-3×1 000 cm3=1 179 g,n(HCl)=cV=12 mol·L-1×1 L=12 mol,m(HCl)=nM=12 mol×36.5 g·mol-1=438 g,溶质的质量分数w=438 g÷1 179 g×100%≈37.15%。
[答案] (1)c(HCl)=5 mol·L-1;c(H+)=5 mol·L-1
(2)1.5 mol·L-1 0.3 mol·L-1 (3)37.15%
[生成认知]
1.由溶液中溶质的质量或微粒数计算物质的量浓度
(1)若已知溶质质量
(2)若已知溶液中某粒子的个数
2.由标准状况下气体的体积计算物质的量浓度
(1)若已知溶液的体积
3.溶液的稀释与混合
(1)稀释时
溶质质量不变:m1w1=m2w2;
溶质的物质的量不变
c(浓)·V(浓)=c(稀)·V(稀)。
(2)混合时
c(混)·V(混)=c1V1+c2V2。
[跟踪训练]
1.下列溶液中物质的量浓度为1 mol·L-1的是 ( )
A.将40 g NaOH溶解在1 L水中
B.将22.4 L HCl气体溶于水配成1 L溶液
C.将1 L 10 mol·L-1浓盐酸加入9 L水中
D.将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250 mL
2.下列说法中正确的是 ( )
A.将322 g Na2SO4·10H2O溶于1 L水中,所得溶液的物质的量浓度为1 mol·L-1
B.将1 L 2 mol·L-1 H2SO4溶液加水稀释到2 L,所得溶液的物质的量浓度为1 mol·L-1
C.将1 L 18.4 mol·L-1的H2SO4溶液加入到1 L水中,所得溶液的物质的量浓度为9.2 mol·L-1
D.将336 mL HCl气体溶于水,配成300 mL溶液,所得溶液的物质的量浓度为0.05 mol·L-1
解析:A项错在溶剂体积为1 L;C项溶液浓度大于9.2 mol·L-1;D项,未指明气体所处状况。
答案:B
2.定容时仰视或俯视刻度线产生的误差图解
(1)仰视刻度线(图1)。由于操作时是以刻度线为基准加水,刻度线低于液面,故加水量偏多,导致溶液体积偏大,浓度偏小。
(2)俯视刻度线(图2)。与仰视刻度线恰好相反,刻度线高于液面,使得加水量偏少,浓度偏大。
[跟踪训练]
1.配制一定物质的量浓度的某溶液,下列情况会使配制结果偏低的是
( )
A.未冷却即转移、定容 B.未洗烧杯及玻璃棒
C.定容时俯视刻度线观察液面 D.容量瓶中原有少量蒸馏水
解析:A项,未冷却即转移,最后导致溶液体积偏小,浓度偏高;B项,未洗涤导致溶质减少,浓度偏低;C项,俯视刻度线,导致V偏小,浓度偏大;D项没有影响。
答案:B
2.常温下,用密度为1.84 g·cm-3、溶质的质量分数为98%的硫酸,配制200 mL 2.3 mol·L-1的稀硫酸。
(1)所配制的稀硫酸中,H+的物质的量浓度为______mol·L-1。
(2)需用浓硫酸的体积为______mL。
(3)若所配制的稀硫酸浓度偏小,则下列可能的原因分析中正确的是______。
A.配制前,容量瓶中有少量蒸馏水
B.量取浓硫酸时,仰视液体的凹液面
C.未冷却,立即转移至容量瓶定容
D.定容时,仰视溶液的凹液面
[应用体验]
1.下列配制的溶液浓度偏高的是 ( )
A.配制盐酸用量筒量取浓盐酸时俯视刻度线
B.配制盐酸定容时,仰视容量瓶刻度线
C.称量4 g NaOH配制1 000 mL 0.1 mol·L-1 NaOH溶液时,砝码错放左盘
D.NaOH溶解后未经冷却即注入容量瓶并定容至刻度线
解析:A项,用量筒量取浓盐酸时俯视刻度线,将会使量得盐酸的体积小于计算值,导致浓度偏低;B项,定容时仰视容量瓶刻度线,将会导致加水量增多,使溶液浓度偏小;C项,由于所称NaOH固体的质量为整数,不需移动游码,故称得固体NaOH的质量是准确的,不会影响到配制溶液的浓度;D项,因热胀冷缩,会使容量瓶中的溶液在冷却后液面低于刻度线,导致所配溶液浓度偏高。
答案:D
2.用容量瓶配制一定物质的量浓度的NaCl溶液的实验中,会使所配溶液浓度偏高的是 ( )
A.定容时加水加多了,用滴管吸出溶液至刻度线
B.定容时仰视刻度线
C.没有洗涤溶解NaCl固体的烧杯和玻璃棒
D.称量NaCl固体时砝码上有杂质
解析:A项,用滴管吸出溶液使n(NaCl)减小,浓度偏低;B项,定容时仰视刻度线,溶液的体积偏大,浓度偏低;C项,未洗涤烧杯、玻璃棒,n(NaCl)减小,浓度偏低;D项,砝码上有杂质使本身质量偏大,称量NaCl的质量偏大,浓度偏高。
答案:D
A.标签上的离子的浓度是物质的量浓度
B.该品牌饮用矿物质水中c(Mg2+)最大值为2×10-4 mol·L-1
C.取少量待测液加入稀盐酸酸化,再滴入硝酸银,出现白色沉淀,说明有氯离子
D.一瓶该品牌饮用矿物质水中SO的物质的量不超过1×10-5 mol
2.在无土栽培时,需用0.5 mol·L-1 NH4Cl、0.16 mol·L-1 KCl、0.24 mol·L-1 K2SO4配制而成的营养液。若用KCl、NH4Cl和(NH4)2SO4三种固体来配制1 L营养液,则需此三种固体物质的量分别为 ( )
A.0.4 mol、0.5 mol、0.12 mol
B.0.66 mol、0.5 mol、0.24 mol
C.0.64 mol、0.5 mol、0.24 mol
D.0.64 mol、0.02 mol、0.24 mol
3. (选自鲁科版新教材P29)106 g Na2CO3溶于1 L水中所得溶液与1 mol Na2CO3溶于水稀释成1 L的溶液相比,Na2CO3的物质的量浓度是否相等?为什么?
答案:不相等。106 g碳酸钠溶于1 L水时,所得溶液的体积大于1 L。所得溶液的物质的量浓度小于1 mol·L-1,所以1 mol 碳酸钠溶于水稀释成1 L的溶液,其物质的量浓度为1 mol·L-1。
